羊肉是一种药食兼用的肉类食品,自古以来我国乃至世界人民就有食用羊肉的习惯。羊肉含丰富的动物蛋白,其消化率亦高,一些国家把羊肉列为上等食品[1]。羊肉不仅营养丰富,而且具有特殊的风味。羊肉的风味是由美拉德(Maillard)反应、脂质降解、硫胺素降解及其交互的一系列复杂反应形成[2],但羊肉膻味在一定程度上影响了羊肉的品质,降低了人们对羊肉的可接受程度。WONGE等[3]研究发现,羊肉的这种特征风味物质主要来源于脂肪组织中由8~10个碳原子组成的不饱和脂肪酸。尤其是4-甲基辛酸和4-乙基辛酸,是引起膻味的主要支链脂肪酸。BERUNAND CP等[4]研究证明了4-乙基辛酸是形成山羊膻味的主要化合物。
目前,国内的除膻方法有民间中草药脱膻和高温加热法等,同时开发了β-环状糊精包埋法及自来水漂洗法[5]。目前微生物除膻技术得到很多学者的关注,其主要是利用有针对性的发酵制剂对羊肉进行发酵处理,以达到除膻的目的。近几年国内许多学者运用发酵菌株制成发酵混合制剂,发酵过程中,微生物释放的脂肪酶及蛋白酶类对羊肉的低级挥发性脂肪酸产生作用,降低了羊肉制品的膻味[6],为发酵制品提供了特殊风味和色泽,且不会破坏羊肉制品的品质。穆莎茉莉[7]选用乳酸菌和酵母菌作为发酵剂,对羊肉进行发酵处理,羊肉的感官品质较好,且膻味较小。赵丽华[8]以内蒙古羊肉和羊尾脂肪作为原料,接种由产香肉葡萄球菌(Staphylococcuscarnosus)、戊糖乳杆菌(Lactobacillus pentosus)和戊糖片球菌(Pediococcus pentosaceus)复合而成的发酵剂制成干香肠,发酵后的香肠在组织状态、多汁性、滋味和整体可接受性上的感官评分明显增加,其膻味下降也较明显。
目前微生物除膻是国内除膻技术中相对较好的一种方法,但是要选择合适的菌株一直是一个难题。实验将培养基中的橄榄油替换成羊油,将乳化后的羊油和荧光指示剂加入到筛选平板中,筛选出作用于羊油脂的菌株,通过形态学、生化实验及16S rRNA基因序列和转录间隔区(internal transcribed spacer,ITS)基因序列鉴定,然后将鉴定出的菌株作为发酵剂,通过液态发酵实验分析其对4-甲基辛酸和4-乙基辛酸的降解作用,为微生物除膻技术提供一定的理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
火腿:贵州盘县某企业;土壤:贵州某羊养殖场。火腿和土壤采回后用无菌袋密封,于4℃条件下保存。
1.1.2 试剂
4-甲基辛酸标准液(纯度≥98.0%)、4-乙基辛酸标准液(纯度≥98.0%):美国Sigma公司;甲醇、正己烷(均为色谱纯):美国天地有限公司;氢氧化钾(分析纯):成都金山化学试剂有限公司;浓硫酸(分析纯):重庆川东化工有限公司。
1.1.3 培养基
富集培养基和初筛培养基:参照参考文献[9]并稍作修改。用2 g/100m L的聚乙烯醇乳化羊油,羊油∶聚乙烯醇=1∶4(g∶g)。
细菌保藏培养基:参照参考文献[10];真菌保藏培养基:马铃薯葡萄糖琼脂(potato dextroseagar,PDA)培养基。
种子培养基和发酵培养基:参照参考文献[11]并稍作修改。用2 g/100mL的聚乙烯醇乳化羊油,羊油∶聚乙烯醇=1∶4(g∶g)。
1.2 仪器与设备
Trace DSQ气质联用(gas chromatography-mass spectrometer,GC-MS)仪:美国Finnigan公司;HP-FFAP色谱柱(50m×0.20mm,0.25μm):美国安捷伦科技有限公司;CX21BIM-SET5奥林巴斯生物显微镜:日本奥林巴斯株式会社;VITEK2Compact梅里埃全自动微生物生化鉴定仪:法国生物梅里埃公司;BILON88-II超声波细胞粉碎机:上海比郎仪器制造有限公司。
1.3 方法
1.3.1 样品预处理
称取火腿表皮肉100 g,切碎置于灭菌三角瓶中备用;称取土壤100 g,置于灭菌三角瓶中,60℃条件下烘干至泥土松散,备用。
1.3.2 富集培养
取上述处理的样品各10g,置于90m L无菌生理盐水中,180 r/m in振荡30m in。静置分层后取5m L上清液于50m L富集培养基中,30℃、180 r/min培养48h,再取5m L装入50m L新鲜富集培养基中,进行第2、3次富集。
1.3.3 产脂肪酶菌株的分离和保存
吸取富集培养的菌液1m L置于9m L无菌生理盐水中,随后以10倍为稀释单位进行稀释,逐步稀释至10-5、10-6、10-7。从这3个稀释度的菌液中各取1m L注入平板中,并趁热倒入初筛培养基,每个浓度做3个平行,待其冷却凝固于30℃恒温培养箱中倒置培养72 h。培养好的平板置于波长365 nm的紫外光下观察,若平板上的菌落产生荧光圈则说明该菌落产生脂肪酶。挑选荧光圈较大的细菌菌落和真菌菌落于新的初筛平板上划线分离,以获得单菌落并再次验证该菌株水解羊油脂的能力。将分离得到的单菌落编号并接种于斜面培养基上,培养48 h于4℃条件下保存。
1.3.4 菌株形态观察
将分离出的细菌和霉菌分别接种于细菌保藏培养基和真菌保藏培养基上,30℃条件下恒温培养72 h,观察菌落形态。分别挑取细菌的单个菌落和霉菌的菌丝置于载玻片上进行染色制片,显微镜下观察其染色情况、菌体形态并记录结果。并根据《伯杰氏系统细菌学手册》[12]和《真菌鉴定手册》[13]进行菌株形态学鉴定。
1.3.5 细菌生理生化鉴定
采用梅里埃VITEK2Compact全自动细菌鉴定及药敏分析系统对分离纯化出的细菌菌株进行分析。
1.3.6 菌株分子生物学鉴定
细菌基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)提取:利用细菌基因组DNA提取试剂盒提取目标菌株基因组DNA。采用通用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')聚合酶链式反应(polymerase chain reaction,PCR)扩增菌株的16S rRNA基因。PCR扩增体系:基因组 DNA(20~50 ng/μL)0.5 μL,10×Buffer(含Mg2+)2.5 μL,脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)(各2.5mmol/L)1 μL,酶0.2μL,27F(10μmol/L)0.5 μL,1429R(10μmol/L)0.5μL,加双蒸水(ddH2O)至25μL。PCR扩增条件:94℃预变性4min;94℃变性45 s,55℃退火45 s,72℃延伸1min,共30个循环;最终72℃延伸10m in。纯化后的菌株基因组DNA采用1%的琼脂糖凝胶进行检测;PCR扩增产物的测序由生工生物工程(上海)股份有限公司完成,采用16S rDNA测序方法对菌株进行分子生物学鉴定。
真菌基因组DNA提取:利用真菌基因组DNA提取试剂盒提取目标菌株基因组DNA,具体操作步骤参见试剂盒说明书。采用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')PCR扩增菌株的基因。PCR扩增体系:基因组DNA(20~50ng/μL)0.5 μL,10×Buffer(含Mg2+)2.5 μL,dNTP(各2.5mmol/L)1 μL,酶0.2 μL,ITS1(10 μmol/L)0.5 μL,ITS4(10 μmol/L)0.5 μL,加ddH2O至25μL。PCR扩增条件:94℃预变性4m in;94℃变性45 s,55 ℃退火45 s,72℃延伸1min,共30个循环;最终72℃延伸10m in。纯化后的菌株基因组DNA采用1%的琼脂糖凝胶进行检测;PCR扩增产物的测序由生工生物工程(上海)股份有限公司完成,采用ITS测序方法对菌株进行分子生物学鉴定。
登陆美国国家生物信息中心(nationalcenterofbiotechnology information,NCBI)数据库,将测序结果与GenBank数据库已知序列进行BLAST对比,选取相似性99%以上的菌株序列,采用MEGA5.05软件中的邻接法(neighbor-joining,NJ)法构建系统发育树。
1.3.7 菌株降解脂肪酸的测定
准确称取4-甲基辛酸和4-乙基辛酸各150.0mg,用正己烷定容至500m L,即为脂肪酸标准混合溶液;在150m L三角瓶中加入30m L液体发酵培养基,20m L脂肪酸标准混合溶液,种子菌液以体积分数5%的接种量接入液体培养基;30℃、180 r/min条件下培养48h,取出加入10m L正己烷充分振荡,8 000 r/m in离心20m in,取上清液甲酯化[14],采用GC-MS法测定两种脂肪酸含量。
1.3.8 脂肪酸含量的测定
GC条件:HP-FFAP色谱柱(50m×0.20mm,0.25μm);升温程序:初始温度100℃,保持2m in,以6.0℃/m in升至220℃,保持10min;载气为氦气(He),流速1.0m L/min;进样口温度270 ℃;分流比10∶1;进样量1.0μL;传输线温度230℃。MS条件:离子源温度220℃;电子电离(electron ionization,EI)离子源;电子能量70eV;选择离子监测(selected ionmonitor,SIM)扫描模式。
2 结果与分析
2.1 产脂肪酶菌株的分离筛选结果
从火腿和土壤中共分离出6株产脂肪酶的细菌,编号分别为QT1-2、QT3-1、QT3-2、ZH1-1、ZH2-1、ZH2-2;5株霉菌,编号分别为TZH1、TZH3、TZH4、QT6-2、4TQ3。
2.2 产脂肪酶菌株的鉴定
2.2.1 形态特征和生理生化特征
细菌及霉菌菌落特征如表1所示,细菌及霉菌菌体形态如表2、表3所示。通过梅里埃VITEK2Compact全自动细菌鉴定及药敏分析系统的分析,细菌的生理生化鉴定卡如表4所示。结合《伯杰氏系统细菌学手册》鉴定分类系统和生理生化鉴定结果,初步判定菌株QT1-2为普罗维登斯菌属(Providencia),菌株QT3-1和ZH1-1为克雷伯氏菌属(Klebsiella),菌株QT3-2为肠杆菌属(Enterobacter),菌株ZH2-1为假单胞菌属(Pseudomonas),菌株ZH2-2为柠檬酸杆菌属(Citrobacter)。根据《真菌鉴定手册》中的鉴定分类系统,可初步判定菌株TZH1和TZH3为根霉属(Rhizopus),菌株THZ4和QT6-2为曲霉属(Aspergillus),菌株4QT3为横梗霉属(Lichtheimia)。
表1 细菌和霉菌菌落特征
Table 1 Colony characteristics of bacteria and mold

菌株 大小 颜色 干湿 质地 形状 表面 透明 边缘 表面光泽QT1-2 QT3-1 QT3-2 ZH1-1 ZH2-1 ZH2-2 TZH1 TZH3 TZH4 QT6-2 4QT3小小小小小小大大大大大乳白色灰白色灰白色灰白色乳白色乳白色白色白色或黑褐色白色、黄色或淡绿褐色白色或灰绿色白色湿润湿润湿润湿润湿润湿润干燥干燥干燥干燥干燥黏黏光滑黏黏光滑疏松疏松疏松疏松疏松圆形圆形圆形圆形圆形圆形棉絮状棉絮状棉絮状绒毛状棉絮状扁平扩展扁平扩展微凸起扁平扩展扁平扩展低凹蔓延生长蔓延生长蔓延生长蔓延生长蔓延生长半透明不透明透明不透明半透明半透明不透明不透明不透明不透明不透明整齐整齐整齐整齐整齐不整齐不定形不定形不定形不定形不定形无光泽无光泽无光泽无光泽无光泽有光泽无光泽无光泽无光泽无光泽无光泽
表2 细菌菌体形态
Table 2 Mycelialmorphology of bacteria

注:“G-”表示革兰氏染色结果阴性。
菌株 细胞形态 芽孢情况 鞭毛情况 革兰氏染色QT1-2 QT3-1 QT3-2 ZH1-1 ZH2-1 ZH2-2杆状短杆状杆状短杆状球杆状杆状无芽孢无芽孢无芽孢无芽孢无芽孢无芽孢有鞭毛无鞭毛有鞭毛无鞭毛有鞭毛有鞭毛G- G- G- G- G- G-
表3 霉菌菌体形态
Table 3 Mycelialmorphology ofmold

菌株 菌丝 孢子形态 孢子囊TZH1 TZH3 TZH4 QT6-2 4QT3无隔菌丝无隔菌丝有隔菌丝有隔菌丝有隔菌丝圆形或椭圆形圆形或椭圆形圆形或卵圆形圆形圆形球形椭圆形或球形烧瓶形或球形烧瓶形或球形球形
表4 细菌的生理生化特征
Table 4 Physiologicaland biochem ical characteristics of bacteria

注:“-”表示结果呈阴性;“+”表示结果呈阳性。
实验项目 ZH1-1 ZH2-1 ZH2-2 QT1-2 QT3-1 QT3-2丙氨酸-苯丙氨酸-脯氨酸芳胺酶侧金盏花醇吡咯烷基芳胺酶阿拉伯醇D-纤维二糖β-半乳糖苷酶H2S产生β-N-乙酰葡萄糖苷酶谷胺酰芳胺酶pNA D-葡萄糖γ-谷氨酰转移酶发酵/葡萄糖β-葡萄糖苷酶D-麦芽糖D-甘露醇D-甘露糖β-木糖苷酶β-丙氨酸芳胺酶L-脯氨酸芳胺酶脂酶古老糖酪氨酸芳胺酶尿素酶D-山梨醇蔗糖D-塔格糖D-海藻糖柠檬酸(钠)丙二酸盐5-酮-葡萄糖苷L-乳酸产碱α-葡萄糖琥珀酸盐产碱N-乙酰-β-半乳糖苷酶α-半乳糖苷酶磷酸酶氨基乙酸芳胺酶鸟氨酸脱羧酶赖氨酸脱羧酶组氨酸同化COURMARATE β-葡萄糖苷酸酶O129/耐受谷氨酸-甘氨酸-精氨酸芳胺酶L-苹果酸盐同化ELLMAN L-乳酸盐同化-++-++---++++++++--+++++++++-++-+-++--+---+--+----------------+-+++--+-------+-+----------------+--++--+-+-+++--++++-++-++-++-+-+++++-+++-++--+-++----++++-++---+++-++-++----+--+------+-----++-++-+-+-++++++--++++++-+++++-+-+++++---+-----+--++-+-+++-++++-+++++++-+++-+-++++++----+----
2.2.2 产脂肪酶菌株的分子生物学鉴定
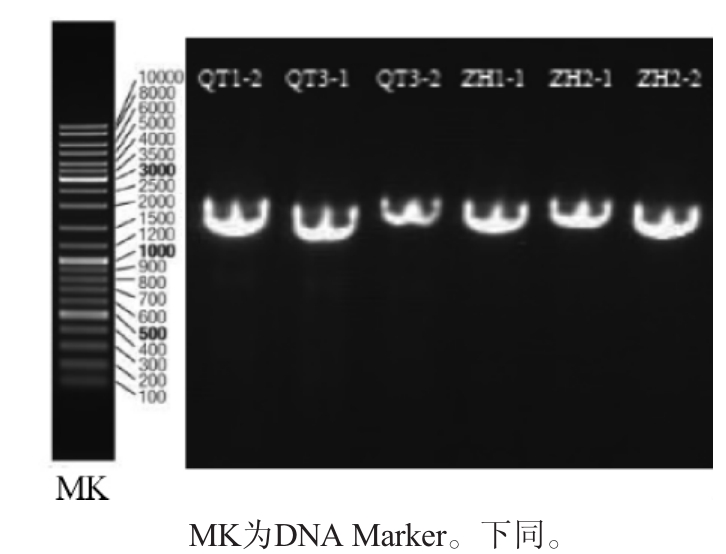
图1 6株细菌的16S rRNA PCR扩增产物电泳图谱
Fig.1 Electrophoretogram of 16S rRNA PCR amplification products of 6 strains of bacteria
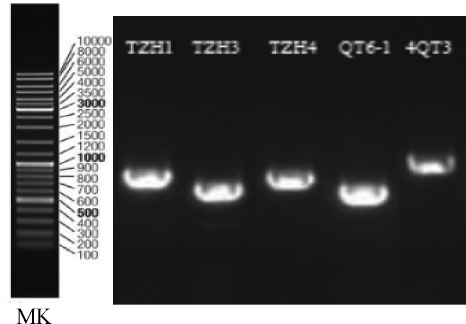
图2 5株霉菌的ITS PCR扩增产物电泳图谱
Fig.2 Electrophoretogram of ITS PCR am plification products of 5 strains ofmolds
由图1可知,将筛选得到的6株细菌以总DNA为模板PCR扩增后经电泳检测,均得到了1.5 kbp左右的条带。由图2可知,将筛选得到的5株霉菌以总DNA为模板PCR扩增后经电泳检测,均得到了600 bp左右的条带。PCR扩增产物由上海生工公司进行测序,测得它们的序列并与GenBank数据库已有的序列比对,选取同源性>99%的菌株序列构建系统发育树,结果见图3和图4。

图3 细菌基于16S rRNA基因序列的6株细菌的系统发育树
Fig.3 Phylogenetic tree of six strains of bacteria based on 16S rRNA gene sequences

图4 基于ITS基因序列的5株霉菌的系统发育树
Fig.4 Phylogenetic tree of five strainsmolds based on ITS gene sequences
由系统发育树结合菌落、菌体形态和生理生化特征可以看出,菌株QT1-2与产碱普罗维登斯菌亲缘性最高(100%),因此鉴定为产碱普罗维登斯菌(Providencia alcalifaciens);菌株QT3-1与肺炎克雷伯氏菌亲缘性最高(100%),因此鉴定为肺炎克雷伯氏菌(Klebsiella pneumoniae);菌株QT3-2与霍式肠杆菌亲缘性最高(100%),因此鉴定为霍式肠杆菌(Enterobacterhormaechei);菌株ZH1-1与产酸克雷伯氏菌亲缘性最高(100%),因此鉴定为产酸克雷伯氏菌(Klebsiella oxytoca);菌株ZH2-1与铜绿假单胞菌的亲缘性最高(100%),因此鉴定为铜绿假单胞菌(Pseudomonasaeruginosa);菌株ZH2-2与弗氏柠檬酸杆菌亲缘性最高(97%),因此鉴定为弗氏柠檬酸杆菌(Citrobacterfreundii)。菌株TZH1与微孢根霉亲缘性最高(100%),因此鉴定为微孢根霉(Rhizopus microsporus);菌株TZH3与米根霉亲缘性最高(99%),因此鉴定为米根霉(Rhizopusoryzae);菌株TZH4与米曲霉亲缘性最高(100%),因此鉴定为米曲霉(Aspergillus oryzae);菌株QT6-2与黄曲霉亲缘性最高(99%),因此鉴定为黄曲霉(Aspergillus flavus);菌株4QT3与多枝横梗霉亲缘性最高(100%),因此鉴定为多枝横梗霉(Lichtheim ia ramosa)。
普罗威登斯菌属(Providencia)菌为革兰氏阴性,属肠杆菌科,是人和动物肠道的正常菌群,也是条件致病菌,能引起腹泻,肠道外感染和尿道感染等疾病[15]。张迁[16]对一种来源于普罗维登斯菌的酸性脲酶进行了研究,这种酶能在发酵酒苛刻环境下高效分解尿素,逐渐受到人们的关注。克雷伯氏菌属(Klebsiella)普遍存在于土壤、水体、谷物等自然环境以及生物体的消化、呼吸系统中[17]。LIU Y等[18]从中国西双版纳土壤中筛选获得一株含漆酶基因(lac)的肺炎克雷伯氏菌,该漆酶具有良好的pH和温度稳定性,可广泛应用于纺织业、造纸工业、食品行业中等。产酸克雷伯氏菌(K lebsiella oxytoca)则能产生赖氨酸脱羧酶,被GALEEF等[19]用于定量分析赖氨酸的含量等。霍氏肠杆菌(Enterobacterhormaechei)属于肠杆菌属(Enterobacter),存在于人和动物肠道,为正常菌群之一。岳喜庆等[20]从一株霍氏肠杆菌中提取了一种青霉素酶,这种酶主要用于对牛奶中青霉素残留量的快速定量测定,并对其发酵产酶条件进行了初步的研究。弗氏柠檬酸杆菌(Citrobacterfreundii)是一种生长能力强的典型人-畜-鱼共患条件致病菌,感染致病性弗氏柠檬酸杆菌后可引起动物和人腹泻、肺炎、败血症及食物中毒等症状[21]。罗会颖等[22]从弗氏柠檬酸杆菌中分离出一种新植酸酶并对其酶学性质研究,植酸酶可作为单胃动物的饲料添加剂,提高植物性饲料磷的利用率等。以上细菌能产生不同的酶并应用于不同领域,但对其脂肪酶的应用却鲜有报道,具有一定的研究前景。
微孢根霉可产生纤维素酶[23]和脂肪酶[24]等,用于处理油脂含量高达1 300mg/L的乳制品废水,35℃条件下发酵72 h后,油脂含量降低至300mg/L以下。米根霉(Rhizopus oryzae)和米曲霉(Aspergillusoryzae)是发酵工业中的重要霉菌,通常应用于腐乳[25]和酱油[26]等发酵食品中。朱东奇等[27]发现,一株米根霉所产脂肪酶具有水解鳀鱼油富集二十二碳六烯酸(docosahexaenoic acid,DHA)的应用潜能。廖焰焰等[28]从豆豉中分离筛选出一株高产脂肪酶菌株,在豆豉发酵过程对其外观及风味的变化具有重要影响,以期为豆豉工业化生产提供理论依据。谭婷婷等[29]从北方黄酒麦曲中筛选出多枝横梗霉,其产脂肪酶的研究却未见报道。2.3菌株对4-甲基辛酸和4-乙基辛酸的降解
各菌株发酵后,所测得脂肪酸含量如表5所示,各菌株发酵后4-甲基辛酸和4-乙基辛酸的含量都明显减少。由于这两种辛酸本身具有一定的挥发性,在不接种菌液的空白对照组中,4-甲基辛酸的减少量达到31.03%,4-乙基辛酸的减少量达到30.36%,所示实验组中4-甲基辛酸的实际减少量为30%~70%之间,而4-乙基辛酸的实际减少量为10%~70%之间。
表5 菌株发酵后脂肪酸含量
Table 5 Fatty acid contents after strains fermentation
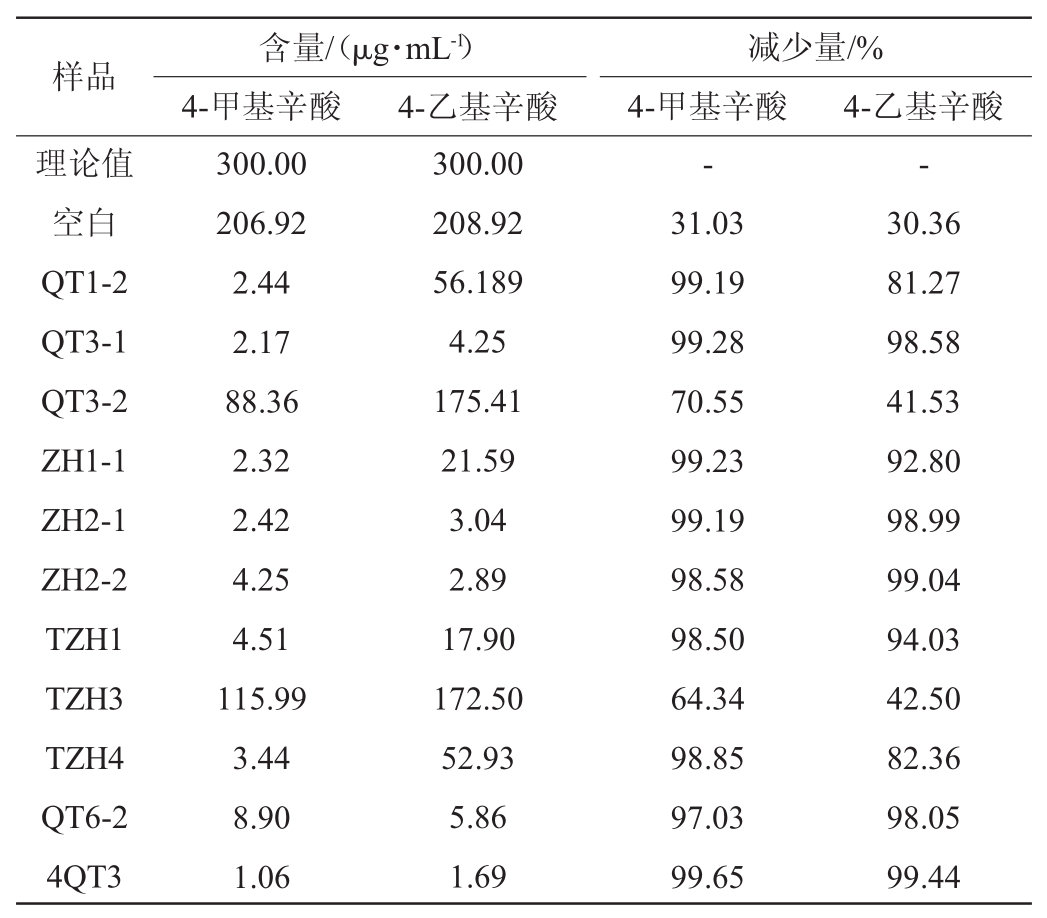
样品理论值空白QT1-2 QT3-1 QT3-2 ZH1-1 ZH2-1 ZH2-2 TZH1 TZH3 TZH4 QT6-2 4QT3 300.00 206.92 2.44 2.17 88.36 2.32 2.42 4.25 4.51 115.99 3.44 8.90 1.06-31.03 99.19 99.28 70.55 99.23 99.19 98.58 98.50 64.34 98.85 97.03 99.65-30.36 81.27 98.58 41.53 92.80 98.99 99.04 94.03 42.50 82.36 98.05 99.44含量/(μg·m L-1)4-甲基辛酸减少量/%4-甲基辛酸 4-乙基辛酸300.00 208.92 56.189 4.25 175.41 21.59 3.04 2.89 17.90 172.50 52.93 5.86 1.69 4-乙基辛酸
3 结论
本研究以筛选产脂肪酶菌株的经典方法为基础进行改良,用乳化羊油代替其中的橄榄油,能准确分离筛选出作用于羊油脂的产脂肪酶菌株。成功分离出6株细菌,分别为QT1-2、QT3-1、QT3-2、ZH1-1、ZH2-1、ZH2-2;5株霉菌,分别为TZH1、TZH3、TZH4、QT6-2、4TQ3。这12株菌均能产生脂肪酶,菌落在波长365 nm的紫外光下均能观察到荧光圈。通过形态观察、生理生化鉴定和分子生物学鉴定,最终确定菌株QT1-2为产碱普罗维登斯菌(Providenciaalcalifaciens),菌株QT3-1为肺炎克雷伯氏菌(Klebsiellapneumoniae),菌株QT3-2为霍式肠杆菌(Enterobacterhormaechei),菌株ZH1-1为产酸克雷伯氏菌(Klebsiella oxytoca),菌株ZH2-1为铜绿假单胞菌(Pseudomonas aeruginosa),菌株ZH2-2为弗氏柠檬酸杆菌(Citrobacterfreundii);菌株TZH1为微孢根霉(Rhizopusmicrosporus),菌株TZH3为米根霉(Rhizopusoryzae),菌株TZH4为米曲霉(Aspergillusoryzae),菌株QT6-2为黄曲霉(Aspergillusflavus),菌株4QT3为多枝横梗霉(Lichtheimiaramosa)。
用分离得到的11株菌对4-甲基辛酸和4-乙基辛酸的混合溶液进行发酵,结果表明,这11株均对这两种脂肪酸具有降解作用,其中4-甲基辛酸的减少量为10%~70%之间,而4-乙基辛酸的减少量为10%~70%。其中菌株TZH1、TZH3、TZH4和4QT3能应用于食品工业,而其余7株菌为条件致病菌,不能直接应用于食品,但可以通过基因工程等手段,对其降解膻味脂肪酸的基因片段进行研究及应用。对产脂肪酶菌株的分离鉴定及其对膻味脂肪酸降解能力的研究可以为今后羊肉除膻和发开新型羊肉制品奠定基础。
[1]郑灿龙.羊肉的营养价值及其品质的影响因素[J].肉类研究,2003(1):47-48.
[2]索效军,张年,李晓锋,等.羊肉风味物质及影响因素的研究进展[J].湖北农业科学,2012(23):5259-5263.
[3]WONG E,JOHNSON CB,NIXON L N.The contribution of 4-methyloctanoic(hircinoic)acid tomutton and goatmeat flavour[J].Nz J Agr Res,1975,18(3):261-266.
[4]BRENNAND CP,LINDSAY RC.Distribution of volatilebranched-chain fatty acids in various lamb tissues[J].M eat Sci,1992,31(4):411-421.
[5]RHEEK S,CHO SH,KIM JO,etal.Lipid classes,fatty acids,flavorand storagestability ofwashed sheepmeat[J].J Food Sci,1998,63(1):168-172.
[6]唐璐,江明锋,王永.羊肉膻味物质的研究进展[J].动物营养学报,2014,26(8):2064-2070.
[7]穆莎茉莉.羊肉发酵脱膻与方便羊肉汤锅加工研究[D].重庆:西南大学,2007.
[8]赵丽华.羊肉发酵干香肠品质特性及挥发性风味变化及其形成机理研究[D].呼和浩特:内蒙古农业大学,2009.
[9]苗君莅,张锋华,肖杨,等.酶解稀奶油使牛奶增香的脂肪酶产生菌的筛选及产酶条件优化[J].中国酿造,2012,31(9):121-124.
[10]李雪玲,陈智明,周伟坚.脂肪酶产生菌的筛选及不同保藏方法对其产酶活性的影响[J].食品科技,2015,40(3):2-6.
[11]董明奇,史岩,姜春雷,等.脂肪酶高产菌株的筛选及酶学特性研究[J].四川大学学报(自然科学版),2008(4):985-990.
[12]BUKANNKN R E,JIBENSIN E,等.伯杰氏系统细菌学手册[M].北京:科学出版社,1984:16-828.
[13]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:1-645.
[14]黄峥,盛灵慧,马康,等.5种脂肪酸甲酯化方法的酯化效率研究[J].中国油脂,2013,38(9):86-88.
[15]SIPAHIO R,BARDAK-OZCEM S,OZGIRAY E,et al.Meningitis due to Providenciastuartii[J].J Clin M icrobiol,2010,48(12):4667-4668.
[16]张迁.普罗维登斯菌酸性脲酶的原核表达及构效基本分析[D].无锡:江南大学,2016.
[17]刘树丽,段正洋,徐龙乾,等.克雷伯氏菌活细胞和死细胞对水中Pb(Ⅱ)的去除性能[J].农业环境科学学报,2018,37(10):2278-2288.
[18]LIU Y,HUANG L,GUOW,etal.Cloning,expression,and characterization of a thermostableand pH-stable laccase from Klebsiella pneumoniae and itsapplication to dye decolorization[J].Process Biochem,2017,53:125-134.
[19]GALEEF,EPPSHM.Theeffectof thepH of themedium during grow th on the enzymic activities of bacteria(Escherichia coli and M icrococcus lysodeikticus)and thebiologicalsignificance of the changes produced[J].Biochem ical J,1942,36(7-9):600-618.
[20]岳喜庆,王桐,单提波,等.霍氏肠杆菌WM 1产青霉素酶发酵条件的研究[J].中国酿造,2010,29(8):91-93.
[21]刘梦佳,任嘉瑞,张耀相,等.弗氏柠檬酸杆菌的分离与鉴定[J].畜牧兽医杂志,2017,36(4):3-6.
[22]罗会颖,石鹏君,李江,等.弗氏柠檬酸杆菌植酸酶的分离纯化及其酶学性质研究[J].微生物学报,2006(1):139-142.
[23]贺建超,杨云云,贺榆霞,等.1株产纤维素酶高温根霉的分离和鉴定[J].陕西农业科学,2012,58(1):72-74,89.
[24]ALBERTON D,M ITCHELLD A,JESU′SCORDOVA,etal.Production of a fermented solid containing lipases of Rhizopusmicrosporus and its application in the pre-hydrolysis of a high-fat dairy wastewater[J].Food Technol Biotech,2010.
[25]李顺.总状毛霉和米根霉混合发酵腐乳研究[D].合肥:合肥工业大学,2017.
[26]童星,彭勃.一株高酶活力米曲霉菌株的选育及其在酱油生产中的应用[J].中国酿造,2018,37(11):51-55.
[27]朱东奇,李道明,王卫飞,等.重组米根霉脂肪酶的酶学性质及其催化水解鳀鱼油富集DHA的研究[J].粮油食品科技,2016,24(6):21-25.
[28]廖焰焰,张菊,李翔,等.传统曲霉型豆豉中高产脂肪酶的米曲霉筛选及鉴定[J].江西师范大学学报(自然科学版),2018,42(5):494-499.
[29]谭婷婷,王家林,桑戈,等.北方黄酒麦曲中真菌的筛选、鉴定及系统发育分析[J].安徽农业科学,2015,43(17):15-16,71.