产香酵母是一类可以产生挥发性香味化合物的酵母[1-2]。产香功能性微生物的范围没有明确的定义,产香酵母除了能够产生醇类和酯类,还能生成酮类、醛类等化合物,形成多种风味物质,在代谢过程中产生多种维生素、氨基酸,还能产生某些生物活性物质,增强人体免疫力[3]。
苹果营养丰富,但苹果的消费方式主要以鲜果消费为主,消费方式单一导致苹果出现生产过剩、效益下降的尴尬局面。苹果酒的口味柔和,兼具苹果的水果香味,是老少皆宜的佳酿,因此,开发高品质苹果酒成为苹果消费的新趋势。
苹果酒中的挥发性香味物质成分复杂多样,已知的有上百种,主要为醇、酯、萜、醛类物质等[4-5]。这些香味物质有的来源于果实,有的来源于工艺阶段。W ILLIAMSA A等[6]采用SweetCoppin的苹果汁制作苹果酒,发现苹果中固有的挥发性香味物质成分对苹果酒的香味影响很小。根据MORTON ID等[7]报道,不同品种苹果汁发酵的苹果酒中,还能被分辨出是苹果果实香气的只有金冠等比较典型风味的苹果品种;其他大部分品种苹果酒的香气不能被辨别。尚宏芹[8]综述了苹果酒中主要的香气成分及其来源,并介绍了国内外苹果酒中香气成分的提取和分析方法,揭示了苹果酒的香气成分是构成苹果酒质量的重要因素,决定着苹果酒的风味和典型性。于爱梅等[9-10]研究认为苹果中的挥发性物质的种类和含量对苹果酒的影响重大。苹果酒产业在我国起步相对较晚,生产工艺上不成熟,且发酵用的菌株来源不明,缺乏安全性和明确性,并且产品同质化现象严重。因此,开发安全性高、品质好的苹果酒成为苹果酒产业的一个重要研究方向。产香酵母对酒的感官风味有特别的贡献,但是目前直接应用到低醇果酒生产中的产香酵母菌株仍很匮乏。本实验从赤霞珠葡萄酒酿造不同时期的发酵液中分离获得酵母菌资源,并从中筛选出具有较好产香特性的菌株,研究其对苹果酒发酵特性的影响,为该菌株今后的工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
供试菌株:分离自赤霞珠葡萄酒(本实验室自制,其中赤霞珠葡萄采自郑州NAPA酒庄)酿造不同时期的发酵液,共80株酵母菌株,分别编号为S1-1、3、4、8、13,S2-1~5,S3-9、11、13、14、15,S4-10~14,A1-3~7,A2-11、12、13、14、16,A3-4、10、11、14、15,A4-10 ~14,B1-1、2、5、6、7,B2-9、11、12、13、14,B3-1、3、6、11、13,B4-3、5、6、7、8,D1-11、13、18、19、20,D2-1~5,D3-2、3、10、11、12,D4-4、5、6、8、9。其中S、A、B、D对应于发酵1d、3d、5 d、7 d,下标1~4表示酒样的四个重复。安琪酿酒酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司。
1.1.2 化学试剂
酵母浸粉(生化试剂):北京双旋微生物培养基制品厂;葡萄糖(分析纯):天津市永大化学试剂有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;Ezup柱式基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、26S rDNA D1/D2区扩增引物NL-1和NL-4以及5.8 ITS区扩增引物ITS-1和ITS-4:生工生物工程(上海)股份有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeastextract peptone dextrose,YEPD)液体培养基:酵母浸粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,自然pH,121℃高压蒸汽灭菌20min。
YEPD固体培养基:酵母浸粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,琼脂粉20 g/L,自然pH,121℃高压蒸汽灭菌20min。
1.2 仪器与设备
SW-CJ-2D超净工作台:苏州净化安泰公司;DH-600生化培养箱:北京中兴伟业仪器有限公司;TGL-16G台式离心机:上海安亭科学仪器厂;C1000 TouchTM聚合酶链反应(polymerasechain reaction,PCR)扩增仪:美国Bio-Rad公司;JY023紫外分析仪:北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 菌株初筛
将80株供试菌株分别接种到YEPD固体培养基中,28℃,避光培养2 d,嗅觉灵敏的人员对挥发性风味物质进行感官评估(通过嗅闻法,依据所闻到的香味浓郁程度进行初步评估)。
1.3.2 菌株复筛
将经过初筛得到的产香浓郁的7菌株进行复筛,分别考察其对酒精、SO2、NaCl耐受性。
酒精耐受性的测定:将菌悬液接种至不同酒精含量(8%vol、10%vol、12%vol、14%vol、16%vol)的YEPD液体培养基(接种量为1%),28℃、180 r/min培养至对数期(培养24 h),用比浊法判断菌株酒精耐受性能(比较其在波长600 nm条件下的吸光度值,其值越大,表明耐受性越高,取3组重复的平均值。下同)。
SO2耐受性的测定:将菌悬液接种至不同SO2含量(100mg/m L、120mg/mL、140mg/m L、160mg/mL)的YEPD液体培养基,28℃、180 r/m in培养至对数期(培养24 h),用比浊法判断菌株耐受性能。
NaCl耐受性的测定:将菌悬液接种至不同NaCl含量(0、4%、6%、8%、10%)的YEPD液体培养基,28℃、180 r/m in培养至对数期(培养24 h),用比浊法判断菌株耐受性能[13]。
1.3.3 产香酵母的分子生物学鉴定方法
酵母菌26S rDNA D1/D2区和5.8S-ITS区序列的PCR扩增与检测:采用倪峥飞等[14-15]的实验方法进行酵母菌株基因组DNA的提取,使用正向引物NL-1和反向引物NL-4扩增26S rDNA D1/D2区段。使用正向引物ITS1和反向引物ITS4进行5.8S-ITS区基因扩增[16],PCR反应体系和程序参见刘爱国等[17]的研究方法,结果检测参照张俊杰等[18]的检测方法。
PCR扩增产物的测序及分类地位的确定:PCR扩增产物由生工生物工程(上海)股份有限公司测序,序列结果用MEGA 7.0软件进行校正,校正序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库中局部序列比对基本检索工具(basic localalignment search tool,BLAST)进行同源序列比对,确定该菌株的分类地位。
1.3.4 苹果酒加工工艺及操作要点
原料前处理→苹果榨汁→过滤残渣→添加菌种→密封发酵→苹果酒
操作要点:
将苹果洗净去皮,并切为小块,放入榨汁机中,不加水,直接榨汁。榨汁后的汁液用八层纱布过滤两次,并对得到的汁液进行糖度的测定,若糖度太低则需要加入葡萄糖调节。将培养至对数生长期的安琪果酒酵母和菌株B2-13按照1%的接种量,在无菌条件下接种至苹果汁中,并加入10mmol/L亚硫酸氢钠。苹果汁液密封,28℃条件下发酵7 d,当糖度<5 g/L时,即可终止发酵,得到苹果酒。
1.3.5 分析检测
苹果酒中残糖含量的测定[20]:采用斐林试剂法测定苹果酒中残糖含量;苹果酒中可滴定酸含量的测定[20]:采用酸碱滴定法测定苹果酒中可滴定酸含量;苹果酒中挥发性香气成分的测定:采用同时蒸馏法萃取酒中的香气成分,并进行气质联用(gas chromatography-mass spectrometry,GC-MS)法分析[21]。GC-MS条件如下:
气相色谱(GC)条件:分流方式:不分流;升温程序:初始温度40℃,保持3min,然后以3℃/min升至120℃,最后以8℃/min升至230℃;载气:氦气(He);流速:2m L/min;检测器温度:230℃,入口温度:230℃。
质谱(MS)条件:电子电离(electronic ionization,EI)源,电子能量70eV,离子源温度230℃,扫描范围33~350 u。将萃取好的针插入GC进样口,在230℃解吸附5m in[22]。
定性定量分析:苹果酒香气成分GC-MS检测结果运用计算机检索并与图谱库的标准质谱图对照,结合有关文献,确认化学成分,内标乙酸苯乙酯(0.668mg/m L)用于定量分析。
2 结果与分析
2.1 产香菌株初筛结果分析
80株菌株经过初步筛选,有7株供试菌株产香浓郁,分别编号为A2-12、B1-5、B2-12、B2-13、B4-7、S1-8、S2-4,17株菌株产香稍淡,19株菌株产香微弱,而剩余37株菌株几乎无香味。结果表明大部分的供试菌株并不具备较好的产香能力。因此,将菌株A2-12、B1-5、B2-12、B2-13、B4-7、S1-8、S2-4进行耐受性测定。
2.2 产香菌株复筛结果分析
以安琪酵母菌(Angel)为对照,菌株A2-12、B1-5、B2-12、B2-13、B4-7、S1-8、S2-4耐受性(耐SO2、耐NaCl、耐酒精)分析结果见表1~表3。
表1 菌株SO2耐受性结果
Table 1 Results of SO2 tolerance of strains

菌株编号A2-12 S2-4 S1-8 B4-7 B2-13 B1-5 B2-12 Angel 2.134 2.188 2.015 2.141 2.017 2.036 2.046 2.021 2.111 2.115 1.929 2.096 1.958 1.784 2.010 1.990 2.060 2.124 1.735 2.115 1.788 1.342 1.602 2.015 1.981 1.399 1.792 2.088 1.671 1.191 1.060 2.000 SO2含量/(mg·m L-1)100 120 140 160
由表1可知,8株菌对SO2都有很好的耐受性(在120mg/m L含量下生长基本不受影响,此外在160mg/m L含量下都能有较多的生长量)。其中菌株A2-12、S2-4、B4-7、Angel的耐SO2能力更加优异(在160mg/m L含量下,生长几乎不受影响);菌株S1-8、B2-13、B1-5、B2-12的耐SO2能力相对较差(在140mg/m L含量下,其生长受到了明显的抑制,在160mg/m L含量下,生长量更少)。因此,菌株A2-12、S2-4、B4-7、Angel耐受SO2能力更强。
表2 菌株盐耐受性结果
Table 2 Results of salt tolerance of strains

菌株编号A2-12 S2-4 S1-8 B4-7 B2-13 B1-5 B2-12 Angel 2.187 2.178 2.239 2.187 2.001 2.080 2.131 2.122 1.772 1.892 1.845 1.871 1.823 1.756 1.859 1.032 1.592 1.760 1.804 1.668 1.672 1.386 0.801 0.467含盐量/%0 4 6 0.942 1.015 0.567 0.271 0.034 0.276 0.065 0.192 0.059 0.053 0.060 0.787 0.157 0.047 0.061 0.097 8 10
由表2可知,8个菌株在耐盐性能均较差。在含盐量0~8%范围内,随着含盐量的增加,8个菌株的吸光度值梯度型减少,在无盐量条件下,所有菌株的OD600nm值都>2.0,在含盐量为8%的条件下,几乎所有菌株的OD600nm值都降到了1.0以下;其中菌株S2-4的表现优异,OD600nm值均大于其他菌株,尤其在含盐量为8%的时候表现明显优异于其他菌株,OD600nm值>1.0;菌株B2-12和Angel两个菌株的耐盐性能相对较差,在含盐量为6%的时候比其他6个菌株的表现差,OD600nm值均<1.0。
表3 菌株酒精耐受性结果
Table 3 Results of alcohol tolerance of strains
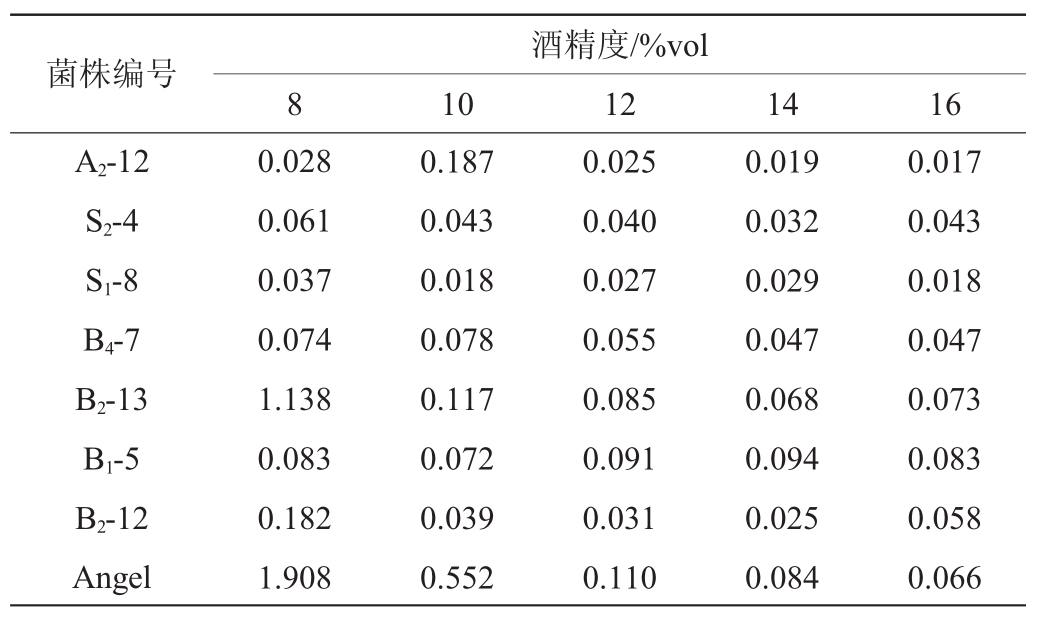
菌株编号A2-12 S2-4 S1-8 B4-7 B2-13 B1-5 B2-12 Angel 0.028 0.061 0.037 0.074 1.138 0.083 0.182 1.908 0.187 0.043 0.018 0.078 0.117 0.072 0.039 0.552 0.025 0.040 0.027 0.055 0.085 0.091 0.031 0.110酒精度/%vol 8 10 12 0.019 0.032 0.029 0.047 0.068 0.094 0.025 0.084 0.017 0.043 0.018 0.047 0.073 0.083 0.058 0.066 14 16
由表3可知,8个菌株中Angel的耐酒精能力最强,在酒精度为8%vol和10%vol的表现上远远超过其他7个菌株,其他菌株在酒精度为10%vol时的菌株含量已经几乎为零;其中菌株B2-13相较于其他6个菌株在酒精度为8%vol表现优异;菌株B2-12相较于其他菌株也表现出了一定的酒精耐受性。
对表1~表3的所有耐受性实验数据进行显著性分析,结果表明,7株菌和对照组安琪酵母在耐SO2、耐盐性能方面的差异不显著(P>0.05)。但是,在酒精耐受性方面,菌株B2-13相较于其他6个菌株表现优异,此外,只有该菌株在酒精度为8%vol时,OD600nm值>1.0。因此,进一步对菌株B2-13(分离自发酵5 d的苹果酒样)进行鉴定并应用于苹果酒的发酵研究。
2.3 菌株鉴定结果
对菌株B2-13的26S rDNA和5.8S ITS序列进行BLAST比对发现,菌株B2-13与葡萄酒有孢汉逊酵母(Hanseniaspora uvarum)的相似性达到99%。基于26S rDNA序列构建系统发育树,结果见图1。由图1可知,菌株B2-13与葡萄酒有孢汉逊酵母(Hanseniasporauvarum)聚于一支,因此,酵母菌株被鉴定为B2-13葡萄酒有孢汉逊酵母(Hanseniasporauvarum)。

图1 基于26S rDNA序列菌株B2-13的系统发育树
Fig.1 Phylogenetic tree of strain B2-13 based on 26S rDNA sequences
2.4 发酵苹果酒香气成分结果分析
香气成分的GC-MS分析结果见图2。由图2可知,由不同菌种发酵的苹果酒中的香气成分有一定的差异,在由安琪牌果酒酵母发酵的苹果酒中,共检出29种香气成分,主要有酯类(10种)、醛酮类(仅有呋喃甲醛)、醇类(5种),酸类(9种)等,其中异戊醇、苯乙醇含量最高,分别为0.871mg/m L和0.481mg/m L,其次为癸酸乙酯和十二酸乙酯,分别为0.065mg/m L和0.049mg/mL,另外酸类如辛酸和癸酸分别为0.042mg/m L和0.043mg/m L。其余物质含量很低;而在由菌株B2-13发酵的苹果酒中,共检出32种香气成分,主要有酯类(6种)、醛酮类(4种)、醇类(6种)、酸类(8种)等,其中醇类如异戊醇、苯乙醇含量最高,分别为0.356mg/m L和0.135mg/mL,另外醛酮类3-羟基-2-丁酮的含量为0.160mg/mL,其余含量很低。高级醇、酯类是影响苹果酒风味的主要成分。综合以上结果,与安琪牌果酒酵母相比,由菌株B2-13发酵的苹果酒中的香气成分更多,尤其是醛酮类的香气成分更多。其次,含有一种特有的香气成分醛酮类3-羟基-2-丁酮,该香气成分更多地存在于赤霞珠葡萄酒中,并且与其他葡萄品种相比,是其特有的香气成分。Hanseniaspora属的菌株有较好的产香能力,这与赵海霞等[23]的研究结果较为一致。因此,将菌株B2-13应用苹果酒的发酵中,可能赋予其一定的赤霞珠葡萄酒风味,具有一定的推广应用价值。

图2 菌株Angle(A)及菌株B2-13(B)发酵苹果酒中香气成分测定结果
Fig.2 Results of the aroma components in cider fermented by strain Angle(A)and strain B2-13(B)
3 结论
经过初步筛选,从80株酵母菌株中筛选得到7株产香浓郁的菌株,对这些菌株进行耐受性分析时,发现在耐SO2性能、耐盐性能方面,菌株并无明显差异,但是在耐酒精能力方面菌株B2-13较突出,该菌株经分子生物学鉴定为葡萄酒有孢汉逊酵母(Hanseniaspora uvarum)。
菌株B2-13发酵苹果酒酒精度为4.2%vol~5.5%vol,糖度为2.6~44 g/L,共鉴定出32种香气成分,主要有酯类(6种)、醛酮类(4种)、醇类(6种)、酸类(8种)等,其中异戊醇、苯乙醇含量最高,分别为0.356mg/m L和0.135mg/m L,另外还有赤霞珠干红葡萄酒的特有香气物质3-羟基-2-丁酮(0.16mg/m L)。菌株B2-13是一株具有较好的苹果酒发酵和产香性能的酵母菌株,有良好的工业化生产应用前景。
[1]叶萌祺,袁亚宏,岳田利,等.产香酵母分离鉴定与苹果酒发酵中的应用[J].农业机械学报,2013,44(12):187-192.
[2]王刚,邢家溧,印伯星,等.泡菜、豆酱中产香酵母菌的筛选及其在面包制作中的应用[J].食品科学,2014,35(23):155-160.
[3]侯小歌,王俊英,李学思,等.浓香型白酒糟醅及窖泥产香功能菌的研究进展[J].微生物学通报,2013,40(7):1257-1265.
[4]FELLMAN JK,RUDELLD R,MATTINSON D S,etal.Relationship of harvestmaturity to flavor regenerationafterCA storageof'Delicious'apples[J].Posth Biol Technol,2003,27(1):39-51.
[5]彭帮柱,岳田利,袁亚宏,等.气相色谱-质谱联用法分析苹果酒香气成分的研究[J].西北农林科技大学学报(自然科学版),2006,34(1):71-74.
[6]WILLIAMS A A,TUCKNOTT O G.The volatile aroma components of fermented cider:minorneutral components from the fermentation of sweet Coppin apple juice[J].JSci Food Agr,2010,29(4):381-397.
[7]MORTON ID,MACLEND A J.Food Flavour-Part B,The Flavour of Beverages[M].Amsterdam:Elsevier,1986:85-97.
[8]尚宏芹.苹果酒的香气成分研究进展[J].中国酿造,2010,29(5):25-28.
[9]于爱梅,徐岩,王栋,等.发酵原料对苹果酒挥发性香气物质影响的分析[J].中国农业科学,2006,39(4):786-91.
[10]汪立平,徐岩,王栋,等.苹果酒香气成分研究进展[J].食品与发酵工业,2002,28(7):59-65.
[11]张俊杰,尚益民,程大伟,等.河南民权地区赤霞珠葡萄表皮酵母菌的多样性研究[J].酿酒科技,2018(9):31-36.
[12]李豪,章霞,张静,等.草莓果酒酵母菌的筛选、鉴定及耐受性研究[J].中国酿造,2017,36(2):85-88.
[13]刘英丽,李文采,张慧娟,等.传统发酵食品产香酵母菌的筛选及其发酵产香特性研究[J].中国食品学报,2015,15(4):63-70.
[14]倪峥飞.镇江香醋固态发酵过程中酿造微生物强化及醋醅总DNA提取方法的初步研究[D].无锡:江南大学,2009.
[15]张俊杰,杨旭,焦健,等.不同株系赤霞珠葡萄表皮酵母菌的多样性研究[J].中国酿造,2017,36(6):126-31.
[16]刘爱国.宁夏贺兰山东麓葡萄酿酒酵母菌的分离及其分类鉴定[D].杨凌:西北农林科技大学,2008.
[17]刘爱国,刘延琳,王泽举,等.宁夏葡萄自然发酵过程中酵母菌的分子生物学鉴定[J].西北农林科技大学学报(自然科学版),2008,36(11):203-207.
[18]张俊杰,尚益民,程大伟,等.河南安阳赤霞珠葡萄果表酵母菌的分离与鉴定[J].轻工学报,2018,33(3):39-44.
[19]宋静,夏玲玲,张玉刚,等.苹果酒发酵工艺对比研究[J].中国酿造,2014,33(4):71-74.
[20]李记明,樊玺,阮士立,等.苹果酒香味成分与感官质量研究[J].食品与发酵工业,2006,32(7):87-90.
[21]李彬,王龙.同时蒸馏萃取刺玫果挥发性香味成分分析[J].河北农业科学,2018,22(3):78-82.
[22]王洋洋,王积武,吴志莲,等.不同酵母菌株发酵苹果酒香气成分比较[J].食品工业,2016,37(8):280-284.
[23]赵海霞,华惠敏,吴桂君.野生苹果酒产香酵母的分离及筛选[J].中国酿造,2014,33(6):119-122.