果聚糖是β-D-呋喃果糖的多聚体,是由蔗糖与一个或多个果糖分子连接而成的水溶性或黏性的高分子多糖。果聚糖存在于某些被子植物(约15%)、细菌和少数真菌中,具有多种生理功能和生物活性。在植物中,除了作为碳水化合物的储备库,果聚糖还可以通过稳定细胞膜来提高植物耐寒和抗旱的能力[1]。在人体内,果聚糖选择性促进双歧杆菌和乳酸菌等肠道有益细菌的生长,促进钙、镁元素的吸收,抑制龋齿和结肠癌的产生[2-3]。因此,果聚糖常被添加到功能食品和饲料中。
糖苷水解酶(glycoside hydrolases,GH)第32家族负责果聚糖糖苷键的水解或合成,包括菊粉酶、蔗糖酶、果聚糖酶等水解酶类和果糖基转移酶类。此家族有共同的三维结构特征:N-端5-折叠β-螺旋浆形成的催化结构域和C-端β-折叠片形成的类似三明治的非催化结构域[4]。目前对于GH32家族N-端催化结构域的研究比较深入,对C-端非催化结构域的功能认知较少,但发现其在底物结合[5-6]和调节底物特异性[7]方面发挥重要作用。
有关GH32家族结构的研究可以追溯到20世纪90年代,早期的研究主要是通过定点突变和化学修饰来确定酶的催化活性中心[8-9],随后对保守区域氨基酸所起的作用进行了研究[10-11],同时研究了活性位点周围氨基酸和loop环在酶活性结构稳定性、底物特异性等方面所起的作用[12-13]。研究人员发现围绕在活性位点周围、连接催化结构域中不同元件的loop环和转角决定酶的特异性[4,14]。近年来,分子对接、分子动力学模拟在研究酶与底物的结合及酶结构稳定性方面发挥越来越重要的作用[15-16]。目前,GH32家族已有15种酶的晶体结构得到解析。晶体结构的解析可以确定酶的催化活性中心、酶与底物的结合位点,阐明酶的催化机制和底物特异性,从而明确酶的结构与功能之间的关系,为酶蛋白的分子改造提供理论依据。
本文综述了GH32家族的成员及功能、三维结构、催化活性中心和催化机制,论述了芳香族氨基酸在酶与底物识别中所起的重要作用,以期为GH32家族的结构研究及分子改造提供参考。
1 GH32家族的成员及应用
GH32家族主要来自植物、真菌和细菌,包括两大类:一是对含果糖的糖类物质进行水解的酶类,如酸性蔗糖酶、菊粉酶、果聚糖酶、植物果聚糖外切水解酶(fructan exohy drolases,FEHs);二是具有果糖转移酶活性的转果糖苷酶类,主要是果聚糖生物合成酶类(fructan biosynthetic enzymes,FBEs),如蔗糖1-果糖基转移酶。
蔗糖酶催化蔗糖水解成葡萄糖和果糖,其水解产物是原核生物和真核生物主要的碳能源储备,而且是植物信号通路的重要组成部分,具有感应植物营养状况的作用。因此蔗糖酶在碳分配、控制植物细胞分化和发育中发挥关键作用[3]。根据最适pH值,蔗糖酶可以分为酸性和中性/碱性蔗糖酶,两类蔗糖酶的序列和生化特性都有很大不同[4]。酸性蔗糖酶存在于液泡或细胞壁中,属于GH32家族。
菊粉酶是一类能水解β-2,1-D-果聚糖果糖苷键的水解酶,根据作用底物方式的不同,分为外切菊粉酶和内切菊粉酶。外切菊粉酶是菊芋生物炼制中的关键酶,其能将菊芋一步水解,获得高纯度的果糖浆,生产燃料乙醇、生物柴油、微生物油脂等工业产品,广泛应用在食品、医药及生物能源等领域[5]。内切菊粉酶可以用来生产低聚果糖,聚合度为2~7的低聚果糖是一种功能性多糖,有多种生理功能,如改善肠道内微生物区系,使肠道菌群中双歧杆菌等有益菌数量增加。
植物FEHs用水分子作为果糖基的受体,从果聚糖供体末端释放果糖分子,由FEHs完成的快速的果聚糖降解,被认为是植物果聚糖动员必不可少的过程[6]。与微生物外切菊粉酶和果聚糖酶通常水解蔗糖不同,目前所有植物FEHs都不能降解蔗糖。
FBEs催化果糖单元到蔗糖分子上,负责果寡糖/果聚糖的合成[2]。
2 GH32家族的结构
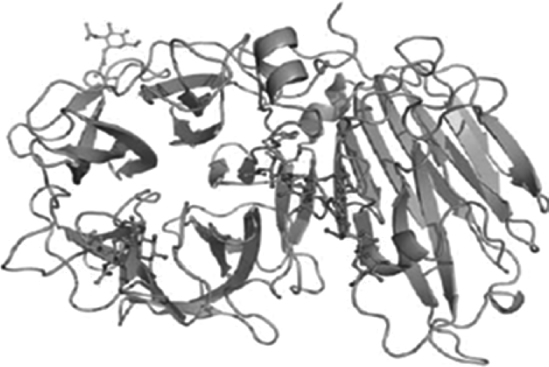
GH32家族由N-端5-折叠β-螺旋浆形成的催化结构域和C-端β-折叠片形成的非催化结构域组成。N-端每个螺旋浆包括4个反向平行的β-折叠片,形成经典的‘W’拓扑结构,辐射状围绕着中心轴,封闭带负电荷的催化活性口袋[17]。每个β-折叠片之间由发卡环连接,β-折叠片4与下一个螺旋浆的β-折叠片1相连。每个螺旋浆的β-折叠片1离中心轴最近,并与中心轴平行。整个N-端结构域的形状类似圆柱形,每个螺旋浆β-折叠片4位于圆柱筒的最外面[17]。地衣芽孢杆菌(Bacillus licheniformis)ATCC 14580来源的6-磷酸蔗糖酶通过亚单位N末端β-折叠片区域的相互作用形成稳定瘦长型同源二聚体[18]。5-折叠β-螺旋浆的晶体结构相对于(β/α)8折叠桶状结构比较少见,主要存在于GH32、GH43、GH62和GH68家族[19],其中GH32和GH68家族归属于GH-J氏族(clan)。GH32家族的结构模式如下[6]:

C-端非催化结构域由2个反向平行的β-折叠片组成,每个β-折叠片包括6股β-折叠线,组装成类似三明治的结构,与凝集素或类凝集素蛋白结构类似。研究发现,酵母来源的多聚体蔗糖酶C-端非催化结构域也具有结合底物、调节底物特异性的作用[6-7]。许旺酵母β-呋喃果糖苷酶二聚体的C-端结构域,通过与另一亚基活性位点复杂的相互作用,参与底物结合并调节底物特异性[7]。同时发现,枯草芽孢杆菌外切果聚糖酶的C-端β-三明治结构域属于多糖结合模块(carbohydratebindingmodule,CBM)66家族[20],CBM具有识别底物、结合底物、使催化结构域接近底物等作用[21-22],从而增大底物附近酶的浓度,以此来提高酶的活性。正是CBM 66与果三糖特异性结合,赋予酶具有底物特异性[20]。N-端和C-端之间由短的多肽链相连,两者之间形成狭长的裂缝,此裂缝可能具有识别长链高聚合度果聚糖底物的作用[23],多个氢键和疏水作用维持这两个结构域处于稳定的位置。
GH32家族第一个晶体结构来自海栖热孢菌(Thermotogamaritima)蔗糖酶,晶体分辨为2Å,揭示了GH32家族的三维结构分为两个结构域:5-折叠β-螺旋浆结构域和β-三明治结构域[24]。此酶底物广泛,不仅可以水解蔗糖,还能水解棉子糖、蔗果四糖和菊粉。无花果曲霉(Aspergillus ficuum)内切菊粉酶晶体结构的解析,揭示了酶具有特异性的内切活性在于围绕着催化活性位点由两个loop环和保守序列WM(I)NDEPG形成的额外口袋[25]。植物中,GH32家族第一个被报道的3D结构是菊苣(Cichorium intybus)来源的果聚糖外切水解酶1-FEH IIa[26]。FEHs在植物中担负着水解果糖的任务,它可能来自有缺陷的蔗糖酶,Asp239位的单突变使拟南芥细胞壁蔗糖酶1(Arabidopsisthalian cell wall invertase1,Atcw INV 1)具有了1-FEH的活性[23]。GH32家族蔗糖酶中首先得到晶体解析的是Atcw INV1[27-28],它只能水解蔗糖,不能水解菊粉。与其他GH32家族不同的是,Atcw INV1的晶体结构显示,N-端与C-端之间的狭长裂缝内存在较长的糖链,糖链会阻止菊粉与酶的结合。因此,推测这个裂缝内存在菊粉结合位点[26]。节杆菌(Arthrobacter ureafaciens)果聚糖转移酶(fructosyl transferase,FTase)催化果聚糖形成环形二果糖苷,三维结构显示其分子基础是活性位点loop环区的序列保守(主要是侧链分子量小的氨基酸),能形成独特的催化活性口袋,即在-1和-2位点容纳环形二果糖苷,而其他GH32家族因loop环序列的改变不存在-2位点[29]。红发夫酵母(Xanthophyllomycesdendrorhous)β-呋喃果糖苷酶(XdINV)的晶体结构解析,首次揭示了N-糖基化修饰参与酶的聚合、调节酶的活性[4]。而白曲霉(Aspergillus kawachii)来源的β-呋喃果糖苷酶(fructofuranosidase,FFase)与果糖底物的晶体结构阐明了此酶具有高活性转果糖基作用的原因,主要是二聚体白曲霉Fase的聚合状态与其他GH32家族酶不同,果糖能同时与-1和+1亚位点结合,+1位点的果糖与Ile146和Glu296通过氢键相互作用[16]。拟南芥细胞壁蔗糖酶1的三维结构模式如下[28]:
3 GH32家族的催化机制
糖苷水解酶对底物糖苷键的水解是通过一般的酸碱催化反应来完成的,需要2个氨基酸残基参与:质子供体和亲核试剂,水解反应发生在-1和+1位点之间[30]。根据底物的异头碳构象水解时是否发生发转,糖苷水解酶的水解反应机制分为两种:保持型和反转型。无论是哪种机制,糖苷水解酶的质子供体与糖苷键氧原子的距离在氢键范围内。在保持型酶中,亲核试剂/碱紧邻糖分子的异头碳原子,平均距离大约为4.5~5.5Å。然而在反转型酶中,亲核试剂与糖分子的异头碳原子之间必须容纳一个水分子,通常平均距离为9.0~9.5 Å[31]。
糖苷水解酶家族的结构并不直接决定酶的催化机制,很多超家族中同时具有保持型和反转型糖苷水解酶。但分属同一家族的水解酶往往具有相同的催化机制。GH32家族的成员属于保持型糖苷水解酶,在进行催化反应时会保留异头碳的构象,通过双取代机制,形成酶-底物中间过渡态来完成水解反应[8]。Atcw INV1的反应机制如图1所示。亲核试剂和酸/碱催化剂分别为D23和E203,经两步反应,蔗糖被水解成果糖和葡萄糖(水为受体)[32]。第一步反应是亲核试剂D23的羧基对底物果糖基的异头碳进行亲核攻击,形成糖-酶共价中间体。酸/碱催化剂E203作为一般的质子供体提供质子给离去基团葡萄糖残基。第二步反应是酸/碱催化剂E203作为广义碱,中和果糖基受体上的质子(蔗糖酶中水为受体),从而水解糖-酶中间体。

图1 拟南芥细胞壁蔗糖酶1的双取代保留反应模式[30]
Fig.1 Double displacement retaining mechanism of sucrase 1 from Arabidopsis thaliana cellwall
4 GH32家族的催化活性中心
GH32家族有3个高度保守的氨基酸,位于催化活性口袋的内部,准确地说,它们是位于色氨酸、甲硫氨酸、天冬酰胺、天冬氨酸、脯氨酸、天冬酰胺、甘氨酸、精氨酸、天冬氨酸、脯氨酸和谷氨酸、半胱氨酸、脯氨酸保守区域中的3个酸性氨基酸,2个天冬氨酸(Asp)(D)和1个谷氨酸(Glu)(E),被称为“催化三联体”,负责结合和催化底物,为GH32家族的催化活性中心[10,16,30]。日本曲霉(Aspergillusjaponicus)CB05果糖基转移酶的催化活性中心见图2,D60/D191/E292为该酶的“催化三联体”[2]。WMNDPNG序列中的Asp为亲核试剂,ECP序列中的Glu担任的是酸/碱催化剂,在催化反应中提供质子,RDP序列中的Asp并不直接参与催化作用,通过H键与果糖分子C3和C4位的羟基相连,在结合底物和稳定底物-酶转换过渡态中发挥重要的作用[30-31]。通过对泡盛曲霉(Aspergillusawamori)外切菊粉酶晶体结构(PDB:1Y4W)的解析,NAGEM R A等[17]研究发现Asp41和Glu241分别为其亲核试剂和酸/碱催化剂。为了阐明RDP保守序列中Asp189在催化反应中的作用,他们将Asp189进行定点突变,得到Asp189Asn的突变体。晶体结构解析表明,Asp189Asn突变并未对催化活性位点氨基酸残基的位置产生较大影响,但使Asp41和Asn189之间可能会形成野生酶中并不存在的H键,这样的H键相互作用将会改变Asp41的亲核性,引起Asp41侧链羟基的电子云密度向Asn189的咪唑基团转移,从而使Asp41的亲核性变弱,影响酶水解蔗糖的效率,但不影响酶的特异性,这为Asp189具有结合和稳定底物的作用提供了结构基础[18]。
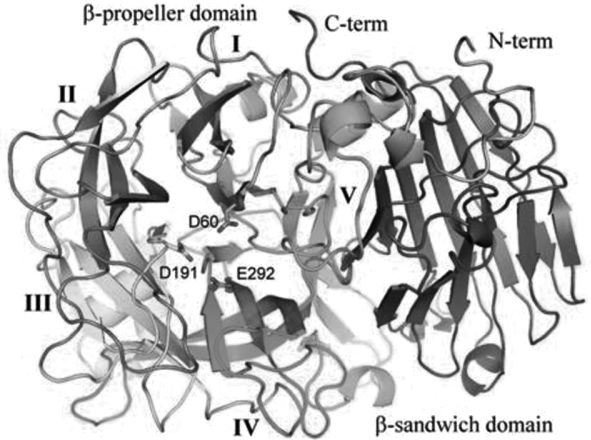
图2 菌株CB05果糖基转移酶的催化活性中心[2]
Fig.2 Catalytic activity center of fructosyltransferase of strain CB05
5 GH32家族中的芳香族区域
酶与糖类底物相互作用时,除了极性基团参与酶对底物的识别,一些非极性C-H基团也可以发挥与众不同的作用,如芳香族氨基酸借助于芳香环与糖分子之间的范德华力和CH-π堆积力发挥稳定糖-酶复合物的作用[23,33]。GH32家族中,在酶催化活性位点周围存在一个主要由色氨酸(Trp)(W)和苯丙氨酸(Phe)(F)组成的芳香族区域,分别位于WMNDPN、WGN和WSGSAT序列中,这个疏水性保守区域对于维持底物与酶的结合具有非常重要的作用。如图3所示,Trp19/Phe46/Trp82组成1-FEH IIa的芳香族区域[23,30]。在GH32家族菊粉酶和蔗糖酶中,第一个序列中的芳香族氨基酸是Trp,然而在FBEs中常以Phe或酪氨酸(Tyr)(Y)代替Trp[34]。在菊粉酶中,第三个序列中的芳香族氨基酸是Phe[25]。Atcw INV1中Trp的单突变使酶对蔗糖表现出米氏常数(K m)值增加,尤其是W 47L突变体的K m值增加了600倍,原因在于W 47最接近催化活性位点,野生酶W 47的芳香环以优势构象与底物相互作用,由于Trp的突变,使得酶与底物的结合不稳定[23]。竹子液泡蔗糖酶和菊苣1-FEH IIa中Trp47的类似物分别为Trp159和Phe46[11,23]。
值得关注的是,芳香族区域氨基酸残基的构象受周围氨基酸的影响,使底物以抑制剂型或底物型两种不同的构象与酶的活性中心结合,改变酶活力。菊苣1-FEH IIa中的丝氨酸(Ser)101会影响Trp 82的构象,将Ser101突变为亮氨酸(Leu)后,1-FEH IIa的底物蔗糖从抑制剂构象变为不稳定的底物构象,从而使1-FEH IIa具有了蔗糖酶活性[35]。1-FEH IIa中抑制剂型蔗糖构象与Atcw INV1中底物型蔗糖的构象明显不同,虽然两者在-1位点的果糖残基构象非常相似,但+1位点葡萄糖残基的构象明显不同(见图4)[35]。Trp82在1-FEH IIa中呈现了与Atcw INV1中Trp82不同的构象。定点突变的研究表明,菊苣1-FEH IIa Trp82的构象受其周围Ser101残基的影响,使蔗糖以抑制剂型的构象与活性位点结合[36]。然而,当许多FEHs中Ser101位被疏水性氨基酸残基(亮氨酸/异亮氨酸/缬氨酸)(Leu/Ile/Val)取代时,101位氨基酸与Trp82类似物产生堆积力,进而阻止蔗糖以抑制剂型构象与催化活性位点结合,这样FEHs具有了水解蔗糖的能力。相反,当101位是小分子甘氨酸(Gly)或Ser时,导致Trp82构象改变,蔗糖以抑制剂型构象与催化活性位点结合,FEHs水解蔗糖的能力被蔗糖强烈抑制[34]。这说明,Trp82的构象决定着蔗糖以抑制型还是底物型与FEHs活性位点结合。
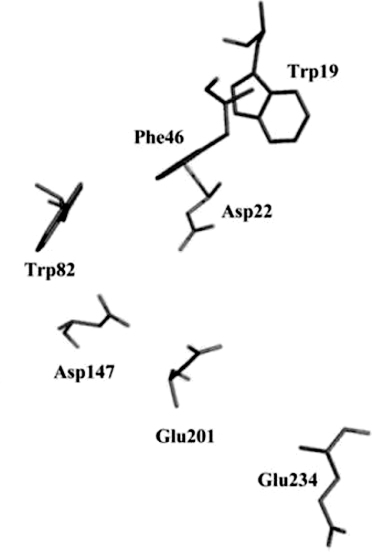
图3 菊苣1-FEH IIa的芳香族区域[23]
Fig.3 Aromatic zone of chicory 1-FEH IIa
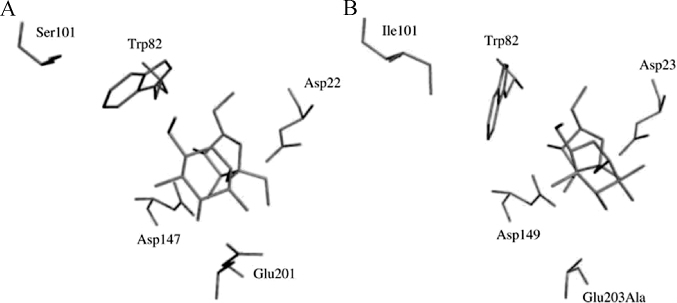
图4 蔗糖作为1-FEH IIa的抑制剂在活性位点的构象(A)以及蔗糖作为Atcw INV1的底物在活性位点的构象(B)[35]
Fig.4 Conformation of sucrose as an inhibitor of 1-FEH IIa(A)or a substrate of Atcw INV1(B)in the active sites
6 展望
近年来,针对GH32家族,科研人员从微生物菌株筛选、诱变改造、酶学性质、克隆表达及同步糖化发酵等方面进行了较多的研究,并初步开始解析其结构和功能基团,然而,现有酶在活力和稳定性方面仍较难达到工业化生产的要求。伴随分子生物学的发展,20世纪80年代兴起的对现有的天然蛋白质进行改造的蛋白分子改造工程是解决这一问题的有效措施。氨基酸序列比对、同源模拟和晶体结构的解析等研究方法,有助于阐明酶与底物的结合位点、酶具有底物特异性的结构基础,加深我们对酶结构、底物结合和催化机理的认知,为酶分子的改造提供理论基础。尤其是酶与底物晶体结构的解析,能揭示酶具有特异性的分子基础,在此基础上进行改造,可以实现酶的“量身定制”,将现有的酶分子改造成适合工业生产、具有商业应用价值的工具酶,丰富现有的酶库。
[1]LAMMENSW,LERK,YUAN S,etal.Crystalstructureof 6-SST/6-SFT from Pachysandra terminalis,a plant fructan biosynthesizing enzyme in complexwith itsacceptorsubstrate6-kestose[J].Plant J,2012,70(2):205-219.
[2]CHUANKHAYAN P,HSIEH C Y,HUANG Y C,etal.Crystal structures of Aspergillus japonicus fructosyltransferase complex with donor/acceptor substrates revealcomplete subsites in theactive site for catalysis[J].J Biol Chem,2010,285(30):23251-23264.
[3]ALMERIGA-DIAZC J,GUTIERREZAM,BAHAMON I,etal.Computational analysis of the fructosyltransferase enzymes in plants,fungi and bacteria[J].Gene,2011,484:26-34.
[4]RAM IREZ-ESCUDERO M,GIMENO-PEREZM,GONZALEZ B,et al.Structural analysis ofβ-fructofuranosidase from xanthophyl lomyces dendrorhous reveal unique features and the crucial role of N-glycosylation in oligomerization and activity[J].JBiol Chem,2016,291(13):6843-6857.
[5]ALVAROl-BENITOM,POLO A,GONZALEZB,etal.Structuraland kinetic analysis of Schwanniomyces occidentalis invertase reveals a new oligomerization pattern and the role of its supplementary domain in substratebinding[J].JBiol Chem,2010,285(18):13930-13941.
[6]SAINZ-POLO M A,RAM IREZ-ESCUDERO M,LAFRAYA A,et al.Three-dimensional structure of Saccharomyces invertase:role of a noncatalytic domain in oligomerization and substrate specificity[J].J Biol Chem,2013,288(14):9755-9766.
[7]ALVARO-BENITOM,SAINZ-POLOM A,GONZALEZ-PEREZD,etal.Structuraland kinetic insightsrevealthattheaminoacid pairGln-228/Asn-254 modulates the transfructosylating specificity of Schwanniomyces occidentalis beta-fructofuranosidase,an enzyme thatproduces prebiotics[J].J Biol Chem,2012,287(23):19674-19686.
[8]MALEY F.Studies on identifying the catalytic role of Glu-204 in the active siteofyeastinvertase[J].JBiol Chem,1996,271(24):13953-13958.
[9]PARK S,HAN Y,KIM H,et al.Trp17 and Glu20 residues in conserved WMNDEPN motif are essential for Aspergillus ficuum endoinulinase activity[J].Biochem istry,2003,68(6):658-661.
[10]VANDAMME A M,M ICHAUX C,MAYARD A,et al.Asparagine 42 of the conserved endo-inulinase INU2motifWMNDPN from Aspergillus ficuum playsa role in activity specificity[J].FEBSOpen Bio,2013,3:467-472.
[11]CHEN T H,HUANG Y C,YANG C S,et al.Insights into the catalytic properties of bamboo vacuolar invertase through mutational analysis of active site residues[J].Phytochem istry,2009,70(1):25-31.
[12]ARJOMANDMR,HABIBI-REZAEIM,AHMADIANG,etal.Deletion of loop fragmentadjacent to activesite dim inishes the stability and activity of exo-inulinase[J].Int J Biol M acromol,2016,92:1234-1241.
[13]ARJOMANDM R,AHMADIANG,HABIBI-REZAEIM,etal.The importance of the non-active site and non-periodical structure located histidine residue respect to thestructureand function ofexo-inulinase[J].Int J Biol Macromol,2017,98:542-549.
[14]TROLLOPE K M,VANWYK N,KOTJOMELA M A,et al.Sequence and structure-based predictionof fructosyltransferaseactivity for functional subclassification of fungal GH32 enzymes[J].FEBS J,2015,282(24):4782-4796.
[15]OLARTE-AVELLANEDA S,RODRIGUEZ-LOPEZ A,PATINO JD,et al.In silico analysisof the structure of fungal fructooligosaccharides-synthesizing enzymes[J].Interdiscipl Sci,2018,10(1):53-67.
[16]M IASNIKOV A N.Characterization of a novel endo-levanase and its gene from Bacillus sp.L7[J].FemsM icrobiol Lett,2010,154(1):23-28.
[17]NAGEM R A,ROJASA L,GOLUBEV A M,et al.Crystal structure of exo-inulinase from Aspergillus awamori:the enzyme fold and structural determinantsof substrate recognition[J].JM ol Biol,2004,344(2):471-480.
[18]MERA A,DE LIMA M Z T,BERNARDES A,et al.Low-resolution structure,oligomerization and its roleon theenzymatic activity ofasucrose-6-phosphatehydrolase from Bacillus licheniformis[J].Am ino Acids,2019,51(4):599-610.
[19]NAGAYA M,KIMURA M,GOZU Y,et al.Crystal structure of a betafructofuranosidasewith high transfructosylation activity from Aspergillus kawachii[J].Biosci Biotechnol Biochem,2017,81(9):1786-1795.
[20]CUSKIN F,FLINT JE,GLOSTER TM,et al.How nature can exploit nonspecific catalytic and carbohydrate binding modules to create enzymatic specificity[J].PNatl Acad SciUSA,2012,109(51):20889-20894.
[21]HETTLEA,FILLO A,ABEK,etal.Properties of a family 56 carbohydrate-bindingmoduleand itsrolein the recognitionand hydrolysisofbeta-1,3-glucan[J].J Biol Chem,2017,292(41):16955-16968.
[22]VENDITTO I,NAJMUDIN S,LUIS AS et al.Fam ily 46 carbohydratebinding modules contribute to the enzymatic hydrolysis of xyloglucan and beta-1,3-1,4-glucans through distinctmechanisms[J].J Biol Chem,2015,290(17):10572-10586.
[23]LER K,LAMMENSW,VAN LAERE A,et al.Influencing the binding configuration of sucrose in theactive sitesof chicory fructan 1-exohydrolase and sugar beet fructan 6-exohydrolase[J].New Phytolog,2008,178(3):572-580.
[24]ALBERTO F,BIGNONC,SULZENBACHERG,etal.The three-dimensionalstructureof invertase(beta-fructosidase)from Thermotogamaritima revealsabimodulararrangementand anevolutionary relationship between retaining and inverting glycosidases[J].J Biol Chem,2004,279(18):18903-18910.
[25]POUYEZ J,MAYARDA,VANDAMMEAM,etal.Firstcrystalstructure of an endo-inulinase,INU2,from Aspergillusficuum:discovery of an extra-pocket in the catalytic domain responsible for its endo-activity[J].Biochim ie,2012,94(11):2423-2430.
[26]VERHAESTM,VAN DEN ENDEW,ROY KL,etal.X-ray diffraction structureofaplantglycosylhydrolase family 32 protein:fructan 1-exohydrolase IIaof Cichorium intybus[J].Plant J,2005,41(3):400-411.
[27]VERHAESTM,LEROY K,SANSEN S,et al.Crystallization and preliminary X-ray diffraction study of a cell-wall invertase from Arabidopsis thaliana[J].Acta Crystall Sect F,2005,61:766-768.
[28]VERHAEST M,LAMMENSW,LE ROY K,et al.X-ray diffraction structureofa cell-wallinvertase from Arabidopsis thaliana[J].Acta Crystall Sect D,2006,62(12):1555-1563.
[29]PARK J,KIM M I,PARK Y D,etal.Structural and functional basis for substrate specificity and catalysis of levanfructotransferase[J].J Biol Chem,2012,287(37):31233-31241.
[30]LAMMENSW,LE ROY K,SCHROEVEN L,et al.Structural insights intoglycosidehydrolase family32and 68enzymes:functionalimplications[J].JExperim Botany,2009,60(3):727-740.
[31]HOLYAVKA M,ARTYUKHOV V,KOVALEVA T.Structural and functionalpropertiesof inulinases:a review[J].Biocat Biotransform,2016,34(1):1-17.
[32]YUAN SG,LEROY K,VENKEN T,etal.pKamodulation of theacid/base catalystwithin GH32 and GH68:a role in substrate/inhibitor specificity[J].Plos One,2012,7(5):e37453.
[33]MARTINEZ-FLEITESC,ORTIZ-LOMBARDIAM,PONST,etal.Crystal structureof levansucrase from theGram-negativebacterium Gluconacetobacterdiazotrophicus[J].Biochem J,2005,390:19-27.
[34]PONST,NAUMOFFD G,MARTINEZ-FLEITESC,etal.Threeacidic residues are at the active site of a propeller architecture in glycoside hydrolase fam ilies32,43,62,and 68[J].Proteins,2004,54(3):424-432.
[35]LEROY K,LAMMENSW,VAN LAEREA,etal.Influencing the binding configuration ofsucrose in theactive sitesof chicory fructan 1-exohydrolaseand sugarbeet fructan 6-exohydrolase[J].New Phytol,2008,178(3):572-580.
[36]VERHAESTM,LAMMENSW,LEROY K,etal.Insights into the fine architectureof theactive siteof chicory fructan 1-exohydrolase:1-kestose assubstratevssucroseas inhibitor[J].New Phytol,2007,174(1):90-100.