近年来,食品安全和农药残留问题一直被广泛关注,食品和农产品的农药残留检测项目日益增多,限量要求日益严格,针对单一类型农药的分析方法已经很难适应新的分析要求。因此,有必要找到一种样品前处理简便、快速且准确的农药多残留分析方法。
QuEChERS(快速Quick,简单Easy,廉价Cheap,高效Effective,耐用Rugged,安全Safe)方法具有快速高效、溶剂使用量少、操作简便、安全可靠等特点[1-3],最初被广泛应用于水果和蔬菜中农药残留的测定,后被应用到更多的样品检测和基质中[4-6],是农药残留快速前处理技术的首要选择[7-8]。
液相色谱-串联质谱法(liquid chromatography-mass spectrometry,LC-MS/MS)具有灵敏度高、选择性好、适用范围广的特点,越来越多地被应用于高通量分析中[9-11]。浆果类水果富含维生素和强抗氧化剂,能延缓衰老,深受消费者喜欢,然而,由于种植过程中农药使用不规范等原因,容易造成农药残留超标,甚至出现使用违禁农药的情况,因此对浆果类水果农药残留监管和检测方法的研究意义重大[12]。
在浆果分析中,其基质中的主要干扰物为脂肪酸、有机酸、碳水化合物、甾醇、脂类和色素等[19-20],乙二胺-N-丙基硅烷(primary secondary amine,PSA)主要吸附基质中的碳水化合物、有机酸、脂肪酸、酚类和少量的色素;石墨化炭黑(graphitized carbon black,GCB)主要去除色素、甾醇类和非极性干扰物;C18则主要去除脂肪和脂类等非极性干扰物。但有些农药在GCB和C18中损失较大。故选择合适的分散剂种类和用量以达到较好的回收和净化目的显得尤为重要。目前浆果中农药残留的检测方法主要有液相色谱-质谱联用法[13-14]、液相色谱-荧光法联用[15]、气相色谱-质谱联用法[16]、气相色谱-质谱/质谱联用[17-18]等方法,但使用QuEChERS前处理结合LC-MS/MS同时检测浆果中有机磷类、氨基甲酸酯类和三唑类3大类10种农药的检测方法尚未见报道。本研究以有机磷类:氧乐果、敌百虫、甲基对硫磷、对硫磷、三唑磷;氨基甲酸酯类:涕灭威、克百威;三唑类:三唑酮、戊唑醇、苯醚甲环唑10种农药作为检测目标,以QuEChERS方法为前处理手段,分别评价了提取溶剂、分散固相萃取材料以及不同基质对蓝莓和葡萄中常见农药残留测定的影响,优化建立液相色谱-串联质谱联用检测浆果中多种农残的方法,对其他植物和水果中农药残留的检测也具有一定的借鉴意义。
1 材料与方法
1.1 材料与试剂
甲醇、丙酮(色谱纯):美国TEDIA公司;甲酸(色谱纯):美国Fluka公司;无水硫酸镁、氯化钠、柠檬酸钠、倍半水合柠檬酸二钠、醋酸钠(分析纯):天津科密欧试剂公司;10种农药标准物质:均购自国家标准物质中心,纯度均在97%以上;分散剂填料PSA、GCB、C18:均购自上海安谱公司。
1.2 仪器与设备
Waters UPLC-TQS Micro三重四级杆质谱仪(配有电喷雾电离源(electrospray ionization,ESI)):美国Waters公司;Milli-Q超纯水器:美国Millipore公司;10~5000μL移液枪:德国Eppendorf公司;ME204E分析天平:瑞士梅特勒-托利多公司;IKA MS3小型旋涡混匀器:德国IKA公司。
1.3 方法
1.3.1 液相条件
色谱柱:ACQUITY UPLC HSS T3(1.8 μm,100 mm×2.1 mm);柱温:30 ℃;进样量:5 μL;流速为0.3 mL/min;离子源为ESI正离子模式;电离电压为5 500 V,扫描方式为多反应选择离子监测方式(multiple reaction monitoring,MRM);流动相A:0.1%甲酸水溶液∶甲醇(98∶2,V/V),流动相B:0.1%甲酸甲醇,具体梯度洗脱条件见表1。
表1 流动相梯度洗脱条件
Table 1 Gradient elution conditions of mobile phase
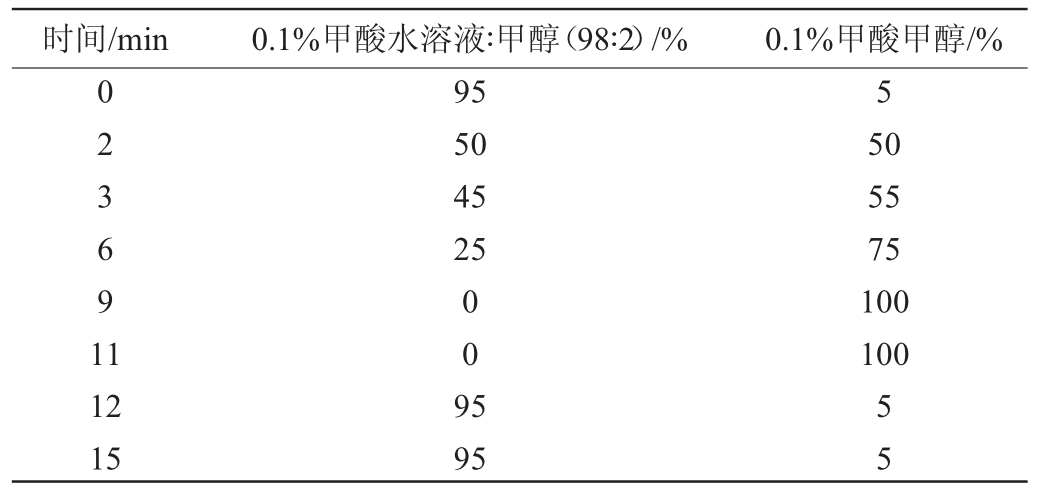
时间/min 0.1%甲酸水溶液∶甲醇(98∶2)/% 0.1%甲酸甲醇/%0 2 3 6 9 1 1 95 50 45 25 5 50 55 75 100 100 12 15 0 0 9 5 95 5 5
1.3.2 质谱条件
质谱条件:离子源为ESI+;检测方式为多反应监测;锥孔电压50 V;去溶剂温度500℃;去溶剂气流量1 000 L/h,各种农药优化母离子和子离子及对应锥孔电压值见表2。
表2 多反应监测主要参数
Table 2 Main parameters of multiple reaction monitoring

注:“*”代表定量离子。
农药名称 母离子 子离子 锥孔电压/V 碰撞能/eV涕灭威213.189.1*1916 116.111氧乐果214.1125.11622 183.1*11克百威222.1123.0*2516 165.116敌百虫25779.01930 109.0*18对硫磷291.9110.02533 236.0*14甲基对硫磷263.979.02936 109.0*22三唑磷314.1118.92235 161.9*18三唑酮294.169.3*2220 197.215戊唑醇30870.1*3122 125.040苯醚甲环唑406111.13760 251.1*25
1.3.3 分散剂种类选择
根据查阅文献[21-23]结合QuEChERS常用分散剂,本研究中分别选择PSA、GCB、C18 3种分散剂进行优化比较实验,分别评价了不同PSA添加量、GCB添加量及C18添加量条件下的回收率,得到最优的添加组合。
具体优化过程按照以下方法进行。称取10 g(精确至0.01 g)粉碎混匀的试样于50 mL离心管中,加入10 mL乙腈,涡旋1 min后加入4.0 g无水硫酸镁、1.0 g NaCl、1.0 g柠檬酸钠和0.5 g倍半水合物柠檬酸二钠,水平振荡器中振荡5.0 min,然后以4 500 r/min离心5.0 min,取1 mL上清液于2 mL高速离心管中加入150 mg无水硫酸镁、分别添加不同量分散剂PSA、GCB和C18(具体添加量及组合见表3);涡旋1 min,然后以10 000 r/min离心10 min,取上清液0.5 mL在40 ℃下氮气(N2)吹干,用流动相(流动相A∶流动相B=60∶40)定容至1 mL,溶解后过0.22 μm滤膜,上机测定。
表3 分散剂添加量优化正交试验因素与水平
Table 3 Factors and levels of orthogonal experiments for dispersing agent addition optimization
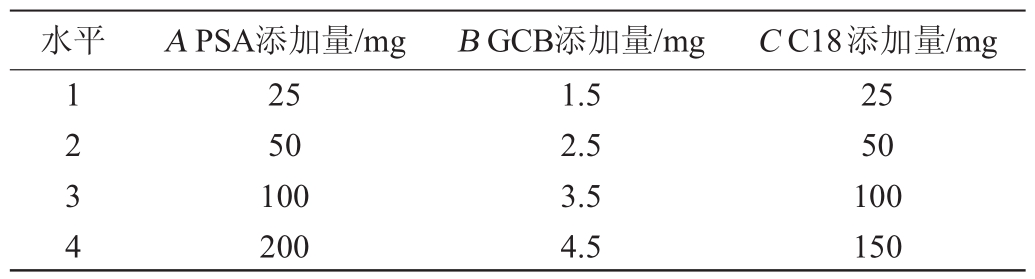
水平 APSA添加量/mg BGCB添加量/mg CC18添加量/mg 1 2 3 4 25 50 100 200 1.5 2.5 3.5 4.5 25 50 100 150
1.3.4缓冲溶液的选择
本实验使用乙腈萃取,然后使用无水硫酸镁从样品中盐析出水分,用NaCl和缓冲柠檬酸盐使液体分层,然后取一部分上清,按照分散固相萃取步骤进一步净化,用柠檬酸盐缓冲液和醋酸盐缓冲液进行选择优化。
称取10 g(精确至0.01 g)粉碎混匀的试样于50 mL离心管中,分别加入10 mL乙腈或10 mL1%醋酸乙腈,涡旋1 min后加入4.0 g无水硫酸镁、1.0 g NaCl、1.0 g柠檬酸钠和0.5 g倍半水合柠檬酸二钠或1.0 g醋酸钠,在水平振荡器中振荡5.0 min后以4 500 r/min离心5.0 min,然后取1 mL上清液于2 mL高速离心管中并加入最优分散剂组合以及150 mg无水硫酸镁,涡旋1 min,然后以10 000 r/min离心10 min,取上清液0.5 mL在40℃条件下氮气(N2)吹干,用1 mL混合液(流动相A∶流动相B=60∶40,V/V)定容,复溶后过0.22 μm滤膜,上机测定。
2 结果与分析
2.1 分散剂优化结果
考察PSA、GCB、C18 3种分散剂净化效果对样品的净化效果,分别衡量了3种分散剂的不同组合效果,首先通过单因素分析确定了PSA的最佳用量是50 mg,GCB的最佳用量是3.5mg,C18的最佳用量是50 mg,然后以10种农药的平均回收率为评价指标,设计正交试验来确定分散剂的添加组合以及用量,试验设计及结果见表4。
表4 分散剂添加量优化正交试验设计结果与分析
Table 4 Results and analysis of orthogonal experiments for dispersing agent addition optimization

试验号 A B C 平均回收率/%1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 1 1 1 1 2 2 2 2 3 3 3 3 4 4 4 4 1 2 3 4 2 1 4 3 3 4 1 2 4 3 2 1 1 2 3 4 4 3 2 1 2 1 4 3 3 4 1 2 65.2 72.6 63.1 60.1 86.5 83.2 71.7 70.1 64.5 69.2 60.7 68.1 65.5 63.4 65.2 61.2 k1 k2 k3 k4 R 65.25 75.38 65.63 63.83 11.55 67.92 72.10 65.17 64.88 7.22 67.58 70.60 65.27 66.63 5.33
由表4中极差值可知,PSA分散剂添加量对试验影响因素最大,其次为GCB分散剂,C18分散剂对试验结果的影响最小。由K值可知分散剂最优组合为A2B2C2,即PSA50mg,GCB 2.5 mg和C18 50 mg。此优化条件下进行基质的净化,平均回收率达75.38%。
2.2 缓冲溶液的选择
不同缓冲溶液对不同农残回收率测定结果的影响见表5。由表5可知,柠檬酸盐缓冲体系条件下,同一种类农药残留的回收率相对比较稳定,10种农残的平均回收率范围为64.42%~84.50%,而醋酸盐缓冲体系下即使同一类农药残留回收率相差较大,10种农残的平均回收率范围为52.88%~97.74%,对比可知柠檬酸盐系统效果较好。
表5 不同缓冲体系对回收率的影响
Table 5 Effect of different buffer systems on recovery rate
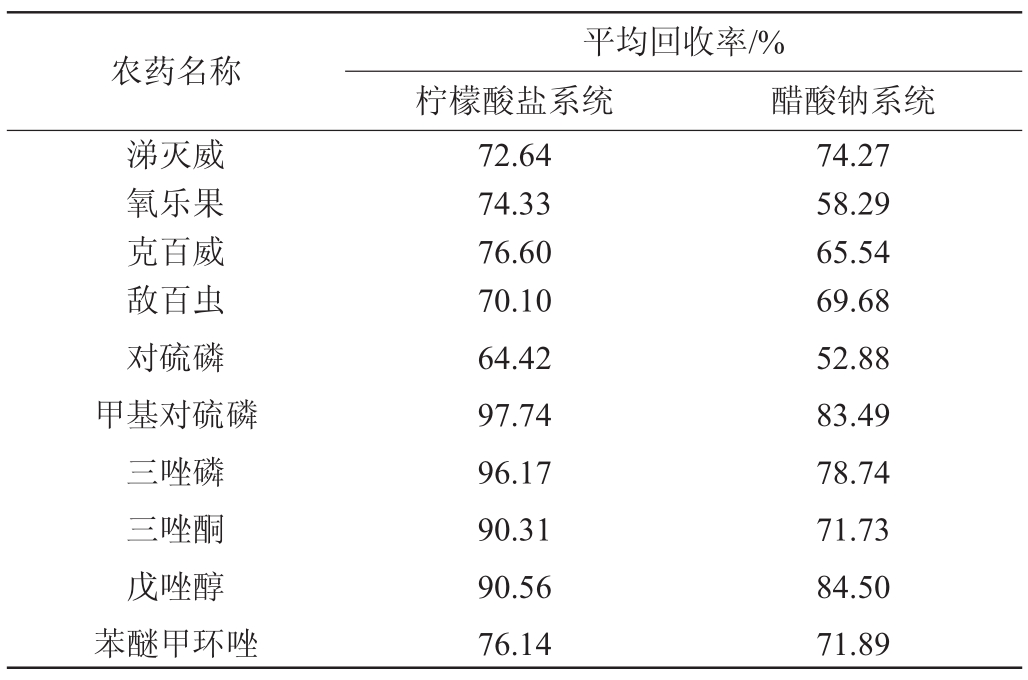
农药名称涕灭威氧乐果克百威敌百虫对硫磷甲基对硫磷三唑磷三唑酮戊唑醇苯醚甲环唑平均回收率/%柠檬酸盐系统 醋酸钠系统72.64 74.33 76.60 70.10 64.42 97.74 96.17 90.31 90.56 76.14 74.27 58.29 65.54 69.68 52.88 83.49 78.74 71.73 84.50 71.89
2.3 方法评价
向葡萄和蓝莓基质中分别添加10 μg/kg、20 μg/kg、50 μg/kg 3个浓度的农药标品,每个浓度设6个重复。样品通过加标基质校准曲线来定量,进行回收率实验。回收率和精密度数据见表6。通过表6可知,测定蓝莓和葡萄中10种农药残留的加标回收率分别为95.31%~111.26%和90.37%~116.20%,相对标准偏差分别为0.90%~4.16%和0.80%~5.09%。说明该方法能够满足测定的要求。
表6 不同农残回收率和精密度结果Table 6 Recovery and precision results of different pesticide residues
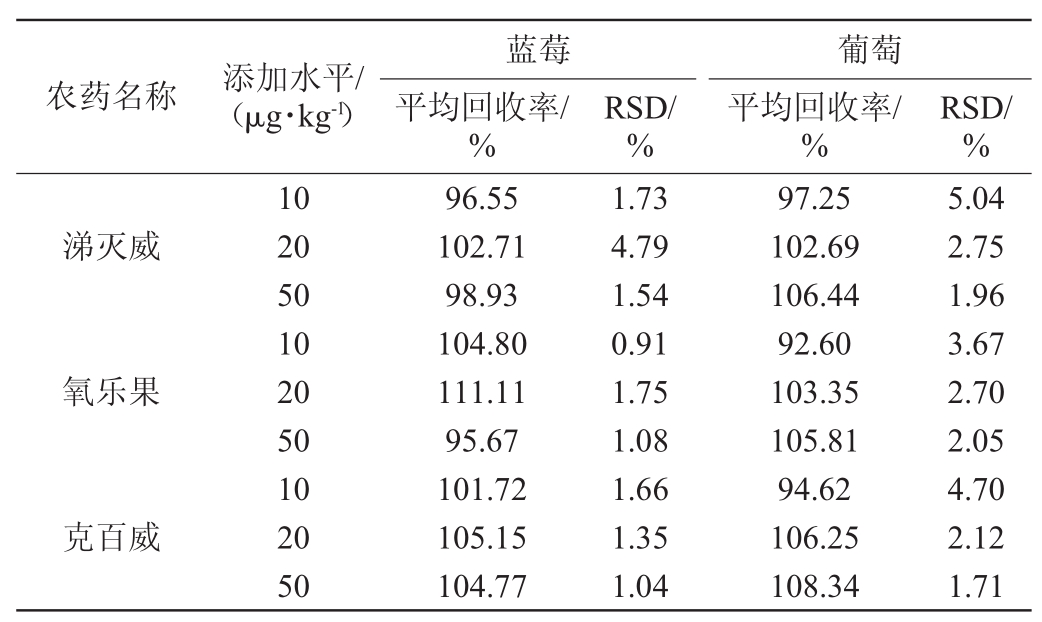
农药名称 添加水平/(μg·kg-1)蓝莓平均回收率/%RSD/%葡萄平均回收率/%RSD/%涕灭威氧乐果克百威10 20 50 10 20 50 10 20 50 96.55 102.71 98.93 104.80 111.11 95.67 101.72 105.15 104.77 1.73 4.79 1.54 0.91 1.75 1.08 1.66 1.35 1.04 97.25 102.69 106.44 92.60 103.35 105.81 94.62 106.25 108.34 5.04 2.75 1.96 3.67 2.70 2.05 4.70 2.12 1.71
续表
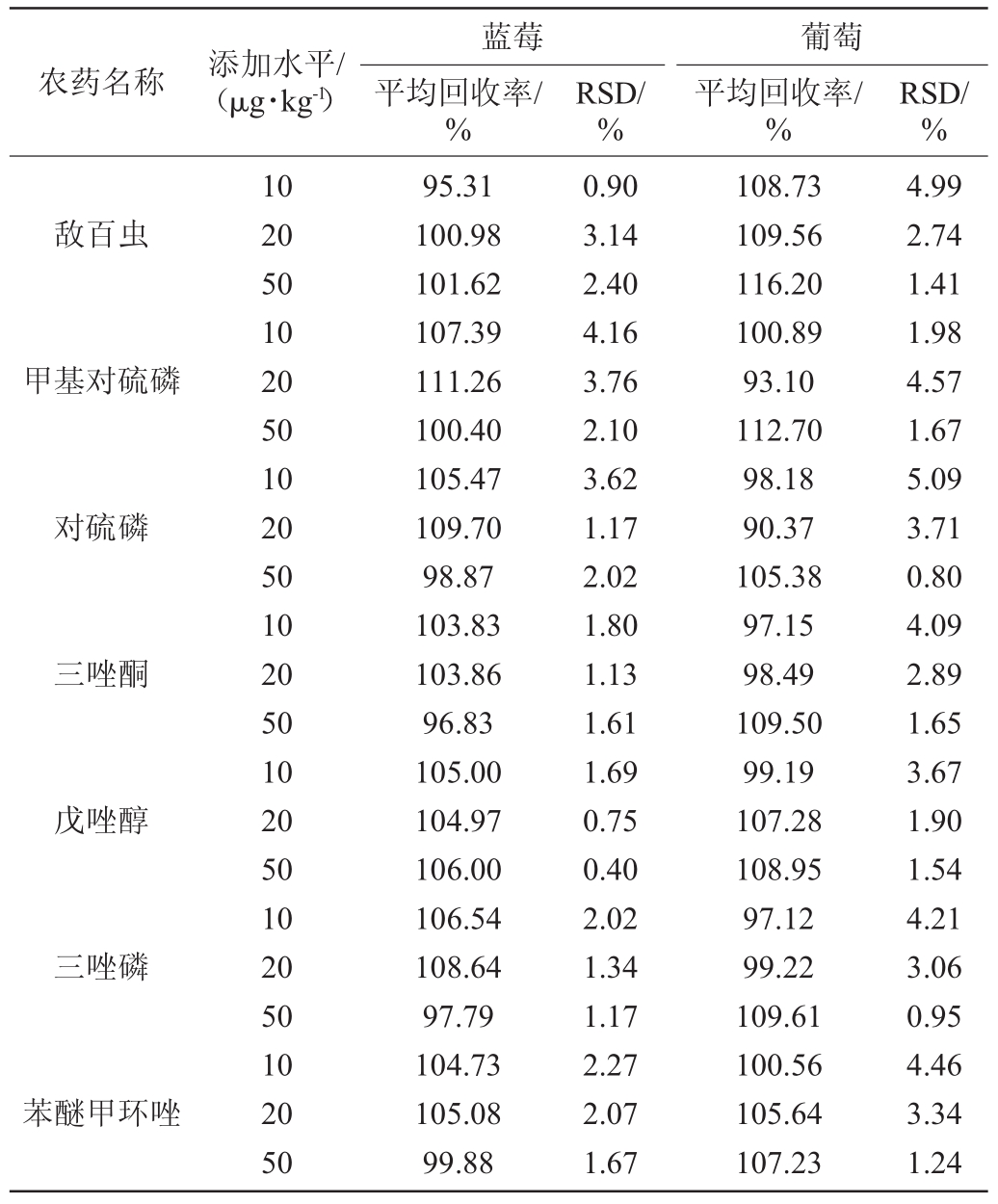
农药名称 添加水平/(μg·kg-1)蓝莓平均回收率/%RSD/%葡萄平均回收率/%RSD/%敌百虫甲基对硫磷对硫磷三唑酮戊唑醇三唑磷苯醚甲环唑10 20 50 10 20 50 10 20 50 10 20 50 10 20 50 10 20 50 10 20 50 95.31 100.98 101.62 107.39 111.26 100.40 105.47 109.70 98.87 103.83 103.86 96.83 105.00 104.97 106.00 106.54 108.64 97.79 104.73 105.08 99.88 0.90 3.14 2.40 4.16 3.76 2.10 3.62 1.17 2.02 1.80 1.13 1.61 1.69 0.75 0.40 2.02 1.34 1.17 2.27 2.07 1.67 108.73 109.56 116.20 100.89 93.10 112.70 98.18 90.37 105.38 97.15 98.49 109.50 99.19 107.28 108.95 97.12 99.22 109.61 100.56 105.64 107.23 4.99 2.74 1.41 1.98 4.57 1.67 5.09 3.71 0.80 4.09 2.89 1.65 3.67 1.90 1.54 4.21 3.06 0.95 4.46 3.34 1.24
2.4 实际样品检测
在选定的色谱质谱条件下,对当地市售的10份番茄样品、10份草莓样品和5份树莓样品进行检测,涕灭威等10种农药的残留量均低于检测限,均未检出。
3 结论
本研究通过采用QuEChERS前处理方法与高效液相色谱-串联质谱联用建立了测定浆果中10种农药残留的方法。通过优化不同分散剂组合及比例、缓冲体系等得到了最优的处理条件,较好地排除了样品基质的干扰,适用的样品基质范围广,简化了操作步骤,净化效果好且回收率符合要求。本研究方法具有操作简单、快速、灵敏度高等特点,适用于大批浆果中的有机磷类、氨基甲酸酯类和三唑类农药残留的同时检测。
[1]孙欣,齐莉,秦廷亭,等.QuEChERS-气相色谱-三重四级杆质谱法检测黄瓜中的 19 种邻苯二甲酸酯[J].色谱,2014,32(11):1260-1265.
[2]夏虹,彭茂民,刘丽.QuEChERS-超高效液相色谱-串联质谱法同时测定柑橘中12种植物生长调节剂残留[J].食品科技,2018,43(10):340-344.
[3]HUANG Y S,SHI T,LUO X,et al.Determination of multi-pesticide residues in green tea with a modified QuEChERS protocol coupled to HPLC-MS/MS[J].Food Chem,2019(4):263-275.
[4]VALVERDE A,ARUILERA A,FERRER C,et al.Analysis of forchlorfenuron in vegetables by LC/TOF-MS after extraction with the buffered QuEChERS method[J].J Agr Food Chem,2010,58(5):2818-2823.
[5]XUE J Y,WANG S L,YOU W X,et al.Multi-residue determination of plant growth regulators in apples and tomatoes by liquid chromatography/tandem mass spectrometry[J].Rapid Commun Mass Spectr,2011,25(21):3289-3297.
[6]SHI X M,JIN F,HUANG Y T,et al.Simultaneous determination of five plant growth regulators in fruits by modified quick,easy,cheap,effective,rugged,and safe(QuEChERS)extraction and liquid chromatography-tandem mass spectrometry[J].J Agri Food Chem,2012,60(1):60-65.
[7]CHEN G,CAO P,LIU R.A multi-residue method for fast determination of pesticides in tea by ultra performance liquid chromatography-electrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procedure[J].Food Chem,2011,125(4):1406-1411.
[8]WU C C.Multiresidue method for the determination of pesticides in Oolong tea using QuEChERS by gas chromatography-triple quadrupole tandem mass spectrometry[J].Food Chem,2017,229:580-587.
[9]PANG G F,CAO Y Z,ZHANG J J,et al.Validation study on 660 pesticide residues in animal tissues by gel permeation chromatography cleanup/gas chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2006,1125:1-30.
[10]KANRARA B,MANDALA S,BHATTACHARYYA A.Validation and uncertainty analysis of a multiresidue method for 42 pesticides in made tea,tea infusion and spent leaves using ethyl acetate extraction and liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2010,1217(12):1926-1933.
[11]YANG X,XU D C,QIU J W,et al.Simultaneous determination of 118 pesticide residues in Chinese teas by gas chromatography-mass spectrometry[J].Chem Paper,2008,63(1):39-46.
[12]ZHANG K,WONG J W,WANG P G.A perspective on high throughput analysis of pesticide residues in foods[J].Chin J Chromatogr,2011,29(7):587-593.
[13]张文,邱国玉,王小乔,等.液相色谱-串联质谱法同时测定浆果类、瓜果类水果中19种植物生长调节剂的残留量[J].食品工业科技,2018(10):1-12.
[14]王娇,齐沛沛,刘之炜,等.液相色谱-串联质谱法分析葡萄中农药残留的基质效应评价[J].浙江农业科学,2018(10):1750-1759.
[15]李朝静,李培培,陈敏,等.高效液相色谱-荧光法同时检测葡萄汁中3 种苯并咪唑类农药[J].食品科学,2016,37(12):192-196.
[16]刘婷.QuEChERS结合GC-MS/MS和LC-MS/MS高通量检测果蔬农药多残留研究[D].长沙:中南林业科技大学,2018.
[17]崔春艳.LC-MS/MS和LC-Q-TOF/MS测定谷物、蔬菜和水果中27种新型杀菌剂农药残留[D].保定:河北大学,2017.
[18]李丽,张锋,王富华,等.常见浆果类水果中农药残留调查研究[J].热带农业科学,2012,32(1):54-57.
[19]吴岩.GC-MS/MS技术分析浆果类食品中农药多残留的研究[D].哈尔滨:黑龙江大学,2012.
[20]高阳,徐应明,孙扬,等.QuEChERS提取法在农产品农药残留检测中的应用进展[J].农业资源与环境学报,2014,31(2):110-117.
[21]郭春景,王建忠,郝晓莉.利用QuEChERS-UPLC-MS/MS法测定甘蓝、草莓中7种农药残留的实验条件优化探索[J].质谱学报,2013,34(2):121-127.
[22]李芳,张静,杨中,等.QuEChERS/液质联用法测定蔬菜中17种农药残留[J].吉林农业科学,2013,38(3):93-96.
[23]候雪,韩梅,骆正联,等.改进的QuEChERS-串联质谱法测定莴苣中124 种农药残留[J].分析试验室,2012,31(8):59-65.