白酒通常是由淀粉或其他含有糖质的原料经过多种工序而获得的蒸馏酒[1]。白酒不仅供日常饮用,也是一种重要的药材,有活血通脉、助药力、增进食欲等作用,如张仲景的《金匮要略》中记载的瓜蒌薤白白酒汤是中医治疗胸痹的著名方剂,现代医学研究也证实瓜蒌薤白白酒汤对心肌缺血再灌注损伤具有保护作用[2]、对冠心病的治疗也有很好的效果[3]。酱香型白酒为中国白酒典型的白酒香型之一,其独特的制酒工艺造就了独特的风味[4]。据文献报道,酱香型白酒含有多种吡嗪类化合物,其含量高达63.6 mg/L[5],远高于普通白酒。人类使用香料作为增味剂具有悠久的历史,近年研究表明,吡嗪类化合物存在于多种香料中[6];同时,研究显示部分吡嗪类化合物具有一定的生物活性,如含吡嗪环的噻唑啉、噻唑烷酮具有优秀的抗菌作用[7]、川芎嗪对红藻氨酸诱导的大鼠海马兴奋性毒性具有保护作用[8]、可保护大鼠大脑免受缺血再灌注损伤[9]及改善体内的肝脏炎症[10]等。
在炎症的发生和发展过程中会伴随着一系列的理化性质的改变,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、一氧化氮(nitric oxide,NO)等含量变化[11-12],同时花生四烯酸代谢通路中前列腺素E2(prostaglandinE2,PGE2)也在炎症发生、发展过程中的也起到很重要的作用[13]。有研究显示,诱异型一氧化氮合酶(induciblenitricoxidesynthase,iNOS)通常可由细胞因子和微生物内毒素等炎性物质诱导表达,从而产生持续高水平的NO[14];同样的,前列腺素E2(PGE2)是由花生四烯酸通过环氧化酶-2(cyclooxygenase-2,COX-2)产生[15];细胞因子TNF-α、白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)与PGE2均为引起炎性反应的关键因子;而血红素氧合酶(heme oxygenase-1,HO-1)的表达上调可抑制多种免疫效应功能[16]。
酱香型白酒中含有多种吡嗪类物质,其中三甲基吡嗪、四甲基吡嗪含量较高[17],但由于乙醇、水及其他物质的存在,其相关生物活性研究鲜有报道。因此,本实验建立脂多糖(lipopolysaccharide,LPS)诱导RAW264.7细胞炎症模型,并通过酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)测定细胞上清液中一氧化氮(NO)、白细胞介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)含量,进而检测诱导型一氧化氮合酶(iNOS)、环氧化酶-2(COX-2)、血红素加氧酶-1(HO-1)、白细胞介素-1(IL-1)、IL-6、TNF-α的信使核糖核酸(messenger ribonucleic acid,mRNA)的表达及对花生四烯酸代谢通路中与有关生成前列腺素E2(PGE2)关键酶的影响,研究吡嗪类化合物对炎症模型中诱导型合酶iNOS及相关炎症因子的变化等,探讨其抗炎机制。
1 材料与方法
1.1 材料与试剂
小鼠巨噬细胞RAW264.7细胞株:美国ATCC公司;酱香型白酒(53度):贵州茅台集团;脂多糖(lipopolysaccharide,LPS):美国Sigma公司;胎牛血清(fetal bovine serum,FBS)、磷酸盐缓冲液(phosphatesalinebuffer,PBS):广州瑞舒生物科技有限公司;RPMI1640培养基:美国HyClone公司;0.25%胰蛋白酶:美国Gibco公司;酶联免疫吸附法(ELISA)试剂盒:碧云天生物科技有限公司;SYBR@PrimeScriptTM逆转录聚合酶链反应(reversetranscriptase-polymerasechainreaction,RT-PCR)试剂盒:大连TaKaRa公司;活细胞计数试剂盒-8(cell counting kit-8,CCK-8):佰易聚生物商城;2-甲基-3-丙基吡嗪、2,5-二甲基吡嗪、2,6-二甲基吡嗪、2,3-二甲基吡嗪、2,3,5-三甲基吡嗪、2-乙基-3-甲基吡嗪、2-丁基-3-甲基吡嗪、2-异丁基-3-甲基吡嗪、2,3,5,6-四甲基吡嗪、2-乙基-3,5-二吡嗪、2-丙基吡嗪、2,3-二乙基-5-甲基吡嗪、2,3-二乙基-5-甲基吡嗪、2,3-二甲基-5-异丙基吡嗪:阿拉丁试剂有限公司。
1.2 仪器与设备
SW-CJ-IC型超净工作台:苏州安泰空气技术有限公司;INCO2108 型CO2培养箱:德国Memmert公司;TECAN infiniteM200多功能酶标仪:美国ThermoFisherScientific公司;2K15型低温高速离心机:美国Sigma公司;R2487高效液相色谱(highperformance liquidchromatography,HPLC):美国Waters公司;Agilent 1200液质联用(liquid chromatographymass spectrometry,LC-MS):美国Agilent公司;Epics Altra型流式细胞仪:美国Beckman公司。
1.3 方法
1.3.1 酱香型白酒中非乙醇类物质的提取及吡嗪类溶液的配制
250 mL分液漏斗中加入50 mL白酒、20 mL水和90 mL氯仿,振荡摇匀、静置,分离氯仿层,重复3次,合并氯仿层。用旋转蒸发仪(4℃)除去氯仿获得有机层化合物。真空冻干水层得水层化合物,合并有机层及水层化合物为酒中非乙醇类物质(Jiu non-ethanol,JNE),-20℃避光保存。参照文献方法,利用液质联用(liquid chromatography-mass spectrometry,LC-MS)法检测酒中非乙醇类物质(JNE)[18],用高效液相色谱法(high-performance liquid chromatography,HPLC)检测酒中吡嗪类化合物的含量[19]。吡嗪类化合物及酒中非乙醇类物质(JNE)溶于PBS,初始质量浓度为10 mg/mL,-20℃避光保存备用。
1.3.2 细胞培养
RAW264.7细胞培养于含有10%FBS的RPMI 1640培养基,培养于37℃、5%CO2、90%相对湿度的培养箱内[20]。将细胞浓度调整为2×105个/mL,并按100 μL/孔接种于96孔板中,在细胞培养板中分别加入0.01 mg的吡嗪类化合物及酒中非乙醇类物质(JNE),终质量浓度为0.10 mg/mL,将处理好的96孔细胞培养板置于培养箱中培养24 h后,每孔加入0.1 μg的LPS,终质量浓度为1.0 mg/L,置于培养箱中培养4 h,CCK-8检测细胞活力。
将细胞浓度调整为2×105个/mL,并按100 μL/孔接种于96孔板中,将实验分为6组:①正常组:正常培养,未对细胞做任何处理;②LPS组:细胞在96孔细胞培养板中培养24 h后,加入0.4 μg/孔,终质量浓度为2.0 mg/L的LPS培养6 h;③酒精+LPS组:96孔细胞培养板中加入0.024 mg乙醇∶水(53∶47,V/V),终质量浓度为0.24 mg/mL,将处理好的96孔细胞培养板置于培养箱中培养24 h后,加入0.4 μg/孔,终质量浓度为2.0 mg/L的LPS培养6 h;④白酒+LPS组:96孔细胞培养板中加入0.024 mg白酒,终质量浓度为0.24 mg/mL,将处理好的96孔细胞培养板置于培养箱中培养24 h后,加入0.4 μg/孔,终质量浓度为2.0 mg/L的LPS培养6 h;⑤JNE+LPS组:96孔细胞培养板中加入0.024 mg酒中非乙醇类物质(JNE),终质量浓度为0.24 mg/mL,将处理好的96孔细胞培养板置于培养箱中培养24 h后,加入0.4 μg/孔,终质量浓度为2.0 mg/L的LPS培养6 h;⑥吡嗪化合物-5(Biqin-5,BQ-5)+LPS组:96孔细胞培养板中加入0.024 mg BQ-5,终质量浓度为0.24 mg/mL,将处理好的96孔细胞培养板置于培养箱中培养24h后,加入0.4μg/孔,终质量浓度为2.0mg/L的LPS培养6 h。CCK-8检测化合物对细胞活力的影响及流式细胞术检测细胞凋亡的情况[21]。采用ELISA试剂盒测定NO、IL-1、IL-6、TNF-α等相关炎症因子及PGE2浓度[22]。细胞裂解后收集裂解物,提取RNA,采用定量聚合酶链式反应(polymerase chain reaction,PCR)测定iNOS、COX-2、HO-1、IL-1、IL-6、TNF-α等基因表达的量。
1.3.3 RNA提取及cDNA的合成
将细胞浓度调整为2×105个/mL,并按2 mL/孔接种于6孔板中,在细胞培养板中分别加入0.48 mg的白酒、BQ-5、JNE和乙醇∶水(53∶47,V/V),终质量浓度为0.24 mg/mL,将处理好的6孔细胞培养板置于培养箱中培养24 h后每孔加入4 μg的LPS,终质量浓度为2.0 mg/L,置于培养箱中培养6 h后,取出6孔板,将孔内的培养基吸出,并加入0.50 mL Biozol Reagent裂解细胞,收集细胞裂解液于2.0 mL离心管,室温静置2 min后加入0.10 mL氯仿,剧烈振荡15 s混匀,静置3 min。在4 ℃、12 000×g条件下离心4 min,取上层水相加入等量异丙醇,漩涡振荡,室温放置10 min;12 000×g条件下离心10min,弃上清,沉淀中加入1.0mL体积分数为75%乙醇洗涤,室温干燥后加入30 μL的焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水溶解即得总RNA,其OD260nm/280nm值为1.8~2.0。互补脱氧核糖核酸(complementarydeoxyribonucleic acid,cDNA)的合成按SYBR@PrimeScriptTMRT-PCR试剂盒操作说明进行,产物保存于-20℃,备测。
1.3.4 PCR扩增
iNOS、COX-2、HO-1、IL-1、IL-6、TNF-α和β-肌动蛋白(β-actin)cDNA参照GenBank中公布的序列,利用Primer5.0软件设计引物,由吉赛生物技术有限公司(广州)合成。PCR扩增具体实验采用总反应体积10.0 μL体系:SYBR-Premix ExTaqTM Ⅱ 5 μL,10 μmol/L由吉赛生物技术有限公司合成的上述7种蛋白的cDNA引物2.0 μL,cDNA模版1.0 μL,双蒸水2.0 μL。PCR反应条件:预变性95℃10 s,变性95℃5 s,荧光检测72 ℃ 10 s,40个循环。
1.3.5 数据处理
所有数据采用SPSS 18软件进行统计。对阴性对照和阳性对照采用独立样本t检验,对BQ-5处理效应进行回归分析。P<0.05表明具有显著差异,P<0.01表明具有极显著差异,结果均以平均值±标准差表示。
2 结果与分析
2.1 吡嗪类化合物对RAW264.7细胞的毒作用
对不同的吡嗪类化合物单体以一定浓度加入细胞培养液中,用CCK-8检测细胞活性。结果显示,吡嗪类化合物质量浓度低于0.35mg/mL时,细胞增殖能力与对照组相比,差异均无显著性(P>0.05),表明吡嗪类化合物的浓度在一定范围内对细胞无明显毒性(以下研究吡嗪类化合物质量浓度均<0.35 mg/mL)。此外,0.10 mg/mL的吡嗪类化合物与RAW264.7细胞共培养24 h后,加入0.1 μg/孔,终质量浓度为1.0 mg/L的LPS培养4 h,CCK8检测细胞增殖,用正常细胞不做任何处理作为空白对照,LPS作为阳性对照。结果见表1。
表1 吡嗪类化合物对RAW264.7细胞增殖能力影响
Table 1 Effect of pyrazines on proliferation of RAW264.7 cells
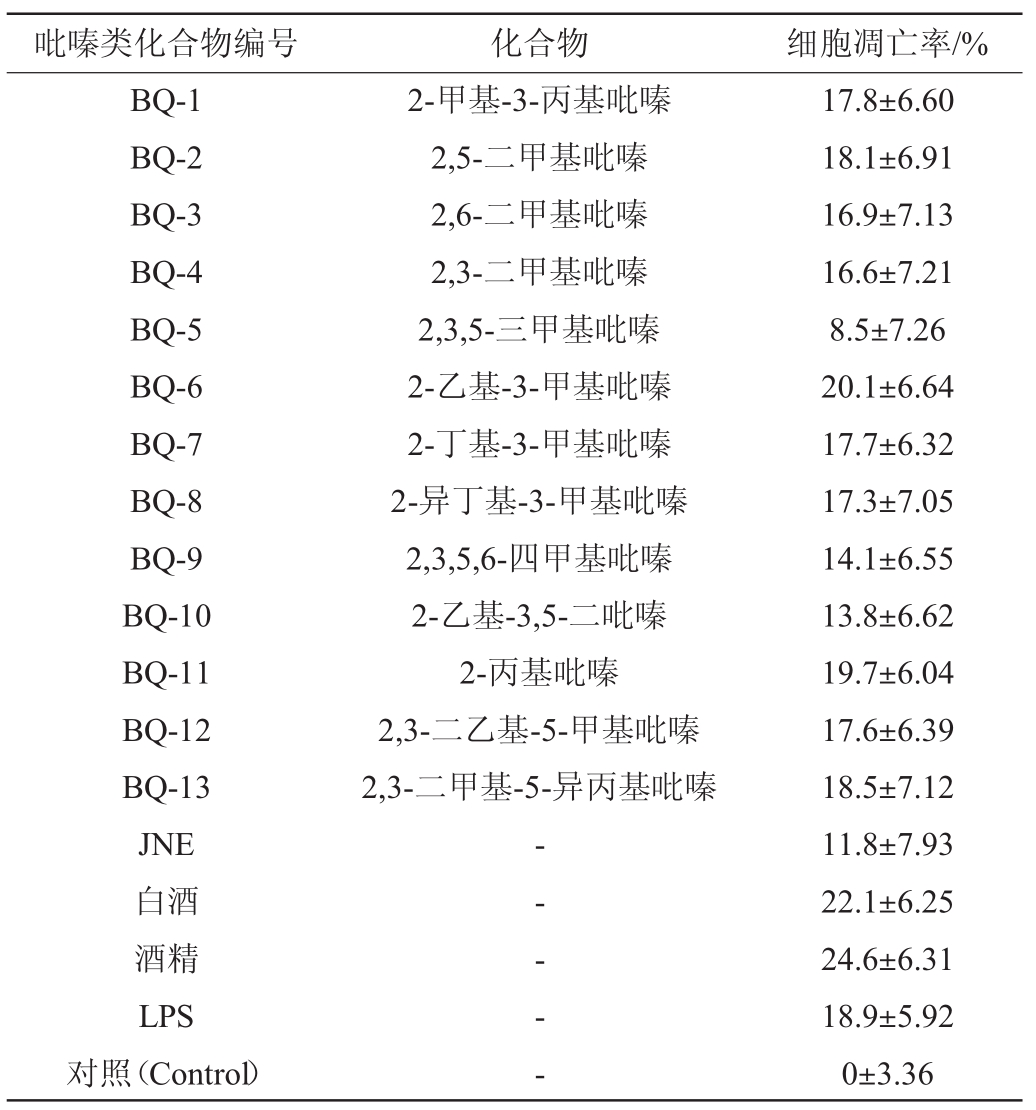
注:“-”表示混合物。
吡嗪类化合物编号 化合物 细胞凋亡率/%BQ-1 BQ-2 BQ-3 BQ-4 BQ-5 BQ-6 BQ-7 BQ-8 BQ-9 BQ-10 BQ-11 BQ-12 BQ-13 JNE白酒酒精LPS对照(Control)2-甲基-3-丙基吡嗪2,5-二甲基吡嗪2,6-二甲基吡嗪2,3-二甲基吡嗪2,3,5-三甲基吡嗪2-乙基-3-甲基吡嗪2-丁基-3-甲基吡嗪2-异丁基-3-甲基吡嗪2,3,5,6-四甲基吡嗪2-乙基-3,5-二吡嗪2-丙基吡嗪2,3-二乙基-5-甲基吡嗪2,3-二甲基-5-异丙基吡嗪- - - - -17.8±6.60 18.1±6.91 16.9±7.13 16.6±7.21 8.5±7.26 20.1±6.64 17.7±6.32 17.3±7.05 14.1±6.55 13.8±6.62 19.7±6.04 17.6±6.39 18.5±7.12 11.8±7.93 22.1±6.25 24.6±6.31 18.9±5.92 0±3.36
由表1可知,相比于对照(Control)组,LPS组细胞增殖显著降低(P<0.05),细胞凋亡率为18.9%,上升18.9%。而相比于LPS组,与BQ-5、BQ-9、BQ-10共培养24 h后,细胞凋亡率明显降低(P<0.05)。其他吡嗪类化合物则对细胞凋亡率未有明显影响(P>0.05)。其中,BQ-5处理的细胞凋亡率为(8.5±7.26)%,相比于其他组,对增强细胞抗LPS刺激产生损伤的能力最强。不同于BQ-5组,白酒及乙醇组细胞存活率均低于LPS处理组,推测可能是由于乙醇降低了细胞抗LPS刺激产生损伤的能力。因此,选择BQ-5进行进一步的研究。
2.2 BQ-5对RAW264.7细胞凋亡及NO,PGE2,TNF-α等相关炎症因子的影响
为了便于比较,将正常组的NO、TNF-α、IL-1、IL-6、PGE2浓度设为1,其他组浓度为相对值,BQ-5对PGE2、NO及TNF-α等相关炎症因子的影响结果见表2,其抗LPS诱导的RAW 264.7细胞凋亡作用,结果见图1。由表2可知,LPS刺激RAW 264.7细胞使NO、IL-6、IL-1、TNF-α及PGE2分泌显著升高(P<0.05)。而BQ-5组与LPS组相比,TNF-α、NO、PGE2及IL-1的含量均显著降低(P<0.05),IL-6含量无显著性差异(P>0.05)。结合图1结果可以说明,BQ-5能有效的降低LPS诱导的RAW264.7细胞炎症因子的产生,同时提高细胞抗LPS损伤的能力。不同于BQ-5组,白酒及乙醇组中TNF-α、NO、IL-1及IL-6的含量均高于LPS组。推测可能是乙醇对细胞的损伤作用导致的。有趣的是JNE中TNF-α、NO、IL-1及IL-6的含量均低于LPS组,其原因可能是白酒中的其他物质增强了细胞的抗LPS损伤的能力。
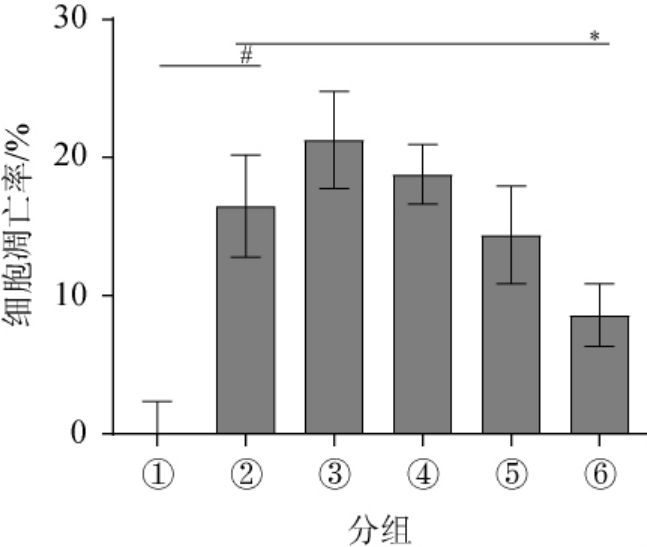
图1 BQ-5抗LPS诱导的RAW264.7细胞凋亡作用
Fig.1 Antagonistic effect of BQ-5 on LPS-induced RAW264.7 cells apoptosis
与Control组对比,“#”表示差异显著(P<0.05),“##”表示差异极显著
(P<0.01);与LPS组对比,“*”表示差异显著(P<0.05)。下同。
表2 BQ-5对PGE2、NO及TNF-α等相关炎症因子的影响
Table 2 Effect of BQ-5 on PGE2,NO,TNF-α and other related inflammatory factors
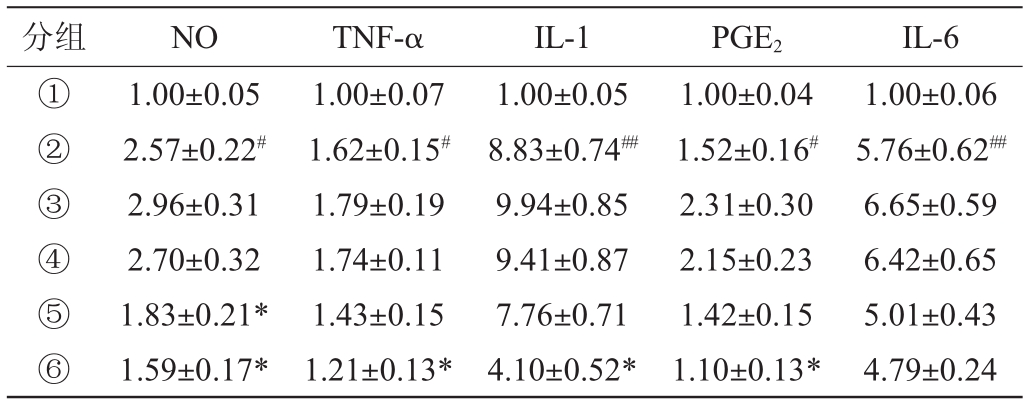
分组 NO TNF-α IL-1 PGE2 IL-6①1.00±0.051.00±0.071.00±0.051.00±0.041.00±0.06②2.57±0.22#1.62±0.15#8.83±0.74##1.52±0.16#5.76±0.62##③2.96±0.311.79±0.199.94±0.852.31±0.306.65±0.59④2.70±0.321.74±0.119.41±0.872.15±0.236.42±0.65⑤1.83±0.21*1.43±0.157.76±0.711.42±0.155.01±0.43⑥1.59±0.17*1.21±0.13*4.10±0.52*1.10±0.13*4.79±0.24
2.3 BQ-5对LPS诱导的PLA2、COX-2活性的影响
BQ-5对LPS诱导的PLA2、COX-2活性的影响结果见图2。由图2可知,LPS诱导后,PLA2、COX-2的活性显著增加(P<0.05),而JNE和BQ-5对PLA2、COX-2的活性具有不同程度的抑制作用(P<0.05),但白酒及乙醇组中PLA2、COX-2的活性反而显著增加(P<0.05),推测是乙醇对细胞的损伤协同LPS诱导PLA2、COX-2的活性上升的。

图2 BQ-5对LPS诱导的PLA2、COX-2活性的影响
Fig.2 Effect of BQ-5 on LPS-induced PLA2 and COX-2 activities
2.4 BQ-5对LPS诱导的细胞炎性介质(IL-1、IL-6、TNF-α)
及诱导型合酶(iNOS、COX-2、HO-1)基因表达的影响
BQ-5对LPS诱导的细胞炎性介质及诱导型合酶基因表达的影响结果见图3。同样的,为了便于比较,将正常组的iNOS、COX-2、HO-1、IL-1、IL-6、TNF-α的mRNA表达量设为1,其他组表达量为相对值。由图3可知,相比于正常组,LPS诱导后诱导型合酶iNOS、COX-2、HO-1 mRNA的表达分别是正常组的56.2倍(P<0.01)、13.7倍(P<0.01)及3.97倍(P<0.05)。相比于LPS组,BQ-5组的诱导型合酶iNOS、COX-2 mRNA的表达分别下降40.1%(P<0.05)、59.7%(P<0.05),HO-1没有显著性差异(P>0.05)。
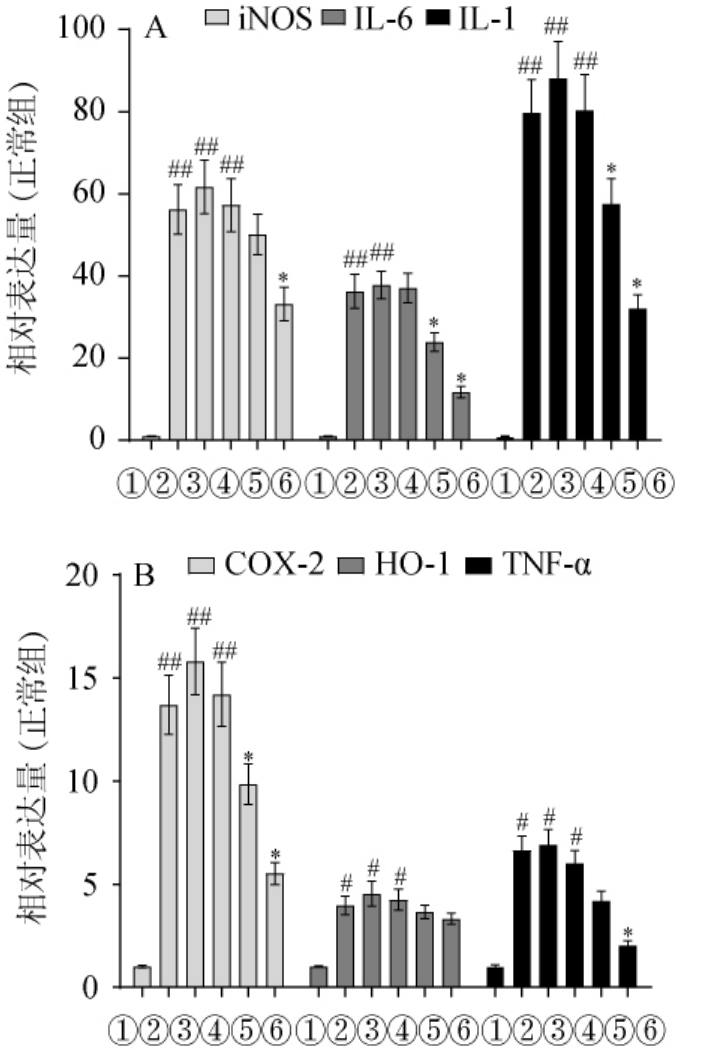
图3 BQ-5对LPS诱导的细胞炎性介质(A)及诱导型合酶(B)基因表达的影响
Fig.3 Effect of BQ-5 on LPS-induced cellular inflammatory mediators(A)and inducible synthase(B)gene expression
相比于正常组,LPS诱导后细胞炎性介质(IL-1、IL-6、TNF-α)的mRNA表达增加分别是正常组的78.7倍(P<0.01)、35.3倍(P<0.01)及5.63倍(P<0.05)。相比于LPS组,BQ-5组的IL-1、IL-6、TNF-α mRNA的表达分别下降59.6%(P<0.05)、69.4%(P<0.05)、67.5%(P<0.05)。
不同于BQ-5可降低细胞炎性介质及诱导型合酶mRNA的表达,白酒及乙醇未表现出类似的作用。JNE对细胞炎性介质及诱导型合酶mRNA的表达的影响与BQ-5类似,推测是白酒中的非乙醇类物质发挥的作用。
3 结论
本实验针对酱香型白酒中吡嗪类化合物对LPS诱导RAW264.7细胞损伤及对相关炎症因子表达的影响进行了研究。首先用CCK-8检测白酒中含有的各种吡嗪类化合物细胞活性的影响,其中酱香型白酒中吡嗪类化合物(BQ-5)处理细胞后,细胞凋亡率为(8.5±7.26)%,相比于其他化合物,对LPS诱导的细胞损伤的保护性更强。然后将实验分为6组,用流式细胞术检测6组细胞的凋亡情况,其中BQ-5处理的细胞存活率为(8.6±2.28)%,是6组中除空白组外最高,进一步说明BQ-5对细胞保护作用。提取上述各组细胞的mRNA和炎症因子,检测其中NO、TNF-α及IL-1的生成与释放,相比于LPS组,iNOS、TNF-α及IL-1的基因表达分别下降23倍、4.6倍、46.6倍;相比于LPS组,NO、TNF-α及IL-1的释放量分别下降0.98倍、0.41倍、4.73倍,说明BQ-5能显著降低NO、TNF-α及IL-l的生成与释放(P<0.05)。同时检测COX-2、PLA2的活性变化、COX-2的基因表达情况和PGE2的释放情况,BQ-5处理组的COX-2、PLA2的相对活性与LPS组相比,分别降低44%和71%,COX-2的基因表达量降低8.18倍,PGE2的释放量降低42%,结果表明,BQ-5可通过抑制PLA2活性和COX-2表达而减少PGE2合成,这可能是BQ-5抗炎的另一主要作用机制。由此可以推测BQ-5可能通过调节巨噬细胞产生NO及TNF-α等炎症因子来发挥作用的。
本研究显示酱香型白酒中的非乙醇成分及吡嗪类化合物(BQ-5)具有直接的抗LPS诱导的RAW264.7细胞炎症作用,说明酱香型白酒中的吡嗪类物质具有增强细胞抗炎性损伤的能力。其发挥抗炎作用与减少RAW264.7细胞炎症介质生成与释放、抑制花生四烯酸代谢途径PGE2的合成的关键酶活性密切相关。同时,分析实验结果发现,酱香型白酒及酒精组未显示出任何增强细胞抗炎能力,推测其中的乙醇降低了细胞的抗炎能力。
[1]熊子书.中国名优白酒酿造与研究[M].中国轻工业出版社,1995:1-2.
[2]周波,陈飞,仲维娜,等.从NO、NOS变化探讨瓜蒌薤白白酒汤对心肌缺血再灌注损伤的防治作用[J].中医药学报,2010,38(3):36-38.
[3]童芬芬,韩勇,魏珍珍.瓜蒌薤白白酒汤联合穴位注射治疗冠心病心绞痛的临床研究[J].中医药导报,2018,24(10):70-73.
[4]杨国华,邱树毅,黄永光.酱香白酒生产中产香微生物研究[J].中国酿造,2011,30(4):24-27.
[5]崔利.酱香型白酒中吡嗪类化合物的生成途径及环节[J].酿酒,2007,34(5):39-40.
[6]VASUNDHARA T S,PARIHAR D B.Studies in pyrazines formed in roasted spices:Coriandrum sativum,Cuminum cyminumandTrigonella foenum-graecum[J].Mol Nutr Food Res,2010,24(7):645-651.
[7]BONDE C G,GAIKWAD N J.Synthesis and preliminary evaluation of some pyrazine containing thiazolines and thiazolidinones as antimicrobial agents[J].Bioorg Med Chem,2004,12(9):2151-2161.
[8]SHIH Y H,WU S L,CHIOU W F,et al.Protective effects of tetramethylpyrazine on kainate-induced excitotoxicity in hippocampal culture[J].Neuroreport,2002,13(4):515-519.
[9]JIA J,ZHANG X,HU Y S,et al.Protective effect of tetraethyl pyrazine against focal cerebral ischemia/reperfusion injury in rats:therapeutic time window and its mechanism[J].Thromb Res,2009,123(5):727-730.
[10]WU X,ZHANG F,XIONG X,et al.Tetramethylpyrazine reduces inflammation in liver fibrosis and inhibits inflammatory cytokine expression in hepatic stellate cells by modulating NLRP3 inflammasome pathway[J].Iubmb Life,2015,67(4):312-321.
[11]ZELOVÁ H,HOŠEK J.TNF-alpha signalling and inflammation:interactions between old acquaintances[J].Inflamm Res,2013,62(7):641-651.
[12]BOSCÁ L,ZEINI M,TRAVÉS P G,et al.Nitric oxide and cell viability in inflammatory cells:a role for NO in macrophage function and fate[J].Toxicology,2005,208(2):249-258.
[13]NAKANISHI M,ROSENBERG D W.Multifaceted roles of PGE2 in inflammation and cancer[J].Semin Immun,2013,35(2):123-137.
[14]KANWAR J R,KANWAR R K,BURROW H.Recent advances on the roles of NO in cancer and chronic inflammatory disorders[J].Curr Med Chem,2009,16(19):2373-2394.
[15]BRYN T,YAQUB S,MAHIC M,et al.LPS-activated monocytes suppress T-cell immune responses and induce FOXP3+T cells through a COX-2-PGE2-dependent mechanism[J].Int Immunol,2008,20(2):235-245.
[16]WOO J,IYER S,CORNEJO M C,et al.Stress protein-induced immunosuppression:inhibition of cellular immune effector functions following overexpression of haem oxygenase(HSP 32)[J].Transpl Immunol,1998,6(2):84-93.
[17]孙棣,赵贵斌,杨波.酱香型白酒中吡嗪类化合物的检测及特点[J].中国酿造,2015,34(12):162-166.
[18]付桂明,万茵,张硕,等.杜仲叶总黄酮超临界流体提取工艺优化及其成分的液质联用分析[J].食品科学,2007,28(12):128-131.
[19]王增明,郭庆东,谢芳,等.HPLC测定茶多酚中儿茶素类及咖啡因含量[J].中国药学杂志,2011,46(21):1674-1676.
[20]ESKRA L,MATHISON A,SPLITTER G.Microarrayanalysis of mRNA levels from RAW264.7 macrophages infected withBrucella abortus[J].Infect Immun,2003,71(3):1125-1133.
[21]DIVE C.Analysis and discrimination of necrosis and apoptosis(programmed cell death)by multiparameter flow cytometry[J].Biochim Biophys Acta,1992,1133(3):275-285.
[22]LENG S X,MCELHANEY J E,WALSTON J D,et al.ELISA and multiplex technologies for cytokine measurement in inflammation and aging research[J].J Gerontol A-Biol,2008,63(8):879-884.