燕麦(Avena sativaL.)属禾本科植物,是集食用、饲用、经济、生态与社会价值于一体的农作物[1-2]。燕麦具有较高的营养价值,富含淀粉、蛋白质、脂肪酸、维生素和矿物质等营养成分,同时富含丰富的膳食纤维,有促肠胃蠕动、降血脂、降血糖、抗氧化、减肥、增强免疫力等功效[3-8]。燕麦的抗氧化成分主要是多酚黄酮类物质,同时燕麦中的维生素E(vitamin E,VE)、甾醇、羟基脂肪酸也有一定的抗氧化作用[9-11]。β-葡聚糖作为目前燕麦功能成分研究热点之一,已被证实燕麦降血脂和降餐后血糖功能与其富含的β-葡聚糖密切相关,燕麦中β-葡聚糖具有降低血清胆固醇、调节血糖水平、改善肠道菌群、增强免疫力、保护肝损伤等功能[12-16]。
苹果(Malus pumilaMill.)中含有糖类、果胶、维生素、矿物质及有机酸等多种成分[17]。苹果醋是苹果汁经酵母菌、醋酸菌等微生物发酵而成。近年来研究发现,苹果醋具有促进新陈代谢、调节酸碱平衡、消除疲劳等功能[18]。苹果醋能清洗消化系统,促进关节、血管及其他内脏等器官长期积累的毒素代谢,还具有降低血脂和促进排毒的作用[19]。
本研究将燕麦粉碎后,混合苹果汁进行酒精发酵,后接种醋酸菌进行醋酸发酵制备燕麦苹果复合果醋,通过单因素和响应面试验优化醋酸发酵工艺,并利用2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonat,ABTS)法和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法对燕麦苹果醋黄酮类物质抗氧化活性进行测定分析,并采用气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)仪对产品中的黄酮类化合物进行检测分析,为产业化开发燕麦苹果复合果醋产品提供新的思路。
1 材料与方法
1.1 材料与试剂
燕麦、鲜苹果、蔗糖:市售;活性干酵母:安琪酵母股份有限公司;巴氏醋杆菌(Acetobacter pasteurianus)CP-A11:天津科技大学微生物制药研究室;无水乙醇、甲基叔丁基醚、甲醇、亚硝酸钠、硝酸铝、氢氧化钠(均为分析纯):天津天力化学试剂有限公司;葡萄糖(分析纯):山东西王糖业有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;硅烷化试剂(N,O-双(三甲基硅烷基)三氟乙酰胺(bis(trimethylsilyl)trifluoroacetamide,BSTFA)+1%三甲基氯硅烷trimethylchlorosilane,TMCS)(色谱纯):美国Sigma公司。
GY培养基:1%酵母膏,3%葡萄糖,1%蛋白胨,0.5%碳酸钙,3.5%vol乙醇。
1.2 仪器与设备
7890B-5977A型气质联用仪:美国安捷伦公司;TG16-WS型高速离心机:长沙湘仪离心机仪器有限公司;FD-1C-50真空冷冻干燥机:北京博医康仪器有限公司;200Y粉碎机:永康市铂欧五金制品有限公司;HLG-A恒温振荡培养箱:太仓市实验设备厂;HH-2水浴锅:邦西仪器科技(上海)有限公司;C18固相萃取柱:美国Waters公司。
1.3 试验方法
1.3.1 燕麦苹果复合果醋加工工艺流程及操作要点

操作要点:取新鲜经清洗、去核去皮的苹果破碎后用螺旋榨汁机榨汁,过滤得到的苹果汁与粉碎并过40目筛燕麦按一定比例调配,并添加适量蔗糖至总糖含量为200~220 g/L,然后按照15%接种量接入已经用33~35℃温水活化30 min的酵母液,25℃静置发酵10 d,即得燕麦苹果复合果酒,此时酒精度为8%vol~12%vol,总糖含量为(11.9±1.5)g/L。调整初始酒度为4%vol~12%vol,将已用GY培养基活化12 h后的醋酸菌按2%~12%接种量接入燕麦苹果复合果酒,26~36℃、120~200 r/min条件下恒温发酵8 d,可得燕麦苹果复合果醋,最后经板框压滤机压滤澄,进行巴氏消毒(68~70℃、30 min),即得燕麦苹果复合果醋。
1.3.2 醋酸发酵工艺优化单因素试验
以总酸含量为评价指标,分别考察影响醋酸发酵的主要因素:醋酸菌接种量、发酵温度、摇床转速及发酵初始酒精度等单因素对醋酸发酵的影响。装液量为50mL/250mL,每组设置3个平行试验,具体考察条件参数如下所示:考察不同接种量(2%、4%、6%、8%、10%、12%)、不同发酵温度(26℃、28℃、30℃、32℃、34℃、36℃)、不同摇床转速为(120 r/min、140 r/min、160 r/min、180 r/min、200 r/min)及不同初始酒精度(4%vol、6%vol、8%vol、10%vol、12%vol)对总酸含量的影响。
1.3.3 醋酸发酵工艺优化响应面试验
采用响应面试验设计,以接种量(A)、初始酒精度(B)、摇床转速(C)、发酵温度(D)为影响因素,以总酸含量(Y)为响应值,设计4因素3水平响应面试验,各因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design
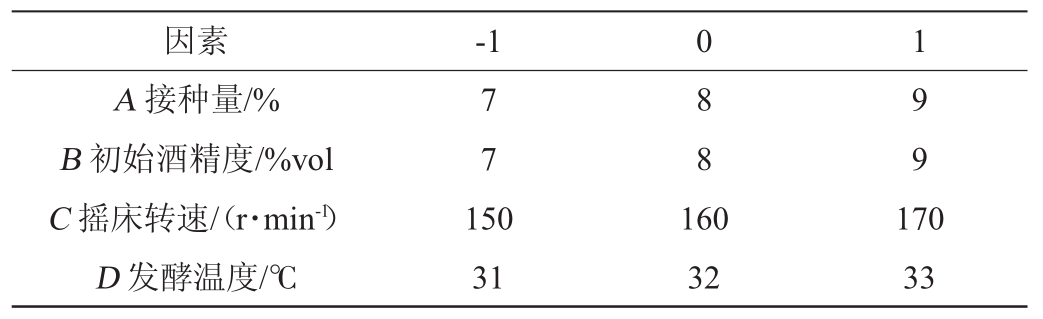
因素 -1 0 1 A接种量/%B初始酒精度/%vol C摇床转速/(r·min-1)D发酵温度/℃7 7 8 8 9 9 150 31 160 32 170 33
1.3.4 抗氧化活性分析
(1)黄酮类物质的提取
参照文献[20]的方法,取燕麦苹果复合果醋100 mL于5 000 r/min转速条件下离心,上清液调pH值至2.0(此时黄酮类化合物的稳定性最好,不易被氧化),通过C18固相萃取柱,控制流速1 mL/min。将C18固相萃取柱置于冷冻干燥机中冻干除去水分,同时减少黄酮类物质被氧化,用于后续气质联用分析,用等体积的洗脱液(甲基叔丁基醚∶甲醇=3∶2,V/V)洗脱柱填料中的黄酮类物质,将收集到的洗脱液氮气吹至干,将得到的黄酮类物质干粉分成两部分,一部分用于后续的抗氧化试验研究,另一部分加入1 mL硅烷化试剂于50℃反应60min,将反应液过0.22μm滤膜备用。
(2)ABTS自由基清除率的测定[21]
维生素C(VitaminC,VC)标准曲线的绘制:将维生素C标准液稀释成1 mg/100 mL、5 mg/100 mL、10 mg/100 mL、15mg/100mL、20mg/100mL。在96孔板中加入200μLABTS工作液后,加入10 μL各质量浓度VC稀释液,空白组中为10μL磷酸盐缓冲液(phosphate buffer solution,PBS),混匀,室温避光孵育5min,测定波长734nm处的吸光度值,以VC质量浓度(x)为横坐标,ABTS自由基清除率(y)为纵坐标,绘制VC标准曲线,得标准曲线回归方程为y=4.9089x-3.47534,相关系数R2为0.9997。ABTS自由基清除率计算公式如下:式中:A空白表示空白组的吸光度值,A样品表示样品组的吸光度值。
抗氧化活性测定:将复合果醋黄酮类物质溶解后,在96孔板中加入200 μL ABTS工作液后,加入10 μL的上述制备的粗黄酮冻干样品,混匀,室温避光孵育5 min,测定波长734 nm处的吸光度值,按照VC标准曲线计算燕麦苹果醋黄酮类物质的抗氧化活性,结果以维生素C等值当量(vitamin C equivalent,VCE)表示(mg VCE/L)。
(3)DPPH自由基清除率的测定[22]
取1 mL粗黄酮溶液(0.025 mg/mL、0.050 mg/mL、0.100 mg/mL、0.500mg/mL、1.000mg/mL)于具塞试管中,与0.1mmol/L的DPPH自由基乙醇溶液1mL混合反应20min后,355 r/min离心10 min,取上清液在波长517 nm处测定吸光度值,记为Ai,同时用乙醇作空白对照,吸光度值记为Ac,以及1mL样品水溶液和1mL无水乙醇混匀按上述方法测定吸光度值,记为Aj。DPPH自由基清除率计算公式如下:
1.3.5 燕麦苹果复合果醋中黄酮类物质检测[23]
采用气相色谱质谱联用(GC-MS)法测定复合果醋中黄酮类物质。GC条件:HP-5色谱柱(30 mm×0.25 mm×1 μm),进样口温度300℃;载气为氦气(He),流速1mL/min;进样量1.5μL,分流比10∶1;升温程序:初始温度为60℃,以5℃/min升至300℃。MS条件:电子电离(electronic ionization,EI)源,离子源温度230℃;四极杆温度150℃;数据采集频率3 Hz;扫描范围45~999 m/z。
1.3.6 数据分析
每个样品至少3次重复数据,采用SPSS 20.0软件进行方差分析和Tukey's相关性分析,采用Origin 8.5软件作图,实验数据以平均值±标准差(X±SD)表示,显著性差异以P<0.05为标准。
2 结果与分析
2.1 醋酸发酵工艺优化单因素试验
2.1.1 接种量对总酸含量的影响
发酵过程接种量的大小会影响发酵时间的长短,进而影响总酸的含量[24]。本试验在发酵温度30℃、摇床转速150 r/min、初始酒精度为8%vol条件下,醋酸菌接种量设置为2%、4%、6%、8%、10%、12%(V/V),发酵8d后,测定各组总酸含量,结果见图1。由图1可知,总酸含量随接种量在2%~8%(V/V)范围内增加而增高,并在接种量>8%(V/V)之后趋于稳定。因此,最适醋酸菌接种量为8%(V/V)。

图1 接种量对总酸含量的影响
Fig.1 Effect of inoculum on total acid content
2.1.2 发酵温度对总酸含量的影响
微生物发酵过程中各种酶的作用至关重要,温度是影响酶活力的重要因素之一。正常情况下,温度过高或偏低都会直接影响酶活力[25]。醋酸菌在不同的生长阶段对温度的敏感性也不同,在接种量为8%、摇床转速150 r/min、初始酒精度为8%vol条件下,发酵温度设置为26℃、28℃、30℃、32℃、34℃、36℃,发酵8 d后,测定各组总酸含量,结果见图2。由图2可知,总酸含量随温度在26~32℃范围内增加而增高,并在温度为32℃时总酸含量最高,温度高于32℃之后下降。因此,最适发酵温度为32℃。
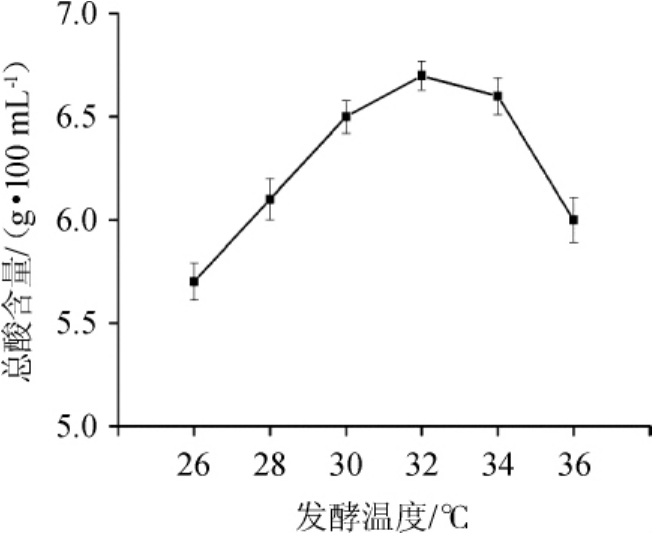
图2 发酵温度对总酸含量的影响
Fig.2 Effect of fermentation temperature on total acid content
2.1.3 摇床转速对总酸含量的影响
摇床转速与发酵液中的溶解氧呈正相关关系[26]。对于醋酸菌等好氧微生物而言,发酵液中的溶解氧会影响其自身的生长代谢。在接种量为8%、发酵温度为32℃、初始酒精度为8%vol条件下,摇床转速设置为120 r/min、140 r/min、160 r/min、180 r/min、200 r/min,发酵8 d后,测定各组总酸含量,结果见图3。由图3可知,总酸含量随转速在120~160 r/min范围内增加而增高,并在转速为160 r/min时总酸含量最高,转速>160 r/min之后总酸含量趋于稳定。因此,最适转速为160 r/min。

图3 摇床转速对总酸含量的影响
Fig.3 Effect of rotational speed on total acid content
2.1.4 初始酒精度对总酸含量的影响
醋酸菌对酒精具有一定的耐受性,低酒精浓度下有利于酸的产生,但较高的酒精浓度会影响醋酸菌的活性[27]。在接种量8%、发酵温度32℃、摇床转速160 r/min条件下,初始酒精度设置为4%vol、6%vol、8%vol、10%vol、12%vol,发酵8d后,测定各组总酸含量,结果见图4。由图4可知,总酸含量随初始酒精度在4%vol~8%vol范围内增加而增高,并在初始酒精度为8%vol时总酸含量最高,初始酒精度>8%vol之后总酸含量下降。因此,最适初始酒精度为8%vol。
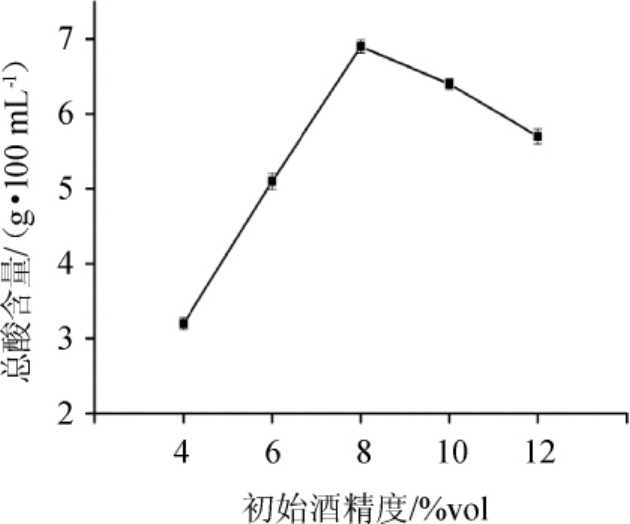
图4 初始酒精度对总酸含量的影响
Fig.4 Effect of initial alcohol content on total acid content
2.2 醋酸发酵工艺优化响应面试验
以单因素试验得到对总酸含量影响较大的4个因素进行4因素3水平响应面试验,试验方案及结果见表2,方差分析见表3。
采用Design-Expert.V8.0.6.1对表2结果进行响应面回归分析,经分析得到一个多元二次回归方程:
Y=6.64-0.058A+0.022B+0.046C-0.33D+0.032AB-0.027AC+0.041AD+0.010BC-0.014BD+6.27E-003CD-0.043A2+9.84E-003B2+0.052C2+0.19D2
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
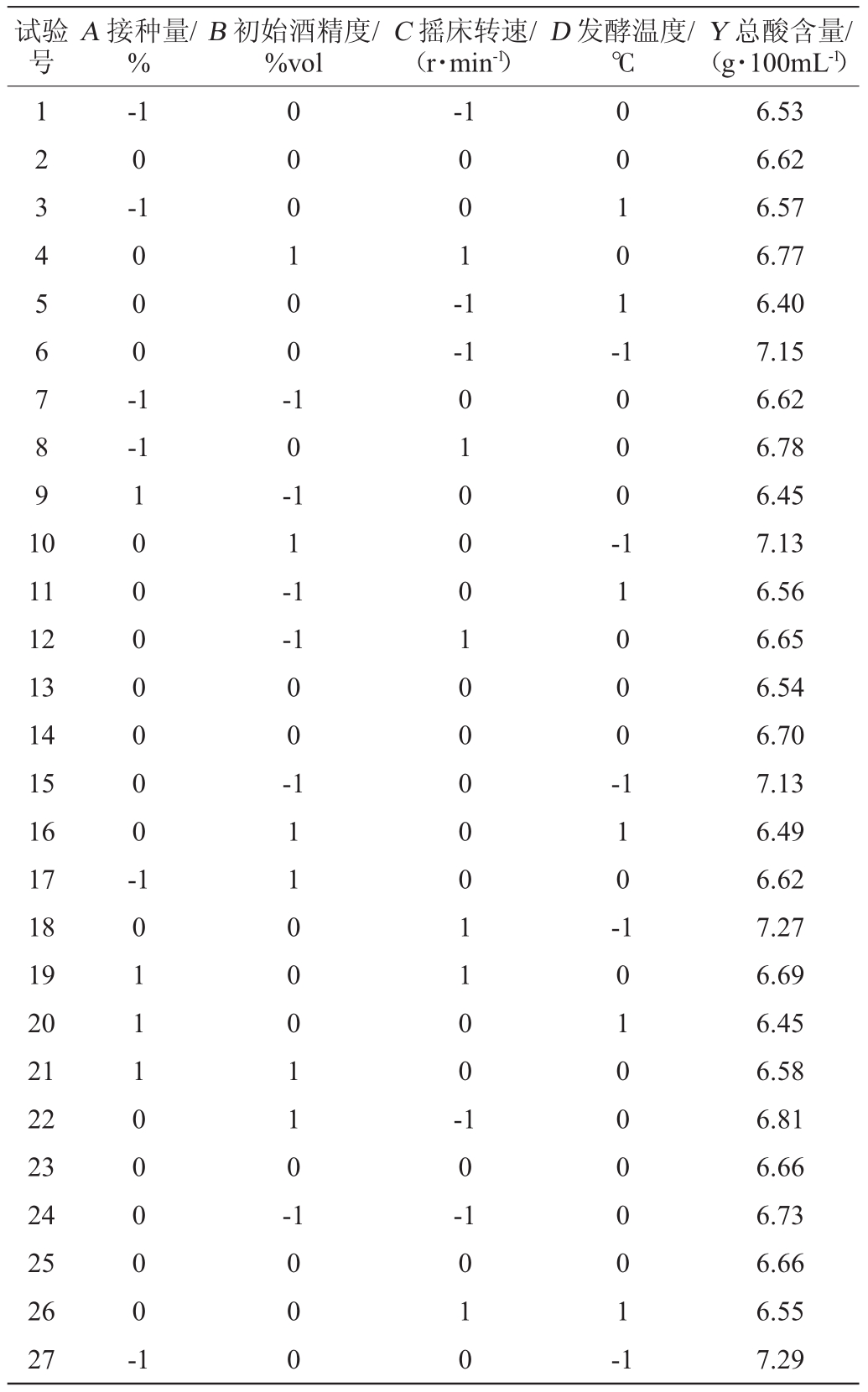
试验号A接种量/%B初始酒精度/%vol C摇床转速/(r·min-1)D发酵温度/℃Y总酸含量/(g·100mL-1)1 2 3 4 5 6 7 8 9 1 0-1 0-1-1 0 0 0 -1 0 0 0 1 0 0-0 0 1 -1-1 0 0 1 0 1--1 1 0 -1 0 0 0 -11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 1 0 0 0 0 0 0 0-1 1 -1-1 0 0 -1 1 0 0 0 -1 0 1 1 1 0 0 0 0 0-1 1 1 1 0 0 0 1 1 0-0 1 0 0 0 1 0 0 0 0 0 1 1 0 0 -1 1 0 -1 0 0 0 1 0 -1 0 1 0 1 0 1 0 0 0 0 0 1-1 6.53 6.62 6.57 6.77 6.40 7.15 6.62 6.78 6.45 7.13 6.56 6.65 6.54 6.70 7.13 6.49 6.62 7.27 6.69 6.45 6.58 6.81 6.66 6.73 6.66 6.55 7.29
表3 回归模型方差分析
Table 3 Variance analysis of regression model
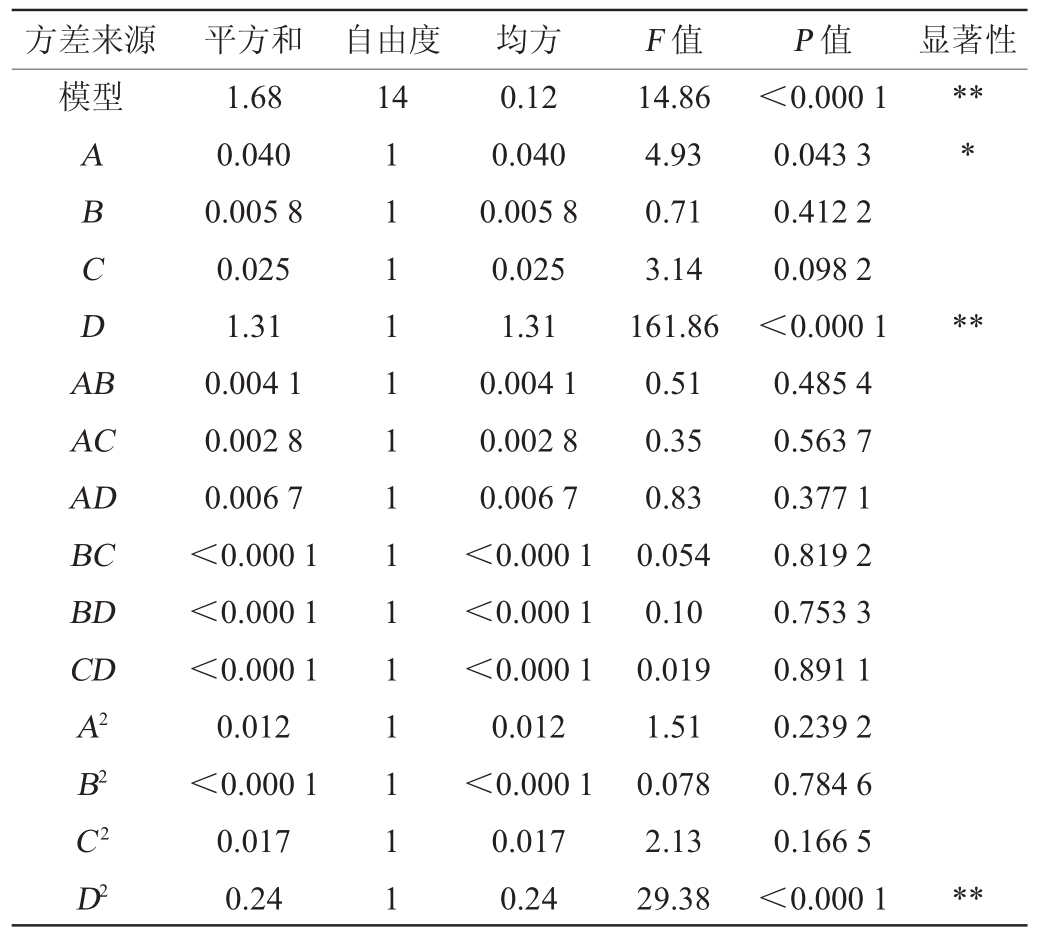
方差来源 平方和 自由度 均方 F值 P值 显著性模型14 A B C D A B*****AC AD BC BD CD A2 B2 C2 D2 1.68 0.040 0.005 8 0.025 1.31 0.004 1 0.002 8 0.006 7<0.000 1<0.000 1<0.000 1 0.012<0.000 1 0.017 0.24 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0.12 0.040 0.005 8 0.025 1.31 0.004 1 0.002 8 0.006 7<0.000 1<0.000 1<0.000 1 0.012<0.000 1 0.017 0.24 14.86 4.93 0.71 3.14 161.86 0.51 0.35 0.83 0.054 0.10 0.019 1.51 0.078 2.13 29.38<0.000 1 0.043 3 0.412 2 0.098 2<0.000 1 0.485 4 0.563 7 0.377 1 0.819 2 0.753 3 0.891 1 0.239 2 0.784 6 0.166 5<0.000 1**
续表

注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F值 P值 显著性残差失拟项纯误差总误差0.11 0.099 0.015 1.80 14 10 4 28 0.008 0 0.009 8 0.003 7 2.68 0.177 6
由表3可知,该回归方程模型P值<0.000 1,表明模型极显著;模型的失拟项的F值和P值分别为2.68和0.177 6,证明失拟项不显著,表明回归模型是合适的,可以用来分析和预测醋酸发酵工艺条件。模型决定系数R2为0.937 0,说明93.70%的期望值变化可以用这一多项式解释。一次项A对响应值的影响显著(P<0.05)、一次项D和二次项D2对响应值的影响极显著(P<0.01)。由Design-Expert8.06软件得出最佳醋酸发酵工艺条件为醋酸菌接种量7.3%、初始酒精度8.9%vol、转速169r/min、发酵温度31℃。在此条件下总酸含量理论值为7.34 g/100 mL。为了便于实际操作,将上述最佳醋酸发酵工艺条件为接种量7%、初始酒精度9%vol、转速170r/min、发酵温度31℃。以此条件进行3次平行验证试验,最终得到的总酸含量为(7.35±0.04)g/100mL,与理论值基本一致,说明响应面法得出的醋酸发酵工艺条件是可行的。
2.3 燕麦苹果醋抗氧化活性分析[28-30]
2.3.1 ABTS法分析燕麦苹果复合果醋抗氧化活性
利用ABTS法对其抗氧化活性进行测定可得出不同质量浓度粗黄酮与ABTS清除率的关系,结果如图5所示,随着燕麦苹果复合果醋中黄酮物质含量的增加,其ABTS自由基清除率逐步升高,同时依据1.3方法计算出燕麦苹果醋黄酮类物质抗氧化活性值为(100.27±3.53)mgVCE/L,能有效清除ABTS自由基,表现出较高的抗氧化活性。

图5 燕麦苹果复合果醋粗黄酮清除ABTS曲线
Fig.5 ABTS scavenging curve of flavonoids in oat-apple compound fruit vinegar
2.3.2 DPPH法分析燕麦苹果复合果醋抗氧化活性
由图6可知,DPPH自由基清除能力与燕麦苹果复合果醋提取黄酮类物质含量呈量效关系,即随着黄酮类物质含量的增加,DPPH自由基清除能力逐渐增加,表明燕麦苹果复合果醋中黄酮类物质具有较好的抗氧化活性,清除率可达(60.21±1.56)%,其DPPH自由基清除率与郑淑彦[31]利用氯仿/乙酸乙酯萃取枳椇醋得到物质的DPPH自由基清除活性一致。
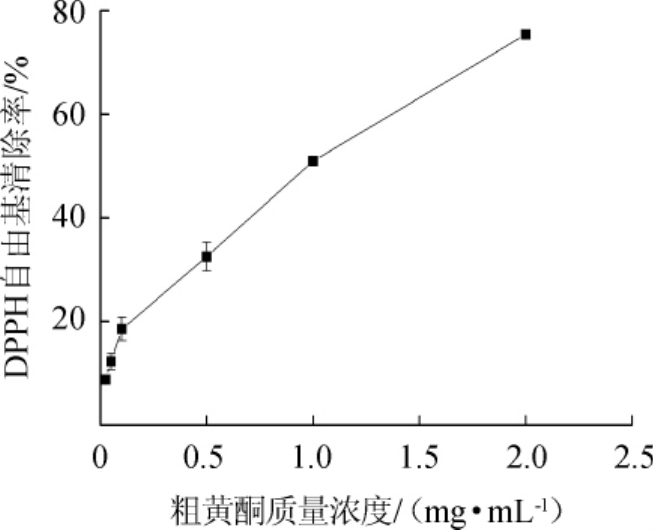
图6 燕麦苹果复合果醋粗黄酮含量清除DPPH曲线
Fig.6 DPPH scavenging curve of flavonoids in oat-apple compound fruit vinegar
2.4 燕麦苹果醋中黄酮化合物GC-MS检测结果
通过气相色谱质谱联用仪对燕麦苹果醋中的黄酮类化合物进行检测,总离子流色谱图见图7。
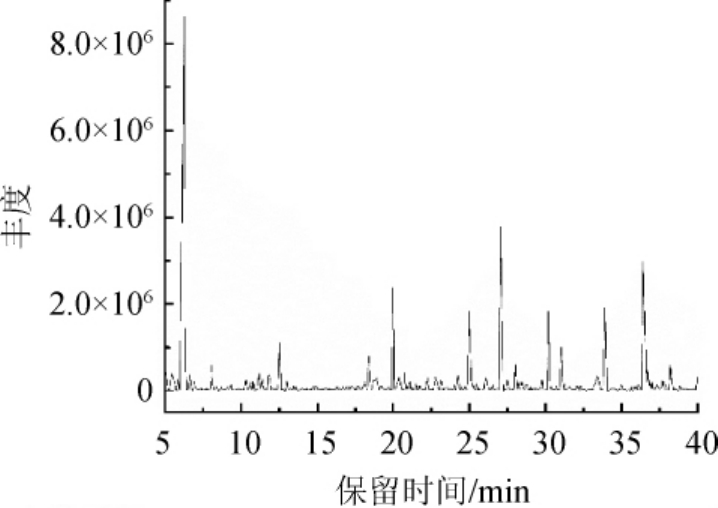
图7 燕麦苹果复合果醋黄酮化合物GC-MS分析总离子流图
Fig.7 Total ions chromatogram of flavonoids in oat-apple compound fruit vinegar analyzed by GC-MS
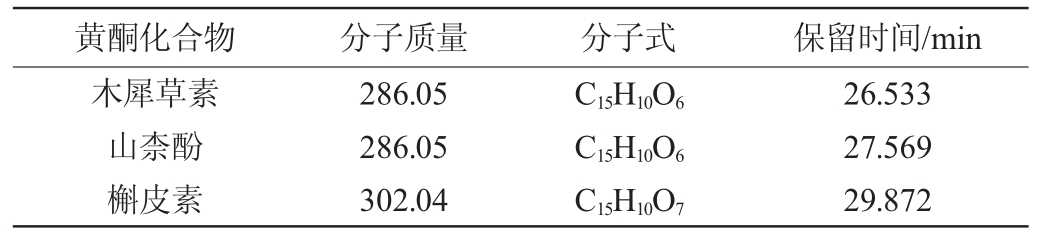
根据燕麦苹果醋样品GC-MS总离子流图中质谱特征、保留参数,比对查询美国国家标准与技术研究院(national institute of standards and technology,NIST)11谱库,得到样品中黄酮类化合物种类、结构式及特征峰保留时间,结果见表4。由表4可知,燕麦苹果复合果醋中共检测到3种黄酮类化合物,分别为木犀草素、山柰酚和槲皮素。实验研究证明[32-33],这3种黄酮类化合物具有较高的抗氧化活性。
表4 燕麦苹果复合果醋中黄酮类化合物GC-MS分析结果
Table 4 Results of flavonoids in oat-apple compound fruit vinegar analyzed by GC-MS
黄酮化合物 分子质量 分子式 保留时间/min木犀草素山柰酚槲皮素286.05 286.05 302.04 C15H10O6 C15H10O6 C15H10O7 26.533 27.569 29.872
3 结论
通过响应面试验设计对燕麦苹果醋醋酸发酵阶段影响因素进行分析并对工艺条件进行优化,在接种量7%(V/V)、发酵温度31℃、转速170r/min、初始酒精度9%vol条件下,总酸含量为(7.35±0.04)g/100mL,比未优化前提高19.67%。通过ABTS法对燕麦苹果醋黄酮类物质抗氧化活性进行测定,其抗氧化活性值为(100.27±3.53)mgVCE/L,对ABTS自由基有较好的清除能力,同时测定其DPPH自由基清除率可达(60.21±1.56)%,表明燕麦苹果醋具有较高的抗氧化活性。并利用GC-MS法从燕麦苹果醋产品中共检出3种黄酮类化合物,分别为木犀草素、山柰酚及槲皮素。研究结果对燕麦苹果醋产品开发提供了技术支持。
[1]汪海波,谢笔钧,刘大川.燕麦中抗氧化成分的初步研究[J].食品科学,2003,24(7):62-67.
[2]张越.糖添加量对燕麦酵素发酵特性的影响[J].安徽农业科学,2019,47(4):165-169.
[3]ANDERSON J W,STORY L,SIELING B,et al.Hypocholesterolemic effects of oat-bran or bean intake for hypercholesterolemic men[J].Am J Clin Nutr,1984,40(6):1146-1150.
[4]PETERSON D M.Oat antioxidants[J].J Cereal Sci,2001,33(2):115-129.
[5]EMMONS C L,PETERSON D M,PAUL G L.Antioxidant capacity of oat(Avena sativaL.)Extracts.2.in vitroantioxidant activity and contents of phenolic and tocol antioxidants[J].J Agr Food Chem,1999,47(12):4894-4898.
[6]BUTT M S,TAHIR-NADEEM M,KHAN M K I,et al.Oat:unique among the cereals[J].Eur J Nutr,2008,47(2):68-79.
[7]LI M,KOECHER K,HANSEN L,et al.Phenolic recovery and bioaccessibilityfrom milled and finished whole grain oat products[J].Food Funct,2016,7(8):3370-3381.
[8]XIA Z,CHOLEWA J M,DARDEVET D,et al.Effects of oat protein supplementation on skeletal muscle damage,inflammation and performance recovery following downhill running in untrained collegiate men[J].Food Funct,2018,9(9):4720-4729.
[9]ALFIERI M,REDAELLI R.Oat phenolic content and total antioxidant capacity during grain development[J].J Cereal Sci,2015,65:39-42.
[10]XING Y M,WHITE P J.Identification and function of antioxidants from oat groat and hulls[J].J Am Oil Chem Soc,1997,74(3):303-307.
[11]RIPSIN C M,KEENAN J M,JACOBS D R,et al.Oat products and lipid lowering:Ameta-analysis[J].J Am Med Associat,1992,267(24):3317-3325.
[12]刘博,林亲录,罗非君.燕麦葡聚糖的生理功能研究进展[J].粮食与油脂,2016,29(2):1-5.
[13]AKRAMIENE D,KONDROTAS A,DIDZIAPETRIENE J,et al.Effects of beta-glucans on the immune system[J].Medicina,2007,43(8):597-606.
[14]WILCZAK J,BLASZCZYK K,KAMOLA D,et al.The effect of low or high molecular weight oat beta-glucans on the inflammatory and oxidative stress status in the colon of rats with LPS-induced enteritis[J].Food Funct,2015,6(2):590-603.
[15]PEI S P,MAI W J,SUN H,et al.The hepatoprotectuve effect of oat betaglucans on liver injury in hyperlipemia rats[J].Acta Nutrimenta Sinica,2009,31(1):55-58.
[16]YOU S,HU X,ZHAO Q,et al.Oat β-glucan inhibits lipopolysaccharide-induced nonalcoholic steatohepatitis in mice[J].Food Funct,2013,4(9):1360-1368.
[17]李明星.苹果醋生产工艺优化及其抗运动疲劳功能研究[J].粮食与油脂,2018,31(3):59-64.
[18]王斌.一种苹果醋生产的新工艺[J].青岛科技大学学报(自然科学版),2018,39(S1):52-54.
[19]李曦,陈倩,唐伟.苹果醋饮料中的有机酸分析[J].食品与发酵工业,2017,43(2):224-229.
[20]KINGSLEY K,TRUONG K,LOW E,et al.Soy protein extract(SPE)exhibits differentialin vitrocell proliferation effects in oral cancer and normal cell lines[J].J Nutraceut Funct Med Food,2011,8(2):169-188.
[21]姚佳慧.山西老陈醋对氧化应激肝损伤保护作用及机制研究[D].天津:天津科技大学,2018.
[22]YU X,YANG M,DONG J,et al.Comparative analysis of the antioxidant capacities and phenolic compounds of oat and buckwheat vinegars during production processes[J].J Food Sci,2018,83(3):844.
[23]RACHARLA A.Survey of flavonoids and their distribution in different kinds of onions using high performance liquid chromatography and gas chromatography-mass spectrometry[D].Johnson City:East Tennessee State University,2011.
[24]陈曦,李国林,陈梦玉,等.响应面法优化发酵蓝莓果醋发酵工艺条件[J].中国酿造,2018,37(9):73-77.
[25]ESPLEY R V,BUTTS C A,LAING W A,et al.Dietary flavonoids from modified apple reduce inflammation markers and modulate gut microbiota in mice[J].J Nutr,2014,144(2):146-154.
[26]ZHANG L M,LI R C,HAO L M,et al.Response surface methodology for optimization of extracting total flavonoids from maca leaves and antioxidant evaluation[J].Mod Food Sci Technol,2014,30(4):233-239.
[27]MILLER N J,RICE E C,DAVIES M J,et al.A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clin Sci,1993,84(4):407-412.
[28]薛淑琴.适度发酵结合冷冻浓缩对苹果醋品质及抗氧化性的研究[D].南昌:南昌大学,2017.
[29]徐清萍.镇江香醋抗氧化研究[D].无锡:江南大学,2005.
[30]LEE S,LEE J A,PARK G G,et al.Semi-continuous fermentation of onion vinegar and its functional properties[J].Molecules,2017,22(8):1313-1315.
[31]郑淑彦.枳椇醋抗氧化性研究[D].杨凌:西北农林科技大学,2011.
[32]段亚云,李建颖,程瑶,等.黑果枸杞叶槲皮素的制备及其体外抗氧化活性研究[J].食品研究与开发,2019(5):59-64.
[33]胡栋宝,赵剑雄.中药满山红中4个黄酮类化合物结构及其抗氧化活性的理论研究[J].中国中药杂志,2016,41(14):2675-2679.