鲊广椒也称为鲊尖椒、鲊金椒、酸面、面果子,是湖北宜昌、恩施地区汉族、土家族的特色发酵食品。鲊广椒是以鲜红辣椒酱和苞谷面(玉米面)为主要原料加工而成的,具有营养全面、开胃爽口的特点,适合人们养生所用。乳酸菌(lactic acidbacteria,LAB)是指发酵糖类主要产物为乳酸的一类无芽孢、革兰氏染色阳性细菌的总称[1]。目前,主要通过传统纯培养法对发酵食品中的乳酸菌进行研究,CHEN Y S[2-7]等已从台湾腌桃子、印度泡菜、辣白菜、四川泡菜中成功分离出大量的乳酸菌。
电子鼻又称气味扫描仪,电子鼻技术是以特定的传感器模拟人类嗅觉感官系统,快速提供被测样品的整体信息,从而指示样品中隐含特征的技术[8]。电子鼻技术是新兴的无损检测方法之一,随着科学技术的不断进步,电子鼻技术的研究越来越趋于完善,其已广泛应用于工业生产的各个部门。FAN Y等[9]利用电子鼻技术分析了中国传统虾酱中的特色风味物质;LIN X等[10]利用电子鼻技术研究了4个不同酵母株系对苹果酒风味物质的影响。
目前,关于鲊广椒中乳酸菌及其对鲊广椒挥发性风味物质的影响的研究还很少。因此,本研究对恩施鲊广椒中的乳酸菌进行分离纯化,采用分子生物学技术对其进行鉴定;然后将优势乳酸菌应用于鲊广椒,并利用电子鼻技术研究不同乳酸菌对鲊广椒中挥发性物质的影响,为鲊广椒的研究提供基础的依据,采用主成分分析(principal component analysis,PCA)筛选出适合鲊广椒发酵的乳酸菌菌种,为鲊广椒的工业化生产奠定基础。
1 材料与方法
1.1 材料与试剂
鲊广椒样品:采集自湖北恩施的农户家中,采集后的样品放入采样箱中低温保存。
玉米粉、红辣椒、盐、花椒、白胡椒和白酒:市售;MRS琼脂(液体)培养基:青岛海博生物技术有限公司;Axygen聚合酶链式反应(polymerase chain reaction,PCR)清洁试剂盒:康宁生命科学吴江有限公司;DL15000Marker、DL2000 Marker、PCR buffer、rTaq脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、pMD18-T克隆载体:宝生物工程(大连)有限公司;引物M13F(-47)、M13R(-48)、27F和1492R:武汉天一辉远生物科技有限公司。
1.2 仪器与设备
PTC-100 PCR仪:美国ABI公司;Fluor Chem FC3化学发光凝胶成像系统:美国Protein Simple公司;DG250厌氧工作站:英国Don Whitley公司;PEN3电子鼻(配备W1C、W5S、W3C、W6S、W5C、W1S、W1W、W2S、W2W和W3S10个金属氧化传感器):德国Airsense公司。
1.3 实验方法
1.3.1 乳酸菌的分离
采用稀释涂布平板法[11]对乳酸菌进行分离,取10-4、10-5、10-6三个梯度的稀释液涂布于含1.5%CaCO3的MRS固体培养基,于厌氧工作站30℃培养48h。挑取菌落形态不同和透明圈明显的单菌落纯化3次,纯化后的菌株进行革兰氏染色[12]与过氧化氢酶实验,初步确认其为乳酸菌后保存于-80℃冰箱中。
1.3.2 乳酸菌的鉴定
将初步确认为乳酸菌的菌株从-80℃冰箱中取出活化,收集菌体,采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammoniumbromide,CTAB)法[13]提取DNA。以此为模板,采用引物27F(5′-AGAGTTT GATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)对细菌的16S rDNA进行PCR扩增。PCR扩增体系[14](25 μL):DNA模板1 μL,rTaq酶0.5 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ri bonucleoside triphosphate,dNTP)2 μL,5 μmol/L27F0.5 μL,5 μmol/L 1495R 0.5 μL,10×PCR buffer 2.5 μL,用双蒸水(ddH2O)将体系补充至25 μL。PCR扩增条件:94℃预变性4 min;94℃变性1 min,55℃退火45 s,72℃延伸1 min,共30个循环;72℃再延伸10min,4℃保存。采用琼脂糖凝胶电泳检测PCR扩增产物,对符合目的片段大小的PCR扩增产物进行清洁并与pMD18-T载体进行连接,转化到大肠杆菌(Escherichia coli)TOP10中,利用引物M13F(-47)(5′-CGCCAGGGTTTTCCCAGTCACGAC-3′)和M13R(-48)(5′-AGCGGATAACAATTTCACACAGGA-3′)鉴定阳性克隆子,将阳性克隆子送往武汉天一辉远生物科技有限公司测序。测序结果去除引物序列后在美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行Blast搜索,选取同源性较高的模式菌株的16SrDNA序列,采用MEGA5软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.3 鲊广椒的制作
选取鲊广椒中的优势菌株进行鲊广椒的制作。将菌株从-80℃取出,取50μL菌液注入150mLMRS液体培养基中,37℃条件下培养24 h,进行第1代活化,连续活化3代后,10 000 r/min离心5 min,去除上清后加入45 mL生理盐水重悬菌体待用。
取750g玉米粉,225g切碎的红辣椒(手工切碎3~5mm宽度),3.15 g粉碎的花椒、胡椒,45 mL待用菌液(对照组加入等量的生理盐水),混合均匀,装入坛中,用水封口后于30℃培养箱中发酵20 d。鲊广椒发酵完成后,取300 g样品装入样品瓶中,-20℃保存备用。
1.3.4 基于电子鼻技术恩施鲊广椒风味品质的评价
取10 g鲊广椒样品置于电子鼻样品瓶中,室温下平衡30min,采用电子鼻技术对挥发性物质进行检测。电子鼻参数:进样吸气流量200mL/min,传感器清洁时间90s,调零时间5s,测定时间60s,每隔1s测量1个响应值。电子鼻有10个金属氧化传感器,每个传感器与其对应的敏感物质如表1所示[15]。
表1 金属传感器及其对应的性能描述
Table 1 Description of metal sensors and its corresponding performance
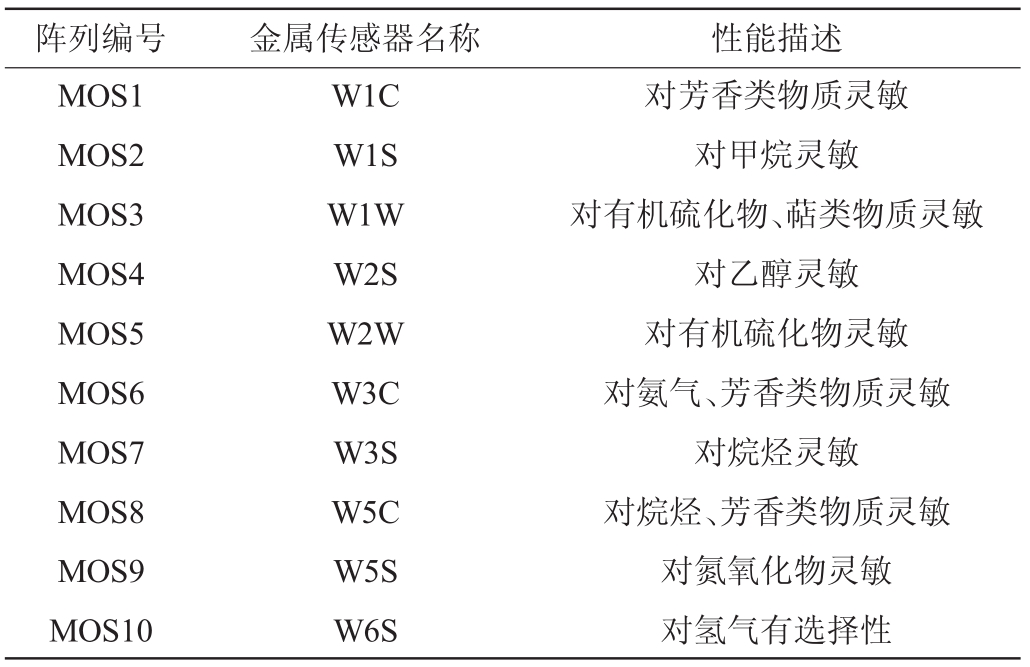
阵列编号 金属传感器名称 性能描述MOS1 MOS2 MOS3 MOS4 MOS5 MOS6 MOS7 MOS8 MOS9 MOS10 W1C W1S W1W W2S W2W W3C W3S W5C W5S W6S对芳香类物质灵敏对甲烷灵敏对有机硫化物、萜类物质灵敏对乙醇灵敏对有机硫化物灵敏对氨气、芳香类物质灵敏对烷烃灵敏对烷烃、芳香类物质灵敏对氮氧化物灵敏对氢气有选择性
1.3.5统计学分析
利用The SAS V8和Origin 2017进行电子鼻统计分析。使用主成分分析(PCA)对加入不同乳酸菌的鲊广椒的风味进行差异性分析。
2 结果与分析
2.1 菌株的分离纯化
采用稀释涂布平板法从恩施地区鲊广椒样品中共分离纯化出15株乳酸菌,编号为HBUAS51131、HBUAS51132、HBUAS51133、HBUAS51134、HBUAS51135、HBUAS51136、HBUAS51137、HBUAS51141、HBUAS51142、HBUAS51143、HBUAS51144、HBUAS51145、HBUAS51146、HBUAS51147、HBUAS51148。
2.2 菌株的鉴定
采用CTAB法提取15株乳酸菌的DNA,结果如图1所示。由图1可知,各菌株基因组DNA均在15 000 bp之上,且条带清晰明亮,证明提取的DNA可用于乳酸菌16S rDNA基因序列扩增[16]。

图1 乳酸菌基因组DNA琼脂糖凝胶电泳图
Fig.1 Agarose gel electrophoretogram of lactic acid bacteria
genomic DNA
M:DL15 000 DNA Marker;1:HBUAS51131;2:HBUAS51132;3:HBUAS51133;4:HBUAS51134;5:HBUAS51135;6:HBUAS51136;7:HBUAS51137;8:HBUAS51141;9:HBUAS51142;10:HBUAS51143;11:HBUAS51144;12:HBUAS51145;13:HBUAS51146;
14:HBUAS51147;15:HBUAS51148。下同。

图2 乳酸菌16S rDNA的PCR扩增产物琼脂糖凝胶电泳图
Fig.2 Agarose gel electrophoretogram of PCR amplification products of lactic acid bacteria 16S rDNA
M:DL2 000 DNA Marker。
15株乳酸菌16S rDNA PCR扩增产物琼脂糖凝胶电泳检测结果如图2所示。由图2可知,各泳道在1 500 bp左右都出现了一条明显的亮带,证明各菌株目标片段均被成功扩增。用清洁试剂盒对PCR扩增产物进行清洁,克隆后挑选阳性克隆子送往武汉天一辉远生物科技有限公司测序。
测序后所得序列进行拼接,在NCBI上进行同源性比对,15株乳酸菌16S rDNA序列同源性比对分析结果见表2。有文献报道[17],与模式菌株相比,同源性>98.65%的细菌被判定为同种。由表2可知,恩施地区鲊广椒的15株乳酸菌与其对应的模式菌株同源性均≥99%,表明乳酸菌均已鉴定到种的水平。
表2 乳酸菌16S rDNA序列同源性比对结果
Table 2 Homology alignment results of 16S rDNA sequences of lactic acid bacteria

菌株编号 登录号 模式株 同源性/%HBUAS51131 HBUAS51132 HBUAS51133 HBUAS51134 HBUAS51135 HBUAS51136 HBUAS51137 HBUAS51141 HBUAS51142 MH715359 MH665752 MH665753 MH665754 MH515355 MH665755 MH665756 MH665760 MH665761 99 99 100 99 99 99 99 99 99 HBUAS51143 HBUAS51144 HBUAS51145 HBUAS51146 HBUAS51147 HBUAS51148 MH665762 MH665763 MH665764 MH665765 MH665766 MH665767植物乳杆菌(Lactobacillusplantarum)NBRC15191 LactobacillusplantarumNBRC15191 LactobacillusplantarumNBRC15191 LactobacillusplantarumNBRC15191 LactobacillusplantarumNBRC15191 LactobacillusplantarumNBRC15191副干酪乳杆菌(Lactobacillusparacasei)JCM8130 LactobacillusplantarumNBRC15191发酵乳杆菌(Lactobacillusfermentum)CIP10298食品乳杆菌(Lactobacillusalimentarius)DSM20249 LactobacillusfermentumCIP10298 LactobacillusplantarumNBRC15191 LactobacillusplantarumNBRC15191 LactobacillusplantarumNBRC15191 LactobacillusfermentumCIP10298 99 99 99 99 99 99
选取同源性较高的模式菌株,采用NJ法构建系统发育树,结果如图3所示。由图3可知,菌株HUBAS51131、HUBAS51132、HUBAS51133、HUBAS51134、HUBAS51135、HUBAS51136、HUBAS51141、HUBAS51145、HUBAS51146和HUBAS51147 10株乳酸菌与植物乳杆菌(Lactobacillus plantarum)聚于一支,同源性≥99%,亲缘关系最近,因此鉴定这10株乳酸菌为植物乳杆菌(Lactobacillus plantarum);菌株HBUAS51142、HBUAS51144和HBUAS51148 3株乳酸菌与发酵乳杆菌(Lactobacillus fermentum)聚于一支,同源性≥99%,亲缘关系最近,因此鉴定这3株乳酸菌为发酵乳杆菌(Lactobacillus fermentum);菌株HBUAS51137与副干酪乳杆菌(Lactobacillusparacasei)聚于一支,同源性≥99%,亲缘关系最近,因此鉴定其为副干酪乳杆菌(Lactobacillus paracasei);菌株HBUAS51143与食品乳杆菌(Lactobacillus alimentarius)聚于一支,同源性≥99%,亲缘关系最近,因此鉴定其为食品乳杆菌(Lactobacillus alimentarius)。由此可推断,L.plantarum为恩施鲊广椒中的优势菌,占分离菌株总数的66.67%。与王玉荣等[18-19]对当阳地区鲊广椒中细菌多样性的研究结果相似,Lactobacillus属是优势菌属。

图3 基于16S rDNA序列乳酸菌的系统发育树
Fig.3 Phylogenetic tree of lactic acid bacteria based on 16S rDNA sequences
2.3 基于电子鼻技术恩施鲊广椒风味品质的评价
电子鼻有10根传感器,不同时间鲊广椒的电子鼻传感器响应值如图4所示。由图4可知,不同传感器对鲊广椒呈现不同的响应,W1W对鲊广椒的响应值最高,W1S、W5S、W2S和W2W响应值次之,W2S、W6S、W3C、W5C和W1C响应值偏低。随着检测时间的延长,传感器W1C(对芳香类物质灵敏)、W3C(对氨气、芳香类物质灵敏)和W5C(对烷烃、芳香类物质灵敏)的响应值呈下降趋势,传感器W1W(对有机硫化物、萜类物质灵敏)和W1S(对甲烷灵敏)响应值呈明显的上升趋势。结果表明,鲊广椒中挥发性风味物质有机硫化物、萜类物质以及甲烷等含量可能较高,芳香类挥发性风味物质的含量可能较低。鲊广椒的信号强度在45~55s趋于平稳,选取49 s、50 s、51 s的测量数据作为参考值,取3个数据的平均值进行PCA。
PCA是将提取的传感器响应值信号进行数据转换和降维,对降维后的特征向量进行线性分类,PC1和PC2上包含了在PCA转换中得到的第一主成分和第二主成分的方差贡献率。方差贡献率越大,说明此主要成分可以较好地反映原来多指标的信息[20]。一般情况下,总贡献率超过70%~80%的方法即可使用[21]。对于一个具有多个变量的全局函数来说,因子图分析法具有很大的通用性。基于电子鼻技术PC1和PC2的因子载荷图如图5所示。
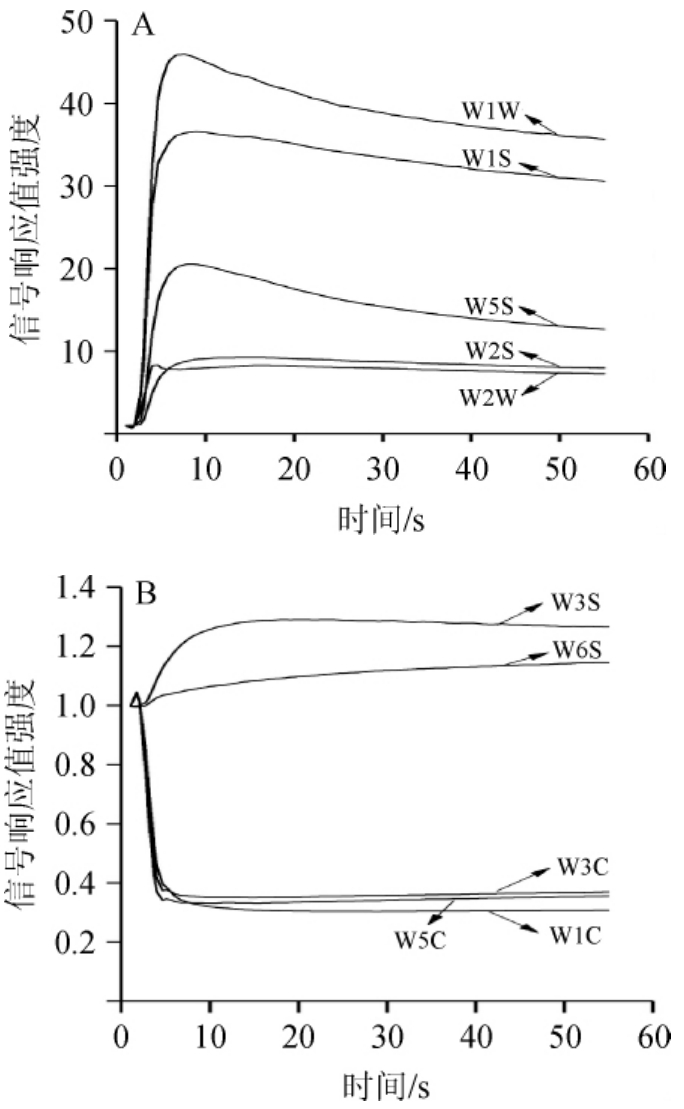
图4 不同时间鲊广椒的电子鼻传感器时间-强度动态响应
Fig.4 Time-intensity dynamic response of electronic nose sensor for Zhaguangjiao at different time
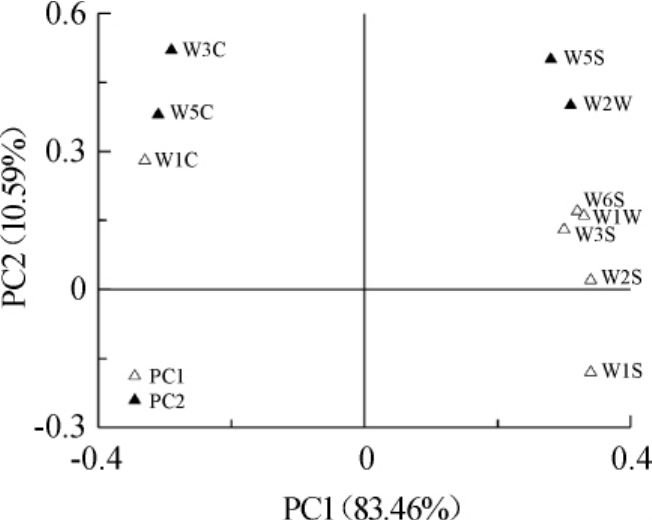
图5 基于主成分分析的因子载荷图
Fig.5 Factor loading diagram based on PCA
由图5可知,第一主成分贡献率为83.46%,第二主成分的贡献率为10.59%,总贡献率为94.04%,大于80%,说明PC1和PC2已经可以较好地反映样品的整体信息。而且,由于PC1的方差贡献率为83.46%,所以主要通过横坐标来反映10个样品的信息。第一主成分包括W1C、W1W、W6S、W2W、W3S、W2S和W1S;第二主成分包括W2W、W5C、W3C和W5S。基于电子鼻技术PC1和PC2的因子得分图如图6所示。
由图6可知,添加植物乳杆菌组均分布于第一、二、三象限中,对照组则处于第四象限。由此可知,添加植物乳杆菌组与对照组的差异性较大。结合图5分析可得,与对照组相比,添加植物乳杆菌组的鲊广椒芳香性物质含量更高,氮氧化物、氢化物、有机硫化合物和烷烃等物质含量显著降低。结合图5、图6分析可知,不同植物乳杆菌对鲊广椒的影响也存在较为显著的差异,植物乳杆菌HUBAS51132和HUBAS51141分布于第二象限,芳香类物质含量更高;植物乳杆菌HUBAS51134、HUBAS51147、HUBAS51133和HUBAS51131分布于第一象限,氢气、乙醇、烷烃、有机硫化物和萜类物质等物质含量更高。由此可见,利用HUBAS51132和HUBAS51141两株植物乳杆菌制作的鲊广椒芳香性更好。
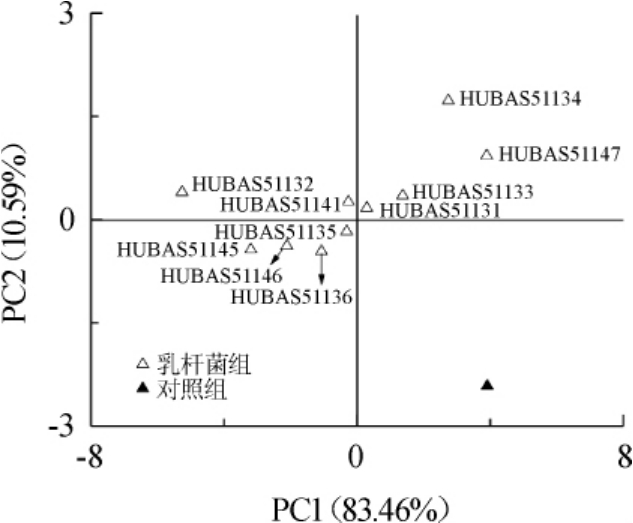
图6 基于主成分分析的因子得分图
Fig.6 Factor scores based on PCA
3 结论
本研究通过传统培养分离方法,从湖北恩施地区采集的15个鲊广椒样品中共分离出15株乳酸菌,通过分子生物学技术鉴定10株为植物乳杆菌(Lactobacillus plantarum)、3株为发酵乳杆菌(Lactobacillus fermentum)、1株为副干酪乳杆菌(Lactobacillus paracasei)、1株为食品乳杆菌(Lactobacillus alimentarius),其中L.plantarum占分离菌株总数的66.67%,为恩施鲊广椒中的优势乳酸菌。利用这10株植物乳杆菌制作鲊广椒,并利用电子鼻及主成分分析(PCA)分析与不添加乳杆菌的鲊广椒样品挥发性风味物质的差异。结果表明,与对照相比,添加L.plantarum的鲊广椒芳香类物质明显增多,氮氧化物、氢化物、有机硫化合物和烷烃等物质含量显著降低,且植物乳杆菌HUBAS51132和HUBAS51141制作的鲊广椒芳香性更好,在风味上更迎合消费者的喜好。
[1]曹振辉,刘永仕,潘洪彬,等.乳酸菌的益生功能及作用机制研究进展[J].食品工业科技,2015,36(24):366-370,377.
[2]CHEN Y S,WU H C,PAN S F,et al.Isolation and characterization of lactic acid bacteria from yan-taozih(pickled peaches)in Taiwan[J].Ann Microbiol,2013,63(2):607-614.
[3]MONIKAM,SAVITRI,KUMAR V,et al.Isolation and characterization of lactic acid bacteria from traditional pickes of Himachal Pradesh,India[J].J Food Sci Tech,2017,54(7):1945-1952.
[4]孟令帅,张颖,邹婷婷,等.辣白菜中乳酸菌的分离鉴定[J].食品科学,2015,36(11):130-133.
[5]YU J,GAO W,QING M,et al.Identification and characterization of lactic acid bacteria isolated from traditional pickles in Sichuan,China[J].J Gen Appl Microbiol,2012,58(3):163-172.
[6]杨吉霞,张利玲,蒋厚阳,等.眉山泡菜中乳酸菌的分离鉴定[J].食品科学,2015,36(17):158-163.
[7]张蓓宿,王柱,王宪斌,等.四川地区泡菜微生物的多样性分析[J].食品与发酵科技,2016,52(1):1-5.
[8]郭若海,吴映江,刘玉春,等.电子鼻技术在高分子材料气味分析中的应用[J].新材料产业,2018(8):64-68.
[9]FAN Y,YIN L,XUE Y,et al.Analyzing the flavor compounds in Chinese traditional fermented shrimp pastes by HS-SPME-GC/MS and electronic nose[J].J Ocean U China,2017,16(2):311-318.
[10]LIN X,HU X P,WU W Y,et al.Evaluation of the volatile profile of wax apple(Syzygium samarangense)wines fermented with different commercialSaccharomyces cerevisiaestrains[J].Food Sci Biotechnol,2019,28(3):657-667.
[11]王丹丹,倪慧,赵慧君,等.凤窝酒曲中乳酸菌的分离及其作用下的米酒品质评价[J].中国酿造,2018,37(6):80-84.
[12]黄元桐,崔杰.革兰氏染色三步法与质量控制[J].微生物学报,1996,36(1):76-78.
[13]吴多桂,林栖凤,李冠一.红树DNA的十六烷基三甲基溴化铵法提取及其随机扩增多态DNA反应[J].中国生物化学与分子生物学报,1999,15(1):67-70.
[14]赵慧君,葛东颖,沈馨,等.襄阳大头菜腌制液中产膜醭酵母菌的多样性分析[J].中国酿造,2018,37(5):33-36.
[15]陈丽萍,徐茂琴,何红萍,等.应用PEN3型电子鼻传感器快速检测食源性致病菌[J].食品科学,2014,35(8):187-192.
[16]夏雪娟,陈芝兰,陈宗道,等.16S rDNA序列分析法快速鉴定西藏地区传统乳制品中的乳酸菌[J].食品科学,2013,34(14):245-249.
[17]KIM M,OH H S,PARK S C,et al.Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J].Int J Syst Evol Micr,2014,64:346-351.
[18]王玉荣,沈馨,董蕴,等.鲊广椒细菌多样性评价及其对风味的影响[J].食品与机械,2018,34(4):25-30.
[19]王玉荣,孙永坤,代凯文,等.基于单分子实时测序技术的3个当阳广椒样品细菌多样性研究[J].食品工业科技,2018,39(2):108-112,118.
[20]杨春杰,丁武,马利杰.电子鼻技术在区分酸羊奶发酵菌种中的应用[J].食品科学,2014,35(18):267-271.
[21]梁爱华,贾洪锋,秦文,等.电子鼻在方便米饭气味识别中的应用[J].中国粮油学报,2010,25(11):110-113,123.