黄曲霉毒素B1(aflatoxin B1,AFB1)是目前已发现的黄曲霉毒素中毒性最强的一种,其具有强肝毒性、高致突变性和高致畸性[1],广泛存在于农产品及饲料食品中,对人类健康存在严重威胁,同时对粮食和畜牧业造成严重的经济损失。AFB1的去除方法主要有物理法、化学法和微生物法。相对于物理法和化学法而言,微生物降解法反应条件温和,不易造成营养的流失,也不易产生新的毒素[2-3]。有选择性的使用微生物降解AFB1是一种对产品价值无明显损坏的去毒方法,因而,寻找能够高效安全降解AFB1的菌株已成为目前的研究热点[4-5]。
近年来,国内外已对降解AFB1的微生物进行了大量研究。PETCHKONGKAEWA等[6]从泰国传统发酵豆制品中筛选到一株能降解AFB1的芽孢杆菌(Bacillusspp.);TENIOLAO等[7]从受多环芳烃污染的土壤中分离出一株具有降解AFB1的红串红球菌(Rhodococcus erythropolis);张盼等[8]从发酵食品纳豆中筛选出一株AFB1降解率达到85.73%的枯草芽孢杆菌(Bacillus subtilis);关心等[9]从鸡粪中分离得到一株对AFB1高效降解的蔬菜芽孢杆菌(Bacillus oleronius);朱新贵等[10-12]也利用该种方法筛选得到不同的菌株。
虽然已有大量研究,但是真菌对AFB1降解率不高,且降解机理较为复杂,反应时间较长,因而较难进行实际应用[13-14]。细菌降解AFB1是一种有效、安全和环保的解毒方法。因此,本实验从多种不同环境中筛选能够高效、安全降解AFB1的细菌,并采用形态观察、生理生化实验及分子生物学技术对菌株进行鉴定。一方面为生物法降解AFB1的研究奠定基础,另一方面通过初步研究,为后期生物法降解AFB1的实际应用提供技术依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
豆类发酵食品、不同环境的土壤、动物肠道及其内容物:采集于佛山地区。
1.1.2 主要试剂
香豆素、AFB1标准品:美国Sigma公司;真菌抑制剂:美国Biosharp公司;AFB1快速检测试剂盒:北京华安麦科生物技术有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DNAMarker、DNA胶回收盒:日本Takara公司;甲醇、乙腈(均为色谱纯):德国默克公司;革兰氏染色液试剂盒:青岛海博生物技术有限公司;考马斯亮蓝快速染色液:北京百奥莱博科技有限公司。
1.1.3 培养基
富集培养基:(NH4)2SO45.0g,NaCl8.5g,超纯水1000mL,pH 7.0,121℃灭菌15 min。加入过滤除菌的香豆素溶液至1 g/L。
初筛培养基:(NH4)2SO45.0 g,KH2PO42.5 g,MgSO4 1.0 g,Na2HPO4·12H2O 0.5 g,CaCl20.1 g,琼脂20 g,蒸馏水1 L,pH 6.5,121℃灭菌15 min。加入过滤除菌的香豆素溶液至1 g/L。
营养肉汤培养基:牛肉膏3.0 g,蛋白胨10 g,NaCl 5.0 g,pH 7.0,121℃灭菌15 min。固体培养基中加入20 g琼脂。
复筛培养基:牛肉膏3.0 g,蛋白胨10 g,葡萄糖1.0 g,NaCl8.5g,KH2PO41.0g,蒸馏水1L,pH6.0,121℃灭菌15min。
斜面培养基:牛肉膏3.0 g,蛋白胨10 g,NaCl 5.0 g,琼脂20 g,蒸馏水1 L,pH 7.0,121 ℃灭菌15 min。
1.2 仪器与设备
Multiskan MK3酶标仪:美国Thermo公司;MS3旋涡混合器:德国IKA公司;AG22331聚合酶链式反应(polymerase chainreaction,PCR)仪:德国艾本德公司;DYCZ-24电泳仪:北京六一生物科技有限公司;BX51显微镜:日本奥林巴斯公司;GHP-9160隔水式培养箱:上海一恒科学仪器有限公司;CL-40M高压灭菌锅:日本ALP公司。
1.3 方法
1.3.1 富集培养
取5 g样品于含有45 mL生理盐水的均质袋中,利用均质器使样品和生理盐水混合均匀。从中吸取5mL加入45mL富集培养基中,加入0.1 g真菌抑制剂,37℃、150 r/min振荡培养24h,进行富集培养,以相同培养条件连续富集3次。
1.3.2 AFB1降解菌株的筛选
初筛:取富集培养液1mL于含9mL生理盐水的试管中,涡旋混匀。梯度稀释至10-4,吸取200 μL稀释液涂布于初筛培养基上,37℃倒置培养7 d。选取生长良好的单菌落保存于斜面培养基。
复筛:取斜面培养基中的菌株一环接种于10 mL营养肉汤培养基中,37℃、150 r/min振荡培养24 h。取5 mL营养肉汤培养液于45 mL复筛培养基中,37℃、150 r/min振荡培养3d。取培养液800μL,加入200μL质量浓度为100μg/L的AFB1标准品,以复筛培养基加等量AFB1标准品作为空白对照组。将样品置于37℃条件下避光静置培养72h后,4000r/min离心5min,吸取上清液,采用酶联免疫试剂盒测定AFB1含量。
1.3.3 降解作用与吸附作用的区分
将1.3.2中与AFB1反应后的培养液进行离心,去除上清液。加入1.0 mL磷酸缓冲盐溶液(phosphate buffer saline,PBS)(10 mmol/L,pH 7.0),涡旋混匀。37 ℃静置10 min,离心,将洗脱液移至5 mL离心管中,重复洗脱3次。使用体积分数为60%的甲醇进行提取,采用酶联免疫试剂盒测定提取液中AFB1的含量。以含质量浓度为20 μg/L AFB1的磷酸盐缓冲液作为空白对照。
1.3.4 AFB1降解菌株的鉴定
形态学鉴定:将筛选菌株接种于营养肉汤培养基中,37℃条件下培养24h。采用接种环在营养琼脂平板上划线,37℃条件下培养48 h,观察菌落形态,并进行革兰氏染色,观察细胞形态。
生理生化鉴定:分别进行过氧化氢酶、接触酶、脲酶、氨基酸脱羧酶与水解酶、糖醇类发酵、硝酸盐还原、酸碱耐受性等试验,参照《常见细菌系统鉴定手册》[15]和《伯杰氏系统细菌学手册》[16]进行初步鉴定。
分子生物学鉴定:采用DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板,采用通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对筛选菌株的16SrRNA进行PCR扩增。PCR扩增体系:模板DNA2μL,上下游引物(20μmol/L)各1 μL,PremixTaqDNA聚合酶25 μL,双蒸水(ddH2O)21 μL。PCR扩增条件:94℃预变性5min;94℃变性30s,54℃退火30 s,72℃延伸90 s,共35个循环;72℃再延伸10 min。PCR扩增产物经琼脂糖凝胶检测后,送往生工生物工程(上海)股份有限公司进行测序。测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行Blast同源性搜索,选取同源性较高的模式菌株的16S rRNA序列,采用MEGA 7的邻接(neighbour-joining,NJ)法构建系统发生树。
2 结果与分析
2.1 AFB1降解菌株的初筛结果
AFB1是香豆素的衍生物,两者结构相似。AFB1具有很强的毒性,如果使用AFB1直接进行初筛实验,可能会危害实验者的身体健康。LEELS等[17]研究发现,微生物降解AFB1的过程可能是分解AFB1中的香豆素基团,从而导致其毒性、致畸性的降低。
因此,本研究以香豆素代替AFB1为唯一碳源,进行初筛,结果见表1。由表1可知,共有9株细菌在以香豆素为唯一碳源的培养基中生长良好,其中2株(FJ4、FJ12)来源于发酵食品,1株(HS1)来源于花生地土壤、6株(ZC2、YAC2、JF1、YF4、YC2、YC8)来源于动物肠道及其内容物。
表1 黄曲霉毒素B1降解菌株初筛结果Table 1 Preliminary screening results of aflatoxin B1degrading strains
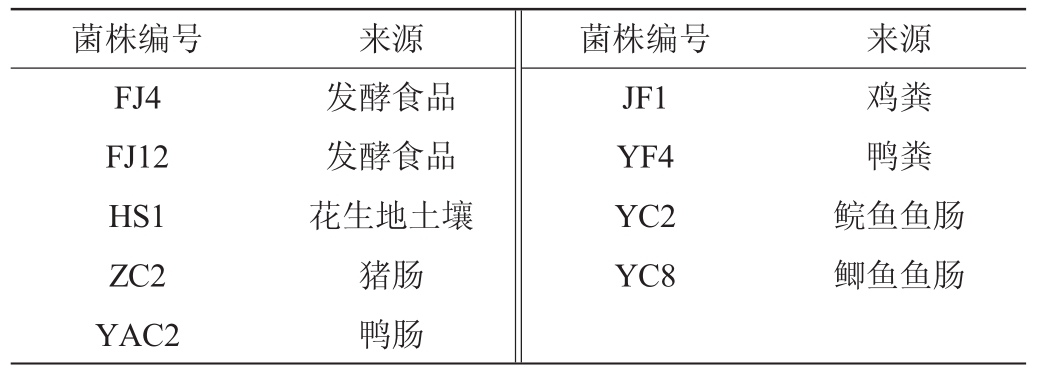
菌株编号 来源 菌株编号 来源FJ4 FJ12 HS1 ZC2 YAC2发酵食品发酵食品花生地土壤猪肠鸭肠JF1 YF4 YC2 YC8鸡粪鸭粪鲩鱼鱼肠鲫鱼鱼肠
2.2 AFB1降解菌的复筛结果
对初筛得到的9株细菌进行复筛,结果见图1。由图1可知,空白对照组中,AFB1降解率为2.2%,9株细菌的AFB1降解率均高于空白对照组,且8株细菌的AFB1降解率均>50%,其中菌株YC2的AFB1降解能力最强,降解率达到90.7%。因此,选择菌株YC2进行进一步研究。
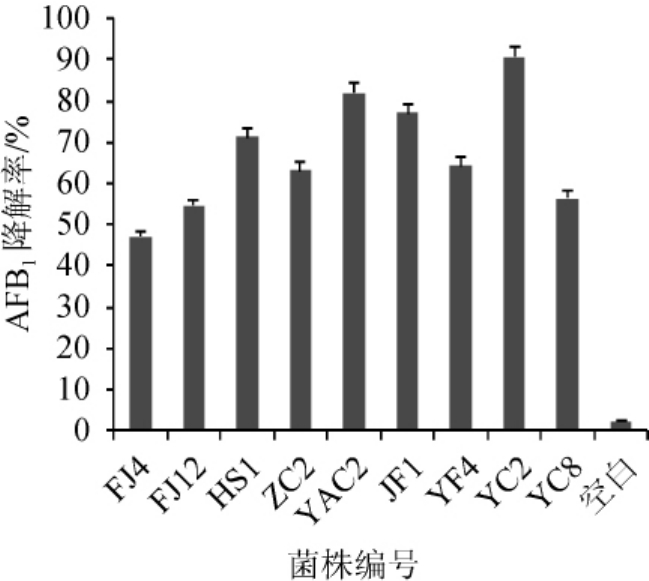
图1 黄曲霉毒素B1降解菌株复筛结果
Fig.1 Secondary screening results of aflatoxin B1degrading strains
2.3 降解作用与吸附作用的区分
微生物去除AFB1主要有两种作用方式,一种是降解作用,即将AFB1分解转化,形成新的低毒或无毒的产物。另一种是吸附作用。吸附作用是一种可逆的过程,主要是通过菌株细胞壁吸附黄曲霉毒素,而非共价结合,这种作用过程虽能有效降低AFB1,然而随着时间的延长,毒素会重新释放,是一种可逆的过程,无法对毒素达到有效的去除。因此,区分菌株降解和吸附作用是研究细菌降解AFB1的关键[18-22]。
菌株YC2的培养液与AFB1反应后,进行洗脱、萃取,测定萃取液中AFB1的含量,空白对照中AFB1的提取率达到96.3%,而菌株YC2与AFB1反应后的萃取液中AFB1提取率只有2.2%。结果表明,菌株YC2对AFB1的去除过程主要为降解反应,不是吸附作用。
2.4 菌株YC2的鉴定
2.4.1 菌株的形态学鉴定
菌株YC2的菌落和细胞形态见图2。由图2a可知,菌株YC2在营养琼脂平板上的菌落呈圆形、乳白色,边缘整齐且薄,菌体中央微隆起,呈丘状。由图2b可知,细胞形态呈杆状,革兰氏染色呈阳性。
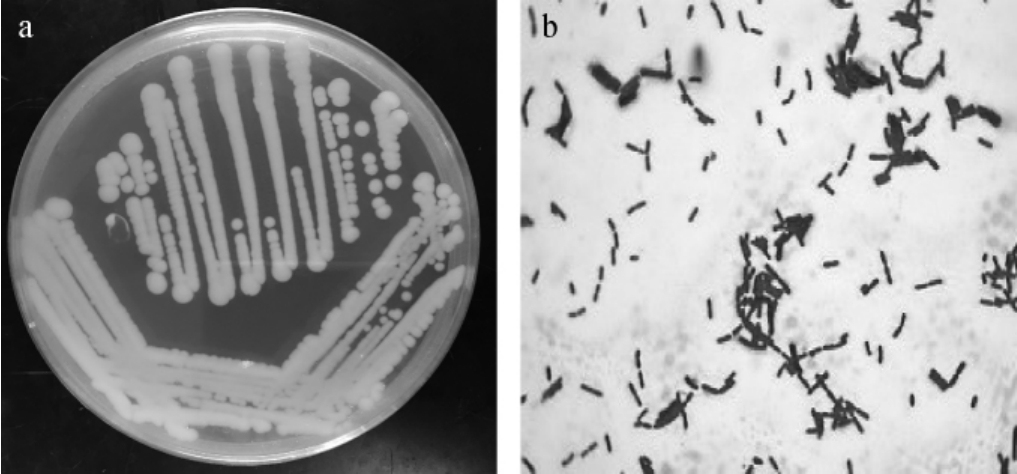
图2 菌株YC2的菌落(a)和细胞(b)形态
Fig.2 Colony(a)and cell(b)morphology of strain YC2
2.4.2 菌株的生理生化特征
由表2可知,菌株YC2能利用葡萄糖、木糖、阿拉伯糖、甘露醇等;水解淀粉、液化明胶、还原硝酸盐、柠檬酸盐、7%NaCl、甲基红试验、过氧化氢酶试验等均呈阳性反应;吲哚、硫化氢、苯丙氨酸酶试验等均呈阴性,且不耐受10%NaCl。参照《常见细菌系统鉴定手册》[15]和《伯杰氏系统细菌学手册》[16],并结合形态特征,初步鉴定菌株YC2隶属于芽胞杆菌属(Bacillus)。
表2 菌株YC2的生理生化试验结果
Table 2 Physiological and biochemical tests results of strain YC2

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
项目 检测结果 项目 检测结果葡萄糖甘露糖鼠李糖棉子糖麦芽糖蔗糖木糖果糖蕈糖脱氧核糖阿拉伯糖卫矛醇山梨醇甘露醇木醇肌醇侧金盏花醇水杨素七叶苷淀粉蜜二糖纤维二糖乳糖++----++-++--+---+++-++吲哚试验甲基红试验O/F试验ONPG试验硫化氢过氧化氢酶脲酶三糖铁柠檬酸盐硝酸盐还原石蕊牛乳精氨酸双水解酶精氨酸脱羧酶赖氨酸脱羧酶鸟氨酸脱羧酶苯丙氨酸酶明胶10%NaCl 7%NaCl 5%NaCl 2%NaCl pH 9.5 pH 5.5-++--++++++-++--+-+++--
2.4.3菌株的分子生物学鉴定结果
菌株16SrRNA的PCR扩增结果见图3。由图3可知,PCR扩增产物的碱基长度约1 500 bp,与预期结果相符。

图3 菌株YC2 16S rRNA PCR扩增产物电泳图
Fig.3 Electrophoregram of 16S rRNA PCR amplification products of strain YC2
PCR扩增产物经测序,将测序结果提交至NCBI的GenBank数据中进行Blast比对发现,该菌株与枯草芽孢杆菌(Bacillus subtilis)的同源性最高,达99%。选取同源性较高的模式菌株的16S rRNA序列,采用MEGA 7软件中的NJ法构建系统发育树,结果见图4。由图4可知,菌株YC2与枯草芽孢杆菌(Bacillus subtilis)KCTC 13241聚于一支,亲缘关系最近,因此,鉴定菌株YC2为枯草芽孢杆菌(Bacillus subtilis)。

图4 基于16S rRNA序列菌株YC2的系统发育树
Fig.4 Phylogenetic tree of strain YC2 based on 16S rRNA sequences
3 结论
以香豆素为唯一碳源,从豆类发酵食品、土壤、动物肠道及其内容物中筛选到9株具有AFB1降解能力的菌株,通过复筛,筛选到一株AFB1降解能力最高的菌株YC2,AFB1降解率为90.7%。通过降解作用与吸附作用的区分,确定该菌株去除AFB1主要为降解作用。通过形态观察、生理生化试验及分子生物学技术鉴定菌株YC2为枯草芽孢杆菌(Bacillussubtilis)。本研究为生物法降解AFB1的研究奠定基础,同时,为后期生物法降解AFB1的实际应用提供技术依据。
[1]RUSTOM I Y S.Aflatoxin in food and feed:occurrence,legislation and inactivation by physical methods[J].Food Chem,1997,59(1):57-67.
[2]计成,赵丽红.黄曲霉毒素生物降解的研究及前景展望[J].动物营养学报,2010(2):241-245.
[3]刘立芳.黄曲霉毒素的检测及其降解方法进展[J].中国酿造,2014,33(1):23-26.
[4]DAS C,MISHRA H N.In vitrodegradation of aflatoxin B1in groundnut(Arachis hypogea)meal by horse radish peroxidase[J].LWT-Food Sci Technol,2000,33(4):308-312.
[5]王海鸥,陈守江,胡志超,等.花生黄曲霉毒素污染与控制[J].江苏农业科学,2015,43(1):270-273.
[6]PETCHKONGKAEW A,TAILLANDIER P,GASALUCK P,et al.Isolation ofBacillusspp.from Thai fermented soybean(Thua-nao):screening for aflatoxin B1and ochratoxin A detoxification[J].J Appl Microbiol,2008,104(5):1495-1502.
[7]TENIOLA O,ADDO P,BROST I,et al.Degradation of aflatoxin B1by cell-free extracts ofRhodococcus erythropolisandMycobacterium fluoranthenivoranssp.nov.DSM44556T[J].Int J Food Microbiol,2005,105(2):111-117.
[8]张盼.生物法降解黄曲霉毒素B1的初步研究[D].北京:中国农业科学院,2015.
[9]关心,何剑斌,董双,等.黄曲霉毒素B1高效降解菌株的筛选鉴定及其降解[J].华中农业大学学报,2016,35(2):90-96.
[10]朱新贵,林捷.几种食品微生物降解黄曲霉毒素作用的研究[J].食品科学,2001,22(10):65-68.
[11]李超波,李文明,杨文华,等.降解黄曲霉毒素微生物筛选中降解与吸附结合作用的区分[J].食品与发酵工业,2012,38(5):17-21.
[12]戴军,邵帅,王常高,等.产黄曲霉毒素B1降解酶菌株的筛选鉴定及发酵条件优化[J].工业微生物,2014,44(6):54-59.
[13]张志敏,王燕,毛勇,等.一株瘤胃黄曲霉毒素B1降解菌的分离鉴定及特性研究[J].动物医学进展,2014,35(8):49-53.
[14]计成.霉菌毒素与饲料食品安全[M].北京:化学工业出版社,2007:36-37.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-398.
[16]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册(第八版)[M].北京:科学出版社,1984:729-830.
[17]LEE L S,DUNN J J,DELUCCA A J,et al.Role of lactone ring of aflatoxin B1in toxicity and mutagenicity[J].Experientia,1981,37(1):16-17.
[18]AZAB R M,TAWAKKOL W M,HAMAD A R M,et al.Detection and estimation of aflatoxin B1in feeds and its biodegradation by bacteria and fungi[J].Egypt J Nat Toxins,2005,2:39-56.
[19]BRADY D,STOLL A D,STARKE L,et al.Chemical and enzymatic extraction of heavy metal binding polymers from isolated cell walls of Saccharomyces cerevisiae[J].Biotechnol Bioeng,1994,44(3):297-302.
[20]HASKARD C A,EL-NEZAMI H S,KANKAANP P E,et al.Surface binding of aflatoxin B1by lactic acid bacteria[J].Appl Environ Microbiol,2001,67(7):3086-3091.
[21]PELTONEN K,EL-NEZAMI H,HASKARD C,et al.Aflatoxin B1 binding by dairy strains of lactic acid bacteria and bifidobacteria[J].J Dairy Sci,2001,84(10):2152-2156.
[22]TURBIC A,AHOKAS J T,HASKARD C A,et al.Selectivein vitro binding of dietary mutagens,individually or in combination,by lactic acid bacteria[J].Food Addit Contam,2002,19(2):144-152.