β-胡萝卜素是类胡萝卜素的典型代表,主要有全反式、9-顺式、13-顺式及15-顺式4种形式。大量研究表明,β-胡萝卜素能转化为维生素A,具有抗氧化、预防癌症、预防心血管疾病、提高免疫系统等功能[1-3]。β-胡萝卜素的主要来源有天然物提取法、化学合成法、微生物发酵法。天然物提取法受产品原料、气候、运输条件的制约,成本高,产量较低;化学合成法存在一定的危害。与其他方法相比,微生物发酵法易培养,产量高,产品具有顺式和反式混合体,更加安全,因此得到广泛的应用[4-6]。
产β-胡萝卜素的微生物主要有三孢布拉氏霉菌(Blakeslea trispora)[7]、粗壮脉纹孢菌(Neurospora crassa)[8]、红酵母(Rhodotorula)[9-10]、胶红酵母(Rhodotorula mucilagi nosa)[11]、盐藻类等[12-13]。HE Z J等[14]研究发现,乙烯能够导致三羧酸循环代谢流的下降和乙酰辅酶A的积累,以及甲羟戊酸途径关键基因的转录上调,进而促进三孢布拉氏霉菌合成β-胡萝卜素;向梦雄等[15]研究发现,一定浓度的Zn2+或Mn2+对Blakeslea trispora合成β-胡萝卜素有促进作用,而不同浓度的Fe3+、Cu2+和Ca2+对β-胡萝卜素合成存在抑制作用;樊竹青等[16]从云南抚仙湖湖水中分离出379株酵母菌,研究发现“红色酵母”具有较强的产类胡萝卜素的能力;孔维宝等[17]从土壤中筛选出一株产类胡萝卜素的胶红酵母(Rhodotorula mucilaginosa)K-1,并对其培养条件进行优化,在最优培养条件下,总类胡萝卜素含量达(180.14±2.45)μg/g干菌体,具有高产类胡萝卜素的潜能;BUZZINI P等[18]研究发现,Al3+和Zn2+对牧草红酵母(Rhodotorula graminis)合成β-胡萝卜素和γ-胡萝卜素有促进作用,而Zn2+和Mn2+对红酵母烯和红酵母红素产生了抑制作用。
目前,能产高纯度β-胡萝卜素的菌种还十分有限,合成高纯度β-胡萝卜素的菌株选育仍然是未来研究的重点方向之一。本研究以前期从土壤中分离得到的一株高产高纯度β-胡萝卜素的菌株S3-1为研究对象,采用分子生物学技术对其进行鉴定,并通过单因素试验及正交试验对其发酵工艺进行优化,以期为工业化发酵生产高纯度β-胡萝卜素提供工艺参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
菌株S3-1:本实验室前期从土壤中分离、纯化并保藏。
1.1.2试剂
酵母浸粉、蛋白胨、麦芽糖(均为生化试剂):北京奥博星生物技术有限责任公司;玉米浆:上海方畦仪器有限公司;β-胡萝卜素(纯度≥95%):德国Sigma公司;Ezup柱式真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:上海生工生物工程股份有限公司;其他化学试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基:青岛海博生物技术有限公司。
活化培养基:含0.1 g/L氯霉素的PDA培养基,pH自然,121℃灭菌20 min。
种子培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,pH自然,115℃灭菌30 min。
基础发酵培养基:葡萄糖20 g/L、酵母浸粉10 g/L、蛋白胨20 g/L、无水氯化钙0.5 g/L、磷酸二氢钾0.8 g/L,pH自然,115℃灭菌30 min。
1.2 仪器与设备
FA2004W电子分析天平:上海菁海仪器有限公司;EL20-K pH计:美国梅特勒托利多公司;LDZX-75KBS立式高压蒸汽灭菌锅:上海申安医疗器械厂;SHZ-2A数显气浴恒温振荡器:金坛华峰仪器有限公司;LRH-250生化培养箱:上海一恒科学仪器有限公司;TDZ7-WS离心机:湖南湘仪实验室仪器开发有限公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 菌株S3-1的鉴定
按照Ezup柱式真菌基因组DNA抽提试剂盒提取菌株S3-1的基因组,以其为模板,采用真菌核糖体ITS基因片段的通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行PCR扩增。PCR扩增体系:模板基因组0.5 μL,10×Buffer(含20 mmol/L Mg2+)0.5 μL,2.5mmol/L 脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)1 μL,rTaq酶(5 U/μL)0.2 μL,上下游引物(10 μmol/L)各取0.5 μL,双蒸水(ddH2O)补至25 μL。PCR扩增程序:94℃预变性4 min;94℃变性45 s,55℃退火45 s,72℃延伸1 min,共循环30次;72℃再延伸10 min,4℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测后,送生工生物工程(上海)有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnologyinformation,NCBI)的GenBank数据库中进行Blast比对,选取同源性较高的模式菌株的ITS基因序列,采用MEGA7.0软件中的邻接(neighbor joining,NJ)法构建系统发育树,自展值为1 000。
1.3.2 菌株S3-1产β-胡萝卜素发酵工艺优化
菌株活化:将菌株S3-1划线于活化培养基,28℃倒置培养3 d。种子培养:挑取活化培养基上的单菌落接种于装液量为50 mL/250 mL的种子培养基中,28℃、150 r/min条件下培养至对数期。发酵培养:按6%(V/V)的接种量将种子液接种于装液量为40 mL/250 mL的基础发酵培养基中,28℃、150 r/min条件下培养84 h。参考杨文等[19]的方法,采用酸热法进行破壁,丙酮进行提取,提取至菌体变白,合并提取液,提取过程尽量避光。
在基础发酵培养基的基础上,分别考察碳源种类(葡萄糖、果糖、蔗糖、木糖、乳糖、麦芽糖、可溶性淀粉、甘油)及添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L)、氮源种类(酵母浸粉、蛋白胨、玉米浆、酵母浸粉+蛋白胨)及添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L)、硫酸镁添加量(0、0.3 g/L、0.6 g/L、0.9 g/L、1.2 g/L、1.5 g/L)、初始pH值(5.0、5.5、6.0、6.5、7.0)对菌体生长和β-胡萝卜素产量的影响。根据β-胡萝卜素的产量和纯度筛选影响显著的因子和最佳水平,进行4因素3水平正交试验,正交试验因素与水平见表1。
表1 菌株S3-1产β-胡萝卜素发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for optimization of fermentation process of β-carotene production by strain S3-1

水平 A葡萄糖/(g·L-1)B酵母浸粉/(g·L-1)C初始pH值DMgSO4/(g·L-1)1 2 3 20 30 40 10 20 30 4.5 5.0 5.5 0.2 0.3 0.4
1.3.3 测定方法
生物量的测定:发酵液经离心、水洗后,105℃烘干至恒质量,称菌体质量,以g/L表示。
β-胡萝卜素含量的测定:参考魏娜等[20]的方法,采用高效液相色谱法对β-胡萝卜素进行定性定量分析。HPLC条件:检测波长454nm,柱温28℃,流动相A是体积分数90%乙腈,B是体积分数100%乙酸乙酯。梯度洗脱:0~5 min,B从0升至50%;5.01min,B升至53%;5.01~10 min,B保持53%;10~15.01 min,B升至54%;15.01~20 min,B降至0。
β-胡萝卜素纯度的测定[20]:通过峰面积对其他色素定量,并计算β-胡萝卜素所占比例。
1.3.4 数据统计与分析
采用MSExcel2016进行基础数据统计;采用SPSS24.0软件进行单因素方差分析;采用Duncan法进行组间多重比较。
2 结果与分析
2.1 菌株S3-1的鉴定
菌株S3-1的PCR扩增产物的电泳图谱见图1。由图1可知,PCR扩增产物碱基长度约为574 bp,与目的基因碱基长度相符,进行测序。
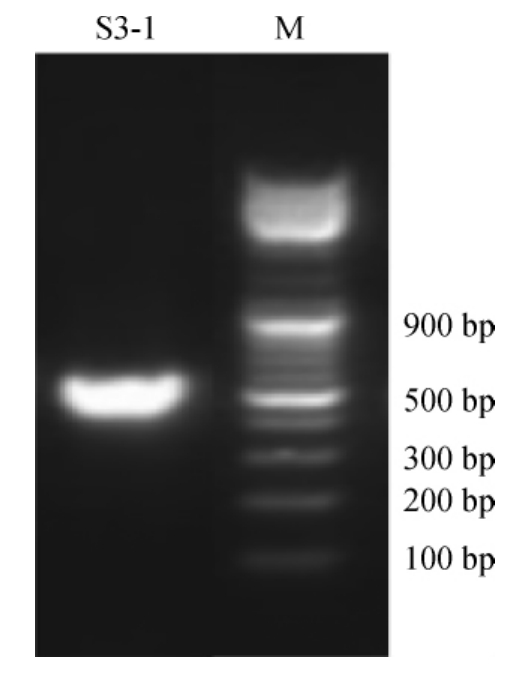
图1 菌株S3-1 PCR扩增产物琼脂糖凝胶电泳图谱
Fig.1 Agarose gel electrophoresis of PCR amplification products of strain S3-1
M为DNA Marker。
将菌株S3-1的ITS测序结果提交至NCBI的GenBank数据库中进行Blast比对,选取同源性较高的模式菌株的ITS基因序列,构建系统发育树,结果见图2。由图2可知,菌株S3-1与近玫色锁掷孢酵母(Sporidiobolus pararoseus)JQ2-1聚于一支,亲缘关系最近,因此,鉴定菌株S3-1为近玫色锁掷孢酵母(Sporidiobolus pararoseus)。韩梅等[21]研究发现,S.pararoseus所产的β-胡萝卜素以全反式结构为主,全反式结构约占总β-胡萝卜素的60%,顺式结构主要有13-顺和9-顺β-胡萝卜素。

图2 基于ITS基因序列菌株S3-1的系统发育树
Fig.2 Phylogenetic tree of strain S3-1 based on ITS gene sequences
2.3 菌株S3-1产β-胡萝卜素发酵工艺优化单因素试验
2.3.1 碳源种类对菌株S3-1产β-胡萝卜素的影响
不同微生物对碳源的需求不同,不同碳源对发酵产物的合成可能产生不同的作用。因此,比较8种不同碳源对菌株S3-1产β-胡萝卜素的影响,结果见表2。由表2可知,当以蔗糖为碳源时,生物量最高,为(13.21±0.08)g/L,与葡萄糖、果糖、可溶性淀粉无显著差异(P>0.05),但显著高于乳糖、麦芽糖、甘油(P<0.05);当以葡萄糖为碳源时,β-胡萝卜素产量及纯度最大(P<0.05),分别为(1.95±0.26)mg/L、(53.91±1.47)%。因此,选择葡萄糖作为最优碳源。
表2 碳源种类对菌株S3-1产β-胡萝卜素的影响
Table 2 Effect of carbon sources types on β-carotene production by strain S3-1
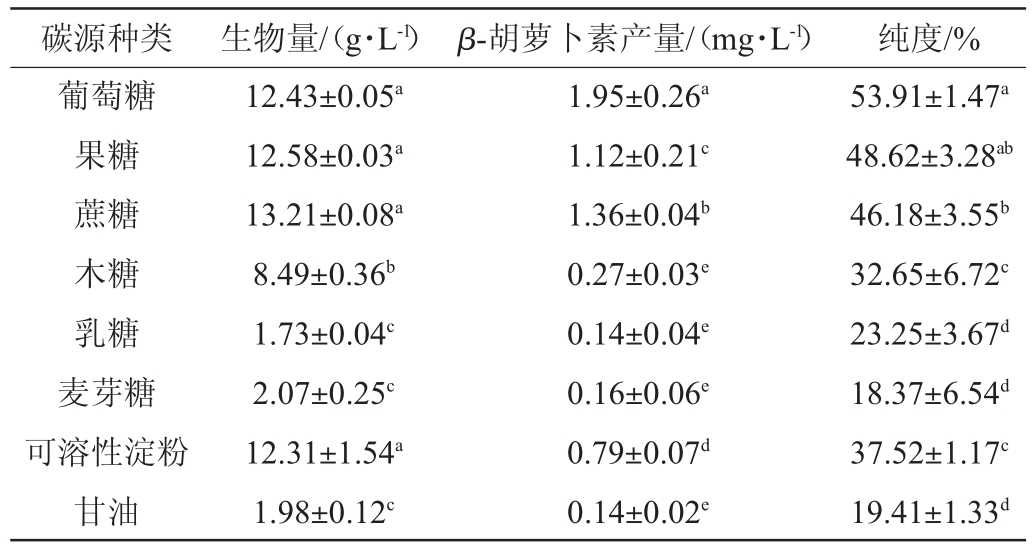
注:相同字母表示组间差异不显著(P>0.05);不同字母表示组间差异显著(P<0.05)。下同。
碳源种类生物量/(g·L-1)β-胡萝卜素产量/(mg·L-1)纯度/%葡萄糖果糖蔗糖木糖乳糖麦芽糖可溶性淀粉甘油12.43±0.05a 12.58±0.03a 13.21±0.08a 8.49±0.36b 1.73±0.04c 2.07±0.25c 12.31±1.54a 1.98±0.12c 1.95±0.26a 1.12±0.21c 1.36±0.04b 0.27±0.03e 0.14±0.04e 0.16±0.06e 0.79±0.07d 0.14±0.02e 53.91±1.47a 48.62±3.28ab 46.18±3.55b 32.65±6.72c 23.25±3.67d 18.37±6.54d 37.52±1.17c 19.41±1.33d
2.3.2 葡萄糖添加量对菌株S3-1产β-胡萝卜素的影响
研究葡萄糖添加量对菌株S3-1产β-胡萝卜素的影响,结果见表3。由表3可知,当葡萄糖添加量为40 g/L时,生物量最高,为(15.10±1.19)g/L;当葡萄糖添加量为30 g/L时,β-胡萝卜素产量及纯度达到最高,分别为(2.17±0.35)mg/L、(54.80±1.45)%。因此,确定葡萄糖的最佳添加量为30 g/L。
表3 葡萄糖添加量对菌株S3-1产β-胡萝卜素的影响
Table 3 Effect of glucose addition on β-carotene production by strain S3-1
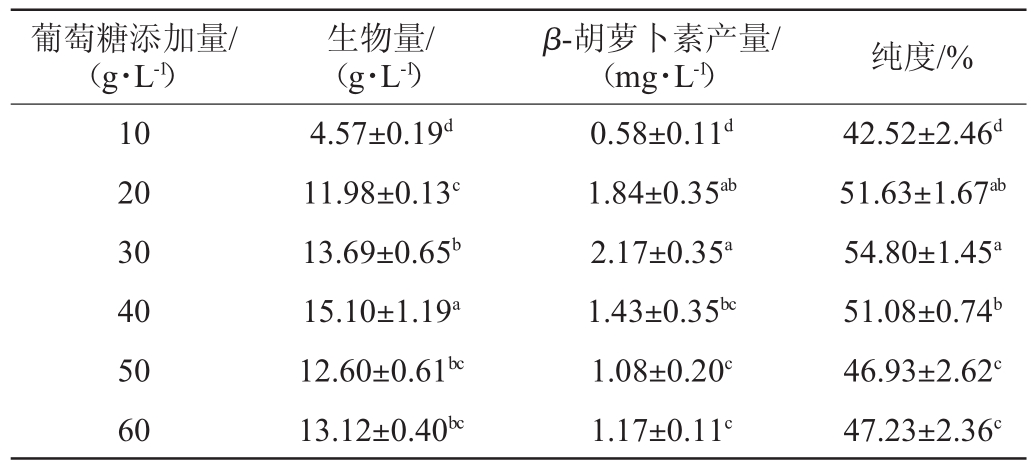
葡萄糖添加量/(g·L-1)生物量/(g·L-1)β-胡萝卜素产量/(mg·L-1) 纯度/%10 20 30 40 50 60 4.57±0.19d 11.98±0.13c 13.69±0.65b 15.10±1.19a 12.60±0.61bc 13.12±0.40bc 0.58±0.11d 1.84±0.35ab 2.17±0.35a 1.43±0.35bc 1.08±0.20c 1.17±0.11c 42.52±2.46d 51.63±1.67ab 54.80±1.45a 51.08±0.74b 46.93±2.62c 47.23±2.36c
2.3.3 氮源种类对菌株S3-1产β-胡萝卜素的影响
微生物利用氮元素在细胞内合成氨基酸和碱基,进而合成蛋白质、核酸等细胞成分,以及含氮的代谢产物,对微生物的生长发育有重要的意义[22]。有机氮源中营养比较丰富,除了含有一定比例的蛋白质、多肽及游离氨基酸外,还含有少量的糖类、脂类、维生素及微量元素等营养成分[22]。由于微生物可以直接从培养基中获得这些营养成分,所以有机氮源更有利于微生物的生长。研究不同有机氮源对菌株S3-1产β-胡萝卜素的影响,结果见表4。由表4可知,当10g/L酵母浸粉和20 g/L蛋白胨作为氮源时,生物量最高,达到(14.49±0.32)g/L;当30 g/L酵母浸粉作为氮源时,β-胡萝卜素产量和纯度最高,分别为(2.62±0.06)mg/L、(60.41±2.62)%。因此,选择酵母浸粉作为最优氮源。
表4 有机氮源种类对菌株S3-1产β-胡萝卜素的影响
Table 4 Effect of organic nitrogen source types on the β-carotene production by strain S3-1
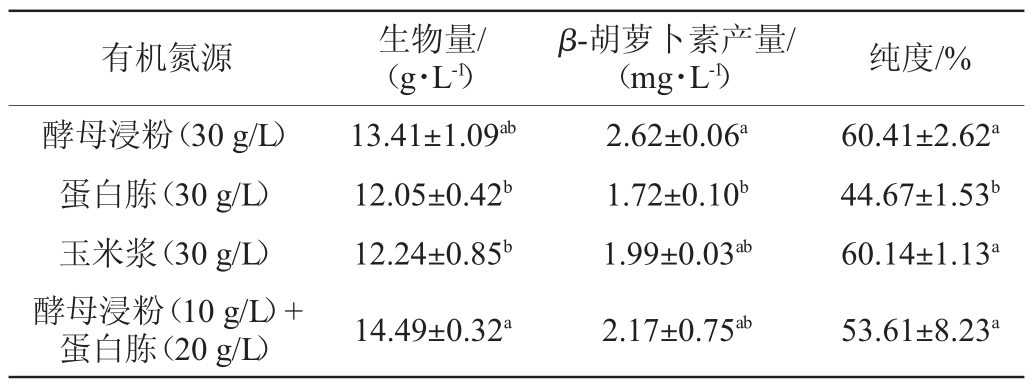
有机氮源 生物量/(g·L-1)β-胡萝卜素产量/(mg·L-1) 纯度/%酵母浸粉(30 g/L)蛋白胨(30 g/L)玉米浆(30 g/L)酵母浸粉(10 g/L)+蛋白胨(20 g/L)13.41±1.09ab 12.05±0.42b 12.24±0.85b 14.49±0.32a 2.62±0.06a 1.72±0.10b 1.99±0.03ab 2.17±0.75ab 60.41±2.62a 44.67±1.53b 60.14±1.13a 53.61±8.23a
2.3.4 酵母浸粉添加量对菌株S3-1产β-胡萝卜素的影响
研究酵母浸粉添加量对菌株S3-1产β-胡萝卜素的影响,结果见表5。由表5可知,当酵母浸粉添加量在10~60g/L范围内,β-胡萝卜素产量随着酵母浸粉添加量的增加呈现先升高后降低的趋势。当酵母浸粉添加量为20 g/L时,菌株S3-1的生物量、β-胡萝卜素产量最高,分别为(14.32±0.25)g/L、(2.01±0.21)mg/L,且显著高于其他添加量(P<0.05)。因此,确定酵母浸粉最佳添加量为20 g/L。
表5 酵母浸粉添加量对菌株S3-1产β-胡萝卜素的影响
Table 5 Effect of yeast extract addition on β-carotene production by strain S3-1
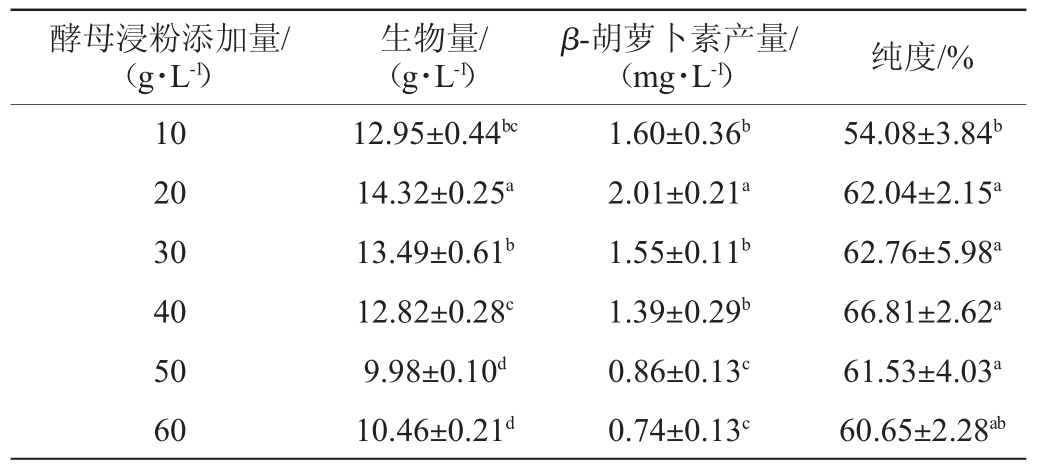
酵母浸粉添加量/(g·L-1)生物量/(g·L-1)β-胡萝卜素产量/(mg·L-1) 纯度/%10 20 30 40 50 60 12.95±0.44bc 14.32±0.25a 13.49±0.61b 12.82±0.28c 9.98±0.10d 10.46±0.21d 1.60±0.36b 2.01±0.21a 1.55±0.11b 1.39±0.29b 0.86±0.13c 0.74±0.13c 54.08±3.84b 62.04±2.15a 62.76±5.98a 66.81±2.62a 61.53±4.03a 60.65±2.28ab
2.3.5 硫酸镁添加量对菌株S3-1产β-胡萝卜素的影响
表6 硫酸镁添加量对菌株S3-1产β-胡萝卜素的影响
Table 6 Effect of MgSO4addition on the β-carotene production by strain S3-1
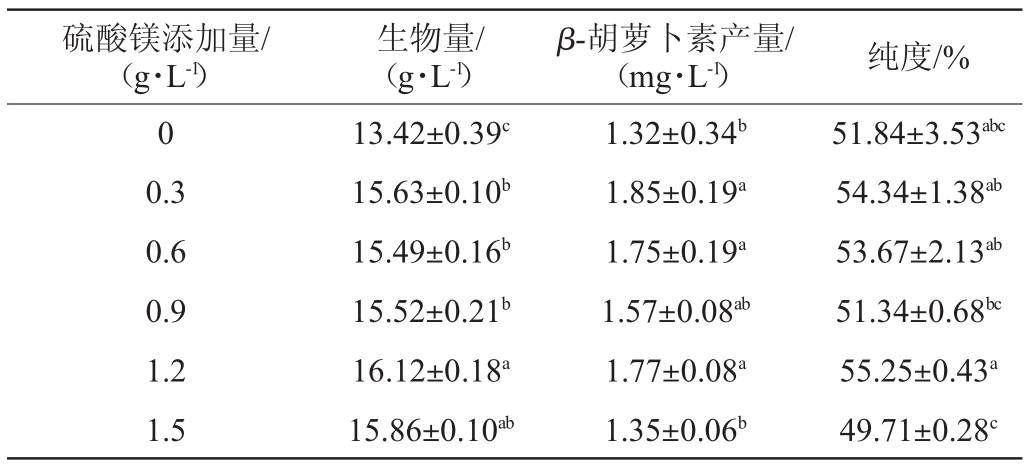
硫酸镁添加量/(g·L-1)生物量/(g·L-1)β-胡萝卜素产量/(mg·L-1) 纯度/%0 0.3 0.6 0.9 1.2 1.5 13.42±0.39c 15.63±0.10b 15.49±0.16b 15.52±0.21b 16.12±0.18a 15.86±0.10ab 1.32±0.34b 1.85±0.19a 1.75±0.19a 1.57±0.08ab 1.77±0.08a 1.35±0.06b 51.84±3.53abc 54.34±1.38ab 53.67±2.13ab 51.34±0.68bc 55.25±0.43a 49.71±0.28c
MgSO4提供Mg2+,Mg2+是重要的辅酶和很多酶的激活剂,也是细胞色素的成分[22]。研究MgSO4添加量对菌株S3-1产β-胡萝卜素的影响,结果见表6。由表6可知,当MgSO4添加量为1.2 g/L时,菌体生物量最大,为(16.12±0.18)g/L;当MgSO4添加量为0.3 g/L时,β-胡萝卜素产量最高,为(1.85±0.19)mg/L。因此,确定MgSO4最佳添加量为0.3 g/L。
2.3.6 初始pH值对菌株S3-1产β-胡萝卜素的影响
初始pH值对菌株S3-1产β-胡萝卜素的影响结果见表7。由表7可知,当初始pH值为5.0时,β-胡萝卜素产量最高,为(2.36±0.24)mg/L。当初始pH值为5.5时,生物量最高,但与初始pH 5.0无明显差异(P>0.05)。LUO H等[23]研究发现,当初始pH值在4.0~7.0范围内,初始pH值较高的培养基有利于酿酒酵母(Saccharomyces cerevisiae)细胞生长,而相对较低的初始pH值有利于β-胡萝卜素的形成。
表7 初始pH值对菌株S3-1产β-胡萝卜素的影响
Table 7 Effect of initial pH on β-carotene production by strain S3-1
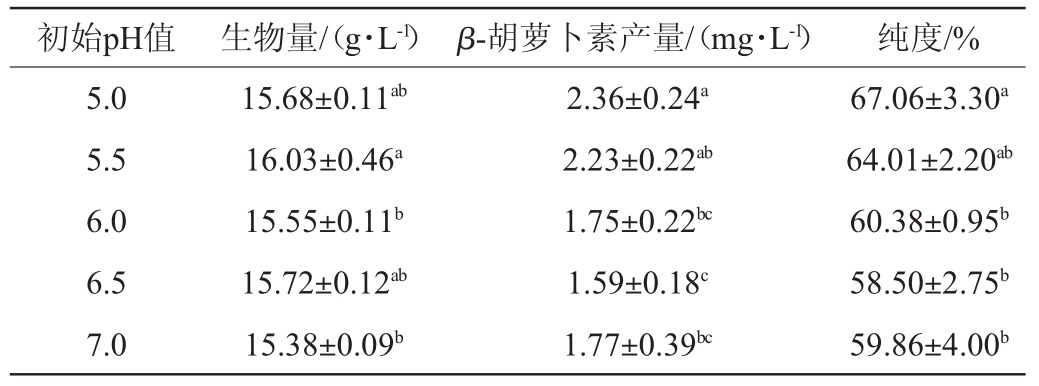
初始pH值生物量/(g·L-1)β-胡萝卜素产量/(mg·L-1)纯度/%5.0 5.5 6.0 6.5 7.0 15.68±0.11ab 16.03±0.46a 15.55±0.11b 15.72±0.12ab 15.38±0.09b 2.36±0.24a 2.23±0.22ab 1.75±0.22bc 1.59±0.18c 1.77±0.39bc 67.06±3.30a 64.01±2.20ab 60.38±0.95b 58.50±2.75b 59.86±4.00b
2.4 菌株S3-1产β-胡萝卜素发酵工艺优化正交试验
在单因素试验的基础上,选择葡萄糖添加量(A)、酵母浸粉添加量(B)、初始pH值(C)及MgSO4添加量(D)为考察因素,β-胡萝卜素产量、纯度为考察指标,进行4因素3水平的正交试验,结果与分析见表8,方差分析见表9和表10。
表8 菌株S3-1产β-胡萝卜素发酵工艺优化正交试验结果与分析
Table 8 Results and analysis orthogonal experiments of optimization of fermentation process of β-carotene production by strain S3-1
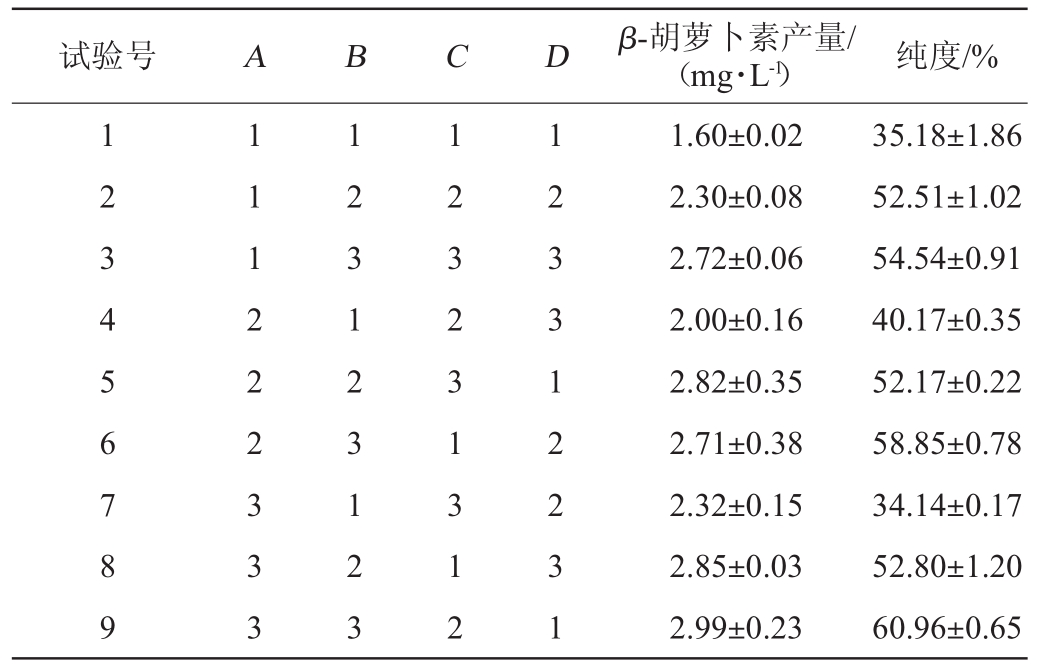
试验号 A B C D β-胡萝卜素产量/(mg·L-1) 纯度/%1 2 3 4 5 6 7 8 9 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 1.60±0.02 2.30±0.08 2.72±0.06 2.00±0.16 2.82±0.35 2.71±0.38 2.32±0.15 2.85±0.03 2.99±0.23 35.18±1.86 52.51±1.02 54.54±0.91 40.17±0.35 52.17±0.22 58.85±0.78 34.14±0.17 52.80±1.20 60.96±0.65
续表
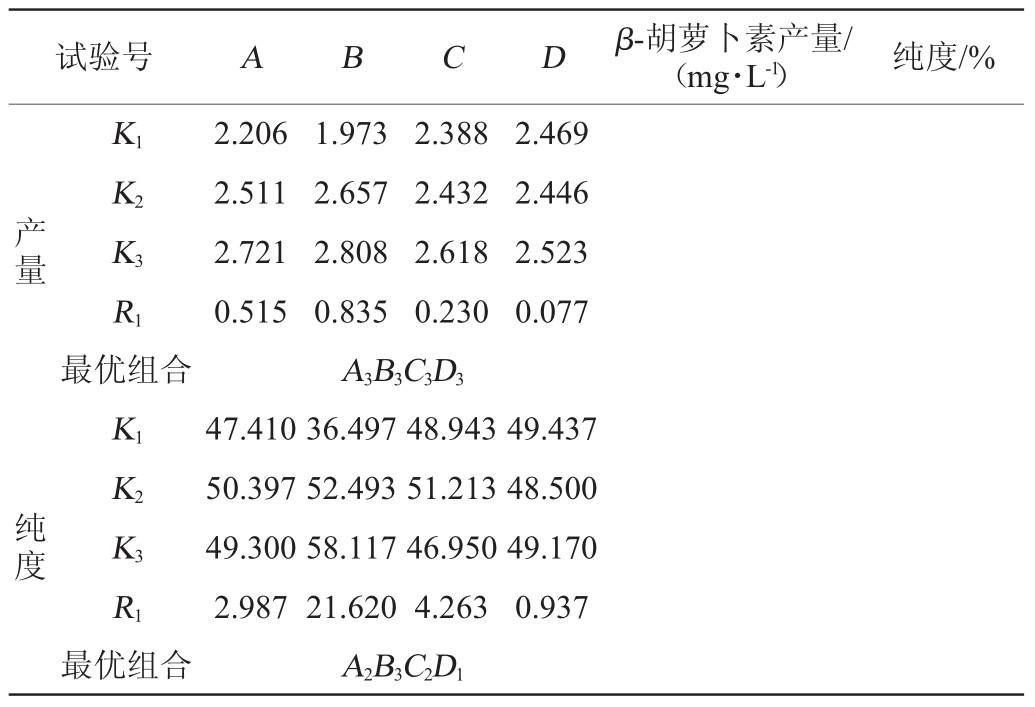
试验号 A B C D β-胡萝卜素产量/(mg·L-1) 纯度/%产量K1 K2 K3 R1 1.973 2.657 2.808 0.835 2.388 2.432 2.618 0.230 2.469 2.446 2.523 0.077最优组合纯度K1 K2 K3 R1 36.497 52.493 58.117 21.620 48.943 51.213 46.950 4.263 49.437 48.500 49.170 0.937最优组合2.206 2.511 2.721 0.515 A3B3C3D3 47.410 50.397 49.300 2.987 A2B3C2D1
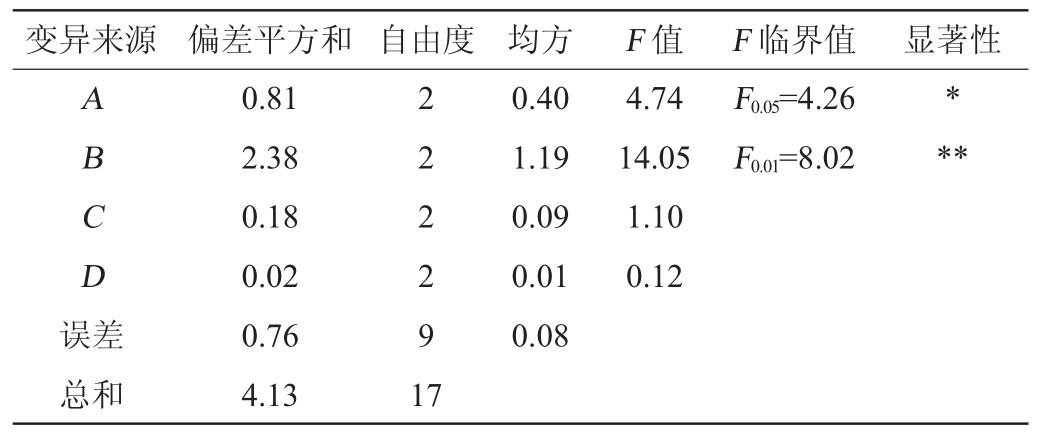
表9 以β-胡萝卜素产量为考察指标的正交试验结果方差分析
Table 9 Variance analysis of orthogonal experiments results using β-carotene production as evaluation index
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
变异来源 偏差平方和 自由度 均方 F值 F临界值 显著性A B C D误差0.40 1.19 0.09 0.01 0.08 4.74 14.05 1.10 0.12 F0.05=4.26 F0.01=8.02***总和0.81 2.38 0.18 0.02 0.76 4.13 2 2 2 2 9 1 7
表10 以β-胡萝卜素纯度为考察指标的正交试验结果方差分析
Table 10 Variance analysis of orthogonal experiments results using β-carotene purity as evaluation index
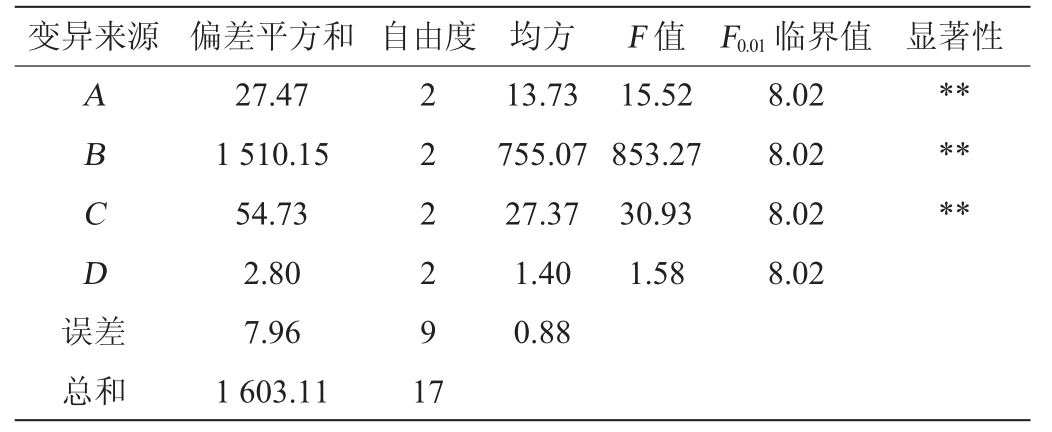
变异来源 偏差平方和 自由度 均方 F值 F0.01临界值 显著性A B C D误差13.73 755.07 27.37 1.40 0.88 15.52 853.27 30.93 1.58 8.02 8.02 8.02 8.02******总和27.47 1 510.15 54.73 2.80 7.96 1 603.11 2 2 2 2 9 1 7
由表8可知,影响β-胡萝卜素产量的因素主次顺序为酵母浸粉>葡萄糖>初始pH值>MgSO4,最佳组合为A3B3C3D3,即葡萄糖40 g/L、酵母浸粉添加量30 g/L、初始pH值5.5、MgSO4添加量0.4 g/L;而影响纯度的因素主次顺序为酵母浸粉>初始pH值>葡萄糖>MgSO4,最佳组合为A2B3C2D1,即葡萄糖添加量30 g/L、酵母浸粉添加量30 g/L、初始pH值5.0、MgSO4添加量0.2 g/L。
由表9可知,酵母浸粉对β-胡萝卜素产量的影响极显著(P<0.01),葡萄糖对结果影响显著(P<0.05)。由表10可知,酵母浸粉、葡萄糖和初始pH值对β-胡萝卜素纯度的影响均为极显著(P<0.01),其中酵母浸粉影响最大,其次为初始pH值,最后是葡萄糖。
采用综合平衡法[24]进行多指标影响分析,获得能兼顾β-胡萝卜素产量和纯度两个指标均衡的优化方案。由此分析:首先酵母浸粉(B)对β-胡萝卜素纯度和产量的影响最大,且均以B3水平最好,因此确定B3为最优水平。葡萄糖(A)对β-胡萝卜素产量的影响大小排第二位,且以A3水平最好,对β-胡萝卜素纯度的影响排第三位,且以A2水平最好,但取A2时,产量比A3减小了7.7%,因此确定A3为最优水平。初始pH值(C)对β-胡萝卜素产量的影响大小排第三位,且以C3水平最好,但对β-胡萝卜素纯度的影响排第二位,且以C2水平最好,因此,确定C2为最优水平。硫酸镁(D)对β-胡萝卜素产量和纯度的影响均最小,分别以D3和D1水平最好。因此,对A3B3C2D1和A3B3C2D3组合进行重复试验,结果表明,组合A3B3C2D1的生物量、β-胡萝卜素产量和纯度均较高,分别为21.03 g/L、3.08 mg/L、60.01%,生物量、β-胡萝卜素产量较未优化前分别提高了75.94%、43.44%。因此,确定菌株S3-1产β-胡萝卜素的最优发酵工艺为A3B3C2D1。
3 结论
本研究以土壤中筛选出的一株高产高纯度β-胡萝卜素的菌株S3-1为研究对象,采用分子生物学技术鉴定其为近玫色锁掷孢酵母(Sporidiobolus pararoseus)。通过正交试验优化确定菌株S3-1产β-胡萝卜素的最优发酵工艺:葡萄糖40 g/L、酵母浸粉30 g/L、硫酸镁0.2 g/L、无水氯化钙0.5 g/L、磷酸二氢钾0.8 g/L、初始pH值5.0。在最优发酵工艺条件下,β-胡萝卜素产量为(3.08±0.46)mg/L,纯度为(60.01±2.66)%。
[1]SHIH C K,CHANG J H,ANG S H,et al.beta-Carotene and canthaxanthin alter the pro-oxidation and antioxidation balance in rats fed a highcholesterol and high-fat diet[J].Brit J Nutr,2008,99(1):59-66.
[2]王莹,曲蕙名,赵博,等.三孢布拉霉产β-胡萝卜素的抗氧化活性动力学研究[J].食品研究与开发,2018,39(10):15-19.
[3]ZWIERZCHOWSKI G,MICIN'SKI J,POGORZELSKA J,et al.Influence of a diet containing β-carotene and omega-3 fatty acids on the biochemical and nonspecific humoral immunity indicators and on the results of experimental calf rearing[J].J Elem,2016,21(1):283-302.
[4]向梦雄.以玉米浆为氮源生产β-胡萝卜素的工艺优化及代谢调控研究[D].武汉:湖北工业大学,2015.
[5]SAINI R K,KEUM Y S.Carotenoid extraction methods:a review of recent developments[J].Food Chem,2017,240:90-103.
[6]MONEGO D L,ROSA M B D,NASCIMENTO P C D.Applications of computational chemistryto the studyof the antiradical activityof carotenoids:A review[J].Food Chem,2017,217:37-44.
[7]KAUR P,GHOSHAL G,JAIN A.Bio-utilization of fruits and vegetables waste to produce β-carotene in solid-state fermentation:Characterization and antioxidant activity[J].Process Biochem,2019,76:155-164.
[8]杨风玲,邓泽元,叶俊,等.粗壮脉纹胞菌发酵产类胡萝卜素的研究进展[J].食品与发酵工业,2012,38(11):115-119.
[9]王岁楼,沙孝,王海翔.利用发酵促进剂提高红酵母β-胡萝卜素产率[J].中国食物与营养,2016,22(5):58-60.
[10]赵紫华,韩雪,王玉营,等.一株高产β-胡萝卜素红酵母菌株的筛选及发酵工艺研究[J].饲料研究,2015(5):10-14.
[11]KOT A M,BŁAZ˙EJAK S,KURCZ A,et al.Effect of initial pH of medium with potato wastewater and glycerol on protein,lipid and carotenoid biosynthesis byRhodotorula glutinis[J].Electron J Biotechnol,2017,27:25-31.
[12]王梓,惠伯棣,宫平.培养基初始pH值和照射光波长对杜氏藻中类胡萝卜素含量的影响[J].食品科学,2015,36(23):183-188.
[13]孙协军,李佳伟,李秀霞,等.响应面法优化盐藻β-胡萝卜素超声波提取工艺[J].食品工业科技,2015,36(12):278-281.
[14]HE ZJ,WANG S Z,YANG Y M,et al.β-Carotene production promoted by ethylene inBlakeslea trisporaand the mechanism involved in metabolic responses[J].Process Biochem,2017,57:57-63.
[15]向梦雄,闫兴,王常高,等.玉米浆中金属离子对三孢布拉霉发酵生产 β-胡萝卜素的影响[J].中国酿造,2014,33(11):70-74.
[16]樊竹青,李治滢,董明华,等.云南抚仙湖产类胡萝卜素酵母菌的资源调查[J].微生物学通报,2017,44(2):296-304.
[17]孔维宝,洋杨,冬陈,等.一株类胡萝卜素产生菌的鉴定及其发酵培养基优化[J].食品科学,2018,39(24):115-122.
[18]BUZZINI P,MARTINI A,GAETANI M,et al.Optimization of carotenoid production byRhodotorula graminisDBVPG 7021 as a function of trace element concentration by means of response surface analysis[J].Enzyme Microb Tech,2005,36(5):687-692.
[19]杨文,吉春明.一种简单的胞壁破碎方法[J].微生物学通报,1995,22(1):58-59.
[20]魏娜,徐琼,张宁,等.掷孢酵母类胡萝卜素的提取与鉴定[J].食品科学,2014,35(19):133-137.
[21]韩梅,翟玉贵,王小波,等.锁掷酵母与海洋红酵母的营养成分分析[J].食品与发酵工业,2013,39(1):11-15.
[22]陶永清,王素英.发酵工程原理与技术[M].北京:中国水利水电出版社,2014:39-46.
[23]LUO H,NIU Y,DUAN C,et al.A pH control strategy for increased β-carotene production during batch fermentation by recombinant industrial wine yeast[J].Process Biochem,2013,48(2):195-200.
[24]王英超,金红,陈丹丹,等.桑黄菌发酵生产特色饲料的多指标正交试验设计[J].饲料工业,2017,38(5):33-37.