酵母菌是白酒生产过程中的主要功能微生物,其在淀粉的糖化、酒精的生成、香气物质的形成、酒醅的发酵及终产品品质等方面都起着重要的作用[1]。因地域、环境、气候、工艺等不同,不同香型白酒酿造过程中,酵母菌群种类分布有一定差异。如浓香型白酒酵母菌种类主要有产酯酵母、假丝酵母、酿酒酵母、接合酵母及伊萨酵母等[2-5];酱香型白酒酵母菌主要有扣囊复膜酵母、异常毕赤酵母、柠檬形接合酵母、东方伊萨酵母及毕赤酵母等[6-8];清香型白酒酵母菌种类主要有酿酒酵母、汉逊酵母及少量的假丝酵母[9]。
目前,酿酒行业研究的酵母菌主要是从大曲、窖泥、糟醅及环境中分离筛选,根据其特性及主要代谢产物种类将其分为酿酒酵母及产香酵母两大功能类别[10-11]。其中酿酒酵母糟醅中主要的乙醇产生菌,产酯酵母菌对基酒中主要酯类比例起着主要作用。只有两类酵母菌具有适当的比例和较高的活性,才能保证糟醅中产乙醇和产酯反应顺利进行,同时糟醅中较高的乙醇含量能够抑制杂菌的过度生长,从而使糟醅酸度控制在适当范围。但是由于生产管理不当、菌群比例不断变化等问题导致白酒生产行业长期普遍存在出酒率低、糟醅酸高、基酒主要酯类比例失调等问题,严重阻碍了产品质量的进一步提升[12]。
近年来酵母菌在酿酒中的研究主要集中在酵母菌的产酒功能、产酯功能等,同时伴随着耐酸、耐热等能力研究[13-14]。本研究从曲药、糟醅、窖泥、辅料抽取多个样品,全面分析多粮浓香型白酒生产过程中可培养酵母菌多样性,基于ITS rDNA序列构建其系统发育树对其进行鉴定;采用酒精度快速测定仪及气相色谱-质谱(gas chromatographymassspectrometry,GC-MS)法分别检测菌株发酵液乙醇含量及酯含量,借此筛选优质酿酒功能酵母菌,并考察其发酵特性。期望通过对白酒生产过程中酵母菌的研究,为多粮浓香型白酒产质量提高提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
从五粮液制曲车间、酿酒车间取样11个,其中大曲3个、糟醅3个、窖泥3个、辅料2个。
1.1.2 试剂
酵母菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、聚合酶链反应(polymerase chain reaction,PCR)扩增试剂盒(B639285):生工生物工程(上海)股份有限公司;无水葡萄糖(分析纯)、琼脂粉(生化试剂):天津大茂化学试剂有限公司。
1.1.3 培养基
麦芽汁液体培养基:麦芽汁130.1g,加水定容至1000mL,121℃灭菌20 min,备用。
麦芽汁固体培养基:琼脂粉20 g,麦芽汁130.1g,加水定容至1 000 mL,121℃灭菌20 min,倒平板,备用。
麸皮培养基:5%麸皮煮沸1 h,用纱布过滤掉麸皮后加入葡萄糖20 g,加水定容至1 000 mL,121℃灭菌20 min,备用。
1.2 仪器与设备
HZQ-F100摇床、LRH-250恒温培养箱、HW326恒温水浴锅:上海一恒科学仪器有限公司;DM-500显微镜:日本尼康公司;4920 000.016移液枪:德国Eppendorf公司;M367983 PCR扩增仪:美国伯乐公司;Dyy-12电泳仪:北京市六一仪器厂;MOD.Super Alcomat酒精度快速测定仪:意大利GIBERTINI公司;ZF-670凝胶成像系统:上海嘉鹏科技有限公司;6890N-5973气相色谱-质谱仪:美国安捷伦公司;LD5-2A离心机:北京京立离心机有限公司;SJIA-10N-50A冷冻干燥机:上海秋佐科学仪器有限公司。
1.3 方法
1.3.1 酵母菌分离纯化与保藏
称取5.00 g样品,倒入装有50 mL已灭菌麦芽汁液体培养基的锥形瓶中,160~180 r/min、28℃富集培养24 h。按10倍稀释法对富集液进行梯度稀释,移取稀释液0.5 mL均匀涂布于麦芽汁固体培养基上,28℃恒温倒置培养48~72 h。挑取单菌落在麦芽汁固体培养基上纯化1~2次,获得纯化菌株[15]。
纯化菌株采用麦芽汁固态培养基斜面培养短时间保存[16],用冷冻干燥机将菌株冷冻干燥,保护剂为20%甘油,预冻温度为-80℃,预冻时间为3 h,冻干时间为8 h,菌株干粉在-80℃条件下长期保存。
1.3.2 菌株鉴定
(1)菌株形态观察
将筛选到的酵母菌接种在麦芽汁固体平板培养基上,28℃恒温培养2d,观察并记录酵母菌株在麦芽汁固体培养基上的菌落及细胞形态。
(2)菌株的分子生物学鉴定
DNA提取:按照上海生工酵母菌基因组DNA抽提试剂盒说明书的实验步骤提取目的菌株的总DNA。
ITS rDNA序列扩增与序列分析:上游引物ITS1:5′CTTggTCATTTAgAggAAgTAA3′;下游引物 ITS4:5′TCCTCCgCTTATTgATATgC3′。PCR扩增体系(50μL):ddH2O 22 μL,2×PCR master 25 μL,Primer 1 2 μL,Primer 2 2 μL,模板1μL。PCR扩增程序:94℃、5min;94℃、30s,55℃、30s,72 ℃、1 min,共35个循环,72 ℃、10 min。
扩增的ITS rDNA序列产物送至生工生物工程(上海)股份有限公司测序,测序结果登录美国国立生物技术信息中心(national center for biotechonology information,NCBI)网站用基本局部比对搜素工具(basic local alignment search tool,BLAST)进行序列比对,通过MEGA5软件中的邻接(neighbor-joining,NJ)法构建系统进化树。
1.3.3 优质功能酵母菌筛选
将分离到的酵母菌分别接种于麸皮培养基,接种量5%,装液量250 mL/500 mL,28℃、160~180 r/min条件下摇床培养72 h后,分别用酒精度快速测定仪测定发酵液中乙醇含量[17-18],用气相色谱-质谱(GC-MS)法测定发酵液中己酸乙酯、乙酸乙酯含量[19-20]。
气相色谱条件:DB-WAX毛细管色谱柱(60m×250μm,0.25 μm);手动无分流进样,进样口温度230℃;程序升温:初始温度40℃,保留1 min,以3℃/min的速率升至180℃,再以2.5℃/min的速率升至230℃,保留10 min;汽化室温度230℃;载气为氦气(He),流速1 mL/min。
质谱条件:电子电离(electronic ionization,EI)源,电子能量70 eV,扫描范围20~500 u,离子源温度250℃;接口温度230℃。
1.3.4 功能酵母菌的发酵特性
将初筛到的4株酵母菌分别接种于麸皮培养基,接种量5%,装液量250mL/500mL,于温度分别为20℃、25℃、30℃、35℃、40℃,pH值分别为2、3、4、5、6条件下160~180r/min振荡培养72 h后分别用酒精度快速测定仪测定发酵液中乙醇含量,用气相色谱-质谱(GC-MS)法测定发酵液中己酸乙酯、乙酸乙酯含量,考察功能菌株在不同发酵温度及pH值条件下的发酵特性。
2 结果与分析
2.1 酵母菌分离纯化及形态特征
从多粮浓香型白酒生产过程中多次取样,经过反复分离纯化,共分离出43株酵母菌,曲药中得到15株酵母菌,糟醅中得到17株酵母菌,窖泥中得到7株酵母菌,辅料中得到4株酵母菌。通过麦芽汁培养基上菌落形态特征和菌落散发出的气味特性,将筛选到的酵母菌分为12种类型,分别编号为WY1(6株,编号为WY1-1~6)、WY2(6株,编号为WY2-1~6)、WY3(2株,编号为WY3-1~2)、WY4(6株,编号为WY4-1~6)、WY5(3株,编号为WY5-1~3)、WY6(5株,编号为WY6-1~5)、WY7(1株,编号为WY7-1)、WY8(2株,编号为WY8-1~2)、WY9(7株,编号为WY9-1~7)、WY10(3株,编号为WY10-1~3)、WY11(1株,编号为WY11-1)、WY12(1株,编号为WY12-1)。12种类型酵母菌的菌落及细胞形态见图1和表1。

图1 多粮浓香型白酒生产过程中可培养酵母菌菌落及细胞形态
Fig.1 Colony and cell morphology of cultivatable yeast during the production of multi-grain strong-flavorBaijiu
表1 多粮浓香型白酒生产过程中可培养酵母菌菌落及细胞形态特征
Table 1 Colony and cell morphological characteristics of cultivatable
yeast during the production of multi-grain strong-flavorBaijiu

编号 菌落形态 细胞形态WY1 WY2 WY3 WY4 WY5 WY6 WY7 WY8 WY9 WY10 WY11 WY12乳白色,有光泽、平坦、边缘整齐白色,表面干燥、有绒毛、边缘不整齐白色偏黄,有光泽、平坦,边缘整齐乳白色,有光泽,表面光滑,边缘整齐白色偏黄,表面干燥,边缘不整齐乳白色,表面干燥、有凸起,边缘不整齐白色偏黄,表面湿润,周边有小凸起乳白色,表面平滑湿润,边缘整齐白色偏黄,表面干燥,不平坦,边缘不整齐白色,表面干燥不光滑,边缘不整齐黄褐色,光滑湿润,凸起,边缘整齐黄色,光滑湿润,凸起,边缘整齐20~30μm,卵圆形20~30μm,椭圆形25~30μm,卵圆形25~40μm,卵圆形30~50μm,椭圆形20~35μm,椭圆形20~40μm,椭圆形20~40μm,椭圆形15~30μm,椭圆形30~60μm,长椭圆形20~30μm,球形25~30μm,球形
在分离纯化菌株基础上,通过有效分析多粮浓香型白酒生产过程中可培养酵母菌多样性,为后续菌株的分子生物学鉴定和优质功能酵母菌筛选奠定基础。
2.2 酵母菌分子生物学鉴定
在酵母菌菌落形态及细胞形态观察基础上,从12种形态类型中各选择1株综合特征能够代表本类酵母菌、长势健壮的模式菌株,提取其总DNA并进行ITS rDNA基因PCR扩增,结果见图2。
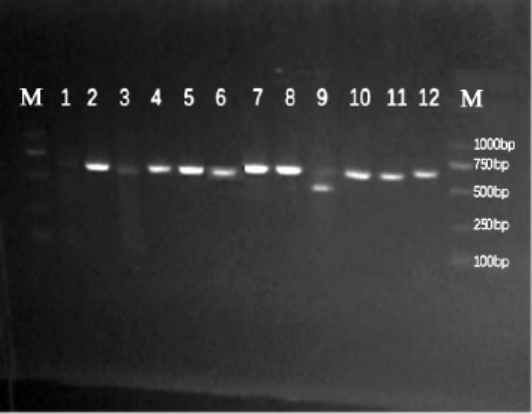
图2 酵母菌基于ITS rDNA基因序列PCR扩增产物电泳图
Fig.2 Electrophoretogram of PCR amplification products based on ITS rDNA gene sequence of yeasts
1~12依次为菌株WY1~WY12,M为DNAMarker。
由图2可知,12株酵母菌的ITS rDNA基因PCR扩增产物无杂条带,且均在500~750 bp之间,这与目的DNA序列大小一致,说明引物设计、PCR扩增体系合理,扩增效果比较理想,无需进行纯化,可直接送测序公司测序。
测序结果在NCBI上进行Blast比对,用DNAMAN8.0软件将上述序列与扩增的ITS序列进行序列比对,并辅以人工修剪将开始和末尾处长短不同的序列剪切整齐,基于Kimura双参数模型,用MEGA5软件中的邻接(NJ)法进行系统关系分析并构建系统发育树,结果见图3。
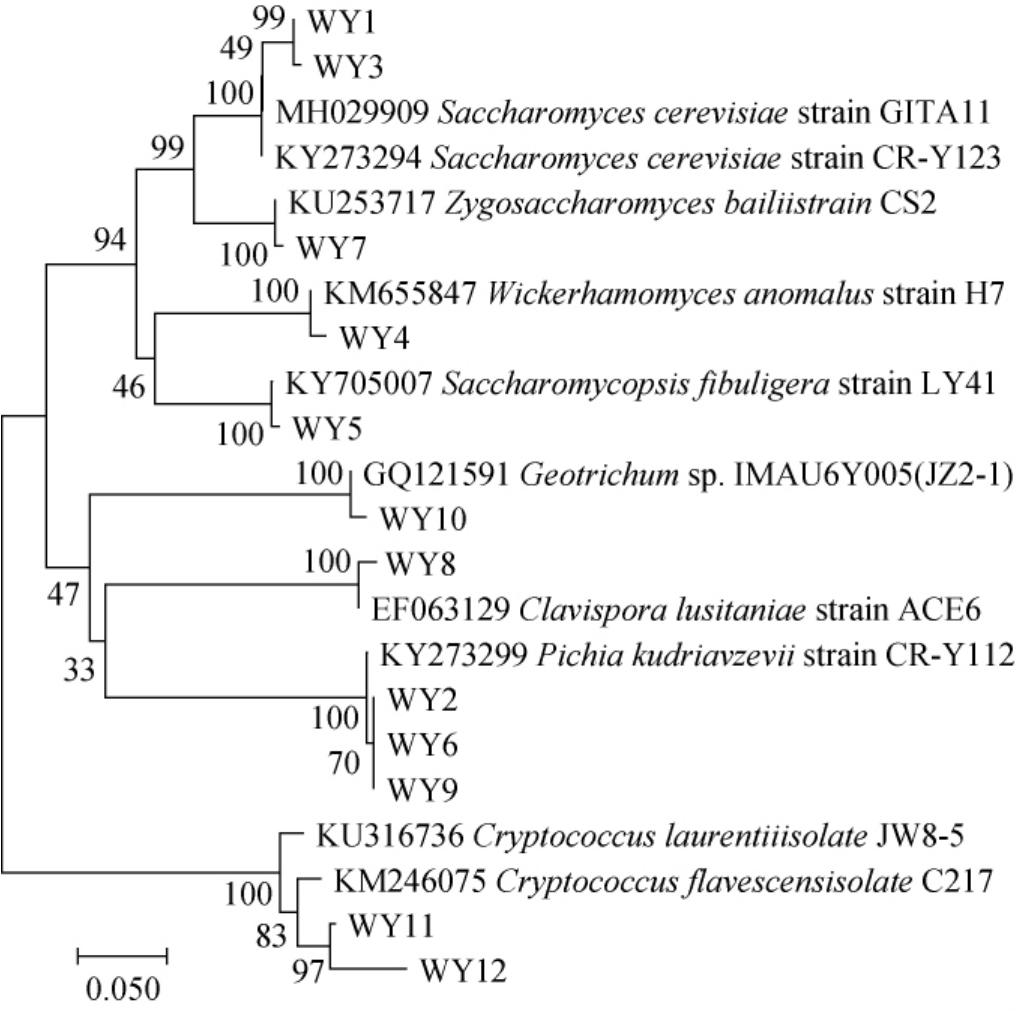
图3 基于ITS rDNA序列构建的多粮浓香型白酒生产过程中可培养酵母菌系统发育树
Fig.3 Phylogenetic tree of cultivable yeasts during the production of multi-grain strong-flavorBaijiubased on ITS rDNA sequences
由图3可知,系统发育树共分为8个分支,从上到下依次为第1~8分支,其中菌株WY1和WY3位于第1分支,菌株WY2、WY6和WY9位于第7分支,菌株WY11和WY12位于第8分支,其他筛选菌株与各自模式菌株位于同一分支,系统发育树的聚类结果与扩增的ITS序列测序结果在NCBI比对的同源性鉴定结果趋于一致。
一般Bootstrap值达到95以上可以判断二者是同一种,因此本研究系统发育树前7个分支同一分支上的酵母菌可初步判定为同一种,第8个分支上的酵母菌可以鉴定到属。结合筛选酵母菌与模式酵母菌的形态和生理特性,筛选到的12种形态类型酵母菌被鉴定为8种酵母菌,具体如下:①菌株WY1和WY3为酿酒酵母(Saccharomyces cerevisiae);②菌株WY2、WY6和WY9为库德里阿兹威(氏)毕赤酵母(Pichia kudriavzevii);③菌株WY11和WY12为罗伦隐球酵母(Cryptococcus laurentii);④菌株WY4为海洋嗜杀酵母(Wickerhamomyces anomalus);⑤菌株WY7为拜氏接合酵母(Zygosaccharomyces bailii);⑥菌株WY5为扣囊复膜酵母菌(Saccharomycopsis fibuligera);⑦菌株WY8为葡萄牙棒孢酵母(Clavispora lusitaniae);⑧菌株WY10为季也蒙毕赤酵母(Galactomyces geotrichum)。
2.3 功能酵母菌筛选
行业内大量研究证明,白酒生产中主要功能酵母菌为假丝酵母、酿酒酵母、接合酵母、嗜杀酵母、伊萨酵母、扣囊复膜酵母、毕赤酵母等[5]。因此结合2.2中鉴定结果,选取菌株WY1和WY3、WY4、WY5、WY2、W6和WY9、WY10共6类酵母菌,探索其乙醇发酵特性和产酯特性。由于每个类别都包含有多个菌株,只列出在每个组别酵母菌中性状表现较好的菌株,结果见表2。
表2 13株酵母菌发酵液产乙醇和产酯(己酸乙酯和乙酸乙酯)测定结果
Table 2 Determination results of ethanol and ester(ethyl caproate and ethyl acetate)production in the fermentation broth of 13 yeasts

菌株编号乙醇含量/%vol酯含量/(mg·100mL-1)菌株编号乙醇含量/%vol酯含量/(mg·100mL-1)WY1-3 WY1-5 WY3-2 WY2-1 WY2-4 WY6-1 WY6-3 13 11 9 3 4 2 4 13 50 30 210 317 398 438 WY9-2 WY9-6 WY4-1 WY4-2 WY5-1 WY10-1 2 2 5 7 9 5 521 489 341 267 85 156
由表2可知,菌株WY1-3、WY5-1、WY3-2发酵液中乙醇含量分别为13%vol、9%vol、9%vol,显著高于其他菌株乙醇产量,最高可达6.5倍;菌株WY6-3、WY9-2、WY4-1发酵液中己酸乙酯、乙酸乙酯总含量分别为438 mg/100 mL、521 mg/100 mL、341 mg/100 mL,显著高于其他菌株发酵液中己酸乙酯、乙酸乙酯总含量,最高可达40倍。因此筛选菌株WY1-3、WY5-1、WY3-2进一步研究发酵温度和pH值对其乙醇发酵特性的影响;筛选菌株WY6-3、WY9-2、WY4-1进一步研究发酵温度和pH值对其产酯特性的影响[21-22]。
2.4 功能酵母菌的发酵性能
研究发酵温度和pH值对菌株WY1-3、WY5-1、WY3-2乙醇发酵特性的影响以及对菌株WY6-3、WY9-2、WY4-1产酯特性的影响,结果见图4。
由图4a、4c可知,3株产乙醇特性较好的酵母菌都具有一定的耐酸性,在pH值为3的环境中依然能保持产乙醇能力,发酵结束时,3株菌的发酵液中乙醇含量保持2%vol以上,菌株WY5-1具有较好的温度适应性,且乙醇产生能力较强。菌株WY3-2在较低温度条件下具有一定的乙醇产生能力,这两个菌株可作为强化功能菌株应用于实际生产,有目的性的快速积累大量的乙醇,从而随着发酵温度的升高,通过乙醇抑制杂菌的生长。
由图4b、4d可知,菌株WY4-1、WY6-3、WY9-2这3株菌都具有一定的温度适应性,在20℃低温和35℃高温环境中具有己酸乙酯、乙酸乙酯产生能力,在适宜的温度环境中,发酵结束时,3株菌的发酵液中己酸乙酯、乙酸乙酯总含量保持400 mg/100 mL以上,菌株WY9-2产酯能力最强,最高可达552 mg/100 mL,菌株WY6-3次之,但是3株菌的酸度耐受性稍差。
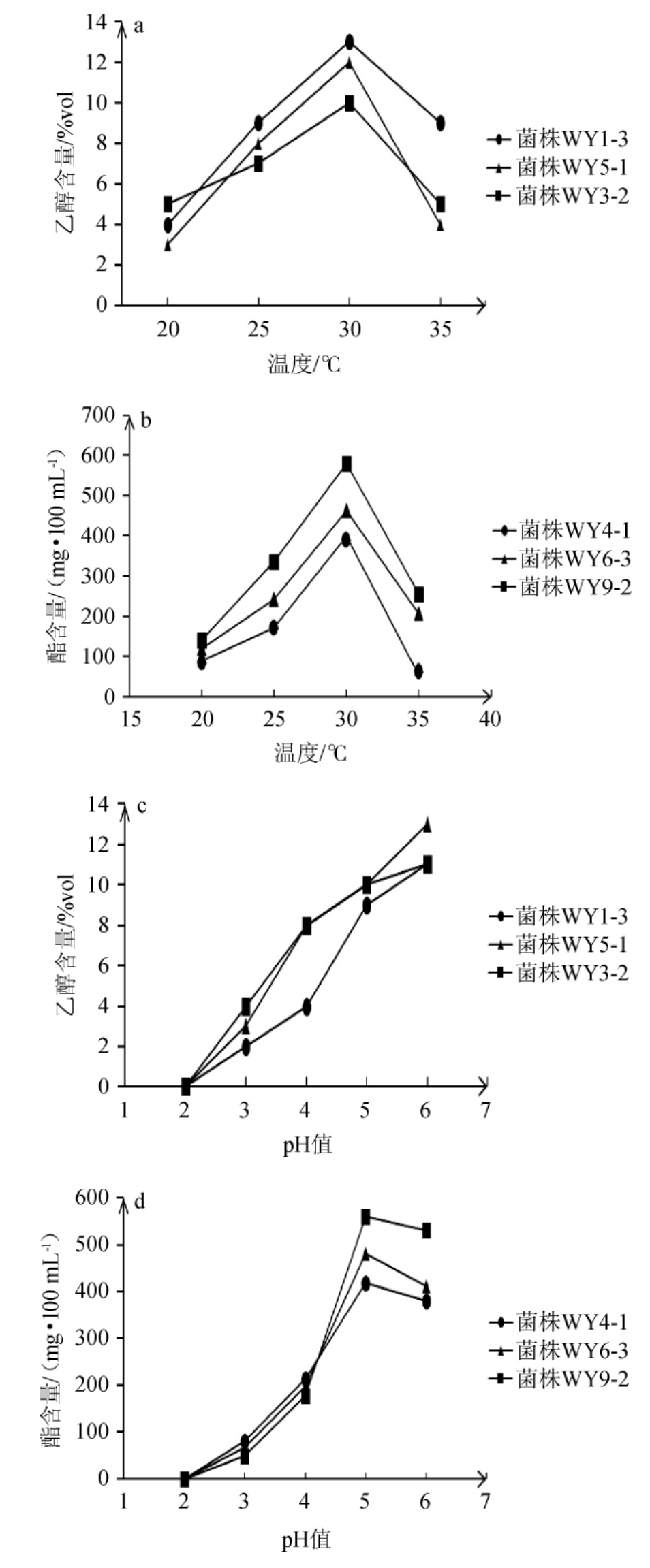
图4 温度和pH值对酵母菌发酵液中乙醇和酯含量的影响
Fig.4 Effect of temperature and pH on ethanol and ester contents in the yeast fermentation broth
结合系统发育树及可培养酵母菌筛选情况,菌株WY6、WY9和WY2三者具有很近的亲缘关系,ITS rDNA相似度为99%,且在本研究所筛选酵母菌中占有较高的比例,菌株WY6、WY9和WY2三类酵母菌共有18株菌,占所筛选酵母菌的42%,从而有效解释浓香型白酒生产中乙酸乙酯偏高的原因。
3 结论
通过ITS序列扩增、测序,并构建系统发育树,本研究得到的12种形态类型酵母菌被鉴定为8种酵母:菌株WY2、WY6、WY9为库德里阿兹威(氏)毕赤酵母(Pichia kudriavzevii);菌株WY1、WY3为酿酒酵母(Saccharomyces cerevisiae);菌株WY4为海洋嗜杀酵母(Wickerhamomyces anomalus);菌株WY5为扣囊复膜酵母菌(Saccharomycopsis fibuligera);菌株WY7为拜氏接合酵母(Zygosaccharomyces bailii);菌株WY8为葡萄牙棒孢酵母(Clavispora lusitaniae)、菌株WY10为季也蒙毕赤酵母(Galactomyces geotrichum)、菌株WY11、WY12为罗伦隐球酵母(Cryptococcuslaurentii)。
功能酵母菌筛选结果表明,扣囊复膜酵母菌(Saccharomycopsis fibuligera)WY5-1和酿酒酵母(Saccharomyces cerevisiae)WY3-2具有良好的产乙醇特性;库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)WY6-3和WY9-2具有良好的产酯特性。菌株WY5-1具有较好的温度适应性,且乙醇产生能力较强,WY3-2在较低温度条件下具有一定的乙醇产生能力,在20℃的环境中发酵结束时,发酵液乙醇含量保持4%vol以上。菌株WY4-1、WY6-3、WY9-2这3株菌都具有一定的温度适应性,但是3株菌的酸度耐受性稍差,菌株WY9-2产酯能力最强,最高可达552 mg/100 mL,菌株WY6-3次之,最高含量为493 mg/100 mL。
本研究最终筛选到2株产乙醇特性较好菌株,扣囊复膜酵母菌(Saccharomycopsis fibuligera)WY5-1和酿酒酵母(Saccharomyces cerevisiae)WY3-2;2株产己酸乙酯、乙酸乙酯特性较好的菌株,库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)WY6-3和WY9-2。4株功能酵母菌均具有较好的温度适应性和一定的酸度耐受性,下一步通过深入研究优化这4株菌的生长特性和代谢产物,并探索不同种类酵母菌的相互作用关系,以期为白酒生产产质进一步提升提供理论基础。
[1]汤有宏.酒醅中酵母的分离及其生理生长特性的研究[J].酿酒,2011,38(5):45-47.
[2]赵爽,杨春霞,徐曼,等.浓香型白酒生产中酿酒微生物研究进展[J].食品与发酵科技,2012,48(1):24-29.
[3]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[4]杨舒雯,周志江,韩烨,等.浓香型白酒窖泥中酵母种类的研究[J].食品工业科技,2011,32(5):138-141,144.
[5]胡帮超,刘国英,董琪,等.白酒酿造中功能性酵母菌的研究及应用[J].酿酒,2017,44(2):13-18.
[6]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[7]任道群,唐玉明,姚万春,等.酱香型酒糟醅酵母菌的初步分类及选育[J].酿酒,2007,34(6):44-45.
[8]庞博.酱香型大曲酒酿造过程酵母微生态及功能菌株筛选[D].贵阳:贵州大学,2014.
[9]李增胜,任润斌.清香型白酒发酵过程中酒醅中的主要微生物[J].酿酒,2005,32(5):33-34.
[10]王琛.白酒酒醅中酵母菌的分离鉴定及特性研究[D].雅安:四川农业大学,2013.
[11]陈臣,张静,孙骏飞,等.产乙酸乙酯酵母筛选鉴定及与乙酸乙酯偏高关系探究[J].酿酒,2019,46(1):48-51.
[12]孟亦浩.白酒质量安全风险及控制[J].食品安全导刊,2018(15):43.
[13]李锐利.高产乙酸乙酯酵母的选育及在清香型小曲酒中的应用研究[D].武汉:湖北工业大学,2011.
[14]蔡燕丽,刘欢,王翀,等.新疆酿酒葡萄园可培养酵母菌多样性分析[J].江苏农业科学,2019,47(2):282-287.
[15]黄海,李光辉,杨官荣,等.浓香型白酒生产酵母菌筛选和特性研究[J].酿酒科技,2011(3):27-29.
[16]SAKSINCHAI S,SUZUKI M,CHANTAWANNAKUL P A,et al.A novel ascosporogenous yeast species,Zygosaccharomyces siamensisand the sugar tolerant yeasts associated with raw honey collected in Thailand[J].Fungal Divers,2012,52(1):123-139.
[17]李超,王素娟,秦云华,等.GC-MS法同时快速测定酒精中9种醇类化合物的含量[J].中国测试,2019,50(1):77-82.
[18]李国辉,高红波,吕志远,等.酒精度快速测定仪测定饮料酒酒精度[J].食品与发酵工业,2019(1):197-201.
[19]张丹丹,李晓路,周宇,等.利用GC-MS分析不同白酒中的微量组分[J].安徽农业科学,2018,46(10):167-169.
[20]李俊刚,郭文宇,罗英,等.利用GC-MS法对不同窖龄下浓香型白酒风味物质的研究[J].中国酿造,2015,34(9):141-144.
[21]葛隐,唐圣云,赵东,等.五粮液窖池中耐酸性酿酒酵母菌的分离与筛选[J].中国酿造,2010,29(8):130-132.
[22]唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012(7):921-930.