桂圆(Dimocarpus longganaLour.)又称龙眼,为无患子科龙眼属植物。桂圆树为常绿乔木,食用部分是假种皮,乳白或淡白色,肉质脆,清甜[1-2]。其果肉含有多种营养物质,有补血安神、健脑益智、补养心脾的功效,是健脾长智的传统食物,对失眠、心悸、神经衰弱、记忆力减退、贫血及抗衰老等有益[2-3]。我国桂圆产业规模化、产品系列化正在形成,传统产品形式为鲜果、桂圆干及桂圆肉干[4],深加工产品如桂圆果汁[5]、桂圆果酒[6-7]、桂圆果醋[2,8-9]、发酵饮料[10-11]及酵素[12]等也有研究开发。
酵素是近年在欧美日韩等经济体中新兴的一种产品形式,在我国也极具市场潜力。酵素按用途可分为食用酵素、环保酵素、日化酵素及饲用酵素。其中,食用酵素是指以动物、植物及菌类为原料,经微生物发酵而制得具有特定生物活性成分可食用的产品[13]。其中对生物现象有影响的微量或少量物质生物活性成分包括多糖类、寡糖类、蛋白质及多肽类、氨基酸类、维生素类及醇、酯、酸、酚类等[14]。
酚类化合物是多羟基酚类化合物的总称,主要包括类黄酮和酚酸两大类,酚类化合物具有很强的抗氧化作用,被称为“第七类营养素”,除了抗氧化功能外,还有降血脂、抗癌、抗炎症和凝聚血小板等功能,是近年功能性食品领域热点研究的生物活性因子[15-16]。水果酚类化合物主要包括单宁或鞣质及小分子酚酸类化合物,如花青素、儿茶素、阿魏酸、没食子酸和鞣花酸等[17]。桂圆果肉中含有多种游离态和结合态酚类化合物[18],其中已经鉴定的酚类化合物有没食子酸、绿原酸、儿茶素、表儿茶素、4-甲基儿茶酚、芦丁、槲皮素、柯里拉京(Corillagin)、香豆酸、香草酸、原花青素三聚体A型、短链苯甲酰甲酸甲酯及鞣花酸等[19-23]。研究表明,酚类化合物,除了水果中本身自有外,也可通过微生物发酵的全细胞催化作用转化生成[24],例如乳酸菌发酵桂圆水提液可以增加发酵液中游离态总酚和总黄酮含量,降低结合态总酚和总黄酮含量[25]。
近年来,桂圆发酵饮料及酵素的相关研究也有报道。如庞泽翀等[26]对龙眼乳酸菌发酵饮料工艺进行了优化;葛瑞宏等[12]以胞外多糖含量为评价指标,优化了桂圆水提液乳酸菌酵素的发酵工艺;KHANSA等[22]分析了桂圆水提液乳酸菌发酵液中酚类化合物及游离氨基酸组成和抗氧化潜力。本研究以桂圆水提液为原料,总酚含量为评价指标,采用单因素及正交试验优化桂圆酵素的发酵工艺;并采用高效液相色谱法(high performance liquid chromatography,HPLC)分析了桂圆酵素中酚类化合物的生物转化情况,为进一步研究阐明其转化机制,进而为定向研究开发富含特定酚类化合物并且具有特定功能的桂圆酵素奠定基础。
1 材料与方法
1.1 材料与试剂
干制桂圆肉:产自广东省高州市;酿酒酵母(Saccha romycescerevisiae)CGMCC2.3853:中国普通微生物菌种保藏管理中心;醋酸杆菌(Acetobacterpasteurianus)CICC20064、植物乳酸杆菌(Lactobacillus plantarum)CICC21790:中国工业微生物菌种保藏管理中心。
绿原酸、阿魏酸、柚皮苷、柚皮素、橙皮素、没食子酸标准品(均为色谱纯):北京索莱宝科技有限公司;乙酸乙酯(色谱纯)、甲醇(色谱纯):德国默克公司;福林-酚试剂(分析纯):福州飞净生物技术有限公司;Na2CO3(分析纯):购自天津市百世化工有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母粉1%,蛋白胨2%,葡萄糖2%;LB培养基:酵母粉0.5%,蛋白胨1%,NaCl 1%。培养基均在121℃灭菌20 min。
1.2 仪器与设备
WJS1222F型榨汁机:美的电器公司;HH-2型数显恒温水浴锅:国华电器公司;DHZ-DA型卧式恒温摇床:苏州培英公司;RE-2000A旋转蒸发仪:上海亚荣公司;YP10002电子天平:上海佑科公司;SPT-16A全自动氮空吹扫浓缩仪:北京斯珀特公司;Gene1580R台式高速冷冻离心机:基因有限公司;L5S型紫外可见分光光度计:上海仪电公司;LC-20AT高效液相色谱:日本岛津公司;InertSustain C18色谱柱:日本GL Sciences公司。
1.3 方法
1.3.1 桂圆酵素的制作工艺与操作要点
蒸馏水 菌种培养→离心去上清↓↓
干制桂圆肉→粉碎→热水浸提→过滤→水提液→接种菌体→发酵→静置澄清→上清离心过滤→桂圆酵素
操作要点:
桂圆水提液的制备:取干制桂圆肉打碎成粉末状,按料液比1∶10加入蒸馏水,70℃水浴浸提1 h,无菌纱布过滤去渣后,获得桂圆水提取液。
菌株培养:分别培养酿酒酵母(YPD培养基,接种量0.1%,30℃、180 r/min振荡培养)、醋酸杆菌(LB培养基,接种量0.1%,30℃、180 r/min振荡培养)与植物乳酸杆菌(LB培养基,接种量0.1%,37℃、180 r/min振荡培养)至对数生长中后期。
接种发酵:按10%接种量量取菌液,10 000 r/min、4℃条件下离心10min,弃上清液取菌体,无菌生理盐水洗涤菌体2次(重悬菌体后离心弃上清液)。桂圆水提取液分装每瓶120 mL,按单因素及正交试验要求接入相应的菌株或组合菌株,培养发酵。
离心与过滤除菌:发酵液静置澄清2h后,取上清8000r/min离心10 min,取上清0.45 μm滤膜过滤,即得桂圆酵素。
1.3.2 桂圆酵素发酵工艺优化单因素试验
分别考察菌株组合(①酿酒酵母;②醋酸杆菌;③植物乳酸杆菌;④酿酒酵母+醋酸杆菌;⑤酿酒酵母+植物乳酸杆菌;⑥醋酸杆菌+植物乳酸杆菌;⑦酿酒酵母+醋酸杆菌+植物乳酸杆菌)、发酵温度(28℃、30℃、32℃、34℃、36℃及38℃)及发酵时间(12 h、24 h、36 h、48 h、60 h及72 h)对发酵培养后桂圆酵素中的总酚含量的影响。初始发酵条件为:菌株组合比例1∶1和1∶1∶1,桂圆水提取液量120 mL,接种量10%(菌株活化培养与洗涤后接入菌体),发酵温度30℃,转速180 r/min,发酵时间24 h。
1.3.3 桂圆酵素发酵工艺优化正交试验
依据单因素试验结果,选取菌株组合、发酵温度及发酵时间3个因素进行3因素3水平正交试验,以发酵培养后桂圆酵素中的总酚含量为评价指标,确定最优桂圆酵素发酵工艺。
1.3.4 总酚含量测定
按照参考文献[27]以OD765nm值(x)为横坐标,以没食子酸质量浓度(y)为纵坐标,绘制没食子酸标准曲线y=8.514 9x-0.499 2,R2=0.996 2。
样品总酚含量的测定:预试验确定样品合适的稀释倍数后用蒸馏水稀释样品,量取稀释样品0.25 mL于10 mL具塞的定容试管中,加入福林-酚试剂1 mL及质量分数为12%的Na2CO3溶液2 mL,蒸馏水定容至10 mL,室温下避光反应1 h,测定OD765nm值,依据标准曲线回归方程确定样品中总酚含量。
1.3.5 HPLC分析桂圆酵素中的酚类化合物
酚类化合物的萃取:取样液(桂圆水提液或发酵液)50 mL,8000r/min离心20min,取上清液于80℃水浴10min,再次8000r/min离心20min,去除沉淀的杂蛋白,取上清液。将得到的上清液用1 mol/L的盐酸溶液调整pH值至2.0,然后加入20 mL乙酸乙酯萃取,振荡5 min后静置分离有机相和水相,保留有机相;取水相加入20 mL乙酸乙酯重复萃取1次,保留有机相;两次萃取后的水相,加入6.0 mol/L的NaOH溶液调pH值至6.0,加入20 mL乙酸乙酯萃取,振荡5 min后静置分离有机相和水相,保留有机相[28]。将所有有机相合并,于旋转蒸发仪中30℃下旋转蒸发至约3mL左右,然后于氮吹仪中接入氮气吹干,用甲醇(色谱纯)反复冲洗并定容至1 mL,过0.22 μm滤膜后,进行HPLC分析。
酚类化合物标准品配制:精密称取标准品绿原酸、阿魏酸、柚皮苷、柚皮素及橙皮素各0.001 0 g,分别用超纯水溶解,并定容至10mL,取1mL过0.22μm滤膜后,进行HPLC分析。
HPLC检测酚类化合物:用岛津LC-20AT高效液相色谱仪对酚类化合物标准品、桂圆水提液及发酵液中酚类化合物进行检测,检测条件:C18柱(4.6 mm×250 mm×5 μm)。洗脱方案:双溶剂梯度流动相为超纯水(A)和甲醇(B)。梯度设定为:0~20 min,37%~50%A;20~35 min,50%~80%A;35~40 min,80%~100%A;40~50 min,100%A;50~70min,37%A。流动相流速0.7mL/min;柱温35℃;检测波长283nm;进样量5μL。
1.3.6 数据处理
单因素及正交试验数据用统计软件SPSS 20.0进行处理与分析。
2 结果与分析
2.1 桂圆酵素发酵工艺优化单因素试验
2.1.1 菌种组合
发酵菌株组合对桂圆酵素总酚含量的影响如图1所示。由图1可知,组合①、④、⑦与组合②差异显著(P<0.05),说明菌株组合对桂圆酵素的总酚含量有显著影响。因此,选取组合①、④、⑦进行桂圆酵素发酵正交试验。

图1 发酵菌株组合对桂圆酵素总酚含量的影响
Fig.1 Effect of fermentation strains combination on total phenolic
content of longan ferment
“*”表示与最小值比较差异显著(P<0.05)。下同。
2.1.2 发酵温度
发酵温度对总酚含量的影响结果如图2所示。由图2可知,在28~38℃范围内,桂圆酵素中总酚含量随发酵温度的升高,呈先增加后降低的趋势。在发酵温度38℃时总酚含量最低,与最小值(38℃)比较,28℃、30℃、32℃及34℃时的4个温度水平均差异显著(P<0.05),说明发酵温度对桂圆酵素的总酚含量有显著影响。选取其中总酚含量高的28℃、30℃、32℃三个温度水平,进行桂圆酵素发酵条件优化正交试验。
2.1.3 发酵时间
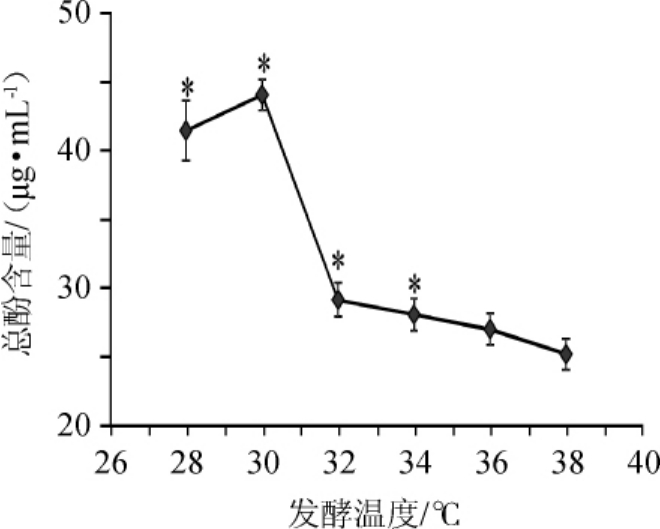
图2 发酵温度对桂圆酵素总酚含量的影响
Fig.2 Effect of fermentation temperature on total phenolic content of
longan ferment
发酵时间对总酚含量影响的结果如图3所示。由图3可知,在12~72 h范围内,桂圆酵素中总酚含量随发酵时间的升高,呈先增加后降低的趋势。发酵时间为12 h时总酚含量最低,与最小值(12 h)比较,其他5个时间水平均有显著差异(P<0.05),说明发酵时间对桂圆酵素的总酚含量有显著影响。选取其中总酚含量高的24 h、36 h、48 h三个发酵时间水平,进行桂圆酵素发酵条件优化正交试验。
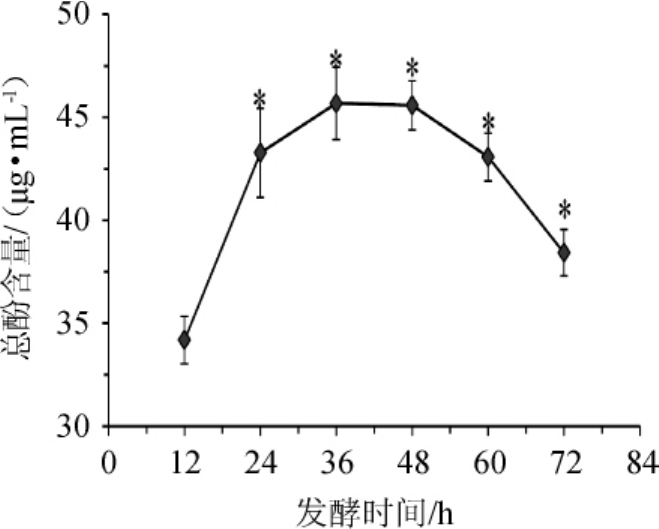
图3 发酵时间对桂圆酵素总酚含量的影响
Fig.3 Effect of fermentation time on total phenolic content of
longan ferment
2.2 桂圆酵素发酵工艺优化正交试验
依据单因素试验结果,选取菌株组合(A)、发酵温度(B)及发酵时间(C),进行3因素3水平(L9(33))正交试验,优化桂圆酵素的发酵工艺,结果与分析如表1所示。2.3 HPLC分析桂圆酵素的酚类化合物
表1 桂圆酵素发酵条件优化正交试验结果与分析
Table 1 Results and analysis of orthogonal experiments for longan ferment fermentation conditions optimization
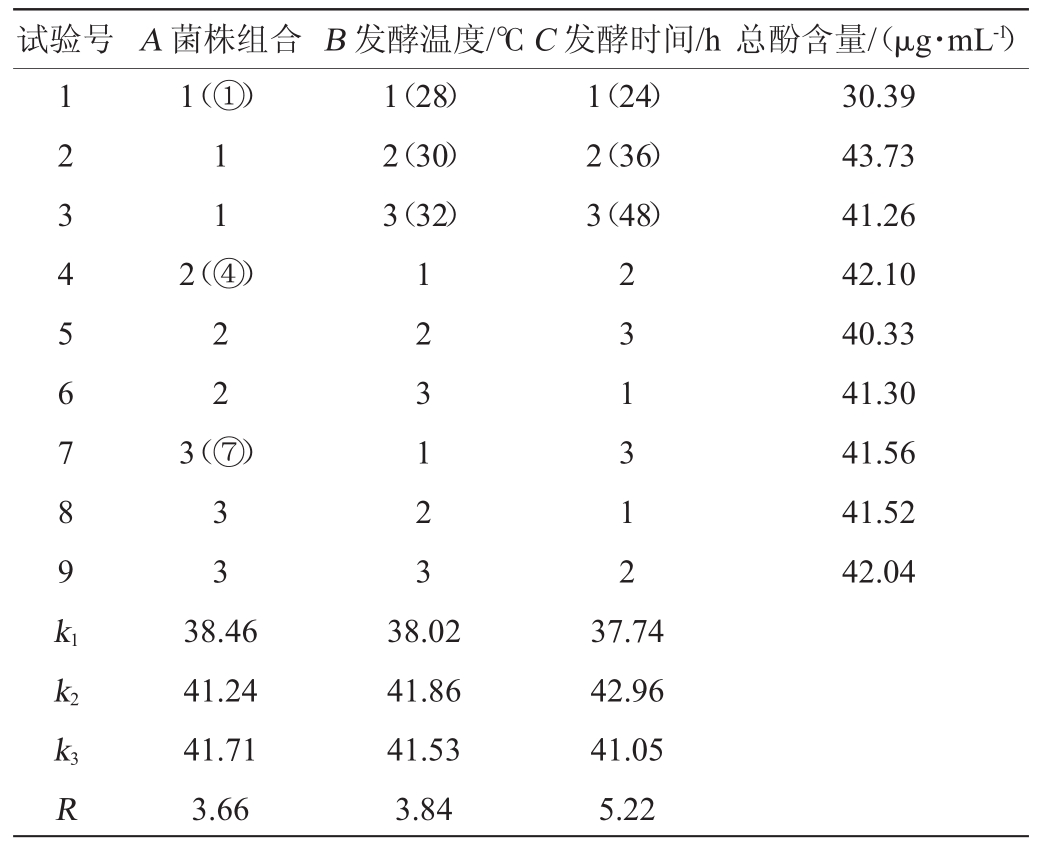
试验号A菌株组合B发酵温度/℃C发酵时间/h总酚含量/(μg·mL-1)1 2 3 4 5 6 7 8 9 k1 k2 k3 R 1(①)1 1 2(④)2 2 3(⑦)3 3 38.46 41.24 41.71 3.66 1(28)2(30)3(32)1 2 3 1 2 3 38.02 41.86 41.53 3.84 1(24)2(36)3(48)2 3 1 3 1 2 37.74 42.96 41.05 5.22 30.39 43.73 41.26 42.10 40.33 41.30 41.56 41.52 42.04
利用正交试验确定的最优工艺进行桂圆酵素发酵,发酵后对桂圆水提液和桂圆酵素进行高效液相色谱分析,结果见图4。
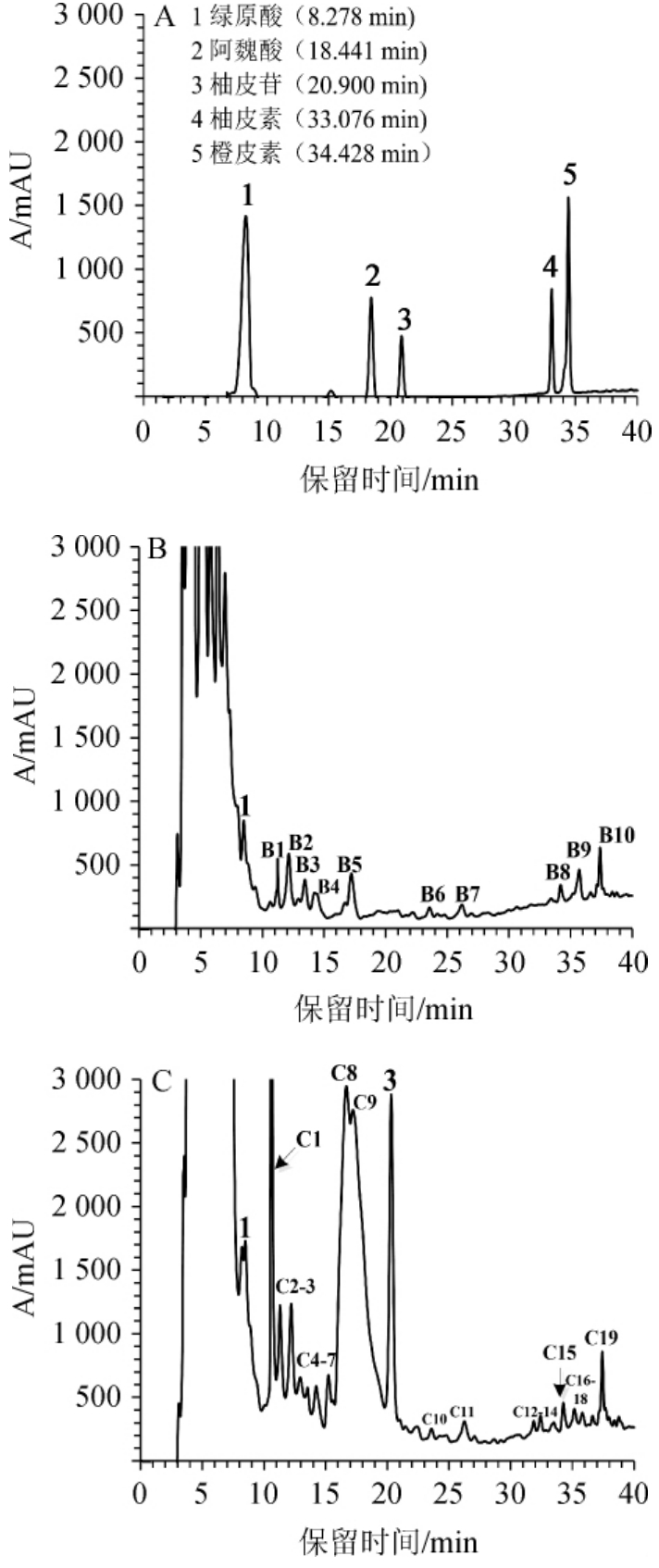
图4 混合标准品(A)、桂圆水提液(B)及酵素(C)中多酚类化合物的HPLC图
Fig.4 HPLC chromatogram of phenolic compounds in mixed standards(A),water extract(B)and longan ferment(C)
菌株组合、发酵温度及发酵时间这3个因素所对应的极差(R)为RC>RB>RA,从而得知影响桂圆酵素发酵的主次因素依次为发酵时间>发酵温度>菌株组合。由极差分析可知,桂圆酵素发酵工艺的最优方案为A3B2C2。即发酵菌株组合为⑦(酿酒酵母+醋酸杆菌+植物乳酸杆菌)、发酵温度为30℃、发酵时间为36h。在此条件下进行3次验证试验,结果表明,桂圆酵素的总酚含量达(46.05±0.76)μg/mL,是桂圆水提液总酚含量(9.12±0.26)μg/mL的5.05倍。此条件下生产的酵素营养、功能及卫生指标符合要求。
由图4可知,与桂圆水提液(图4B)比较,桂圆酵素(图4C)酚类化合物的总含量与种类均明显增加。在桂圆水提液中检测到的酚类化合物至少有10种,其中含量较高的保留时间集中在3~8 min(图4B);含量较低的酚类化合物保留时间集中在8 min后,至少有11种;参照标准品(图4A)可以确定其中1种为绿原酸(图4B中峰1)。桂圆酵素中至少含有20余种酚类化合物,含量较高的保留时间集中在3~11min及16~21 min;参照标准品(图4A)可以确定其中2种为绿原酸及柚皮苷(图4C中的峰1,峰3)。
进一步比较桂圆水提液(图4B)与桂圆酵素(图4C)的HPLC图谱发现,峰B1与峰C2、峰B2与峰C3、峰B8与峰C15、峰B9与峰C17的保留时间分别一致,所以它们应分别为同一种酚类物质。因此除此上述4种酚类化合物及绿原酸之外,桂圆水提液中所检测到的其他酚类化合物,经发酵后均被完全转化。桂圆酵素(图4C)中至少有16个峰的保留时间与桂圆水提液不一致,说明桂圆酵素中至少有16种酚类化合物为新生成;对新生成16酚类化合物与5种标准品的保留时间进行比较,可以确定其中1种为柚皮苷(图4C中峰3);对应于标准品按峰面积进行计算,桂圆酵素中柚皮苷含量为3.32 μg/mL。桂圆水提液中某些酚类化合物的完全被转化,及桂圆酵素中新生成了桂圆水提液中原来没有的酚类化合物,是酿酒酵母、醋酸杆菌与植物乳酸杆菌协同催化的结果,将在后续研究中进一步研究其协同催化机制与催化效率。
3 结论
以总酚含量为评价指标,优化后的桂圆酵素发酵工艺为:发酵菌株组合酿酒酵母+醋酸杆菌+植物乳酸杆菌(1∶1∶1)、接种量10%、发酵温度30℃、发酵时间36 h。在此工艺条件下,桂圆酵素的总酚含量达(46.05±0.76)μg/mL,是桂圆水提液总酚含量(9.12±0.26)μg/mL的5.05倍。原桂圆水提液中检测到的10多种酚类化合物,在最优工艺条件下,除了绿原酸及其他4种酚类化合物外,其余酚类化合物经发酵后均被完全转化。最优工艺条件下制得的桂圆酵素中至少含有20余种酚类化合物,至少有16种为新生成;新生成的酚类化合物中的1种可以确定为柚皮苷,其在桂圆酵素中含量达3.32 μg/mL。
[1]郭倩倩,张晓卫.龙眼的化学成分与药理活性研究[J].现代生物医学进展,2011,11(23):4552-4554.
[2]尹爱国,曾霞,纪秀玲,等.复合龙眼果醋的醋酸发酵工艺优化及其风味成分分析[J].食品研究与开发,2018,39(23):102-107.
[3]蔡长河,唐小浪,张爱玉,等.龙眼肉的食疗价值及其开发利用前景[J].食品科学,2002,23(8):328-330.
[4]潘学文,曾莲,李荣,等.广东龙眼产业的优势分析[C].海峡两岸荔枝龙眼产业发展研讨会论文集.2009:3-7.
[5]彭颖,周如金.两个品种龙眼果汁芳香及营养成分测定与分析[J].食品工业科技,2017,38(16):263-266.
[6]李进,吴冬梅.泸州晚熟龙眼果酒酿造工艺研究[J].食品工业,2017(6):1-4.
[7]肖丽琼,成坚,邱修柄.发酵桂圆酒加工工艺研究[J].中国酿造,2013,32(12):145-147.
[8]姚荣清,梁世中.龙眼保健果醋酿造工艺研究[J].食品工业,2003,24(5):32-34.
[9]陈丽娜,符丽丽,罗志辉,等.龙眼果醋发酵工艺研究[J].现代食品,2018(9):170-175.
[10]郝秋娟,李树立,郝东旭,等.红枣山楂桂圆酸奶的研制[J].中国酿造,2015,34(12):171-174.
[11]赖婷.燕麦桂圆乳酸菌发酵饮料加工活性成分变化分析与工艺优化[D].福州:福建农林大学,2016.
[12]葛瑞宏,储瑞蔼,李井泉,等.桂圆酵素制备及其抗氧化性研究[J].食品科技,2015,40(8):262-267.
[13]中国生物发酵产业协会.T/CBFIA08001—2016酵素产品分类导则[S].北京:中国标准出版社,2016.
[14]刘加友,王振斌.微生物酵素食品研究进展[J].食品与发酵工业,2016,42(1):273.
[15]欧雅文,周倩,刘琪,等.酚类化合物与肠道微生物对高血脂症的作用机制[J].中国食品学报,2018,18(10):269-275.
[16]华晓雨,陶爽,孙盛楠,等.植物次生代谢产物-酚类化合物的研究进展[J].生物技术通报,2017,33(12):22-29.
[17]林晓丽,韩文凤,郭红英,等.水果中酚类化合物研究进展[J].食品与发酵科技,2018,54(3):82-84.
[18]林耀盛,张名位,张瑞芬,等.不同品种龙眼果肉酚类物质的抗氧化活性比较[J].食品科学技术学报,2016,34(3):20-30.
[19]吴诗玄.龙眼中多酚的提取、分离纯化、结构鉴定及体外抗氧化活性测定[D].广州:暨南大学,2018.
[20]孙菡峥,孙培冬.龙眼核多酚的提取分离及抗氧化性能的研究[J].食品与发酵工业,2019,45(9):197-201.
[21]ZHANG R F,KHAN S A,LIN Y S,et al.Phenolic profiles and cellular antioxidant activityof longan pulp of 24 representative Chinese cultivars[J].Int J Food Prop,2018,21(1):746-759.
[22]KHAN S A,LIU L,LAI T,et al.Phenolic profile,free amino acids composition and antioxidant potential of dried longan fermented by lactic acid bacteria[J].J Food Sci Technol,2018,55(12):4782-4791.
[23]LI P,YU X,XU B.Effects of UV-C light exposure and refrigeration on phenolic and antioxidant profiles of subtropical fruits(litchi,longan,and rambutan)in different fruit forms[J].J Food Qual,2017,2017:8785121.
[24]KAPRASOB R,KERDCHOECHUEN O,LAOHAKUNJIT N,et al.Fermentation-basedbiotransformationofbioactivephenolicsandvolatile compounds from cashew apple juice by select lactic acid bacteria[J].Process Biochem,2017,59:141-149.
[25]赖婷,刘磊,张名位,等.不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J].中国农业科学,2016,49(10):1979-1989.
[26]庞泽翀,梁燕清.龙眼乳酸菌发酵饮料工艺的优化[J].贵州农业科学,2018,46(11):125-129.
[27]张桂伟,张秋云,江东,等.中国主栽葡萄柚果肉酚类化合物组成及其抗氧化活性[J].中国果业信息,2015,48(6):1785-1794.
[28]吴燕华,刘文力,阎红,等.高效液相色谱法测定苹果中的酚类化合物[J].分析化学,2002(7):826-828.