中国白酒是世界上最古老的蒸馏酒之一,也是世界上消费量最大的含酒精饮品之一[1]。其是以高粱、大米等作为主要原料,大曲、小曲或麸曲作为酿酒的糖化剂,经蒸煮、糖化和液化、发酵、蒸馏而制成的蒸馏酒[2]。大曲是以大麦、小麦、豌豆等为原料,经过粉碎,加水混捏,制成形状较大且含有多种生物酶和菌类的曲块[3],是名优白酒生产中糖化剂和酿造微生物的主要来源之一。白酒酿造用曲量大,制成的白酒有特殊的曲香,对白酒风味形成具有非常重要的作用。俗话说“有美酒必备佳曲”、“曲为酒之骨”[4]。
特香型白酒为我国10大香型白酒之一,其是采用独特红条石窖池踩糟发酵工艺,生产的富含以丙酸乙酯为主的奇数碳脂肪酸乙酯的特有香型白酒。特香型白酒生产企业,大多在江西省赣江中下游沿岸天然湿润环境地区制曲,并酿造出优质特香型白酒,与其特殊地理、气候环境下所特有的微生物种类密不可分。特香型大曲生产工艺为以面粉、麦麸为主要原料,其独具特色的配料方式是添加一定比例的酒糟以提高大曲的酸度[5],选择性的让环境中耐酸微生物在大曲上生长,生产出一种特有的中高温大曲。目前对特香型大曲的研究主要集中于微生物的分离和对大曲质量的分析,而生产环境对特香型大曲的影响鲜见相关报道。
目前,用于微生物群落结构研究的微生物分子生态学方法主要有核酸探针杂交技术、变性梯度凝胶电泳(denaturinggradientgelelectrophoresis,DGGE)、温度梯度凝胶电泳(temperature gradient gelelectrophoresis,TGGE)、实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,Q-PCR)技术、限制性片段长度多肽性(restrictionfragment length polymorphism,RFLP)分析、末端标记限制性片段长度多态性(terminal-restriction fragment length polymorphism,T-RFLP)分析、单链构象多态性(singlestrand conformationpolymorphism,SSCP)分析、随机扩增多态性脱氧核糖核酸标记(randomly amplified polymorphic deoxyri bonucleicacid,RAPD)分析和下一代测序(nextgenerationsequencing,NGS)[6]。近年来,下一代测序因其成本低、测序通量高、速度快等优点已被广泛应用于白酒大曲[7]、酒醅[8]和窖泥[9]的研究中。
本实验研究了赣江边和市区不同生产环境下,采用相同特香型大曲生产工艺与配料制造的两种大曲的理化特性、挥发性成分及微生物组成的差异,并探讨制曲环境对大曲中微生物种类及组成和各种酶活力等关键质量指标的影响规律,以期为特香型大曲标准化生产提供科学依据。
1 材料与方法
1.1 材料与试剂
大曲样品:分别来自于江西省赣江流域两个采用相同的特香型白酒大曲配料和工艺制曲的曲房,A样品大曲取自于赣江边湿润环境曲房,B样品大曲取自市区曲房。
氢氧化钠、盐酸、硫酸、葡萄糖、氯化钙、3,5-二硝基水杨酸、乙酸钠、碘、碘化钾、可溶性淀粉、三氯乙酸、氢氧化钾等(均为分析纯):国药集团化学试剂公司;福林酚(分析纯):北京索莱宝科技有限公司;冰乙酸(分析纯):上海阿拉丁生化科技股份有限公司;正构烷烃:美国Sigma公司;4-甲基-2-戊醇:德国Dr.Ehrenstorfer公司。
1.2 仪器与设备
SP-756P紫外可见分光光度计:上海光谱仪器有限公司;固相微萃取手动进样柄、DVB/CAR/PDMS(50/30 μm)萃取头:美国Supelco公司;Agilent7890/7000A三重串联四级杆气质联用仪(gas chromatography-mass spectrometer,GC-MS)仪:安捷伦科技有限公司。
1.3 方法
1.3.1 特香型大曲制备
以面粉、麦麸为主要原料,添加一定比例的酒糟以提高大曲的酸度,具体配比为麦麸(40%~50%)、面粉(40%~35%)、酒糟(20%~15%)。制成的曲坯入曲房自然接种发酵,发酵周期一般为30~35 d,期间经过多次翻曲和并房,当水分<15%即可出房,于曲库室温放置3个月即得到成品曲。
1.3.2 大曲样品的处理
选取A、B曲房中成熟的大曲,采样时间为2017年12月。为确保取样具有科学依据和代表性,从曲房上部、中部和下部各随机抽取一块曲,将样品粉碎并通过四分法混合均匀作为一个样品。取一部分样品储存于-80℃用于微生物群落结构分析,其余样品储存于4℃用于大曲其他性质的分析。
1.3.3 特香型大曲理化指标测定方法
水分含量、酸度、淀粉含量、酯化力、发酵力的测定参照参考文献[3]和QB/T 4257—2011《酿酒大曲通用方法》[10]。还原糖含量、糖化酶活力测定方法参照文献[11-12]稍作改动。用Yoo改良法[13]测定液化酶活力。糖化酶活力定义:1g绝干曲在40℃、pH4.6条件下,1 h分解可溶性淀粉生成1 mg葡萄糖,为1个酶活力单位(U/g)。液化酶活力定义:1 g绝干曲在40℃、pH6.0条件下,5 min液化1 mg可溶性淀粉,称为1个酶活力单位(U/g)。蛋白酶活力定义:1 g绝干曲在40℃下1 min水解酪蛋白产生l μg酪氨酸,定义为1个酶活力单位(U/g)。
1.3.4 特香型大曲挥发性成分分析
样品预处理:大曲样品预处理参照文献[14-15]。
固相微萃取操作:取5mL上清液,按0.2g/mL的质量浓度加入NaCl,再添加10μL4-甲基-2-戊醇内标溶液(10μg/mL),50℃平衡30 min。将固相微萃取萃取头(DVB-CAR-PDMS)插到顶空瓶中的顶空部分,萃取30 min;萃取结束后,插入气相进样口热解吸5 min后分析检测,采集数据。每个样品平行测定3次。
气相色谱条件:HP-5MS色谱柱(30m×0.25mm×0.25μm);载气为氦气(He);流速1 mL/min;分流比10∶1;进样口温度250℃;升温程序为40℃保持1 min,2℃/min升温至70℃,4℃/min升温至160℃,10℃/min升温至250℃保持5 min。质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度230℃,质量扫描范围28~500 amu,扫描方式为全扫描。
挥发性成分的定性及定量分析:未知挥发性化合物经计算机数据系统检索并与标准质谱谱图库美国国家标准技术研究所(national institute of standards and technology,NIST)MS Search 2.0进行比对,结合保留指数(retention index,RI)进行定性分析,以4-甲基-2-戊醇为内标物进行定量分析。
1.3.5 特香型大曲群落结构分析
将大曲样品送至上海美吉生物医药科技有限公司,进行高通量测序。根据测序结果,对其物种注释和丰度及α-多样性等进行分析。将加工整理后的序列与silva库(http://www.arb-silva.de/)进行比对,进而对其群落结构进行分析。
2 结果与分析
2.1 特香型大曲理化指标测定结果
表1 特香型大曲理化指标分析结果
Table 1 Results of physicochemical indexes analysis for Te-flavour Daqu
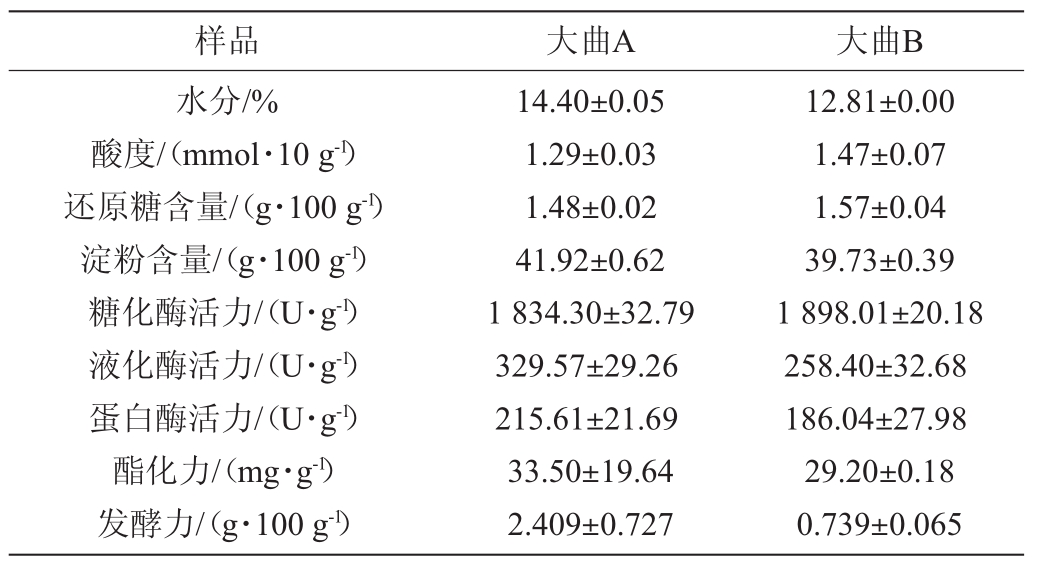
样品 大曲A 大曲B水分/%酸度/(mmol·10 g-1)还原糖含量/(g·100 g-1)淀粉含量/(g·100 g-1)糖化酶活力/(U·g-1)液化酶活力/(U·g-1)蛋白酶活力/(U·g-1)酯化力/(mg·g-1)发酵力/(g·100 g-1)14.40±0.05 1.29±0.03 1.48±0.02 41.92±0.62 1 834.30±32.79 329.57±29.26 215.61±21.69 33.50±19.64 2.409±0.727 12.81±0.00 1.47±0.07 1.57±0.04 39.73±0.39 1 898.01±20.18 258.40±32.68 186.04±27.98 29.20±0.18 0.739±0.065
由表1可知,大曲A中水分含量高于大曲B,可能是大曲A生产环境湿度高于大曲B导致;酸度和还原糖含量则大曲B高于大曲A,淀粉含量大曲A要略高,说明大曲B中产酸菌较多、淀粉被降解的更多。
除糖化酶活力大曲B略高外,大曲A的液化酶活力、蛋白酶活力、酯化力及发酵力分别比大曲B高27.54%、15.89%和14.73%。大曲A的发酵力为大曲B的3.26倍。
2.2 特香型大曲中挥发性成分分析
表2 特香型大曲挥发性成分分析结果
Table 2 Results of volatile compounds analysis in Te-Daqu

编号化合物保留时间/min RI(实测值)含量/(μg·kg-1)大曲A 大曲B 1 234567891 0 24.1561847酸类化合物反,反-西基乙酸醇类化合物异戊醇正己醇蘑菇醇2-乙基己醇芳樟醇苯乙醇香叶醇(+)-雪松醇(-)-异长叶醇酯类化合物异戊酸乙酯甲酸己酯己酸甲酯γ-壬内酯丙酮香叶酯豆蔻酸甲酯邻苯二甲酸二异丁酯原膜散酯棕榈酸甲酯邻苯二甲酸二丁酯棕榈酸乙酯亚油酸甲酯(Z)-油酸甲酯n.d 0.29±0.04 3.778 8.369 11.81 12.952 14.371 14.666 16.958 21.481 22.436 727 873 985 1033 1102 1119 1259 1603 1687 n.d 2.87±0.53 4.10±2.74 2.73±0.57 n.d 0.89±0.28 5.37±1.23 n.d 31.01±4.81 1.05±0.49 n.d 0.43±0.27 1.11±0.18 9.63±0.49 94.88±9.82 n.d 0.50±0.25 17.32±11.43 11 12 13 14 15 16 17 18 19 20 21 22 23 7.717 8.362 10.284 18.571 19.694 22.879 24.479 24.748 24.983 25.427 25.648 26.677 26.724 856 873 931 1372 1458 1727 1878 1904 1928 1973 1996 2099 2104 5.16±1.43 n.d n.d 3.91±0.38 n.d 2.15±0.58 1.56±0.53 2.49±0.07 14.98±3.83 0.70±0.01 1.19±0.36 5.87±2.15 3.63±1.07 n.d 3.69±3.3 0.85±0.01 0.92±0.22 1.28±0.91 0.76±0.03 2.65±0.64 10.86±3.58 4.25±1.09 n.d 0.84±0.2 2.32±0.31 0.79±0.13
续表
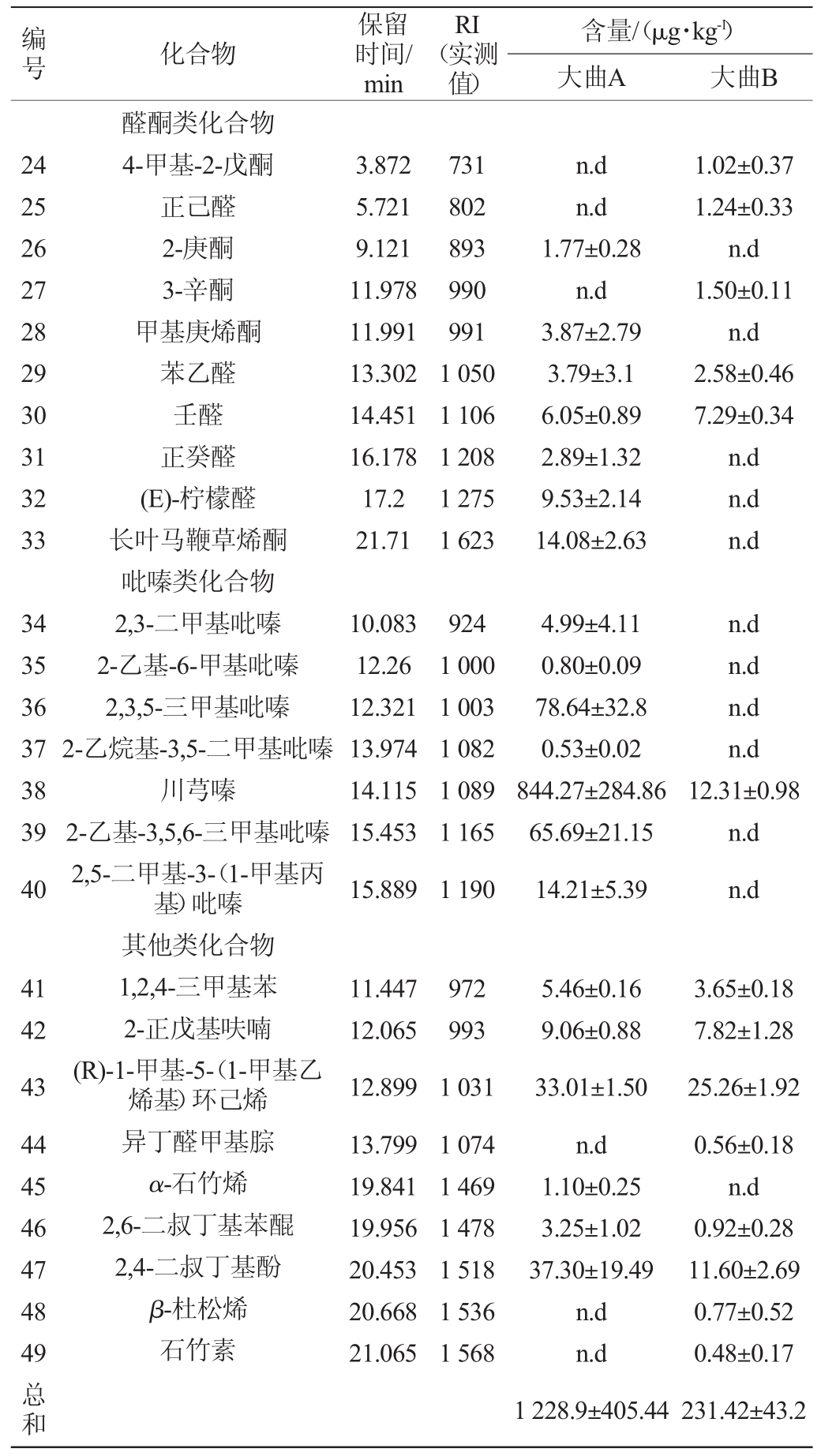
注:n.d表示未检出。
编号化合物保留时间/min RI(实测值)含量/(μg·kg-1)大曲A 大曲B 24 25 26 27 28 29 30 31 32 33 3.872 5.721 9.121 11.978 11.991 13.302 14.451 16.178 17.2 21.71 731 802 893 990 991 1050 1106 1208 1275 1623 n.d n.d 1.77±0.28 n.d 3.87±2.79 3.79±3.1 6.05±0.89 2.89±1.32 9.53±2.14 14.08±2.63 1.02±0.37 1.24±0.33 n.d 1.50±0.11 n.d 2.58±0.46 7.29±0.34 n.d n.d n.d 34 35 36 37 38 39 40 10.083 12.26 12.321 13.974 14.115 15.453 15.889 924 1000 1003 1082 1089 1165 1190 4.99±4.11 0.80±0.09 78.64±32.8 0.53±0.02 844.27±284.86 65.69±21.15 14.21±5.39 n.d n.d n.d n.d 12.31±0.98 n.d n.d 41 42 43 44 45 46 47 48 49醛酮类化合物4-甲基-2-戊酮正己醛2-庚酮3-辛酮甲基庚烯酮苯乙醛壬醛正癸醛(E)-柠檬醛长叶马鞭草烯酮吡嗪类化合物2,3-二甲基吡嗪2-乙基-6-甲基吡嗪2,3,5-三甲基吡嗪2-乙烷基-3,5-二甲基吡嗪川芎嗪2-乙基-3,5,6-三甲基吡嗪2,5-二甲基-3-(1-甲基丙基)吡嗪其他类化合物1,2,4-三甲基苯2-正戊基呋喃(R)-1-甲基-5-(1-甲基乙烯基)环己烯异丁醛甲基腙α-石竹烯2,6-二叔丁基苯醌2,4-二叔丁基酚β-杜松烯石竹素11.447 12.065 12.899 13.799 19.841 19.956 20.453 20.668 21.065 972 993 1031 1074 1469 1478 1518 1536 1568总和5.46±0.16 9.06±0.88 33.01±1.50 n.d 1.10±0.25 3.25±1.02 37.30±19.49 n.d n.d 1228.9±405.44 3.65±0.18 7.82±1.28 25.26±1.92 0.56±0.18 n.d 0.92±0.28 11.60±2.69 0.77±0.52 0.48±0.17 231.42±43.2
由表2可知,两种大曲共检测出挥发性成分49种,多为醇类、酯类和醛酮类物质。大曲A检测出36种挥发性成分,包括6种醇、10种酯、7种醛酮、7种吡嗪以及其他类6种;大曲B检测出33种挥发性成分,包括1种酸、7种醇、11种酯、5种醛酮、1种吡嗪以及其他类8种。
大曲A和B中醇类化合物含量分别为46.97 μg/kg和124.92 μg/kg。大曲A中含量最高的醇类化合物为(-)-异长叶醇,含量为31.01 μg/kg。苯乙醇是大曲B中含量最高的醇类化合物,含量为94.88 μg/kg,具有花草香和果香,对曲香的形成具有较大的贡献。
γ-壬内酯、豆蔻酸甲酯、邻苯二甲酸二异丁酯、原膜散酯、棕榈酸甲酯、棕榈酸乙酯、亚油酸甲酯、(Z)-油酸甲酯在两种大曲中都被检测到,大曲A中酯类化合物含量为41.64 μg/kg,其中低气味的棕榈酸甲酯是大曲A中含量最高的酯类化合物,含量为14.98 μg/kg。酯类化合物在大曲B中含量为29.21 μg/kg,其中含量最高的酯类化合物为低气味的原膜散酯,含量为10.86 μg/kg。
醛酮类化合物也是大曲挥发性成分中重要的组成部分,大曲A和B分别检测到41.98 μg/kg和12.61 μg/kg,大曲A中含量最高的醛是具有强烈的柠檬香气的(E)-柠檬醛,其含量为9.53 μg/kg;大曲B中含量最高的醛是壬醛,含量为7.29 μg/kg。
大曲A中主要挥发性成分吡嗪类化合物占总挥发性成分的82.12%,总含量达1 009.13 μg/kg,其中川芎嗪含量达844.27 μg/kg,占吡嗪类化合物83.66%。而在大曲B中吡嗪类只有川芎嗪,含量为12.31 μg/kg。
2.3 特香型大曲微生物群落结构多样性分析2.3.1大曲微生物多样性分析
采用高通量测序对大曲中微生物进行测序,序列经过优化后,16S rRNA测序共得到有效序列77 492条,平均每条序列长度为401.63 bp;18S rRNA测序共得到有效序列74 478条,平均每条序列长度为445.97 bp。稀释曲线可用来说明样本取样大小是否合理,两种特香型大曲的稀释性曲线见图1。从图1可以看出,曲线有趋于平缓的趋势,说明样品中所有的物种基本被覆盖,测序深度足够。
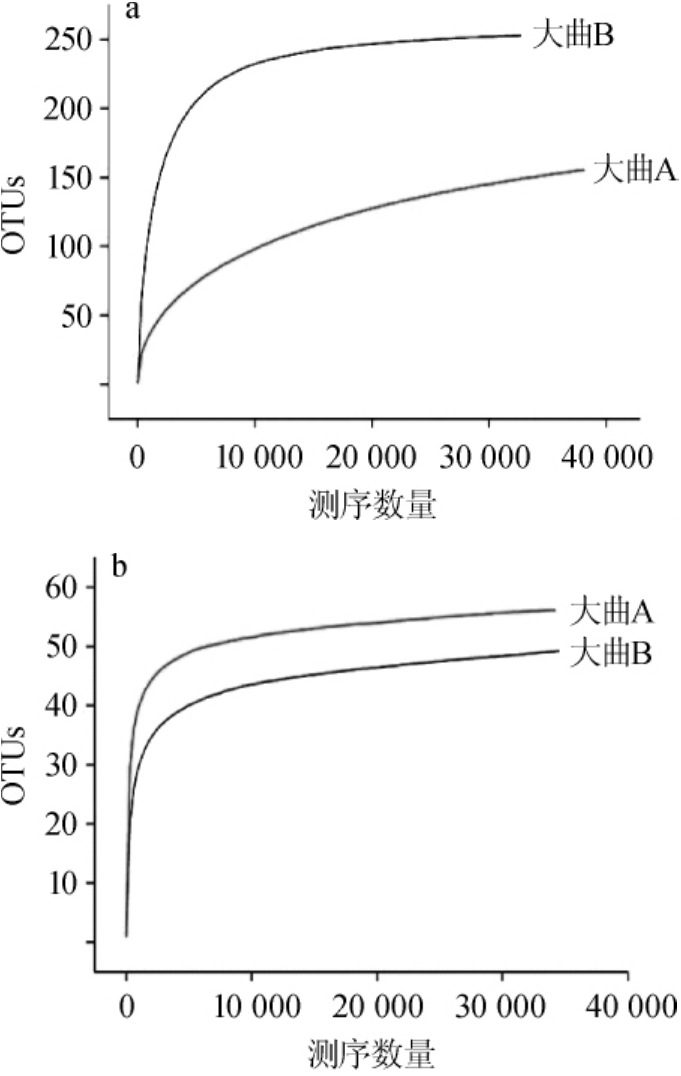
图1 大曲中细菌(a)和真菌(b)稀释性曲线
Fig.1 Rarefaction curves of bacteria(a)and fungi(b)in Daqu
表3 大曲中细菌和真菌多样性指数
Table 3 Bacterial and fungal diversity indexes in Daqu

样品名称AB OTUs细菌Shannon指数细菌Chao1指数细菌157 253真菌 真菌 真菌57 50 1.65±0.22 3.16±0.16 2.36±0.40 1.64±0.67 199.13±23.10 256.49±41.84 58.92±4.83 72.75±30.05 Coverage指数细菌 真菌0.998 9±0.000 1 0.999 7±0.000 1 0.999 9±0.000 1 0.999 8±0.000 1
大曲中细菌和真菌多样性指数见表3。由表3可知,细菌操作分类单元(operational taxonomic unit,OUT)数明显高于真菌,可见大曲中细菌种类要比真菌复杂,同时大曲B中细菌种类组成比大曲A复杂,而真菌则呈现相反的趋势。细菌多样性大曲B高于大曲A,而真菌多样性则大曲A更高。Chao1指数无论是细菌还是真菌,大曲B均高于大曲A,说明大曲B微生物群落丰富度均比大曲A高。这些差异可能是由于制曲环境所产生的,生产大曲A的曲房所处赣江边人烟稀少、空气潮湿,环境空气中细菌种类复杂程度远低于人烟稠密的市区生产大曲B的曲房,但是潮湿江边环境中真菌种类多于市区。测序覆盖率(Coverage)指数均>0.99,说明测序数目足够,所得结果准确可靠。
2.3.2 大曲微生物群落结构分析
图2(A)和图2(B)显示了大曲样品中细菌和真菌在属水平上的相对丰度。细菌高通量测序结果显示,两种大曲共检测到271个不同属细菌,相对丰度>1%的有19个属,两种大曲中细菌组成差异显著,大曲A中主要为克罗彭斯特菌(Kroppenstedtia)和海洋芽孢杆菌(Oceanobacillus),分别占细菌总量的44.46%和37.08%。以产液化酶和蛋白酶强的芽孢杆菌(Bacillus)也为大曲A中的优势细菌属,相对丰度为7.70%,而大曲B中仅为1.78%,这与表1中大曲A表现出更高的蛋白酶和液化酶活力结果一致。芽孢杆菌还具有调节白酒风味的作用,是白酒酿造过程中一类重要的功能微生物[16]。此外,吡嗪类物质多由芽孢杆菌产生[17],大曲A中吡嗪类化合物含量远高于大曲B,进一步说明大曲A中芽孢杆菌含量较高。而大曲B中丰度高达17.47%的产碱杆菌(Alcaligenes),不能利用糖类,没有产淀粉酶和糖化酶能力。醋酸菌属(Acetobacter)和乳杆菌属(Lactobacillus)是大曲中两大重要的细菌属,在大曲发酵过程中,分别可产生乙酸和乳酸,经过酶的作用和乙醇反应生成乙酸乙酯和乳酸乙酯,对白酒的风味具有重要贡献,乳酸菌在A、B大曲中相对丰度分别为2.71%和1.77%,醋酸菌在大曲A中占比为1.70%,未在大曲B中检测出。大曲B中含量较高的魏斯氏菌属(Weissella)具有将葡萄糖转化成乙醇或乙酸的作用,其相对丰度为7.05%,而在大曲A中未检测到,因此大曲B中醇类化合物和酸类化合物含量高于大曲A。在大曲B中还检测到丰度为9.54%的高温放线菌(Thermoactinomyces),代谢可产生α-耐高温淀粉酶、纤维素酶及几丁质酶等多种耐高温酶系[18],但其产生的土霉异味常在白酒中能检测到[19]。
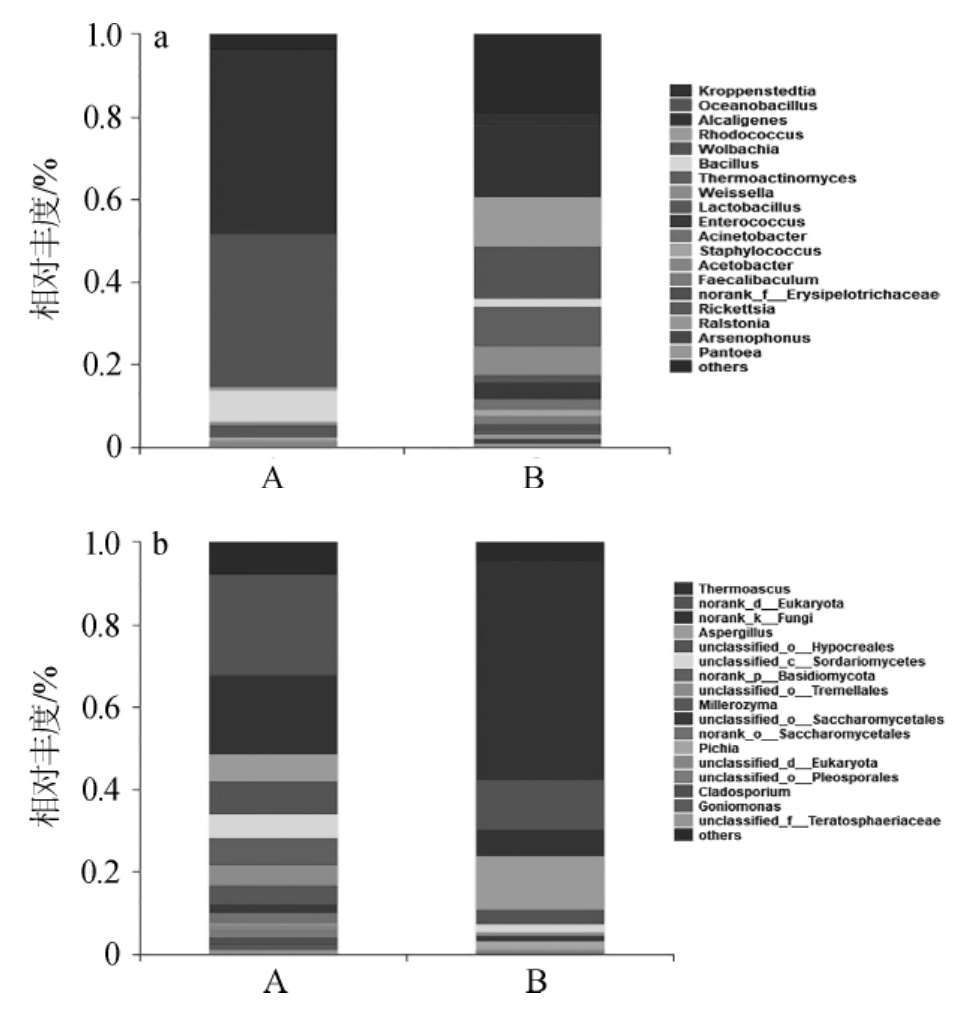
图2 大曲中细菌(A)和真菌(B)在属水平上的相对丰度
Fig.2 Relative abundance of bacteria(A)and fungi(B)at genus level in Daqu
属水平上分析,两种大曲共检测到60个真菌属,相对丰度>1%的主要有17个属。比较发现,两者真菌群落组成相差不大,但比例差异明显。大曲A中各菌属相对丰度较均衡,占比靠前的包括norank-d-Eukaryote和真菌属(norankk-Fungi),分别占真菌总量的24.68%和19.12%。大曲B中丰度最高的为嗜热子囊菌属(Thermoascus),相对丰度达53.18%,大曲发酵过程中,嗜热子囊菌属能产生热稳定的水解酶,如纤维素酶和木聚糖酶,继而将谷物中的纤维素降解,是大曲发酵不可或缺的重要菌属。曲霉属(Aspergillus)是大曲中普遍存在的,也是两种大曲中优势真菌属之一,大曲A中相对丰度为6.39%,相比于大曲B中12.98%较低,能产生多种蛋白酶及其他分解酶类,将蛋白质和淀粉类物质水解为多肽、糖类、氨基酸等降解产物,对大曲糖化力、液化力和生香作用都有很大的影响。
毕赤酵母属(Pichia)具有较强产酯功能,能够生成大量酯类风味物质,是白酒酿造中一类重要的功能微生物。大曲B中检测到毕赤酵母属相对丰度为2.07%,远高于大曲A(0.31%)。大曲A中除毕赤酵母外还检测到其他酵母属2.60%,而大曲B中只检测到1.12%。酿酒酵母(Saccharomyces cerevisiae)、产酯酵母、假丝酵母(Candida)和毕赤酵母(Pichia pastoris)为酵母属中主要的种属,其中酿酒酵母具有较强的产酒精能力,产酯酵母可利用酸类和醇类物质生成酯类物质[20],这可能是大曲A发酵力高于大曲B及大曲A中酯类含量高于大曲B的原因。
3 结论
本研究首次利用高通量测序技术对特香型大曲中微生物进行分析,并将大曲理化指标、挥发性成分和微生物群落3者结合起来,更好地阐述制曲环境影响特香型白酒大曲中优势菌种的种类及丰度,这些优势丝状真菌和细菌在大曲发酵过程中代谢生产大量淀粉酶、糖化酶和蛋白酶,另外酿酒酵母和产酯酵母则提供发酵力和酯化力,是导致赣江边曲房生产的大曲各项关键质量指标优于市区曲房产大曲的重要原因之一,可以作为特香型大曲标准化生产和提高特香型白酒品质的理论依据。
[1]JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63:18-28.
[2]王文芹,孔玉涵.国内外发酵食品的发展现状[J].发酵科技通讯,2007,
36(2):55-56.
[3]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:11-15.
[4]侯召华,宁浩然,聂帅,等.国内外酒曲研究进展[J].特产研究,2013(3):72-76.
[5]周斐成,吴生文,朱庆圣,等.特香型大曲发酵过程中曲块不同部位理化指标及主要酶系动态分析[J].中国酿造,2019,38(4):58-64.
[6]乔晓梅.清香大曲糖化力酯化力功能及真菌群落结构分析[D].临汾:山西师范大学,2015.
[7]李斌,闫志鹏,李慧星,等.基于高通量测序技术的浓香型和芝麻香型白酒酒曲细菌群落结构分析[J].中国酿造,2018,37(8):148-152.
[8]胡佳音,周森,王瑛,等.牛栏山二锅头大茬酒醅发酵过程中细菌群落结构分析[J].中国酿造,2018,37(9):39-42.
[9]杨小丽,尚雪娇,余海忠,等.基于Miseq高通量测序技术的古襄阳酒窖泥细菌多样性评价[J].中国酿造,2018,37(7):26-30.
[10]中国食品发酵工业研究院,中国酿酒工业协会,宜宾五粮液股份有限公司,等.QB/T4257—2011酿酒大曲通用分析方法[S].北京:中国轻工业出版社,2011.
[11]陈钧辉.生物化学实验[M].兰州:兰州大学出版社,2015:32-39.
[12]占乐.新型高效糖化酶的获得及其酶学性质研究[D].长春:吉林大学,2014.
[13]史承利,姜涌明.五种α-淀粉酶测活方法的比较研究[J].微生物学通报,1996,23(6):371-373.
[14]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced withBacillus licheniformisby solid-state fermentation[J].Lett Appl Microbiol,2013,57(1):11-18.
[15]KONG Y,WU Q,ZHANG Y,et al.In situ analysis of metabolic characteristics reveals the key yeast in the spontaneous and solid-state fermentation process of Chinese light-style liquor[J].Appl Environ Microbiol,2014,80(12):3667-3676.
[16]张荣.地衣芽孢杆菌固态发酵产地衣素及风味活性物质对白酒品质的影响[D].无锡:江南大学,2014.
[17]王鹏.地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡:江南大学,2017.
[18]罗小叶.酱香型大曲高温放线菌的特性研究[D].贵阳:贵州大学,2017.[19]张建敏.酱香白酒酿造过程放线菌的筛选与风味研究[D].贵阳:贵州大学,2015.
[20]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[21]徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016,35(2):74-78.