水晶葡萄色泽绿黄、皮薄汁多、酸甜适口,有浓郁的狐香味,且可溶性固形物含量>15%,是品质优良的葡萄品种。与其他葡萄品种相比,水晶葡萄还具有抗病性强、耐贫瘠、易管理及丰产性好等优点,特别适合山区种植。目前,水晶葡萄已成为贵州地区的主要栽培品种,种植面积约占贵州总葡萄种植面积的60%,广泛分布于贵州各个地区,规模化种植越来越多。然而水晶葡萄产业存在单一品种种植面积过大、经济附加值低、产品不宜贮存、缺乏大型的葡萄存贮及加工企业等问题[1],给葡萄种植带来一定的滞销风险,在一定程度上影响了农户的种植积极性和产业规模化生产。因此,大力推广水晶葡萄的深加工势在必行。
将新鲜的水晶葡萄用于葡萄酒酿制,可降低水晶葡萄产业过剩、产品滞销、易腐败等风险,提高产品附加值,推动相关产业的发展,带动当地群众就业,符合贵州绿色经济发展的战略定位。决定水晶葡萄酒品质的关键是发酵用酿酒酵母(Saccharomyces cerevisiae),选择适宜的酿酒酵母至关重要[2-4]。目前,市场上酿酒用的酵母多为进口酿酒酵母,其用于国内葡萄酒发酵不能体现本地葡萄的品质和特色,同质化现象严重[5-7]。为解决这一困境,近年,国内外许多学者开展了当地葡萄酿酒酵母的分离及酿酒性能研究,以期筛选出适合当地葡萄发酵的酵母菌。如汤晓宏等[8-9]以蓬莱葡萄酒产区君顶酒庄霞多丽的果皮和葡萄园土壤为原料,分离出对SO2、酒精、高盐及高糖耐受极强的酿酒酵母PJ16,对SO2耐受性高达500 mg/L,对酒精、高盐及高糖耐受性分别达12%vol、2.8 mol/L和60%;庞红勋[10]以天津地区所产的贵人香、玫瑰香和赤霞珠等葡萄为分离材料,筛选出一株酿酒酵母M502,具有生长繁殖快、发酵迅速、糖度耐受性强及酒精发酵度高等特点;高晓航[11]以宁夏贺兰山东麓葡萄酒产区的成熟期葡萄果实、表皮和土壤为原料,分离一株酿酒性能优良的酿酒酵母,并通过诱变育种和原生质体融合,选育出一株性能更为优良的酿酒酵母菌株R17,其可耐受酒精12%vol、SO2250mg/L、糖30%、NaCl 100 g/L,糖的乙醇转化率为88.92%;BELL P J L等[12]以筛选出的野生酿酒酵母YS2为出发菌株,经过驯化后,菌株的糖转化率提高20%以上。以上研究表明,以本地葡萄为原料,经分离筛选可以得到酿酒性能优良的酵母菌株。
因此,本研究以贵州三都县所产水晶葡萄为原料,利用其葡萄汁自然发酵,经分离筛选、耐受性及酿酒性能研究,筛选优良的酿酒酵母,并通过分子生物学技术对其进行鉴定,以期筛选出能够适应当地气候环境和葡萄原料的优良酿酒酵母。1材料与方法
1.1 材料与试剂
1.1.1 原料
水晶葡萄:采摘于贵州三都县葡萄园区。
1.1.2 试剂
LA-PE果酒酵母:烟台帝伯仕自酿机有限公司;2×聚合酶链式反应(polymerase chain reaction,PCR)mix、Gold-ViewTM:全式金生物技术有限公司;其他化学试剂均为国产分析纯。
1.1.3 培养基
WL固体培养基[13]:酵母浸粉4.0 g/L,蛋白胨5.0 g/L,葡萄糖50 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125 g/L,琼脂20 g/L,硫酸镁0.125 g/L,氯化铁0.002 5 g/L,硫酸锰0.002 5 g/L,溴甲酚绿22 mg/L,pH 6.5。121℃高压灭菌20 min。
模拟葡萄汁培养基[13]:葡萄糖200 g/L,硫酸铜0.05 g/L,蛋白胨10 g/L,柠檬酸3 g/L,酵母浸粉5 g/L,121℃高压灭菌20 min。按需要加入SO2、调整pH。
1.2 仪器与设备
DH6000B电热恒温培养箱:天津市泰斯特仪器有限公司;SW-CJ-1G超净工作台:上海苏净实业有限公司;RE-2000旋转蒸发器:上海洪旋实验仪器有限公司;WD-9402B/D非医用基因扩增仪:北京六一生物科技有限公司;HVE-50高压蒸汽灭菌锅:日本HIRAYAMA公司。
1.3 方法
1.3.1 酿酒酵母的分离
取新采摘的水晶葡萄约100 g,去梗粉碎后装入250 mL锥形瓶中,并加入60 mg/L的SO2混匀,置于室温条件下静置发酵。至锥形瓶底部沉降大量白色沉淀且有大量气泡生成时,取底部沉淀液1 mL进行梯度稀释,分别稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7,取200 μL10-5、10-6、10-7梯度稀释液均匀涂布于WL固体培养基,于28℃恒温培养箱中倒置培养2 d。挑取WL平板上圆隆、边缘整齐、稠厚、不透明、乳白色或略带绿色的疑似菌落,转接于WL斜面培养基中培养,编号,镜检,并保藏。
1.3.2 优良酿酒酵母的初筛
挑取少量上述斜面培养种子,转接于4 mL模拟葡萄汁培养基中,于28℃恒温培养箱中静置培养24 h。取1%液体种子,转接入10 mL含杜氏小管的模拟葡萄汁培养基中,28℃静置培养2 d,每株菌设定3个平行。期间记录各菌株的产气起始时间[13]、凝聚性能[13-14]、杜氏管充满气体时间[13-15]及发酵高峰持续时间[8]。将能在2 d内絮凝并产气充满杜氏管的菌株保藏,进行耐受性试验[13-16]。
1.3.3 优良酿酒酵母耐受性的测定
将初筛得到的菌株制备成模拟葡萄汁液体种子(约8.7×108CFU/mL),按1%(V/V)的接种量依次接种于不同糖浓度(10%、20%、30%、40%、50%及60%)、不同乙醇含量(10%vol、12%vol、14%vol、16%vol及18%vol)、不同SO2质量浓度(100 mg/L、150 mg/L、200 mg/L及300 mg/L)的模拟葡萄汁中,pH值控制在2.0,装液量为20 mL/50 mL试管,28℃静置培养2 d,期间记录酵母菌的生长及产气状况,有大量白色沉淀形成的表明生长旺盛,沉淀形成不明显的则采用菌落计数法观察,观察培养前后菌体数量变化。反应结束后各取200μL发酵液均匀涂布于WL固体培养基中,28℃静置培养2 d,观察各菌株在WL固体培养基中的生长情况[6]。综合评价分离菌株的耐受性,逐步筛选出糖、低pH值、酒精及SO2耐受性较高的优良酿酒酵母菌株[13]。
1.3.4 优良酿酒酵母的分子生物学鉴定
挑取斜面上的优良酵母菌种划线于WL平板,28℃静置培养36 h。以平板培养的单菌落为模板,酵母5.8S rDNA通用引物NL1和NL4为上下游引物进行菌落PCR扩增。PCR扩增体系:10 μ mol/L NL1 1 μL,10 μmol/L NL4 1 μL,2×PCR mix 25 μL,双蒸水(dd H2O)23 μL,无菌吸头沾取少许单菌落,混匀。PCR扩增条件:98℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃再延伸10 min。PCR扩增结束后,取5 μL反应液进行琼脂糖凝胶电泳验证,并将PCR反应液提交至上海生工生物工程有限公司进行测序。将5.8S rDNA测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST比对,并采用 MEGA 7.0软件的邻近法(neighbor joining,NJ)构建系统发育树,分析并确定酵母种类。
1.3.5 优良酿酒酵母的酿酒性能分析
将复筛得到的优良菌株和法国进口的LA-PE白葡萄酒酿酒酵母分别接种于100mL/250mL模拟葡萄汁培养基中,28℃静置培养48h制备液体种子。收集各发酵液,8000r/min离心2 min,弃上清液,沉淀用生理盐水洗涤3次,最后悬浮于10mL生理盐水中。将各菌种按1.0×108CFU/mL的浓度分别接种于7 L的水晶葡萄汁中(糖度用白砂糖调至25°Bx,pH用酒石酸调至3.3,SO2质量浓度为60 mg/L),装入10 L玻璃坛中水封发酵20d至产气结束。期间记录各坛产气时间、菌体絮凝时间、主发酵持续时间等。然后对酒液过滤,于5L玻璃坛中满坛陈酿30 d。参照周一琴等[17]的方法检测葡萄酒的澄清度、色泽。参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》检测各菌株发酵酒液的色度(OD520nm值)、酒精度、残糖、总酸及挥发酸的含量[13]。
2 结果与分析
2.1 酿酒酵母的分离结果
葡萄发酵液经梯度稀释和WL固体平板分离,共挑选出18株疑似酿酒酵母,编号为SJJM-1~SJJM-18。所有酵母菌菌落均呈乳白色(少数带浅绿色),生长前期,菌落圆隆光滑、后期高凸,稠厚不透明,酒香味明显,具有典型的酿酒酵母形态特征。其中菌株SJJM-7的菌落和细胞形态特征见图1。
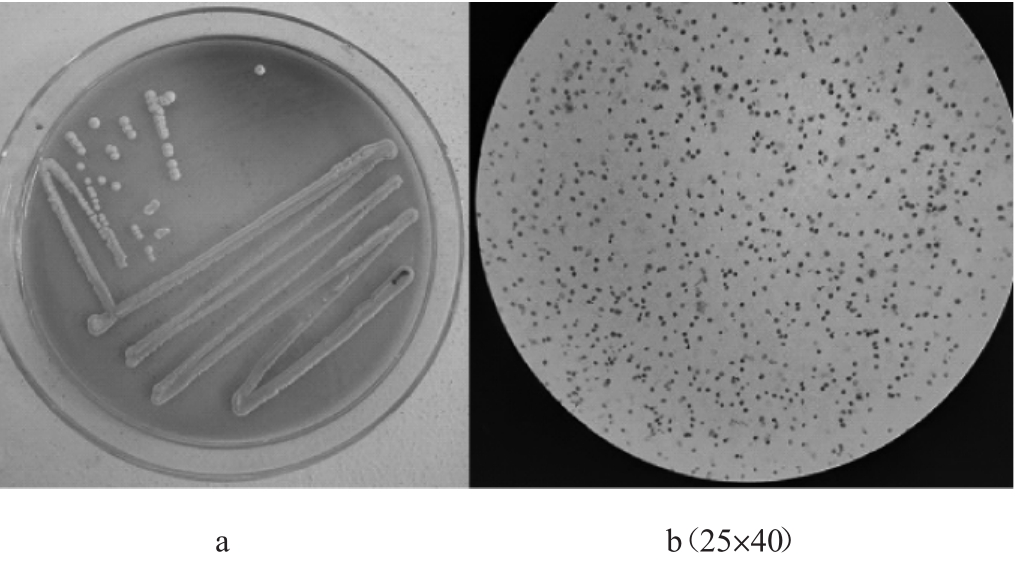
图1 菌株SJJM-7的菌落(a)和细胞(b)形态
Fig.1 Colony(a)and cell(b)morphology of strain SJJM-7
2.2 优良酿酒酵母的初筛
经杜氏管产气试验,检测各菌株的产气起始时间、杜氏管满气时间及菌体凝集性,并记录产气高峰持续时间,结果如表1所示。由表1可知,菌株SJJM-2、SJJM-5、SJJM-6、SJJM-7、SJJM-9、SJJM-10、SJJM-11、SJJM-17、SJJM-18凝聚性能最好,均在培养9 h内开始凝聚,并迅速在管底形成大量白色沉淀;菌株SJJM-7、SJJM-18的产气时间最早,培养4 h即开始产气;菌株SJJM-2、SJJM-5、SJJM-8、SJJM-10、SJJM-13和SJJM-18的发酵高峰持续时间最久,达3 d左右;菌株SJJM-7和SJJM-18发酵最为迅速,在发酵时间为16h时,气体充满杜氏小管。结合各菌株的凝聚性能、产气起始时间、小管满气时间及发酵高峰持续时间,选取菌株SJJM-2、SJJM-5、SJJM-6、SJJM-7、SJJM-8、SJJM-9、SJJM-10、SJJM-11、SJJM-13、SJJM-17和SJJM-18进行耐受性复筛试验。
表1 分离菌株的初筛结果
Table 1 Preliminary screening result of isolated strains
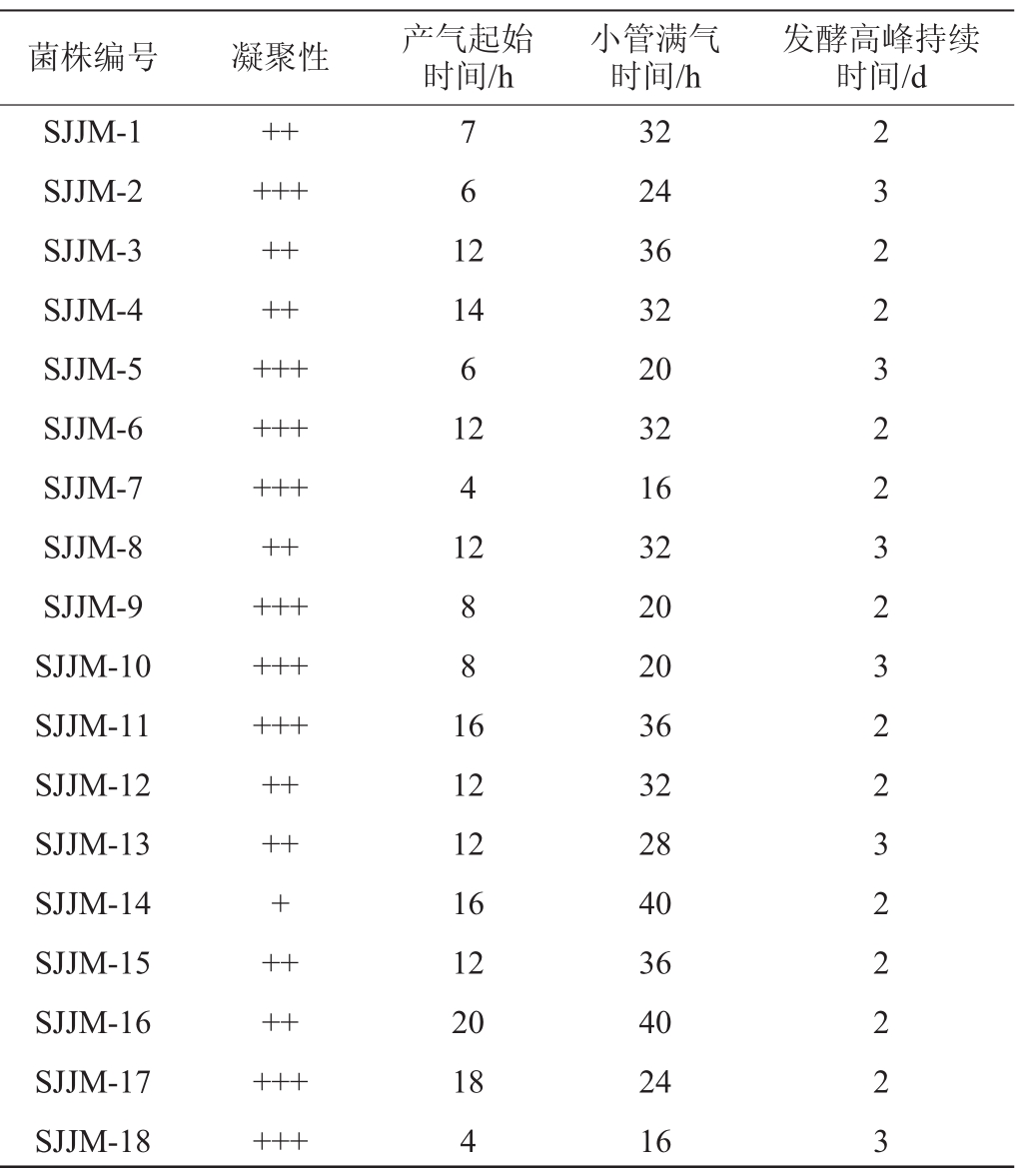
注:“+”表示凝聚性较差;“++”表示凝聚性一般;“+++”表示凝聚性较好。
菌株编号 凝聚性 产气起始时间/h小管满气时间/h发酵高峰持续时间/d SJJM-1 SJJM-2 SJJM-3 SJJM-4 SJJM-5 SJJM-6 SJJM-7 SJJM-8 SJJM-9 SJJM-10 SJJM-11 SJJM-12 SJJM-13 SJJM-14 SJJM-15 SJJM-16 SJJM-17 SJJM-18++++++++++++++++++++++++++++++++++++++++++++7 6 1 2 14 6 12 4 12 8 8 1 6 12 12 16 12 20 18 4 32 24 36 32 20 32 16 32 20 20 36 32 28 40 36 40 24 16 2 3 2 2 3 2 2 3 2 3 2 2 3 2 2 2 2 3
2.3 优良酿酒酵母复筛结果
2.3.1 糖耐受性试验结果
表2 分离菌株的糖耐受性试验结果
Table 2 Sugar tolerance test results of isolated strains

注:“+++”指产气旺盛或菌体生长多;“++”指产气较强或菌体生长一般;“+”指产气弱或菌体生长少;“-”指不产气或菌体减少;“--”指菌体明显减少。
菌株编号糖含量/%10产气生长 生长 生长 生长 生长+++++++++++++++++++++++++++++++++20产气30产气40产气50产气60产气生长SJJM-2 SJJM-5 SJJM-6 SJJM-7 SJJM-8 SJJM-9 SJJM-10 SJJM-11 SJJM-13 SJJM-17 SJJM-18+++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++ +- + - + + - - - +- + - + - + + - - - +- - - + - + + - - - +- - - - - - - ----- +
初筛菌株的糖耐受性试验结果如表2所示。由表2可知,所有菌株在含20%糖培养基中均能正常发酵,菌体数量增长明显;当糖含量增加至40%时,各菌株发酵产气速度迅速下降,菌体数量增长缓慢;当糖含量为60%时,只有菌株SJJM-7、SJJM-9、SJJM-10和SJJM-18能够发酵产气,但产气速率非常低,菌体数量变化不明显,其他菌株菌体浓度下降。与刘畅[18]报道的酿酒酵母只能耐受50%以下的糖含量相比,菌株SJJM-7、SJJM-9、SJJM-10和SJJM-18具有较高的糖耐受性。
2.3.2 pH耐受性试验结果
初筛菌株在pH为2.0的模拟葡萄汁培养基中的存活率如表3所示。由表3可知,初始菌株在pH 2.0的培养基中培养2 d后,菌株SJJM-2、SJJM-5、SJJM-7、SJJM-9及SJJM-18的存活率均>20%。与汤晓宏等[9]报道的葡萄酒野生酿酒酵母可耐受pH 2.5相比,这些菌株对较强酸性环境的抵抗力强,结合糖耐受性试验结果,选取菌株SJJM-2、SJJM-5、SJJM-7、SJJM-9及SJJM-18进行乙醇耐受性试验。
表3 分离菌株的pH耐性性试验结果
Table 3 pH tolerance test results of isolated strains
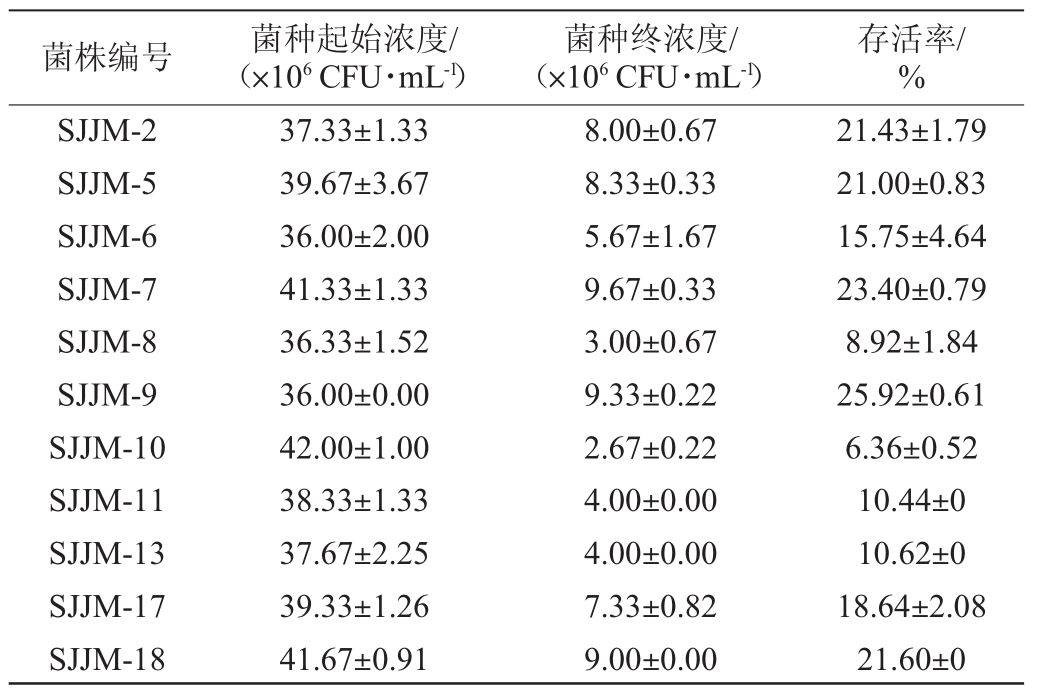
菌株编号 菌种起始浓度/(×106CFU·mL-1)菌种终浓度/(×106CFU·mL-1)存活率/%SJJM-2 SJJM-5 SJJM-6 SJJM-7 SJJM-8 SJJM-9 SJJM-10 SJJM-11 SJJM-13 SJJM-17 SJJM-18 37.33±1.33 39.67±3.67 36.00±2.00 41.33±1.33 36.33±1.52 36.00±0.00 42.00±1.00 38.33±1.33 37.67±2.25 39.33±1.26 41.67±0.91 8.00±0.67 8.33±0.33 5.67±1.67 9.67±0.33 3.00±0.67 9.33±0.22 2.67±0.22 4.00±0.00 4.00±0.00 7.33±0.82 9.00±0.00 21.43±1.79 21.00±0.83 15.75±4.64 23.40±0.79 8.92±1.84 25.92±0.61 6.36±0.52 10.44±0 10.62±0 18.64±2.08 21.60±0
2.3.3 乙醇耐受性试验结果
将菌株SJJM-2、SJJM-5、SJJM-7、SJJM-9及SJJM-18的液体种子分别接种于不同乙醇浓度(10%vol、12%vol、14%vol、16%vol和18%vol)的模拟葡萄汁培养基中培养2 d,观察菌种的生长和产气情况,结果如表4所示。由表4可知,所有菌株均能在乙醇含量为10%vol的培养基中生长、发酵产气;当乙醇浓度为12%vol时,所有菌株发酵产气均明显减弱,其中菌株SJJM-5停止发酵产气,菌体数量减少;乙醇浓度为14%vol时,除菌株SJJM-18少量产气外,其余菌株均停止发酵产气,菌体浓度降低明显;当乙醇浓度增加到16%vol时,所有菌株均停止产气,菌体浓度急剧减少甚至完全检测不到。与汤晓宏等[9,19]报道的野生酿酒酵母的乙醇耐受性相比,这些菌株的乙醇耐受性较低,满足酿造要求还有一定的差距,后期可对其进行进一步驯化和培育,使其满足酿造较高酒精度葡萄酒的条件。
表4 分离菌株的乙醇耐受性试验结果
Table 4 Ethanol tolerance test results of isolated strains
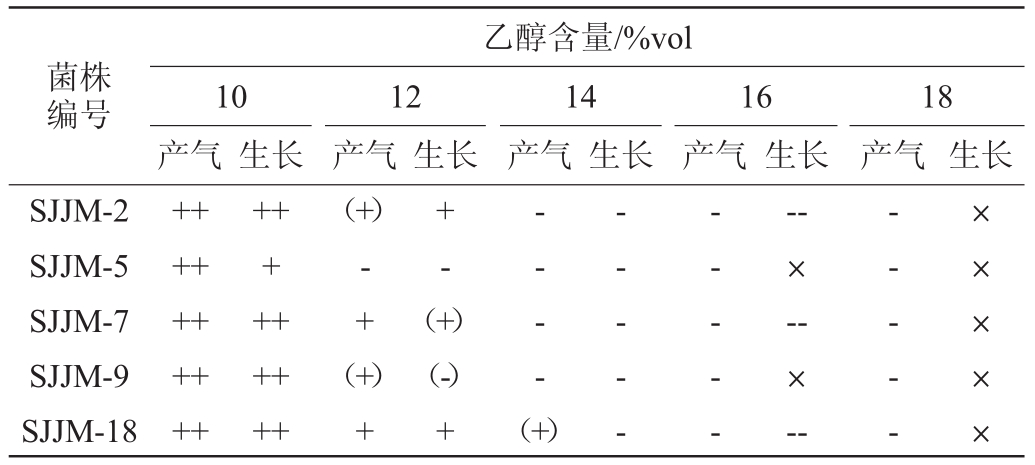
注:“++”指产气或生长旺盛;“+”指产气或生长较少;“(+)”指微量产气或生长;“(-)”指菌体浓度少量减少;“-”指停止产气或菌体浓度显著减少;“--”指菌体浓度减少较多;“×”指无活菌体。
菌株编号乙醇含量/%vol 10产气 生长 生长 生长 生长+++++++++12产气14产气16产气18产气 生长SJJM-2 SJJM-5 SJJM-7 SJJM-9 SJJM-18++++++++++(+)- ++-(+)+(+)(-)+- - - -(+)- - - - -- - - - ---×--×--- - - - -×××××
2.3.4 SO2耐受性试验结果
由乙醇耐受性试验结果可知,菌株SJJM-2、SJJM-7和SJJM-18有较强的乙醇耐受性,因此,对这3株菌株的SO2耐受性进行测定,结果如表5所示。由表5可知,3株菌对SO2均有较高的耐受性,在SO2含量为200mg/L的培养基中仍能保持微弱的发酵和生长。其中,菌株SJJM-7对SO2的耐受性最强,能在SO2含量为300 mg/L的发酵培养基中生长,且能产生少量气泡。
表5 分离菌株的SO2耐受性试验结果
Table 5 SO2tolerance test results of isolated strains

注:“++”指产气或生长旺盛;“+”指产气或生长较少;“(+)”指微量产气或生长;“(-)”指菌体浓度少量减少;“-”指停止产气或菌体浓度显著减少。
菌株编号SO2含量/(mg·L-1)100产气 生长 生长 生长++++++150产气200产气300产气 生长SJJM-2 SJJM-7 SJJM-18++++++++++-+++(+)+(+)(+)+(+)(+)-(-)+(-)
结合初筛和耐受性试验结果可知,菌株SJJM-7和SJJM-18具良好的凝聚性、较早的发酵产气时间、较强的产气能力和较强的耐受性,为优良酿酒酵母,在葡萄酒发酵应用中具有一定潜力。
2.4 优良酿酒酵母的分子生物学鉴定结果
以菌株SJJM-7和SJJM-18的单菌落为模板,以引物NL1和NL4为上下游引物,进行菌落PCR扩增,PCR扩增产物送去测序。测序结果经BLAST比对后发现,菌株SJJM-7和SJJM-18的5.8S rDNA序列与酿酒酵母(Saccharomyces cerevisiae)YLL20等菌株的相似性>99%。选取同源性较高的模式菌株的5.8S rDNA序列,采用NJ法构建系统发育树,结果如图2所示。由图2可知,菌株SJJM-7和SJJM-18与酿酒酵母(Saccharomyces cerevisiae)聚于一支,亲缘关系最近。结合菌株在WL培养基中的菌落特征,鉴定菌株SJJM-7和SJJM-18均为酿酒酵母(Saccharomyces cerevisiae)。

图2 基于5.8S rDNA序列菌株SJJM-7和SJJM-18的系统发育树
Fig.2 Phylogenetic tree of strain SJJM-7 and SJJM-18 based on 5.8S rDNA sequences
2.5 优良酿酒酵母酿酒性能试验结果
将菌株SJJM-7、SJJM-18及LA-PE分别接种于水晶葡萄汁中,经20 d主发酵、30 d陈酿后,检测葡萄酒的澄清度、色度、色泽、酒精度、残糖、总酸及挥发酸的含量,结果如表6所示。由表6可知,菌株SJJM-7、SJJM-18发酵的葡萄酒在澄清度、挥发酸、残糖含量及酒精度等方面优于菌株LA-PE,更适合本地的水晶葡萄酒的酿制。菌株SJJM-7、SJJM-18发酵的葡萄酒的挥发酸、残糖量、酒精度均符合GB 15037—2006《葡萄酒》(挥发酸≤1.2g/L;残糖量≤4.0 g/L;酒精度≥7.0%vol)要求。SJJM-7和SJJM-18组的残糖量均≤4.0 g/L,适合酿制干白葡萄酒(残糖量≤4.0 g/L)。
表6 优良酿酒酵母酿酒性能的测定结果
Table 6 Determination results of enological characteristics for excellentSaccharomyces cerevisiae
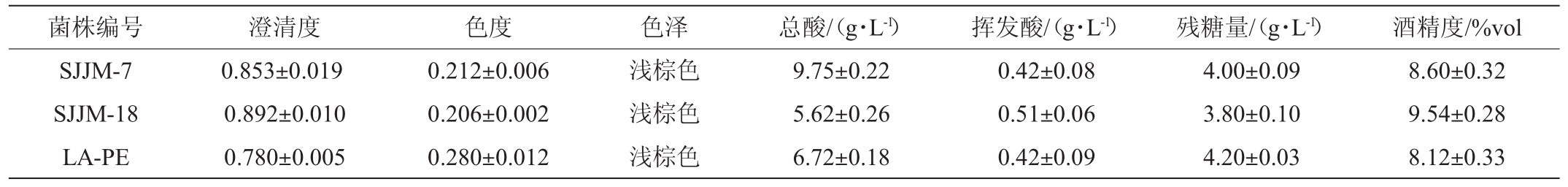
菌株编号澄清度色度色泽总酸/(g·L-1)挥发酸/(g·L-1)残糖量/(g·L-1)酒精度/%vol SJJM-7 SJJM-18 LA-PE 0.853±0.019 0.892±0.010 0.780±0.005 0.212±0.006 0.206±0.002 0.280±0.012浅棕色浅棕色浅棕色9.75±0.22 5.62±0.26 6.72±0.18 0.42±0.08 0.51±0.06 0.42±0.09 4.00±0.09 3.80±0.10 4.20±0.03 8.60±0.32 9.54±0.28 8.12±0.33
3 结论
本研究以贵州省所产的水晶葡萄为原料,分离筛选出两株性能优良的酵母,分别命名为SJJM-7和SJJM-18。两株酵母均具有良好的凝聚性,发酵启动早,产气速度快且发酵高峰持续时间久。耐受性试验结果表明,菌株SJJM-7和SJJM-18均能耐受50%的高糖模拟葡萄汁培养基;能耐受pH为2.0的模拟葡萄汁培养基,发酵2 d后菌体存活率均>20%;乙醇耐受性强,能耐受12%vol的乙醇;能耐受高浓度的SO2,其中菌株SJJM-7能在含300 mg/L SO2的培养基中生长、产气。经分子生物学鉴定后,这两株菌均被鉴定为酿酒酵母(Saccharomyces cerevisiae)。利用这两株菌株发酵水晶葡萄汁后,菌株SJJM-7和SJJM-18的酿酒性能优于进口商品酵母菌株LA-PE。结果表明,菌株SJJM-7和SJJM-18在生产水晶葡萄酒方面具有一定的研究意义和应用价值。
[1]唐冬梅.贵州省水晶葡萄产业发展现状及建议[J].河北林业科技,2015,1(4):112-114.
[2]刘岳.优良酿酒酵母菌的发酵性能分析[J].佳木斯职业学院学报,2016,1(5):423-424.
[3]程仕伟,屈慧鸽,栾丽英,等.新疆霞多丽自然发酵醪中本土酿酒酵母的选育与发酵特性[J].中国食品学报,2017,17(8):119-125.
[4]刘小珍,张汉尧.昆明葡萄酒相关酵母菌的分离与鉴定[J].西北农林科技大学学报(自然科学版),2014,42(5):135-140.
[5]李慧,王惠玲,吴雅琨,等.天然葡萄酒酵母菌种的分离、鉴定和酿造性能评价[J].食品与发酵工业,2010,36(11):14-20.
[6]庞红勋,崔艳,刘金福,等.本土葡萄酒酵母的选育及发酵性能[J].食品研究与开发,2010,31(6):169-174.
[7]SANTAMARFA P,LQPEZ R,LQPEZ E,et al.Permanence of yeast inocula in the winery ecosystem and presence in spontaneous fermentations[J].Eur Food Res Technol,2008,227(5):1563-1567.
[8]汤晓宏.蓬莱葡萄酒产区酿酒酵母的选育[D].济南:齐鲁工业大学,2014.
[9]汤晓宏,胡文效,魏彦锋,等.葡萄酒野生酿酒酵母的筛选及其生物特性的研究[J].山东大学学报(理学版),2014,49(3):12-21.
[10]庞红勋.本土葡萄酒酵母的选育及低醇葡萄酒的酿造[D].石河子:石河子大学,2010.
[11]高晓航.贺兰山产区葡萄酒酵母的分离、主要特性研究及其选育[D].兰州:兰州理工大学,2016.
[12]BELL P J L,HIGGINS V J.Comparison of fermentative capacities of industrial baking and wild-type yeasts of the speciesSaccharomyces cerevisiaein different sugar media[J].Lett Appl Microbiol,2001,32(4):224-229.
[13]程雷.葡萄自然发酵过程中酵母的分离鉴定及优良葡萄酒酵母筛选[D].哈尔滨:东北林业大学,2010.
[14]王英,周剑忠,朱佳娜,等.蓝莓自然发酵酒中优良酵母菌的筛选及鉴定[J].中国食品学报,2013,13(4):202-206.
[15]张丽珠,邢亚阁,许青莲,等.川藏高原威代尔冰葡萄中酵母菌的分离、筛选及其耐受性研究[J].中国酿造,2013,32(10):94-97.
[16]徐清萍,朱广存.野生猕猴桃果酒酵母的筛选鉴定及耐受性的研究[J].中国酿造,2011,30(7):120-123.
[17]周一琴,罗安伟,刘兴华,等.猕猴桃酒天然优良酵母的筛选[J].中国酿造,2008,27(1):63-65.
[18]刘畅.耐高温酵母菌的筛选及特性研究[J].酿酒,2007,34(2):52-54.
[19]李筝,韩北忠,陈晶瑜,等.优良酿酒酵母菌的发酵性能研究[J].中国酿造,2008,27(19):10-12.
[20]凌云.昌黎葡萄酒产区酿酒葡萄果表酵母菌的分离及发酵性能[D].杨凌:西北农林科技大学,2015.