河南的张弓老酒是北方浓香型“黄淮酒”的代表之一,以浓香、味醇而闻名;其风格既有北方浓香型白酒醇厚丰满、绵柔爽净的共性,也有低度酒独特的低而不淡,高度酒高而不暴的特性[1]。大曲是大曲酒生产酿造所需的重要物质,是酿酒生产过程中的糖化、发酵、酒化和生香剂[2]。大曲酶系主要由糖化酶、液化酶、脂肪酶等组成,酿酒的出酒率和成品酒的质量与这些酶系有着很大的关系[3-4]。
脂肪酶是一类酰基水解酶,主要水解甘油和不同长度的脂肪酸形成的甘油三酯,生成脂肪酸、甘油和甘油单酯[5]。脂肪酶在白酒制曲和发酵期间,可以水解原料中所含的脂肪,使淀粉充分接触酵母,促进发酵代谢进程;同时产生有机酸和甘油,有机酸可使酒出现甜味和回甜感,甘油可以增加白酒的醇和度;脂肪酶同时还可以催化有机酸与大量存在的乙醇生成乙酸乙酯、己酸乙酯等酯类香味物质[6],提高白酒中酯类香味物质的含量,明显提高优质酒品率[7]。
关于脂肪酶的研究大部分研究是从富含油脂的土壤或污水中筛选出高产脂肪酶的菌株[8],而从白酒大曲中筛选高产脂肪酶菌株的研究较少,且较少涉及产酶条件优化。本研究从张弓老酒大曲中分离筛选出产脂肪酶活力较高的菌株,并对其产酶条件进行优化,为提高白酒出酒率和改善白酒品质提供理论依据。
1 材料与方法
1.1 材料与试剂
样品:张弓老酒大曲。
筛选培养基[9]:添加1%的三丁酸甘油酯和0.05%的罗丹明B(筛选培养基于121℃灭菌30 min)的营养琼脂培养基。
液体种子培养基[9]:营养肉汤培养基。
摇瓶发酵培养基[10]:酵母膏0.5%,(NH4)2SO40.5%,KH2PO40.2%,NaCl 0.3%,MgSO4·7H2O 0.05%,橄榄油2%(V/V),pH7.0。
罗丹明B(分析纯)、三丁酸甘油酯(分析纯):合肥博美生物科技有限责任公司;柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:天根生化科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
LQZ-211恒温培养摇床:上海知楚仪器有限公司;DNP-9272BS-Ⅲ电热恒温培养箱:上海新苗医疗器械制造有限公司;LDZX-50KBS立式高压灭菌器:上海申安医疗机械厂;HH-6数显恒温水浴锅:方科仪器(常州)有限公司;SW-CJ-2F型双人双面净化工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 脂肪酶产生菌的分离
无菌条件下称取5 g样品放入盛有45 mL无菌水的三角瓶(瓶内预置适当数量的玻璃珠)放入摇床,室温条件下180 r/min振荡打散30 min后取出静置30 min[11],制成1∶10的均匀稀释液。吸取1 mL菌悬液,注入含有9 mL无菌水的试管内,振摇试管20 s使管内溶液混匀,制成1∶100的稀释液,同样方法配制成稀释度为10-3、10-4、10-5、10-6菌悬液。各取0.1 mL涂布于筛选培养基平板上,倒置,于37℃恒温培养箱中培养24~48 h[9]。观察菌落周围有无透明圈出现,将有透明圈产生的菌落挑出并纯化至纯种,于4℃冰箱斜面保存。
1.3.2脂肪酶产生菌的筛选
(1)脂肪酶产生菌的初筛
将斜面上的菌株接种于筛选培养基平板上,37℃培养24~72 h。记录产透明圈的菌株,通过比较透明圈直径(D)和菌落直径(d)的比值,初步判断产酶活力大小[12]。
(2)脂肪酶产生菌的复筛
挑取培养成熟的菌种于液体种子培养基中,37℃、150 r/min条件下振荡培养12 h,按2%(V/V)的接种量接入摇瓶发酵培养基中继续振荡培养24 h。取一定量的发酵液到离心管中,4℃、8 000 r/min条件下离心10 min,离心后取上清液即为粗酶液进行酶活测定[13],进一步确定高产菌株。
(3)脂肪酶活力测定
将培养24 h的菌液依据GB/T 23535—2009《脂肪酶制剂》进行测定:将40 g/L的聚乙烯醇溶液与橄榄油以3∶1(V/V)混合,超声处理6 min[14],制成乳白色的聚乙烯醇(polyvinyl alcohol,PVA)乳化液,即为底物溶液。取该底物溶液4 mL,磷酸缓冲盐溶液5 mL,构成反应体系,于40℃水浴中预热5 min后加入1 mL粗酶液,立即混匀计时,继续保温反应15 min后,加入15 mL体积分数为95%的乙醇终止反应。空白对照则在加入15 mL 95%乙醇后进行预热处理,然后加入粗酶液反应15 min。之后采用0.05 mol/L的NaOH标准溶液分别滴定酶作用后的底物溶液和空白对照,根据消耗的碱量计算其酶活力。
脂肪酶酶活单位定义为:在pH7.5,40℃条件下,每分钟产生1 μmol可滴定脂肪酸所需的酶量为1个酶活力单位(U/mL)。
1.3.3 产脂肪酶菌株的鉴定
(1)菌落形态与生理生化特征
对筛选的菌株进行形态学观察和革兰氏染色,进行初步鉴定,生理生化试验参照文献[15]进行。
(2)菌株的分子生物学鉴定
16S rDNA序列分析[16]:采用细菌基因组DNA提取试剂盒(TIANGEN)提取分离菌株的DNA作为聚合酶链式反应(polymerase chain reaction,PCR)的模板。采用通用引物27F(5′-AGAGTTTCATCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增细菌基因组DNA中的16S rDNA基因。PCR扩增体系:5 μL 10×buffer、4 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)、3 μL模板DNA、0.25 μLTaqDNA聚合酶(5 U/L)、1 μL引物(10 mmol/L),补充无菌超纯水至50 μL。PCR扩增条件:95℃预变性10 min;95℃变性45 s,55℃复性45 s,72℃延伸60 s,30个循环;72℃延伸10 min。PCR过程中阴性对照以去离子水为模板。取3 μL PCR产物经1%琼脂糖凝胶电泳检测产量和特异性,将PCR产物送至上海生工生物有限公司进行测序,将测序所得到的特定序列,在美国国立生物技术信息中心(national center for biotechnology information,NCBI)上通过BLAST程序进行同源性比较与分析。
1.3.4 产酶条件优化[17-19]
(1)单因素试验
以摇瓶发酵培养基为基础,分别考察不同接种量(1%、2%、3%、4%、5%)、不同碳源(蔗糖、葡萄糖、糊精、可溶性淀粉)及碳源含量(1%、2%、3%、4%、5%)、不同氮源(蛋白胨、豆粕粉、酵母浸粉、尿素)及氮源含量(1%、2%、3%、4%、5%)、不同初始pH值(5、6、7、8、9)对脂肪酶活力的影响,每组各做3个平行,菌株在发酵培养基中于37℃、150 r/min振荡培养24 h后将发酵液以4℃、8 000 r/min离心10 min,取上清液测定脂肪酶活力。
(2)响应面优化试验
在前期单因素试验的基础上,选取3个相关影响因素,以酶活力为因变量,利用Design Expert 8.0.6软件设计Box-Behnken试验,确定高产脂肪酶菌株的最佳发酵工艺参数组合并进行验证试验[20-24]。
2 结果与分析
2.1 产脂肪酶菌株的分离和筛选
通过罗丹明B平板法从张弓老酒大曲中筛选了266株产脂肪酶的菌株。经过初筛(透明圈与菌落直径之比≥3.0)得到了12株产脂肪酶能力较好的菌株,进一步检测其产酶活力,测定结果如表1所示。由表1可知,菌株E-11的酶活最高为12.25 U/mL,后续试验将选取产脂肪酶能力最强的菌株E-11为目的菌株。
表1 产脂肪酶菌株筛选结果
Table 1 Screening results of lipase-producing strains

菌株编号透明圈与菌落直径之比脂肪酶活力/(U·mL-1)D-29 E-11 E-15 E-22 F-7 F-9 F-11 F-12 F-17 F-18 F-20 F-22 3.5 4.3 3.8 3.0 3.4 3.3 3.5 3.5 3.1 3.2 3.0 3.5 8.33 12.25 10.29 6.37 8.58 6.13 10.58 10.09 7.35 7.35 6.13 9.80
2.2 产脂肪酶菌株的鉴定
2.2.1 菌落形态与生理生化特征
菌株E-11在营养琼脂平板上37℃培养48 h,E-11菌落呈白色,前期表面光滑,后期表面粗糙有隆起、褶皱,边缘不整齐,具腥臭味。其细胞形态见图1。由图1可知,细胞呈杆状,是革兰氏阳性(G+)菌。菌株E-11的生理生化特征如表2,根据形态和生理生化特征,参照《伯杰氏细菌鉴定手册》[25]可初步确定菌株E-11属于芽孢杆菌属(Bacillus)。2.2.2分子生物学鉴定
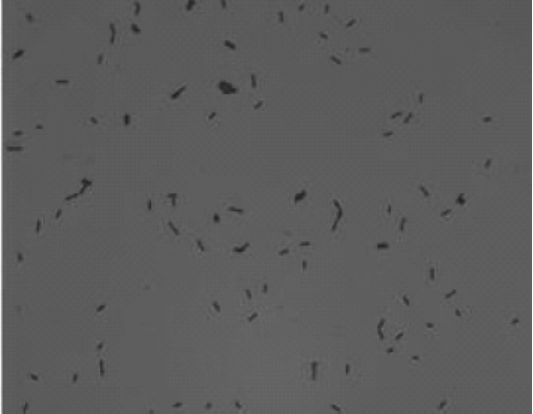
图1 菌株E-11的细胞形态
Fig.1 Cell morphology of strain E-11
表2 菌株E-11的生理生化检测结果
Table 2 Physiological and biochemical determination results of strain E-11
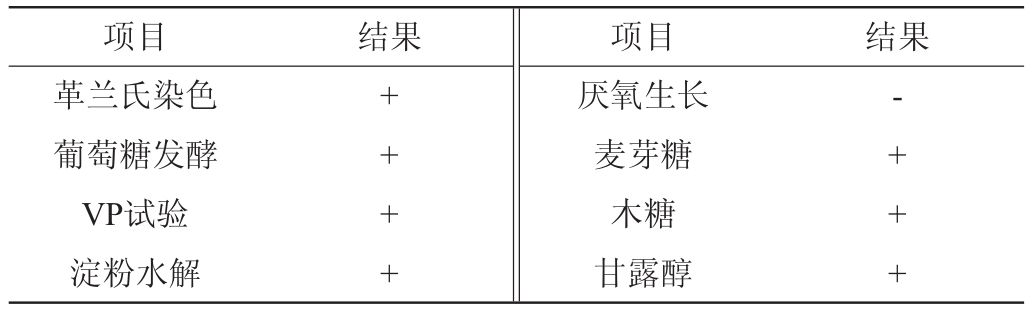
注:“+”为阳性;“-”为阴性。
项目 结果 项目 结果革兰氏染色葡萄糖发酵VP试验淀粉水解++++厌氧生长麦芽糖木糖甘露醇- + + +
以E-11菌株的DNA为模板,PCR扩增菌株的16S rDNA基因,得到的序列碱基长约1490bp。经Blast分析,与GenBank中BacillussubtilisDP12 HQ536001.1的同源性为99%。构建系统发育树见图2。由图2可知,菌株E-11与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近。结合生理生化试验可确定该菌株为枯草芽孢杆菌(Bacillus subtilis)。

图2 菌株E-11基于16S rDNA序列的系统发育树
Fig.2 Phylogenetic tree of strain E-11 based on 16S rDNA sequences
2.3 产酶条件优化
2.3.1 产脂肪酶条件优化单因素试验结果
(1)不同接种量对脂肪酶活力的影响
不同接种量对脂肪酶活力的影响见图3。由图3可知,接种量<2%之前,随着接种量的增加脂肪酶活力不断升高,接种量为2%时,酶活力最高,达到11.38 U/mL,接种量>2%之后,随着接种量的增加,酶活力不断降低。因此,该菌发酵培养时最佳接种量为2%。
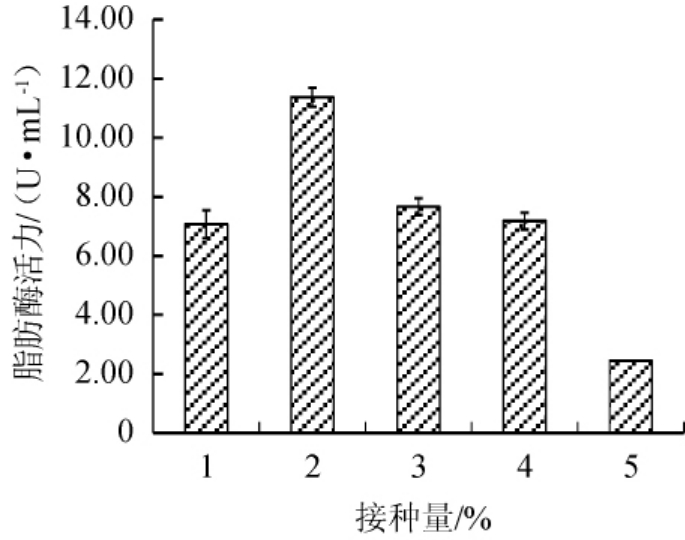
图3 不同接种量对脂肪酶活力的影响
Fig.3 Effect of different inoculum on lipase activity
(2)不同碳源及最适碳源添加量对脂肪酶活力的影响
不同碳源对脂肪酶活力的影响见图4。由图4可知,以葡萄糖为碳源时,酶活力最高,达到12.98 U/mL。表明葡萄糖是最佳碳源。以葡萄糖作为唯一碳源进行发酵,不同葡萄糖添加量对脂肪酶活力的影响见图5。由图5可知,随着葡萄糖添加量的增加,脂肪酶活力也呈现增加的趋势。当葡萄糖添加量为3%时,脂肪酶的酶活力达到最高为10.8 U/mL。当葡萄糖添加量继续增加时,酶活力呈下降趋势。因此,发酵培养时最佳葡萄糖添加量为3%。
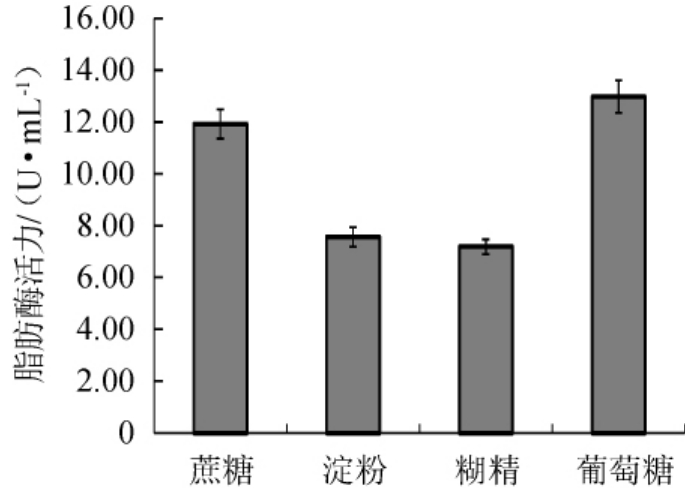
图4 不同碳源对脂肪酶活力的影响
Fig.4 Effect of different carbon sources on lipase activity
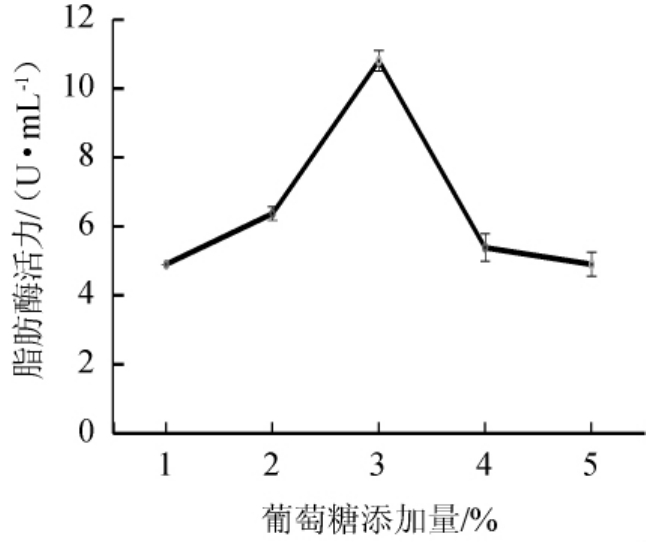
图5 不同葡萄糖添加量对脂肪酶活力影响
Fig.5 Effect of different glucose concentration on lipase activity
(3)不同氮源及最适氮源添加量对脂肪酶活力的影响
不同氮源对脂肪酶活力的影响见图6。由图6可知,以蛋白胨为氮源时,酶活力最高,达到12.34 U/mL。表明蛋白胨是最佳氮源。以蛋白胨作为唯一氮源进行发酵,不同蛋白胨添加量对脂肪酶活力的影响见图7。由图7可知,当蛋白胨添加量为1%~4%时,随着蛋白胨添加量的增加,脂肪酶活力也呈现增加的趋势。当蛋白胨添加量为4%时,脂肪酶的酶活力达到最高为13.23 U/mL。当蛋白胨添加量继续增加时,酶活力呈下降趋势。因此,发酵培养时最佳蛋白胨添加量为4%。
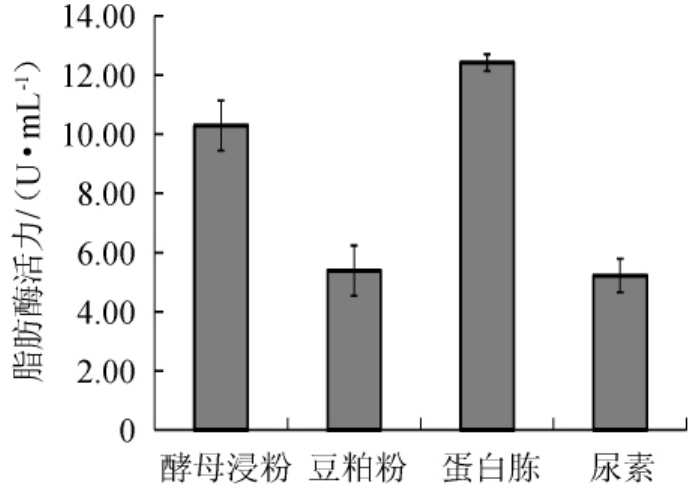
图6 不同氮源对脂肪酶活力的影响
Fig.6 Effect of different nitrogen sources on lipase activity

图7 不同蛋白胨含量对脂肪酶活力影响
Fig.7 Effect of peptone concentration on lipase activity
(4)不同初始pH值对脂肪酶活力的影响
不同初始pH值对脂肪酶活力的影响结果见图8。由图8可知,当初始pH值<8之前,随着初始pH值逐渐升高,酶活力也呈增长趋势,当初始pH值为8时,酶活力最高,达到11.60 U/mL,当初始pH值继续升高时,酶活力开始下降。表明最佳初始pH值为8。
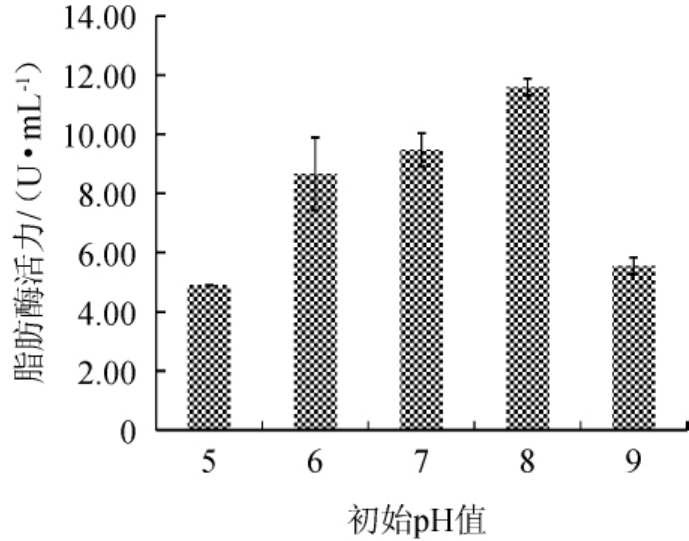
图8 不同初始pH值对脂肪酶活力的影响
Fig.8 Effect of different initial pH on lipase activity
2.3.2 发酵条件优化响应面试验结果与分析
(1)Box-Behnken设计与结果
根据Box-Behnken试验设计原理,设计了17个试验点的响应面分析试验,以脂肪酶酶活(Y)作为响应值,选取葡萄糖含量、蛋白胨含量、初始pH值三个具有显著影响的因素作为自变量,试验设计与结果见表3。采用Design Expert 8.0.5软件对表3数据进行多元二次回归拟合,得到酶活对自变量葡萄糖添加量、蛋白胨添加量、初始pH值的多元回归方程为:
Y=-449.083 25+19.018 50A+29.095 50B+94.081 00C-0.702 50AB-0.56250AC+0.147 50BC-1.892 25A2-3.432 25B2-5.847 25C2
回归方程的方差分析结果见表4。由表4可知,葡萄糖添加量、蛋白胨添加量、初始pH值以及这三个因素之间的交互作用都对结果影响不显著(P>0.05),A2对结果影响显著(P<0.05),B2和C2对结果影响极显著(P<0.01),整个模型极显著,回归模型F值为9.85,且显著性检验为极显著(P=0.003 2),失拟项不显著(P=0.580 9>0.05),说明该模型与实际情况拟合良好。
表3 Box-Behnken试验设计与结果
Table 3 Design and results of Box-Behnken experiments
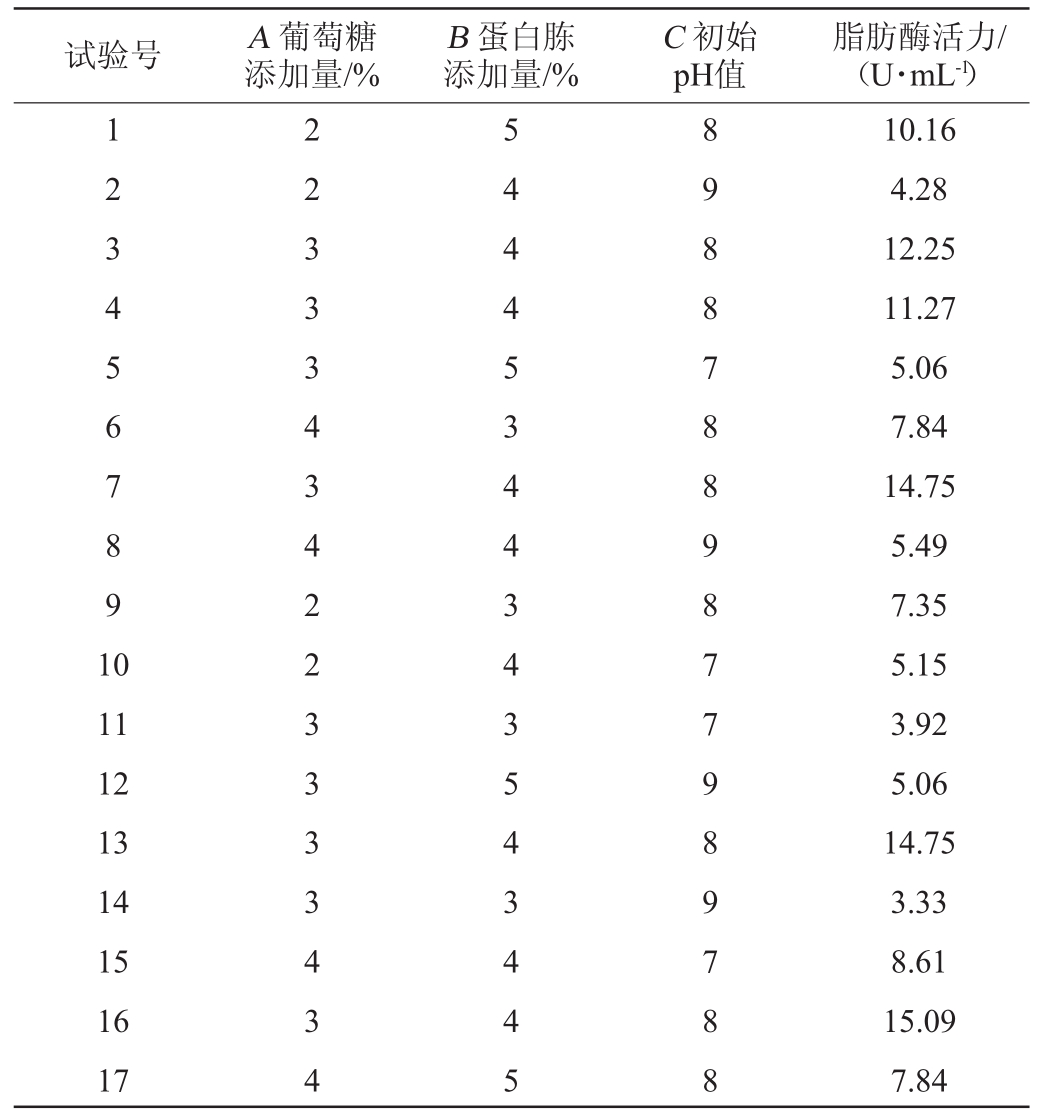
试验号 A葡萄糖添加量/%B蛋白胨添加量/%C初始pH值脂肪酶活力/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 2 2 3 3 3 4 3 4 2 2 3 3 3 3 4 3 4 5 4 4 4 5 3 4 4 3 4 3 5 4 3 4 4 5 8 9 8 8 7 8 8 9 8 7 7 9 8 9 7 8 8 10.16 4.28 12.25 11.27 5.06 7.84 14.75 5.49 7.35 5.15 3.92 5.06 14.75 3.33 8.61 15.09 7.84
表4 响应面试验结果方差分析Table 4 Variance analysis of response surface methodology
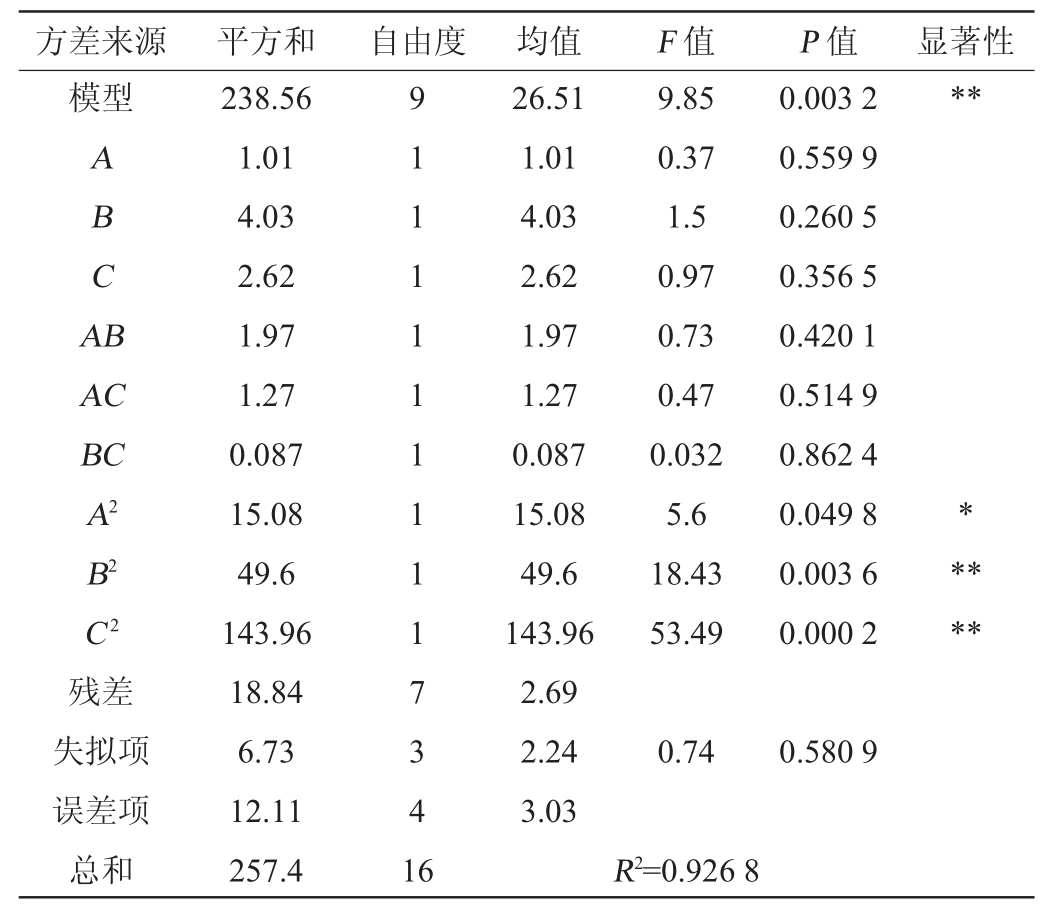
注:“**”表示对结果影响差异极显著,P<0.01;“*”表示对结果影响差异显著,P<0.05。
方差来源 平方和 自由度 均值 F值 P值 显著性模型**ABCA B AC BC A2 B2 C2 9.85 0.37 1.5 0.97 0.73 0.47 0.032 5.6 18.43 53.49 0.003 2 0.559 9 0.260 5 0.356 5 0.420 1 0.514 9 0.862 4 0.049 8 0.003 6 0.000 2*****残差失拟项误差项总和238.56 1.01 4.03 2.62 1.97 1.27 0.087 15.08 49.6 143.96 18.84 6.73 12.11 257.4 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 26.51 1.01 4.03 2.62 1.97 1.27 0.087 15.08 49.6 143.96 2.69 2.24 3.03 0.740.580 9 R2=0.926 8
回归方程决定系数(R2)=0.926 8,表明92.68%的酶活变化可由此模型解释,与实际情况拟合良好。该方程为菌株E-11发酵产脂肪酶提供了一个合适的模型,因此可用上述模型代替真实试验点对脂肪酶发酵进行分析和预测。
(2)各因素交互作用的响应面图
利用Design-Expert 8.0.6软件对二次响应面回归模型做出相应的响应曲面,结果见图9。由回归模型绘制的响应面图(图9)所示,回归模型存在稳定点为A=2.662,B=3.692,C=8.505,对应的实际取值为A=3,B=4,C=8。并根据实际操作条件优化,得最佳发酵条件为葡萄糖含量3%,蛋白胨含量4%,初始pH值8,在此条件下理论预测最大酶活为13.62 U/mL,实际值为15.09 U/mL。与预测值基本接近,说明所建模型拟合良好且可靠。3结论
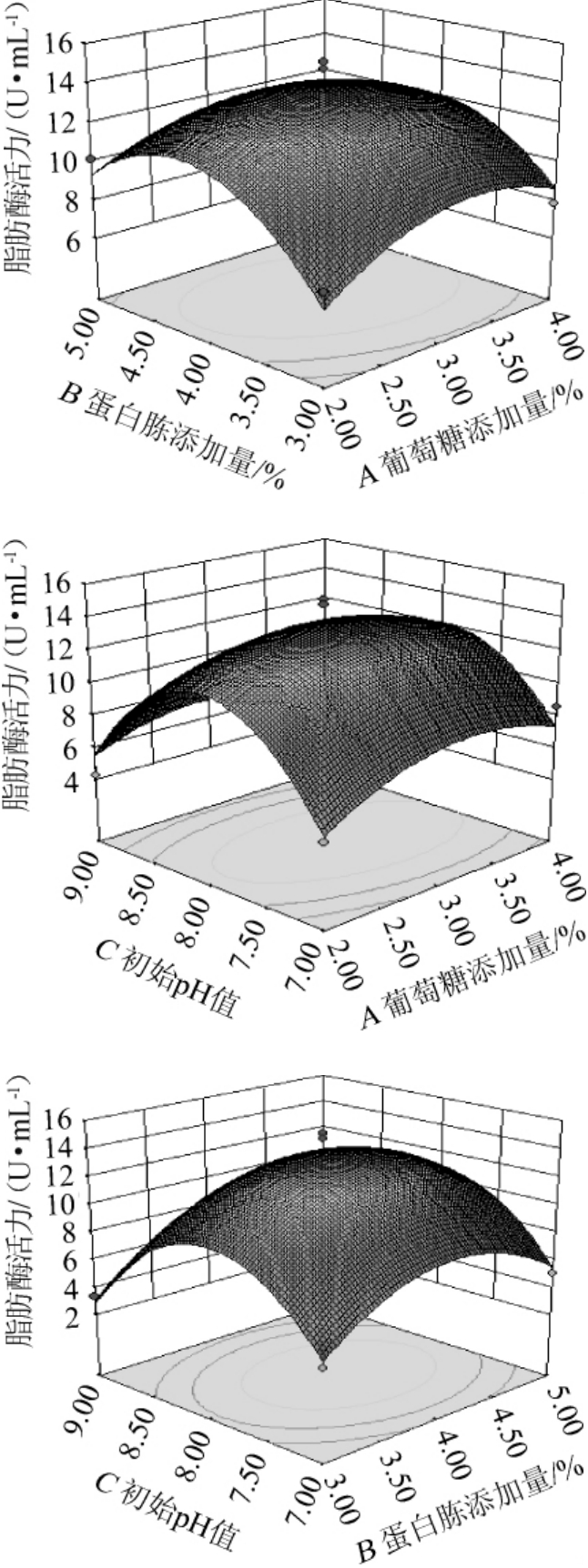
图9 各因素交互作用对脂肪酶活力影响的响应面和等高线
Fig.9 Response surface plots and contour lines of effects of interaction between each factors on lipase activity
本研究通过罗丹明B平板法和脂肪酶活力测定从张弓老酒大曲中分离筛选出一株脂肪酶高产菌E-11,经形态学、生理生化试验和16S rDNA序列分析,鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis),通过单因素和响应面法试验设计对该菌株的产酶条件进行优化,优化后的最佳产酶条件为:葡萄糖添加量3%,蛋白胨添加量4%,初始pH值为8。本研究将响应面分析法应用到脂肪酶发酵的优化过程中,并且得到了较好的结果。在单因素试验基础上,通过响应面Box-Benhnken试验设计,建立了脂肪酶酶活的二次多项式数学模型。优化后的脂肪酶活力达15.09 U/mL,是优化前产酶能力的1.2倍。并对该优化条件进行了试验验证,与响应面试验结果相符,说明该模型稳定可行,且此方法具有实用性强、操作简单的特点。本研究首次从张弓老酒大曲中分离得到产脂肪酶较高的枯草芽孢杆菌,为提高脂肪酶产量进而增香酒品提供了理论依据。
[1]曹静,余有贵,曹智华,等.中国复合香型白酒研究进展[J].食品与机械,2017,33(7):200-204,209.
[2]JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trend Food Sci Technol,2017,63:18-28.
[3]张志刚,吴生文,陈飞.大曲酶系在白酒生产中的研究现状及发展方向[J].中国酿造,2011,30(1):13-16.
[4]魏婷婷,周桂旭,石亚伟.发酵大豆中产碱性蛋白酶菌株鉴定及其部分酶学性质研究[J].山西大学学报(自然科学版),2019,42(1):231-239.
[5]ECKEL R H.Lipoprotein lipase[J].New England J Med,1989,320(16):1060-1068.
[6]胡国华.食品添加剂使用技术[M].北京:化学工业出版社,2012:11.
[7]庄名扬.中国白酒香味物质形成机理及酿酒工艺的调控[J].酿酒,2007(2):109-113.
[8]徐伟芳,黄涛杨,周敏,等.一株脂肪酶产生菌的筛选鉴定及其酶学性质研究[J].西南大学学报(自然科学版),2017,39(5):62-69.
[9]翟磊,信春晖,许玲,等.芝麻香型白酒高温大曲产脂肪酶菌株的筛选与鉴定[J].食品与发酵工业,2015,41(12):36-39.
[10]王春雨,迟乃玉,张庆芳.产低温脂肪酶菌株的筛选、纯化及其部分酶学性质研究[J].中国酿造,2012,31(11):33-37.
[11]刘阳,薛正莲,黄祖耀,等.中高温大曲中产酯酶细菌的筛选[J].中国酿造,2012,31(8):99-102.
[12]邬敏辰,孙崇荣,邬显章.平板扩散法粗略确定碱性脂肪酶的活性[J].无锡轻工大学学报,2000(2):168-172.
[13]胡珺,杜新凯,王常高,等.产脂肪酶菌株的筛选鉴定及产酶条件优化[J].中国酿造,2016,35(11):39-43.
[14]孟玲,王慧.脂肪酶产生菌的筛选及产酶条件优化[J].沈阳化工学院学报,2010,24(1):15-19.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:128-191,349-398.
[16]MUYZER G,DEWAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Appl Environ Microbiol,1993,59(3):695-700.
[17]黎小军,谢莲萍,刘建宏,等.产脂肪酶菌株的筛选、鉴定与产酶条件优化[J].江西师范大学学报(自然科学版),2014,38(1):14-18.
[18]赵伟,王俐琼,郑甲,等.产脂肪酶菌株的分离、鉴定及其产酶条件优化[J].湖南师范大学(自然科学学报),2010,33(3):88-92.
[19]胡珺,杜新凯,王常高,等.产脂肪酶菌株的筛选鉴定及产酶条件优化[J].中国酿造,2016,35(11):39-43.
[20]秦新政,杨新平,付建红.响应面法优化产低温脂肪酶工程菌Cl02的发酵条件[J].中国生物制品学杂志,2013,26(7):1010-1014,1022.
[21]刘自琴,黄惠华.响应面法优化脂肪酶的固定化条件及其水解橄榄油的特性研究[J].食品科学,2012,33(3):184-189.
[22]宋萍,戚小灵,胡燚,等.响应面法优化枯草芽孢杆菌产脂肪酶的合成培养基[J].中国生物工程杂志,2010,30(8):100-105.
[23]尹利,阎金勇,杨江科,等.响应面法优化洋葱假单胞菌产脂肪酶液体发酵工艺[J].微生物学杂志,2007(3):11-15.
[24]张大皓,谭天伟,王炳武.响应面试验设计优化脂肪酶发酵培养基[J].北京化工大学学报(自然科学版),2006(2):41-45.
[25]BUCHANAN R E,GIBBONS N E,等.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:729-758.