葡萄酒中富含多糖、多酚、氨基酸、各种微量元素、维生素、有机酸,长期饮用葡萄酒有益于健康,可以降低癌症、心脑血管的发病,延缓衰老[1]。葡萄酒中适度的有机酸可以增强醇厚感,是葡萄酒的骨架之一,但葡萄中的有机酸含量过高(尤其是苹果酸),会给人一种酸涩粗糙的感觉,此类葡萄酒尤其是干红葡萄酒选择合适的降酸方式显得非常重要[2-3]。苹果酸-乳酸发酵(malolactic fermentation,MLF)是葡萄酒酿造过程中的二次微生物发酵,在乳酸菌的作用下,将L-苹果酸(二元酸)转化成L-乳酸(一元酸),并且释放出CO2,能降低葡萄酒的酸度,提高pH值,丰富葡萄酒的香气,增强细菌的稳定性,提高葡萄酒的质量[2,4]。酒酒球菌(Oenococcusoeni)由于可以较好地适应葡萄酒中的恶劣环境(低pH,高酒精和SO2)和产生较低含量的生物胺,成为进行苹果酸-乳酸发酵的最稳定乳酸菌之一[5]。
葡萄酒生产过程中,MLF的进行是在酒精发酵(alcoholic fermentation,AF)后或自发或人为接种商业乳酸菌进行,即顺序苹果酸-乳酸发酵(sequential MLF,SEQ),以防止产生过量乙酸[6]。然而,酒精发酵后由于酵母代谢产生的乙醇和中链脂肪酸等物质的存在往往会抑制酒酒球菌的生长,致使MLF产生对葡萄酒感官质量有不良影响的副产物,甚至是MLF不能正常启动[7]。同时将酵母和细菌培养物接种到葡萄汁中,可以使细菌逐渐适应葡萄酒中的恶劣环境,这是一种缓解顺序苹果酸-乳酸发酵缺点的一种方法,简称为共发酵(simultaneous MLF,SIM)[8]。传统上,为了避免乳酸细菌可能分解糖和其他葡萄酒成分,共发酵一般被阻止[2]。近年来,部分学者开始尝试利用葡萄汁、荔枝汁和榴莲汁进行共发酵[3,6,8-9]。共发酵可以缩短发酵时间,但由于细菌的快速生长,酿酒酵母和细菌之间的共发酵可能会抑制酵母的生长和代谢,导致产生过多的挥发性酸甚至终止酒精发酵[10]。顺序发酵和共发酵的优点和风险仍然存在争议,特别是其对葡萄酒化学成分变化的影响方面。
该研究将共发酵与仅进行酒精发酵和顺序发酵进行比较,对比不同发酵模式下蛇龙珠干红葡萄酒的发酵动力学模型、化学成分的变化以及感官品质的差异,筛选出葡萄酒进行苹果酸-乳酸发酵的可行新模式,为保留葡萄酒的特色风味,丰富葡萄酒的感官质量提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
蛇龙珠葡萄:新疆巴音郭勒州和硕地区。
酿酒酵母(Saccharomyces cerevisiae)Excellence XR,酒酒球菌(Oenococcus oeni)1:法国卓越集团。酿酒酵母和酒酒球菌发酵剂是以干粉的形式购买,根据供应商提供的产品说明书进行活化使用。
1.1.2 试剂
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基、MRS琼脂和MRS肉汤培养基:海博生物科技有限公司。
葡萄糖、果糖、蔗糖、苹果酸、乳酸、柠檬酸、酒石酸、乙酸、琥珀酸标准品和挥发性物质定量标准参考化合物:美国Sigma-Aldrich公司。
1.2 仪器与设备
BPC-70F型生化培养箱:上海一恒科学仪器有限公司;LC-20A型高效液相色谱仪(配紫外检测器)、GC/MS-QP2010气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS):日本岛津公司;固相微萃取(solid-phase microextraction,SPME) 手动进样手柄57330-U、DVB/CAR/PDMS复合萃取头(50/30μm):美国Supelco公司;AXTG16G型离心机:上海安亭科学仪器厂;pB-10型pH计:新锐仪表仪器有限公司。
1.3 方法
1.3.1 葡萄酒发酵处理
挑选无霉烂的葡萄40 kg,完全除梗后手工破碎(破碎率30%),平均分配到9个5 L玻璃瓶中,加入SO2(50 mg/L),添加果胶酶(20 mg/L)处理2 h。在4℃条件下经72 h冷浸后进行3种不同的发酵处理,即对照(CK,仅接种酵母菌进行酒精发酵)、顺序发酵(SEQ,酒精发酵结束后接种酒酒球菌启动苹果酸-乳酸发酵)和共发酵(SIM,在酵母接种24 h后接种酒酒球菌启动苹果酸-乳酸发酵)[11]。
酿酒酵母干粉于37~40℃的5%蔗糖水中活化20~25 min,接种浓度为107CFU/mL;酒酒球菌干粉于20℃的5%蔗糖水中活化20~30 min,接种浓度为107CFU/mL,发酵温度控制在18~20℃。分别在第0、2、5、8、12、16、21、26天取样离心处理进行各种指标的测定,每个处理重复3次。
1.3.2 微生物计数
酿酒酵母菌细胞和酒酒球菌细胞计数均采用无菌生理盐水(0.9%NaCl)梯度稀释的方法进行。酵母菌细胞计数:吸取100 μL无菌生理盐水适当稀释样品涂布在PDA琼脂培养基,于25℃好氧培养72 h后计数。酒酒球菌细胞计数:吸取100 μL生理盐水适当稀释的样品涂布在MRS琼脂培养基,于28℃厌氧培养5~7d对酒酒球菌进行计数。
1.3.3 基本理化指标和有机酸化学组分分析
可溶性固形物:使用手持糖量计进行测定;酒精:采用密度瓶法测定;pH:通过酸度计测定[12]。有机酸、糖含量采用高效液相色谱法进行分析[13]。
1.3.4 挥发性成分分析
挥发性物质提取:参照 BARBOSA C等[14]描述的方法,对葡萄酒的挥发性成分进行定性定量分析。向20 mL顶空小瓶中分别加入8 mL葡萄酒样品、2 g氯化钠和20 μL的2-辛醇(内标物,814 mg/L)。在40℃条件下加热搅拌萃取50 min后进样,解吸10 min。
色谱条件:色谱柱为DB-Wax(60m×0.25mm×0.25μm);升温程序:30℃保持2min,然后以6℃/min的速度升至130℃,以4℃/min的速度升至230℃,并在230℃保持8 min。载气为氦气(He),平均线速度为25 cm/s,无分流进样。
质谱条件:火焰离子化检测器(flame ionization detector,FID)温度为250 ℃,电子能量:70 eV;质量扫描范围30~400 amu。
定性定量:通过美国国家标准与技术研究院(national institute of standards and technology,NIST)谱库14和NIST 14S比较保留时间和质谱来对香气化合物定性。使用溶解在模拟葡萄酒中的外部标准物(11%vol乙醇水溶液,酒石酸调pH至3.40)和2-辛醇作为原样采用内标法来对挥发性化合物进行定量,对于缺乏纯参考标准的化合物,采用化学结构和碳原子数最大相似的原理进行量化。
1.3.5 感官分析
葡萄酒样品的感官质量评价采用定量描述分析(quantitative descriptive analysis,QDA)的方法进行。品评组由11人组成,包括6名女性和5名男性,年龄为28~46岁。感官品评实验在标准品酒室中进行,品酒室温度23℃左右,通风条件良好,无杂物与异味。要求小组成员描述具有7种气味类别(花香、果香、甜味、生青/酸、溶剂、脂肪和整体香气)的葡萄酒香气。并使用5分制来评估强度,其中1=非常弱,2=弱,3=中等,4=强,5=非常强。
1.3.6 统计分析
使用SPSS16.0对所有数据进行统计学分析,葡萄酒样品之间的显著差异通过方差分析和Duncan检验进行,模型在P<0.05水平具有统计学意义。
2 结果与分析
2.1 发酵动力学变化
葡萄酒的酒精发酵是在酵母菌的作用下,将糖发酵生成酒精,并释放出CO2的过程。酵母菌数量在酒精发酵过程中的动态变化如图1所示,在所有发酵模式(图1A、1B、1C)中,酿酒酵母均能够迅速适应葡萄酒的环境,迅速增长。随着发酵的进行,酵母菌生长需要的必要营养成分不断减少,同时产生了抑制酿酒酵母生长的抑制剂—乙醇,导致酵母菌数量降低[15]。尤其在SIM过程中,由于酒酒球菌的接入,酵母菌的数量迅速降至5.5×108CFU/mL(图1B),在一定程度上影响了酵母菌的生长。这与酿酒酵母的种类和酒酒球菌的种类也直接有关[2]。
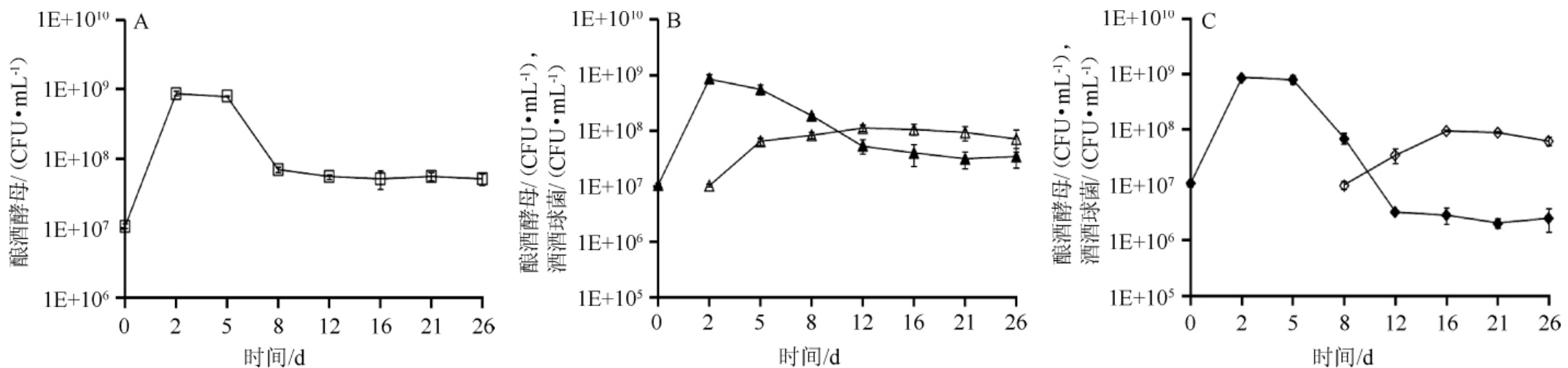
图1 蛇龙珠葡萄酒不同发酵模式CK(A)、SIM(B)、SEQ(C)中微生物数量的动态变化
Fig.1 Dynamic changes of microbial quantity in different fermentation modes CK(A),SIM(B)and SEQ(C)of wine
对照组酿酒酵母(□);SIM组酿酒酵母(▲);SIM组酒酒球菌(△);SEQ组酿酒酵母(◆);SEQ组酒酒球菌(◇)。
酒酒球菌的接入需要经过2 d对葡萄酒环境的适应才能快速生长,顺序发酵模式中在第8天接入酒酒球菌进行MLF降酸实验。酒酒球菌细胞数在接入后的第8天达到最大约8×107CFU/mL,然后保持稳定。而SIM中,酒酒球菌的数量在接入后的第5天达到最大约8×107CFU/mL,然后保持稳定(图1B、图1C)。研究结果表明,共发酵过程中的发酵环境更易于酒酒球菌生长,缩短MLF进程[16]。
在酒精发酵过程中,酵母菌和乳酸菌之间存在着拮抗作用,这种拮抗作用主要是通过酵母对营养的竞争和分泌抑菌物质来实现的[2]。酵母菌在酒精发酵过程中消耗掉发酵基质中绝大部分的精氨酸和其他氨基酸,而这些氨基酸又是酒酒球菌生长所需的重要营养物质。同时酵母菌产生的乙醇也能抑制甚至杀死葡萄酒乳酸菌。酵母生长繁殖过程中产生的拮抗因子(如辛酸和癸酸等)对乳酸菌的生长也有抑制作用。酵母菌与乳酸菌的拮抗作用也因种间关系有所不同。卵形酵母(S.oviformis)能强烈拮抗肠膜明串珠菌(Leuc.mesenteroides)、希氏乳杆菌(L.hilgardii)和短乳杆菌(L.brevis)。在酒精发酵前,发酵汁中的毕赤酵母(Pichia)和路氏类酵母(Saccharomycodes)的增殖能够强烈抑制乳酸菌的生长。另一方面,酵母的代谢和自溶作用却可以刺激乳酸菌的生长。酵母菌生长过程中产生的维生素及氨基酸有利于乳酸菌的生长。酵母的自溶作用可以提高葡萄酒中氨基酸水平,刺激乳酸菌的生长。
2.2 发酵过程中部分理化指标变化
葡萄汁和不同发酵葡萄酒中部分理化指标的变化见表1。由表1可知,所有发酵模式中可溶性固形物的含量从22.04°Bx持续下降至约5.00°Bx,并保持稳定;不同处理中蔗糖、果糖和葡萄糖均无显著差异(P>0.05),这主要与微生物对糖的利用能力有关。所有处理的葡萄酒乙醇含量(12.42%vol~12.50%vol)没有显著差异,这与TANIASURI F等[3]的研究结果一致。但JUSSIER D等[8,17]利用乳酸菌与酵母菌共发酵时发现酵母的生长和发酵活性出现严重的抑制现象甚至是酒精发酵中止。由表1可以看出,SEQ和SIM处理均能使葡萄酒中的苹果酸含量降低至1 g/L以下,其中SIM处理的苹果酸降低更加迅速。在苹果酸-乳酸发酵过程中,L-苹果酸进入细胞,同时被苹果酸-乳酸酶脱羧产生L-乳酸和CO2,然后反应产物离开细胞。由于底物和产物的差异导致介质的碱化,形成质子动力,促使细胞膜ATP酶合成ATP,维持乳酸菌的生长。在葡萄酒生产中,不能让乳酸菌分解糖和其他葡萄酒成分,应该尽快地使糖和苹果酸消失,以缩短酵母菌和乳酸菌繁殖或这两者同时繁殖的时期[2]。
对照CK、SEQ和SIM中葡萄酒的pH值分别从最初的3.59逐渐升高至3.63、3.85、3.79,这一结果符合葡萄酒进行苹果酸-乳酸发酵后pH值增加0.1~0.3单位的理论值,pH的降低主要由于MLF发酵后苹果酸的降解所致。但不同处理中有机酸组分差异较大(表1)。不同处理间苹果酸、乳酸、柠檬酸含量变化差异显著(P<0.05),SEQ和SIM中苹果酸的含量显著低于对照CK(P<0.05)。葡萄酒中苹果酸的大量减少和乳酸的大量增加主要归因于MLF,而对照组CK中苹果酸的降低和乳酸的少量产生是由于酿酒酵母对L-苹果酸的代谢或被动扩散所致[18]。此外,O.oeni还可以通过糖的异源代谢和柠檬酸代谢产生乳酸[19]。MLF后乙酸含量显著增加(表1)主要是因为O.oeni可以通过糖的异源发酵或者柠檬酸途径消耗柠檬酸来生产乙酸[19]。
表1 葡萄汁和不同方式发酵葡萄酒中部分理化指标变化
Table 1 Changes of main physicochemical indexes in grape juice and wine with different fermentation modes

注:每行不同字母表示差异性显著(P<0.05);n.d.表示未检测到,下同。
项目 葡萄汁 CK固形物含量/°Bx pH乙醇/%vol果糖/(g·L-1)葡萄糖(g·L-1)蔗糖(g·L-1)酒石酸(g·L-1)苹果酸(g·L-1)乳酸/(g·L-1)乙酸(g·L-1)柠檬酸(g·L-1)22.04±0.18a 3.59±0.03b 0.03±0.01b 105.73±3.31a 100.14±2.97a 13.11±0.26 18.11±0.52a 3.61±0.05a 0.13±0.03b 0.12±0.01b 0.59±0.02a 4.97±0.08b 3.63±0.01b 12.42±0.16a n.d.0.861±0.01b n.d.2.03±0.02b 2.91±0.34a 0.95±0.06b 0.21±0.15b 0.64±0.03a SEQ SIM 5.01±0.09b 3.85±0.07a 12.50±0.09a n.d.0.866±0.01b n.d.1.08±0.02b 0.68±0.17b 3.15±0.43a 0.57±0.09ab n.d.5.15±0.11b 3.79±0.14a 12.43±0.13a 0.61±0.03b 1.03±0.01b n.d.0.95±0.03b 0.79±0.36b 3.09±0.53a 1.03±0.11a n.d.
由表1可知,在所有发酵过程均发现酒石酸减少的现象。乳酸菌可以通过多种途径对葡萄酒和葡萄汁中的有机酸进行代谢,当葡萄酒的pH值高于3.5时,有些乳酸菌(包括短乳杆菌、植物乳杆菌和片球菌中的个别菌株)能够分解酒石酸,导致葡萄酒中的挥发酸含量增加。在苹果菌-乳酸发酵过程中,只形成一种乳酸,即L-乳酸。当乳酸菌分解其他任何葡萄酒构成成分时都会同时产生L-乳酸和D-乳酸。在酒精发酵过程中,一些酵母菌亦可形成少量乳酸,特别是D-乳酸含量一般控制在200 mg/L以下[2]。本实验过程中接种的乳酸菌为酒酒球菌,造成酒石酸减少的主要原因应该是酒石酸氢钾的结晶析出所致[2]。
2.3 挥发性成分分析
用HS-SPME-GC-MS/FID对葡萄酒中的各种挥发性物质进行定性和定量分析,结果见表2。由表2可知,共定性定量出39种挥发性成分,包括4种酸、9种醇、19种酯、5种醛酮类物质和2种其他类物质。SIM处理的葡萄酒中产生的挥发性香气总量最高,为48.08 mg/L,CK和SEQ处理的挥发性香气总量分别为44.67 mg/L和47.97 mg/L。
表2 不同处理葡萄酒中主要挥发性成分分析
Table 2 Analysis of main volatile components in wine with different treatments
μg/L
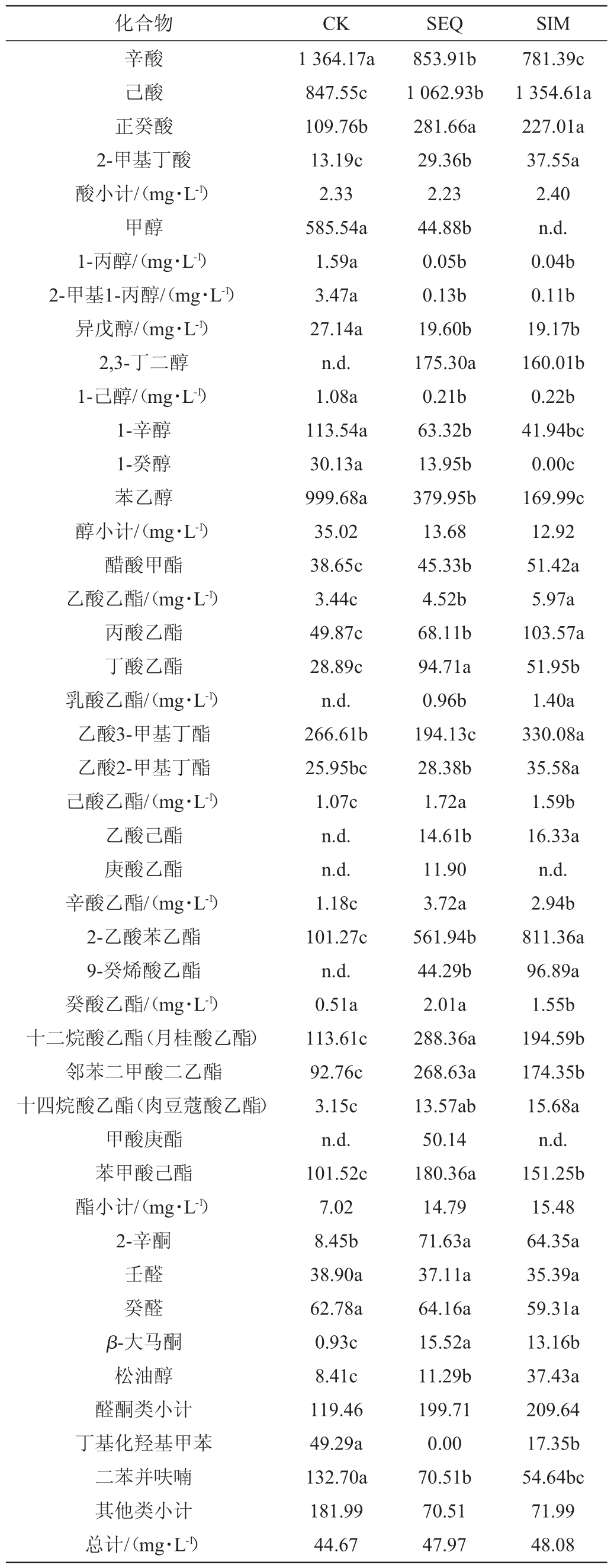
化合物 CK SEQ SIM辛酸己酸正癸酸2-甲基丁酸酸小计/(mg·L-1)甲醇1-丙醇/(mg·L-1)2-甲基1-丙醇/(mg·L-1)异戊醇/(mg·L-1)2,3-丁二醇1-己醇/(mg·L-1)1-辛醇1-癸醇苯乙醇醇小计/(mg·L-1)醋酸甲酯乙酸乙酯/(mg·L-1)丙酸乙酯丁酸乙酯乳酸乙酯/(mg·L-1)乙酸3-甲基丁酯乙酸2-甲基丁酯己酸乙酯/(mg·L-1)乙酸己酯庚酸乙酯辛酸乙酯/(mg·L-1)2-乙酸苯乙酯9-癸烯酸乙酯癸酸乙酯/(mg·L-1)十二烷酸乙酯(月桂酸乙酯)邻苯二甲酸二乙酯十四烷酸乙酯(肉豆蔻酸乙酯)甲酸庚酯苯甲酸己酯酯小计/(mg·L-1)2-辛酮壬醛癸醛β-大马酮松油醇醛酮类小计丁基化羟基甲苯二苯并呋喃其他类小计总计/(mg·L-1)1 364.17a 847.55c 109.76b 13.19c 2.33 585.54a 1.59a 3.47a 27.14a n.d.1.08a 113.54a 30.13a 999.68a 35.02 38.65c 3.44c 49.87c 28.89c n.d.266.61b 25.95bc 1.07c n.d.n.d.1.18c 101.27c n.d.0.51a 113.61c 92.76c 3.15c n.d.101.52c 7.02 8.45b 38.90a 62.78a 0.93c 8.41c 119.46 49.29a 132.70a 181.99 44.67 853.91b 1 062.93b 281.66a 29.36b 2.23 44.88b 0.05b 0.13b 19.60b 175.30a 0.21b 63.32b 13.95b 379.95b 13.68 45.33b 4.52b 68.11b 94.71a 0.96b 194.13c 28.38b 1.72a 14.61b 11.90 3.72a 561.94b 44.29b 2.01a 288.36a 268.63a 13.57ab 50.14 180.36a 14.79 71.63a 37.11a 64.16a 15.52a 11.29b 199.71 0.00 70.51b 70.51 47.97 781.39c 1 354.61a 227.01a 37.55a 2.40 n.d.0.04b 0.11b 19.17b 160.01b 0.22b 41.94bc 0.00c 169.99c 12.92 51.42a 5.97a 103.57a 51.95b 1.40a 330.08a 35.58a 1.59b 16.33a n.d.2.94b 811.36a 96.89a 1.55b 194.59b 174.35b 15.68a n.d.151.25b 15.48 64.35a 35.39a 59.31a 13.16b 37.43a 209.64 17.35b 54.64bc 71.99 48.08
由表2可知,高级醇是葡萄酒中的主要挥发性成分,适量的高级醇能够增加葡萄酒风味的复杂性。实验过程中有9种高级醇被定性定量,其中异戊醇含量最高,其次是2-甲基丙醇,1-癸醇含量最低。除2,3-丁二醇外,MLF显著降低了SEQ和SIM处理的葡萄酒中所有高级醇的含量(P<0.05)。O.oeni可以通过MLF代谢柠檬酸产生双乙酰,当双乙酰浓度低于其阈值(5~7 mg/L)时,随着浓度的增加对葡萄酒的香气和感官质量起到积极作用,但当其含量高于阈值(5~7 mg/L)时,将会产生相反的结果[20]。在葡萄酒发酵过程辛酸、己酸、癸酸和2-甲基丁酸4种有机酸被定性定量,随着发酵的进行总的有机酸酸浓度逐渐增加。除了辛酸外,MLF后葡萄酒中的有机酸含量均高于对照葡萄酒。其中SEQ中癸酸含量达到281.66 μg/L,是对照组的1.57倍,这可能是由微生物种类和水果品种不同导致的[21]。
酯类是葡萄酒中最主要的一类挥发性成分,对葡萄酒的香气构成有着重要贡献。大多数酯类物质是在酒精发酵过程中由酿酒酵母产生的,能赋予葡萄酒新鲜水果香气。MLF过程中在乳酸菌酯酶的作用下,不同酯类物质的含量可能会增加或减少[22]。研究结果表明:3种葡萄酒中乙酸乙酯的含量均最高,其次是辛酸乙酯(表2)。各处理葡萄酒中壬醛,癸醛含量均无显著差异(P>0.05)。与UGLIANO M等[23]的研究结果相似,MLF发酵增加了萜类化合物的含量,赋予了葡萄酒更多的果香和花香。实验过程中有2种萜类化合物被定性定量,与对照CK相比,SEQ和SIM处理的葡萄酒中β-大马酮含量增加显著(P<0.05),分别达到15.52μg/L和13.16μg/L。SEQ和SIM处理的葡萄酒松油醇含量增加也达到差异显著水平(P<0.05),分别为11.29μg/L和37.43μg/L。
2.4 定量描述分析
采用定量描述分析法对不同处理葡萄酒样品进行感官评价。本实验由11名专业葡萄酒感官评定人员对葡萄酒的色泽、香气以及口感等感官指标进行描述分析,并对各描述特征强度取均值,形成风味剖面图(图2)。品评结果表明,对照组产生的葡萄酒具有强烈的“生青”味,以及轻微的“花香”和“溶剂”的味道,略带紫色色调。MLF使葡萄酒的口感在“酸”方面更加柔和,“酒体”更加饱满。其中SIM处理获得的葡萄酒色调突出,果香味明显,这主要和发酵过程中乙酸乙酯、乙酸已酯、乙酸2-甲基丁酯和乙酸3-甲基丁酯含量增加有关。其口感入口舒顺,口感柔和,酒体饱满。而SEQ获得的葡萄酒色泽略显暗淡,虽然在一定程度降低了葡萄酒的生青味,但果香味较淡,口感柔和,酒体圆润。
总体而言,MLF对葡萄酒的感官质量的提高发挥了巨大的作用。同时,酿酒酵母和酒酒球菌共接种获得的葡萄酒大大提高了葡萄酒的酯类物质含量,赋予了葡萄酒丰富的香气和独特的风格特征。综合而言,SIM获得葡萄酒呈宝石红略带紫色色调,果香花香浓郁,入口柔顺,酒体饱满,风格独特。
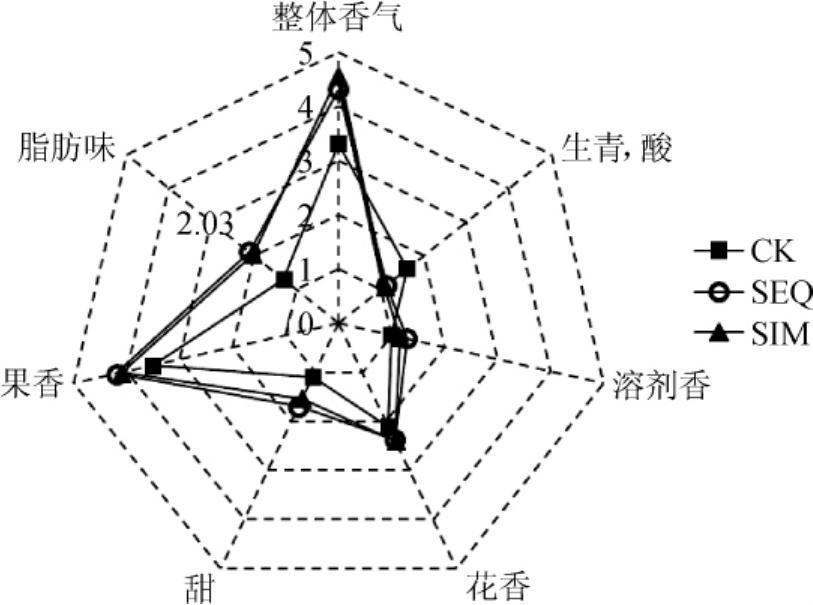
图2 不同发酵模式葡萄酒的二次判别分析
Fig.2 Quadratic discriminant analysis of wine with different fermentation modes
3 结论
与传统的顺序发酵相比,酿酒酵母(S.cerevisiae)Excellence XR与酒酒球菌(O.oeni)1共发酵大大缩短了发酵时间,同时增强了葡萄酒中的花香和果香,丰富了葡萄酒的酒体,提高了葡萄酒的感官质量。因此,采用Excellence XR与酒酒球菌(O.oeni)1共接种具有明显的优势,可以在葡萄酒酿造中推广应用。
[1]张文慧,李青林,黄丽辉,等.葡萄酒与健康关系的研究新进展[J].中国酿造,2019,38(2):11-15.
[2]李华.葡萄酒品尝学[M].北京:科学出版社,2006:35-39.
[3]TANIASURI F,PIN-ROU L,LIU S Q.Induction of simultaneous and sequential malolactic fermentation in durian wine[J].Int J Food Microbiol,2016,230:1-9.
[4]KNOLL C,FRITSCH S,SCHNELL S,et al.Influence of pH and ethanol on malolactic fermentation and volatile aroma compound composition in white wines[J].LWT Food Sci Technol,2011,44(10):2077-2086.
[5]LONVAUD-FUNEL A.Lactic acid bacteria in the quality improvement and depreciation of wine[J].Anton Leeuw,1999,76:317-331.
[6]MASSERA A,SORIA A,CATANIA C,et al.Simultaneous inoculation of Malbec(Vitis vinifera)musts with yeast and bacteria:effects on fermentation performance,sensory and sanitary attributes of wines[J].Food Technol Biotechnol,2009,47:192-201.
[7]CARRETE R,TERESA V M,BORDONS A,et al.Inhibitory effect of sulfur dioxide and other stress compounds in wine on the ATPase activity ofOenococcus oeni[J].FEMS Microbiol Lett,2002,211:155-159.
[8]JUSSIER D,DUBE M A,MIRA de ORDUNA R.Effect of simultaneous inoculation with yeast and bacteria on fermentation kinetics and key wine parameters of cool climate Chardonnay[J].Appl Environ Microbiol,2006,72(1):221-227.
[9]CHEN D,LIU S Q.Transformation of chemical constituents of lychee wine by simultaneous alcoholic and malolactic fermentations[J].Food Chem,2016,196:988-995.
[10]NEHME N,MATHIEU F,TAILLANDIER P.Quantitative study of in-teractions betweenSaccharomyces cerevisiaeandOenococcus oenistrains[J].J Ind Microbiol Biotechnol,2008,35:685-693.
[11]VERSARI A,PATRIZI C,PARPIINELLO G P,et al.Effect of co-inoculation with yeast and bacteria on chemical and sensory characteristics of commercial Cabernet Franc red wine from Switzerland[J].J Chem Technol Biot,2015,91:876-882.
[12]OIV.Compendium of International Methods of Wine and Must Analysis[S].Organisation Internationale de la Vigneet du Vin,Paris.2005.
[13]LU Y,HUANG D,LEE P R,et al.Effects of cofermentation and sequential inoculation ofSaccharomyces bayanusandTorulaspora delbruckiiondurian wine composition[J].Int J Food Sci Tech,2015,50(12):2653-2663.
[14]BARBOSA C,FALCO V,MENDES-FAIA A,et al.Nitrogen addition influences formation of aroma compounds,volatile acidity and ethanol in nitrogen deficient media fermented bySaccharomyces cerevisiae,wine strains[J].J Biosci Bioeng,2009,108(2):99-104.
[15]KING S W,BEELMAN R B.Metabolic interactions betweenSaccharomyces cerevisiaeandLeuconostoc oenosina model grape juice/wine system[J].Am J Enol Vitic,1986,37:53-60.
[16]TRISTEZZA M,FEO L D,TUFARIELLO M,et al.Simultaneous inoculation of yeasts and lactic acid bacteria:Effects on fermentation dynamics and chemical composition of Negroamaro wine[J].LWT-Food Sci Technol,2016,66:406-412.
[17]ROSI I,FIA G,CANUTI V.Influence of different pH values and inoculation time on the growth and malolactic activity of a strain ofOenococcus oeni[J].Aust J Grape Wine Res,2003,9:194-199.
[18]CHEN D,LIU S Q.Chemical and volatile composition of lychee wines fermented with four commercialSaccharomyces cerevisiaeyeast strains[J].Int J Food Sci Technol,2014,49:521-530.
[19]SWIEGERS J H,BARTOWSKY E J,HENSCHKE P A,et al.Yeast and bacterial modulation of wine aroma and flavour[J].Aust J Grape Wine Res,2005,11:139-173.
[20]BARTOWSKY E J,HENSCHKE P A.The'buttery'attribute of winediacetyl-desirability,spoilage and beyond[J].Int J Food Microbiol,2004,96:235-252.
[21]POZO-BAYON M A,ALEGRÍA E G,POLO M C,et al.Wine volatile and amino acid composition after malolactic fermentation:Effect of Oenococcus oeniandLactobacillus plantarumstarter cultures[J].J Agric Food Chem,2005,53:8729-8735.
[22]NIELSEN J C,RICHELIEU M.Control of flavor development in wine during and after malolactic fermentation byOenococcus oeni[J].Appl Environ Microbiol,1999,65:740-745.
[23]UGLIANO M,MOIO L.Changes in the concentration of yeast-derived volatile compoundsof red wine during malolactic fermentation with four commercial starter culturesofOenococcusoeni[J].J Agric Food Chem,2005,53:10134-10139.