木聚糖酶是一种重要的半纤维素水解酶系,能将木聚糖降解为木寡糖和木糖[1],已被用于生物燃料乙醇、食品、医药以及动物饲料等领域[2-3]。PARAB P等[4]利用芽孢杆菌(Bacillussp.)产生的木聚糖酶酶解海藻,得到可发酵的还原糖;DHIMAN S S等[5]利用嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)所产木聚糖酶处理柑橘果汁,通过降解其中果胶、淀粉和半纤维素等大分子多糖,获得了高度澄清的柑橘果汁;KHAMBHATY Y等[6]将木聚糖酶用于纸浆预处理,能有效提高纸浆的白度。
木聚糖酶来源广泛,有微生物、甲壳动物、植物、昆虫、种子等。其中微生物主要包括真菌(如黑曲霉、烟曲霉、米曲霉、木霉、青霉等)、细菌(如地衣芽孢杆菌、黄热芽孢杆菌、嗜热双胞菌、枯草芽孢杆菌、双歧杆菌等)和放线菌[7-9]。一般认为微生物是生产商品木聚糖酶的最佳来源之一[10]。郑丽丽等[11]从土壤中筛得一株黑曲霉,其所产木聚糖酶酶活为78.34 U/mL;KUMAR V等[12]从废弃木材中筛得野生菌疏棉状嗜热霉菌,其所产木聚糖酶酶活为61.09 U/mL;吴仁智等[13]从土壤中筛得野生日本曲霉菌,其所产木聚糖酶酶活为26.26U/mL。由于野生菌所产木聚糖酶酶活较低,而对工业化生产而言,木聚糖酶酶活高不仅能提高生产效率、亦能有效节约能源[14],因此可采用一些方法提高野生菌的产酶能力,诱变育种是其中一种有效方法。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)技术是近些年发展起来的一种新型微生物诱变育种方法,ARTP富含的活性粒子可以改变细胞壁和细胞膜的物理化学性质,并造成组织损伤和遗传物质损伤,微生物细胞被迫启动容错水平高的“SOS修复机制”、出现较多错误倾向修复,引起微生物的基因突变[15-16]。ARTP诱变技术具有突变率高、成本低、环境友好等优点[17],已成为诱变领域的研究热点。
本研究以黑曲霉(Aspergillus niger)FXY为出发菌株,通过ARTP技术进行诱变处理,旨在找到一株木聚糖酶高产突变株,并对突变菌株的酶活提高原因、所产木聚糖酶的酶学性质进行研究,为木聚糖酶的工业化生产和应用范围扩大提供依据,对促进我国酶制剂工业的发展具有现实意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
黑曲霉(Aspergillus niger)FXY:本实验室保藏。
木聚糖(纯度为99%):美国Sigma-Aldrich公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):厦门海标科技有限公司;葡萄糖、MgSO4·7H2O、KH2PO4(均为分析纯):国药集团化学试剂有限公司;蛋白胨、酵母粉(均为生化试剂):北京奥博星生物技术有限责任公司。
1.1.2 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基:称取200g马铃薯切成小块,加水煮烂(煮沸20~30min,能被玻璃棒戳破即可),用8层纱布过滤,加入15~20g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入葡萄糖20g,搅拌均匀,稍冷却后再补足水分至1000mL,121℃高压灭菌20min。
种子培养基:葡萄糖20.0 g/L,蛋白胨20.0 g/L,酵母粉10.0 g/L,pH自然,121℃高压灭菌20 min。
初筛培养基:木聚糖10.0 g/L,酵母粉3.0 g/L,KH2PO4 2.0 g/L,MgSO4·7H2O 2.0 g/L,琼脂 20.0 g/L,pH自然,121 ℃高压灭菌20 min。
发酵产酶培养基:麸皮20.0 g/L,葡萄糖5.0 g/L,酵母粉5.0 g/L,MgSO4·7H2O 1.0 g/L,KH2PO41.0 g/L,pH自然,121℃高压灭菌20 min。
1.2 仪器与设备
ARTP-Ⅱ型诱变育种仪:无锡源清天木生物科技有限公司;DHP-9052型电热恒温培养箱:上海一恒科技有限公司;LDZX-40SC型电热压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-2FD型双人单面超净工作台:苏州净化设备有限公司;HQL-300A型柜式恒温冷冻摇床:中国科学院武汉科学仪器厂;WFI800-D3B型紫外可见分光光度计:北京瑞利分析仪器厂。
1.3 方法
1.3.1 木聚糖酶酶活的测定
木聚糖酶的酶活用DNS法[18]测定。木聚糖酶酶活定义:在一定条件下(50.0℃、pH 5.0),每分钟酶解木聚糖产生1.0 μmol木糖所需的酶量为1个酶活单位(U)。发酵所产木聚糖酶的酶活是以每毫升发酵液所含酶活单位表示,即为U/mL。
1.3.2 孢子悬浮液的制备
将保藏的黑曲霉FXY接入种子培养基,于30.0℃、180r/min活化48.0 h后转接至固体培养基,之后于30.0℃培养96.0 h。用生理盐水将不同培养时间的黑曲霉孢子洗脱至盛有玻璃珠的三角瓶中,于220 r/min充分振荡使其活化并分散。之后经无菌孢子过滤器过滤后用生理盐水将孢子悬浮液稀释至106~108个/mL。
1.3.3 ARTP诱变
将10.0 μL不同培养时间的黑曲霉FXY孢子悬浮液均匀涂布于无菌金属载片上,并分别暴露于ARTP喷射器下1.0~12.0 min。每次处理后,将载片转移至装有1.0 mL无菌水的无菌管中,振荡洗脱后进行稀释涂布,用未经ARTP处理的菌株作为对照,于30.0℃培养72.0h后进行菌落计数,分别用公式(1)、(2)计算致死率、正突变率,并绘制致死率曲线、正突变率曲线。将酶活提高超过对照菌株20.0%及以上的菌株定义为正突变菌株。

1.3.4 初筛
根据诱变的致死率曲线,选取适当的诱变条件进行诱变处理,将处理后的孢子悬浮液稀释涂布至初筛培养基上,于30.0℃、180 r/min培养72.0 h。产酶菌株会在初筛培养基上产生透明圈,测定透明圈与菌落直径的大小,选取透明圈直径(H)与菌落直径(C)比值(即H/C值)较大的菌落进行后续的复筛实验。
1.3.5 复筛
将初筛得到的菌落接种至种子培养基中培养48.0 h,再以2.0%的接种量转接入发酵产酶培养基中,于30.0℃、180r/min培养96.0h后离心收集发酵液,取上清液适当稀释后测其木聚糖酶酶活,与菌株FXY在相同条件下发酵所得粗酶液的酶活进行比较。
1.3.6 诱变菌株的遗传稳定性实验
将诱变所得优势菌株进行连续传代培养,并将各代菌株转接至发酵产酶培养基,测定酶活,比较各代菌株产酶变化情况,以检测诱变菌株的遗传稳定性。
1.3.7 生长曲线的测定
将孢子悬浮液以接种量2.0%接入装液量为50mL/250mL种子培养基中,于30.0℃、180r/min培养。每隔4.0h取出发酵液离心,弃去上清液,并将固体放入105.0℃烘箱中干燥至恒质量。通过测定干细胞质量绘制生长曲线。
1.3.8 产酶曲线的测定
将已培养48.0 h的种子液以2.0%的接种量接入发酵培养基中,于30.0℃、180 r/min培养,每隔12.0 h取样,测定发酵液中木聚糖酶酶活,并用考马斯亮蓝法[19]测定发酵液中的蛋白含量。
1.3.9 木聚糖酶酶学性质
最适温度的确定:将发酵液于8000r/min离心20.0min,上清液即为粗酶液。将粗酶液进行适当稀释,分别于35.0℃、40.0℃、45.0℃、50.0℃、55.0℃、60.0℃进行酶解反应,测定酶活。将木聚糖酶酶活的最高值定义为100.0%,以计算不同温度条件下的相对酶活。
热稳定性实验:将粗酶液进行适当稀释,分别在上述温度保温30.0~180.0 min后测定酶活。将各温度未保温的木聚糖酶酶活最高值定义为100.0%,以计算在不同温度条件下保温不同时间的相对酶活。
最适反应pH值的确定:将粗酶液进行适当稀释,分别在柠檬酸-柠檬酸钠缓冲溶液(pH值为3.0~4.5)、磷酸盐缓冲溶液(pH值为5.0~8.0)、甘氨酸-氢氧化钠缓冲溶液(pH值为8.5~10.0)、磷酸氢二钠-氢氧化钠缓冲溶液(pH值为10.5~11.0)条件下反应,测定酶活。将木聚糖酶酶活的最高值定义为100.0%,以计算不同pH值条件下的相对酶活。
pH稳定性实验:将粗酶液进行适当稀释,分别在上述pH值孵育60min后测定酶活。将各pH值未孵育的木聚糖酶酶活的最高值定义为100.0%,以计算在不同pH值条件下孵育60 min后的相对酶活。
2 结果与分析
2.1 诱变条件的筛选
对不同培养时间的黑曲霉FXY进行ARTP诱变,其致死率曲线如图1所示。由图1可知,菌株FXY培养时间越短,ARTP处理相同时间所对应的致死率越高;培养时间越长,ARTP处理相同时间所对应的致死率越低。这是因为菌株FXY培养时间越长,孢子细胞壁越厚,等离子体中的活性粒子进入细胞受到的阻力会变大,致使活性粒子不易穿透细胞,所以致死率降低。培养4 d的菌株FXY所制备的孢子悬浮液经诱变处理后,致死曲线出现了“马鞍形”,即致死率呈现先升高、后下降、再升高的趋势,是因为ARTP诱变过程中产生了“质量沉积效应”和“电荷交换效应”,在这两种效应的刺激下,可激活菌株体内的应急反应机制(SOS修复)[20-21],该机制是一种自我修复方式、能够降低菌株的致死率,而随着ARTP处理时间进一步延长,受损的菌株细胞不能完全进行自我修复,所以菌株的致死率又会升高[22]。
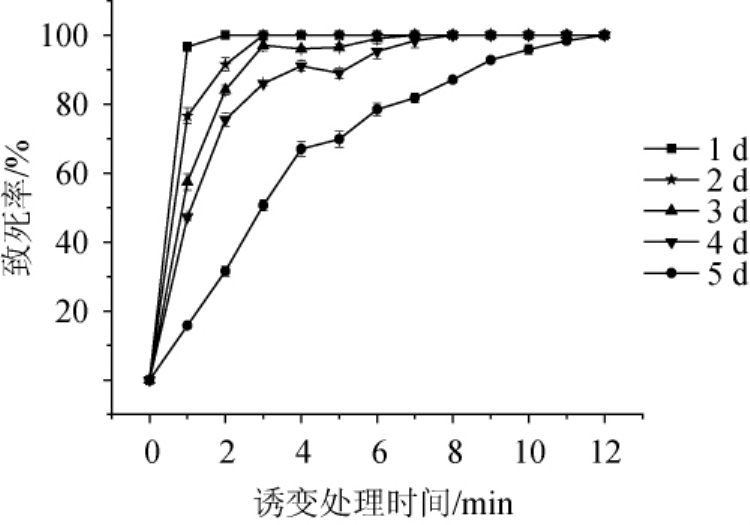
图1 黑曲霉FXY进行常压室温等离子体诱变的致死率曲线
Fig.1 Lethality curve ofAspergillus nigerFXY mutated by atmospheric and room temperature plasma
根据现代诱变理论,诱变致死率在95.0%时有较高的正突变率[23],因此对不同培养时间致死率最接近95.0%的菌株进行产酶筛选,其正突变率结果如图2所示,培养4 d的菌株所对应的正突变率最高,达到了45.6%,因此确定ARTP诱变处理时菌株FXY的培养时间为4 d,诱变处理时间为5.0 min。
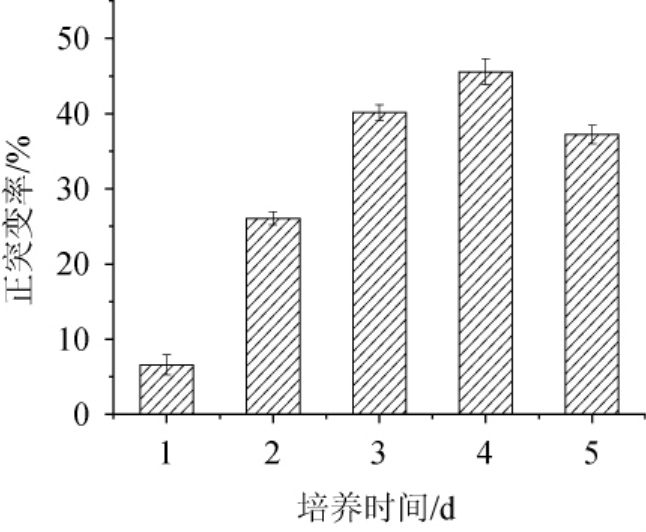
图2 黑曲霉FXY进行常压室温等离子体诱变的正突变率结果
Fig.2 Positive mutation rate results ofAspergillus nigerFXY mutated by atmospheric and room temperature plasma
2.2 诱变菌株的筛选结果
出发菌株黑曲霉FXY的H/C值为1.4,通过比较初筛所得各菌株H/C值大小,从中挑选了49株H/C值超过3.0的菌株,对这49株菌进行产酶发酵并测定酶活,结果如图3所示,与出发菌株(79.42 U/mL)相比,共有42株菌的酶活提高了20.0%及以上,其中编号为ARTP-19、ARTP-49、ARTP-80、ARTP-82的4株菌的酶活提高了100.0%及以上,故后续对这4株优势菌株进行遗传稳定性实验。
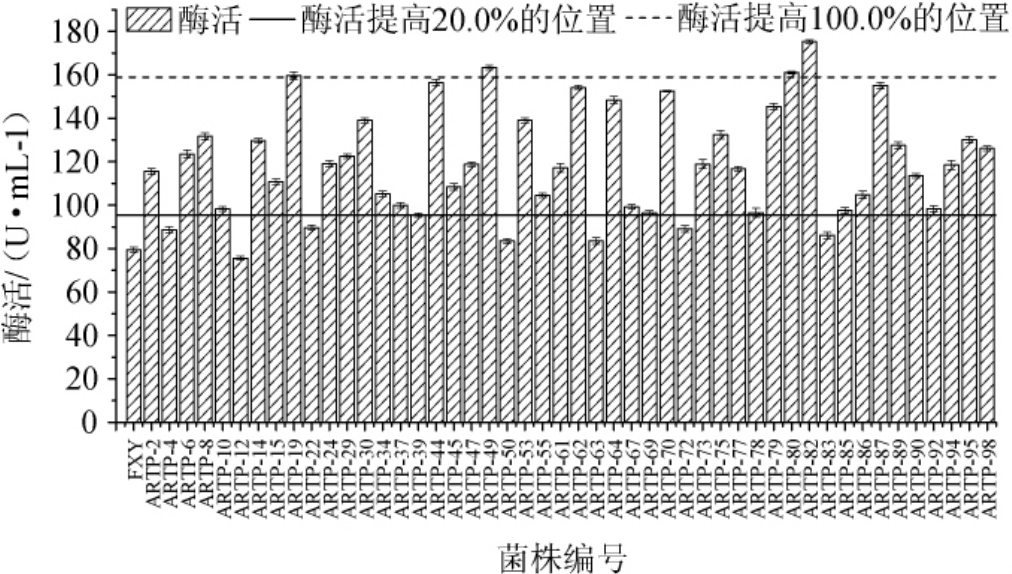
图3 常压室温等离子体诱变菌株所产木聚糖酶酶活
Fig.3 Activities of xylanase produced by atmospheric and roomies temperature plasma mutagenized strains
2.3 诱变优势菌株的遗传稳定性实验
将编号为ARTP-19、ARTP-49、ARTP-80、ARTP-82这4株优势菌株进行连续传代培养,各菌株分别连续传代5次,并将各代菌株转接至发酵产酶培养基中,培养96 h后测定发酵液中木聚糖酶酶活,结果如表1所示。由表1可知,经过5次连续传代培养,这4株正突变菌株均能稳定遗传,其中编号为ARTP-82的菌株所产木聚糖酶酶活最高,达到了175.33 U/mL,较出发菌株(79.42 U/mL)提高了120.8%,因此选用菌株ARTP-82进行后续研究。
表1 常压室温等离子体诱变优势菌株的遗传稳定性实验
Table 1 Hereditary stability experiments of atmospheric and room temperature plasma mutagenic dominant strains

菌株编号ARTP-19 ARTP-49 ARTP-80 ARTP-82酶活/(U·mL-1)第1代 第2代 第3代 第4代 第5代159.62±1.63 163.34±1.14 161.02±0.59 175.33±0.85 155.56±1.22 161.71±1.24 162.54±1.25 175.12±1.73 160.73±1.18 162.25±1.53 164.53±1.41 174.25±1.46 158.76±0.72 164.91±0.68 162.53±0.59 176.37±0.63 161.43±1.52 160.58±0.91 161.49±1.74 178.58±1.19
2.4 生长曲线的测定
采用干重法测定黑曲霉FXY和菌株ARTP-82的生长曲线,结果如图4所示。由图4可知,0~12 h这两株菌生长均较慢,处于“延滞期”,菌体干质量增加少。12 h后,菌株都已适应生长环境,生长速率加快、菌体干重值迅速上升,此时菌株处于“对数生长期”。从36 h开始,这两株菌的生长速率几乎都不变,处于生长的“平稳期”,因此菌体干质量都基本保持不变。比较这两株菌的生长曲线,发现这两株菌在12h后菌体干质量就有差异,在24.0h时,菌株ARTP-82的生物量6.1 g/L比菌株FXY(7.5 g/L)低23.0%,差异达到最大;在36 h时,菌株生长达到平稳期,ARTP-82的生物量9.6 g/L比菌株FXY(10.2 g/L)低5.9%。可见ARTP诱变确实改变了黑曲霉的生长并对其产木聚糖酶也造成了影响,后续实验也验证了这一推断。
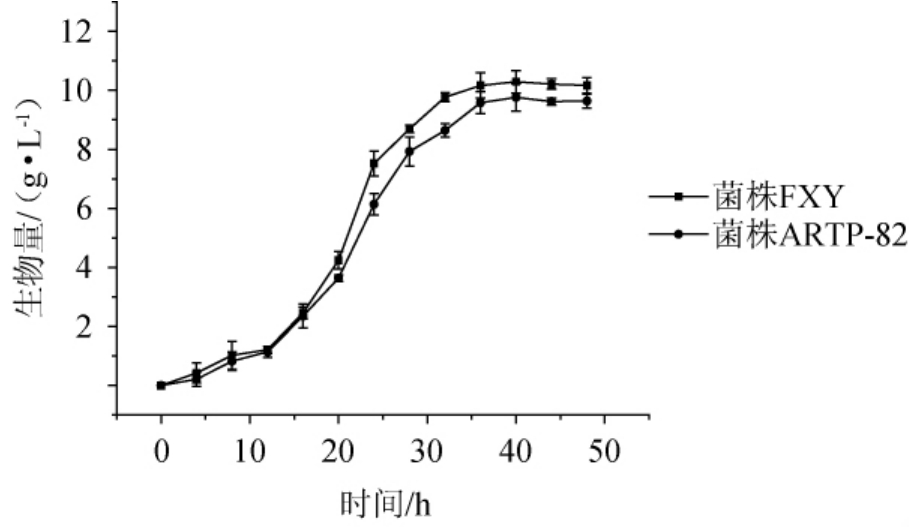
图4 菌株FXY和菌株ARTP-82的生长曲线
Fig.4 Growth curves of strain FXY and strain ARTP-82
2.5 发酵产酶曲线
菌株FXY和菌株ARTP-82的发酵产酶曲线如图5所示,发酵前期,由于菌株主要利用营养物质进行生长,因此产酶较少,蛋白量也较少。当发酵时间达到36 h后,菌株开始大量产酶,蛋白含量亦随之增加。当发酵至96 h时,木聚糖酶酶活达到最高,分别为79.33 U/mL和174.32 U/mL。随着发酵时间再延长,酶活有所下降,可能是因为菌株的代谢产物对酶有抑制作用,而此时蛋白含量不变,这是因为菌株停止产酶,而代谢产物不影响蛋白含量。对比菌株FXY和菌株ARTP-82,在发酵108 h后,两株菌的发酵液中蛋白含量基本保持不变,菌株ARTP-82蛋白含量维持在6.8 mg/mL,比菌株FXY(5.5 mg/mL)提高了23.6%,结合菌株的生长曲线可知,菌株ARTP-82木聚糖酶酶活的增加,与其生物量增加无关、与酶比活力增加有关。

图5 菌株FXY和菌株ARTP-82的发酵产酶曲线
Fig.5 Enzyme production curves by fermentation of strain FXY and
strain ARTP-82
2.6 木聚糖酶的最适反应温度及热稳定性

图6 菌株ARTP-82产木聚糖酶的最适反应温度
Fig.6 Optimum reaction temperature of xylanase produced by strain ARTP-82
不同温度条件下木聚糖酶相对酶活如图6所示,木聚糖酶在40~55℃时能保持80%以上的相对酶活,最适反应温度为45℃,相对酶活为100%。温度较低时,由于酶解反应速率较慢、产生的还原糖少,用DNS法测定酶活,显示相对酶活较低;而温度过高会导致部分木聚糖酶失活,因此相对酶活也会降低。木聚糖酶的热稳定性实验结果如图7所示,该木聚糖酶在35~45℃条件下保温30~180 min,酶活稳定。当温度>45℃,随着保温时间的延长,木聚糖酶的相对酶活会随之降低。在50℃、保温60.0 min后木聚糖酶相对酶活下降了8.5%,保温180min后相对酶活下降了28.8%。在60℃保温60min后木聚糖酶的相对酶活就下降了21.5%,而保温180 min后,相对酶活只有15.7%。这说明温度越高,保温时间越长,木聚糖酶越容易失活,相对酶活也就越低,热稳定性越差。
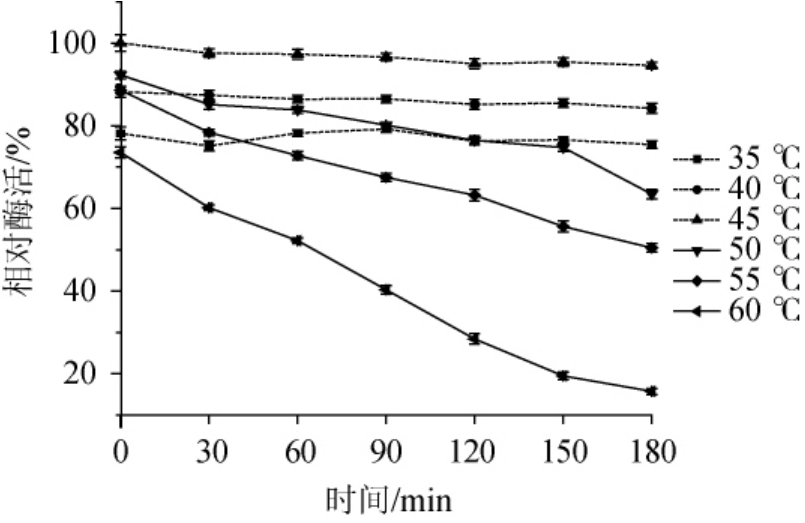
图7 菌株ARTP-82产木聚糖酶的热稳定性
Fig.7 Thermal stability of xylanase produced by strain ARTP-82
2.7 木聚糖酶的最适反应pH值及pH稳定性
不同pH值条件下木聚糖酶相对酶活如图8所示,木聚糖酶在pH值为3~8之间能保持85.0%以上的相对酶活,最适反应pH值为7,反应环境偏酸和偏碱都会使木聚糖酶部分失活,因此在pH值较低和较高的情况下,木聚糖酶的相对酶活都会下降。在pH值为3~5时,木聚糖酶的相对酶活在85.0%以上,而pH值为9~11时,木聚糖酶的相对酶活均<75.0%,这说明该木聚糖酶较适合在酸性环境中使用。
木聚糖酶的pH稳定性结果如图9所示,该木聚糖酶在pH值为7时孵育60 min后,其相对酶活为98.5%,说明,该木聚糖酶在中性环境中较稳定。而在偏酸和偏碱的环境中,将该木聚糖酶孵育60 min后,相对酶活均会下降,并且在碱性环境中酶活下降幅度比在酸性环境中大,这也充分说明了该木聚糖酶对酸的耐受性比对碱的耐受性强。
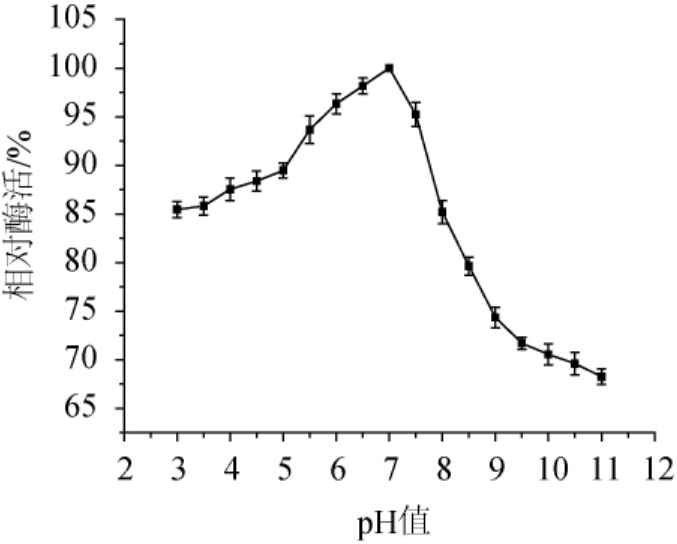
图8 菌株ARTP-82产木聚糖酶的最适反应pH值
Fig.8 Optimum reaction pH of xylanase produced by strain ARTP-82
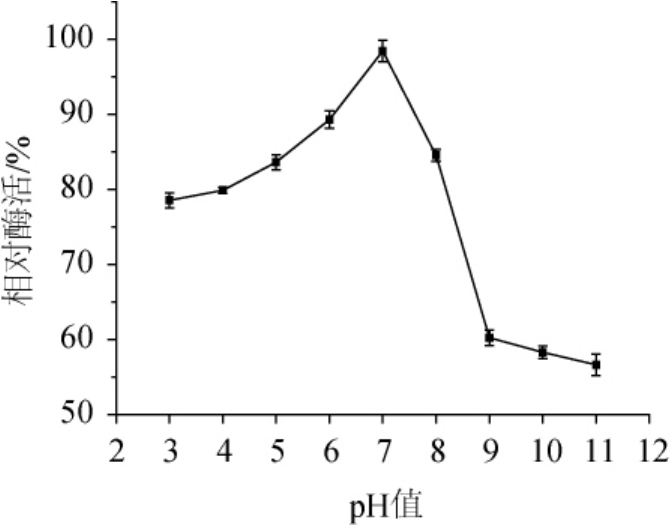
图9 菌株ARTP-82产木聚糖酶的pH稳定性
Fig.9 pH stability of xylanase produced by strain ARTP-82
3 结论
本研究对黑曲霉FXY进行ARTP诱变,分别对出发菌株的培养时间和诱变处理时间进行了考察,结果表明,ARTP诱变的最优条件为:菌株培养时间4 d,诱变处理时间5.0 min,在该条件下,筛得的优势且能稳定遗传的菌株ARTP-82所产木聚糖酶的酶活为175.33 U/mL,较出发菌株提高了120.8%,这表明黑曲霉对ARTP敏感,诱变效果好。本研究证实了ARTP诱变技术的突变率高,对选育木聚糖酶高产菌的可行性和有效性。为了探究诱变菌株木聚糖酶酶活提高的原因,对优势菌株ARTP-82和出发菌株FXY的生长和发酵产酶情况作了对比研究,并得出结论,诱变菌株酶活之所以提高,不是因为菌株生物量的增加,而是与酶比活增加有关。通过对优势菌株ARTP-82所产木聚糖酶酶学性质的研究得知该木聚糖酶的最适反应温度为45℃、最适反应pH值为7,并且在该温度和pH值条件下,酶的稳定性良好。本研究可为其他菌株的ARTP诱变提供有益的参考,对木聚糖酶的工业化生产也具有一定的借鉴意义。
[1]滕超,范园园,曲玲玉,等.嗜热真菌Talaromyces thermophilusF1208产木聚糖酶条件优化[J].中国食品学报,2015,15(8):85-93.
[2]LIU X,LIU Y,JIANG Z,et al.Biochemical characterization of a novel xylanase fromPaenibacillus barengoltziiand its application in xylooligosaccharides production from corncobs[J].Food Chem,2018,264(10):310-318.
[3]张燕青,张超群,王浩猛.木聚糖酶的分子改造方法及其工业应用研究现状[J].中国酿造,2018,37(1):25-29.
[4]PARAB P,KHANDEPARKER R,AMBERKAR U,et al.Enzymatic saccharification of seaweeds into fermentable sugars by xylanase from marineBacillussp.strain BT21[J].Biotech,2017,7(5):296.
[5]DHIMAN S S,GARG G,SHARMA J,et al.Characterization of statistically produced xylanase for enrichment of fruit juice clarification process[J].New Biotechnol,2011,28(6):746-755.
[6]KHAMBHATY Y,AKSHAYA R,RAMA S C,et al.A logical and sustainable approach towards bamboo pulp bleaching using xylanase from Aspergillus nidulans[J].Int J Biol Macromol,2018,118(A):452-459.
[7]陈洪洋,蔡俊,林建国,等.木聚糖酶的研究进展[J].中国酿造,2016,35(11):1-6.
[8]WANG J,MAI G,LIU G,et al.Molecular cloning and heterologous expression of an acid-stable endoxylanase gene fromPenicillium oxalicum inTrichoderma reesei[J].J Microbiol Biotechn,2013,23(2):251-259.
[9]CANAKCI S,CWVHER Z,INAN K,et al.Cloning,purification and characterization of an alkali-stable endoxylanase fromThermophilic Geobacillussp.71[J].World J Microb Biot,2012,28(5):1981-1988.
[10]POLIZELI M L,RIZZATTI A C,MONTI R,et al.Xylanases from fungi:properties and industrial applications[J].Appl Microbiol Biot,2005,67(5):577-591.
[11]郑丽丽,盛占武,韩冰莹,等.不同诱变方法对黑曲霉产木聚糖酶能力的影响[J].生物技术通报,2013(12):146-150.
[12]KUMAR V,CHHABRA D,SHUKLA P.Xylanase production from Thermomyces lanuginosusVAPS-24 using low cost agro-industrial residues via hybrid optimization tools and its potential use for saccharification[J].Bioresource Technol,2017,243:1009-1019.
[13]吴仁智,黄俊,芦志龙,等.酸性木聚糖酶产生菌XYW5的筛选及酶学性质[J].广西科学,2018,25(6):669-677.
[14]LI D,LI X,DANG W,et al.Characterization and application of an acidophilic and thermostable β-glucosidase fromThermofilum pendens[J].J Biosci Bioeng,2013,115(5):490-496.
[15]DONG T T,GONG J S,GU B C,et al.Significantly enhanced substrate tolerance ofPseudomonas putidanitrilase via atmospheric and room temperature plasma and cell immobilization[J].Bioresource Technol,2017,244(Pt 1):1104-1110.
[16]CHENG G,XU J,XIA X,et al.Breeding L-arginine-producing strains by a novel mutagenesis method:Atmospheric and room temperature plasma(ARTP)[J].Preparat Biochem,2016,46(5):509-516.
[17]ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J].Appl Microbiol Biotechn,2014,98(12):5387-5396.
[18]MESHRAM M,KULKARNI A,JAYARAMAN V K,et al.Optimal xylanase production usingPenicilium janthinellumNCIM 1169:A model based approach[J].Biochem Eng J,2008,40(2):348-356.
[19]李娟,张耀庭,曾伟,等.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志,2000,13(2):118-120.
[20]NING Z,LONG Y.Effect of N+ion implantation on antioxidase activity inBlakeslea trispora[J].Radiat Phys Chem,2008,77(9):1046-1049.
[21]林良斌.SOS修复和突变生产[J].湖南科技大学学报(社会科学版),1991,12(3):92-97.
[22]白冠军,任衍钢,宋玉奇,等.紫外线诱导DNA损伤及修复研究的起因与发展[J].生物学通报,2017,52(3):58-62.
[23]CAO S,ZHOU X,JIN W,et al.Improving of lipid productivity of the oleaginous microalgaeChlorella pyrenoidosavia atmospheric and room temperature plasm(ARTP)[J].Bioresource Technol,2017,244(Pt 2):1400-1406.