通过酵母发酵法制备核酸是目前核酸工业生产的主要方法,以核酸为原料通过分解法生产核苷酸已被广泛应用[1]。核酸是一种大分子物质,几乎参与生物体内所有的生化过程[2]。而核苷酸是核酸的基本结构单位,具有重要的生物学功能。大量临床研究和试验数据表明,酵母核苷酸具有增强免疫[3]、抗氧化[4],维持肠道正常菌群的消化和吸收[5],促进细胞和组织再生与修复的功能[3]。
热带假丝酵母(Candida tropicalis)是重要的工业酵母,是生产长链二羧酸[6]、木糖醇[7]和羟基还原酶[8]等工业原料的主要生产菌,也是利用低成本工业废弃物生产单细胞蛋白的重要微生物[9]。热带假丝酵母还是酵母核酸发酵工业重要的菌株来源,从热带假丝酵母提取的核酸广泛应用于食品和医药工业[10-12]。热带假丝酵母耐糖、耐高温、耐酸、生长速度快的生理性质使之成为发酵生产核酸的优良菌株。目前,从自然界分离、筛选仍然是获得热带假丝酵母工业用菌株的主要方法,基因工程或基因编辑改造手段和法规尚不完善,多数研究仍集中于工艺条件优化[10-12]。
电子束辐射是一种安全性高和可控性强的电离辐射技术,其没有辐射源,不会残留有害物质对环境造成污染。电子加速器产生的电子束可以破坏生物细胞的DNA,或者辐射水和小分子产生-H、-OH等活性自由基,这些自由基导致细胞被氧化,对生物体(微生物等)造成不可弥补的损伤。研究者将电子束辐射运用于诱变育种,在很多植物表现了良好的诱变效应[13-14]。研究发现电子束辐射诱变具有辐射生理损伤小、突变频率高、突变谱宽等特点,是一种极具发展潜力的诱变技术。但应用于微生物的相关研究较少[15-17]。Plackett-Burman试验、最陡爬坡试验结合响应面等方法是广泛使用的工艺优化方法,可以快速、准确、有效地预测发酵过程中的显著影响因子、最佳水平范围及最优条件[18-20]。
本研究以目前核酸工业发酵最高水平菌株,核酸含量为15%~17%的热带假丝酵母(Candida tropicalis)HY4-17为出发菌株,采用电子束辐射技术进行诱变育种,以期筛选得到高产核酸的菌株。拟在获得正向突变株的基础上,通过Plackett-Burman试验确定发酵参数中显著影响核酸含量的因素,再设计最陡爬坡试验,获得核酸最大产量区域,应用中心组合设计(centralcomposite design,CCD)响应面分析法对发酵培养基进行优化,确定最佳培养基;并优化接种量缩短发酵时间,以期获得该突变株在实验水平的最佳核酸发酵条件,为工业化发酵酵母核酸提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
热带假丝酵母(Candida tropicalis)HY4-17:湖北海宜生物科技有限公司保藏。
1.1.2 化学试剂
葡萄糖、蔗糖、甘油、硫酸铵、硫酸锌、硫酸亚铁、硫酸镁、氯化钠、磷酸、盐酸、硼酸、氢氧化钠、高氯酸、酵母抽提物、蛋白胨(均为分析纯或生化试剂):国药集团化学试剂有限公司。
1.1.3 培养基
酵母膏胨葡萄糖(yeastextractpeptonedextrose,YEPD)固体培养基:葡萄糖20 g/L,酵母提取物10 g/L,蛋白胨20 g/L,琼脂2 g/L。
种子培养基[21]:蔗糖20 g/L,酵母提取物20 g/L,硫酸铵2 g/L,硫酸锌0.06 g/L,硫酸镁0.5 g/L,硫酸亚铁0.05 g/L,磷酸1 mL/L,用磷酸和氢氧化钠调pH值至4。
发酵培养基:糖蜜45g/L,硫酸铵2g/L,硫酸锌0.05 g/L,硫酸镁0.5 g/L,硫酸亚铁0.05 g/L,磷酸1 mL/L,用磷酸和氢氧化钠调pH值至4。
以上培养基灭菌条件均为121℃、15 min。
1.2 仪器与设备
DNP-9162型电热恒温振荡培养箱:太仓市强乐实验设备有限公司;HH-2型数显恒温水浴锅:国华电器有限公司;GJ-2-Ⅱ电子加速器:上海先锋电机厂;ZHJH-1112型超净工作台:苏净集团安泰公司;Molecular Devices M2多功能酶标仪:美谷分子仪器(上海)有限公司;PB-10标准型pH计:德国赛多利斯股份公司。
1.3 方法
1.3.1 菌种培养
菌种活化:从-80℃冰箱冻存管中挑取少量菌体加入装有5 mL种子培养基的玻璃试管中,30℃、120 r/min过夜振荡培养。
种子培养:从活化好的试管中接种1 mL种子液到装液量为100 mL/500 mL种子培养基中,30℃、180 r/min振荡培养8 h左右,菌种达到对数期,用于摇瓶发酵。
摇瓶发酵培养方法:接种3%的种子培养液于装液量为30 mL/250 mL发酵培养基中,30℃、220 r/min振荡培养。
1.3.2 核酸分析检测
使用酶标仪测定OD562nm值;核酸产量测定参照文献[22]的高氯酸法略作修改:取对数中期的酵母菌液2mL于A、B两个试管中,4000r/min离心10min,A管置于60℃烘箱中烘干称质量,B管倒掉上清,加1mL生理盐水重悬,以4000r/min离心10 min,将上清尽量取干净,加入10%的高氯酸2 mL,置于70℃的水浴锅中加热20 min,期间每隔4~5 min上下颠倒试管混匀,然后置于冰上冷却,以10 000 r/min离心10 min。取100 mL上清液加入4.9 mL的无菌水中,振荡混匀,用酶标仪在波长260nm处测定吸光度值,空白为100 μL 10%的高氯酸加入4.9 mL的无菌水中。核酸含量及核酸产量计算公式如下:
Y=m/2×X
式中:X为核酸含量,%;Y为核酸产量,mg/mL;A为波长260nm处样品的吸光度值;50为稀释倍数;2为高氯酸体积,mL;m为2 mL菌液所得菌体质量,mg;26为1 mL/mg核酸标准品的吸光度值;m/2为生物量,mg/mL。
1.3.3 电子束辐射诱变
电子束辐照诱变热带假丝酵母的最大束功率为2.0MeV,50kW,每次实验辐射能量保持在1.8MeV。取10mL对数中后期的菌悬液装于已灭菌的透明培养袋中,密封用于辐照。热带假丝酵母辐照剂量分别为0.5 kGy、1.0 kGy、1.5 kGy、2.0kGy、3.0kGy、4.0kGy,以未照射的假丝酵母作为对照组。样品处理完毕后,分别用生理盐水稀释,涂布到固体培养基上,在30℃恒温培养48 h,计算菌株致死率,其计算公式如下:
1.3.4 突变菌株的筛选
初筛挑取诱变后较大的单菌落于加入装有5 mL种子培养基的玻璃试管中28℃、120 r/min,过夜振荡培养活化。采用1.3.1的菌种培养方法扩大并发酵8 h,选择OD562nm值>0.6的突变株,根据1.3.2核酸测定方法测定核酸含量,选取核酸含量提高10%以上的突变株复筛。复筛菌株培养方法及核酸含量测定方式同初筛。
1.3.5 突变菌株的生长曲线
接种3%的种子培养液于装液量为30 mL/250 mL发酵培养基中,30℃、220 r/min培养,每隔2 h使用酶标仪检测OD562nm值,以时间为横坐标,OD562nm值为纵坐标绘制生长曲线,根据生长曲线选择生长速率最快的突变株,及确定突变株的生长周期。
1.3.6 突变菌株的遗传稳定性
将经过诱变复筛得到的高产核酸的突变株在YEPD培养基平板上连续转接8代,进行摇瓶发酵试验,测定对数中期核酸含量,检测菌株的遗传稳定性。
1.3.7 发酵培养基的优化
(1)Plackett-Burman(PB)试验设计
选用N=12的Plackett-Burman两水平法对影响核酸产量的7种因素进行考察[21],筛选出对核酸产量有显著作用的因素。使用Minitab 18.0软件进行Plackett-Burman试验设计,试验因素与水平见表1,其中“-1”表示低水平,“1”表示高水平。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman tests design
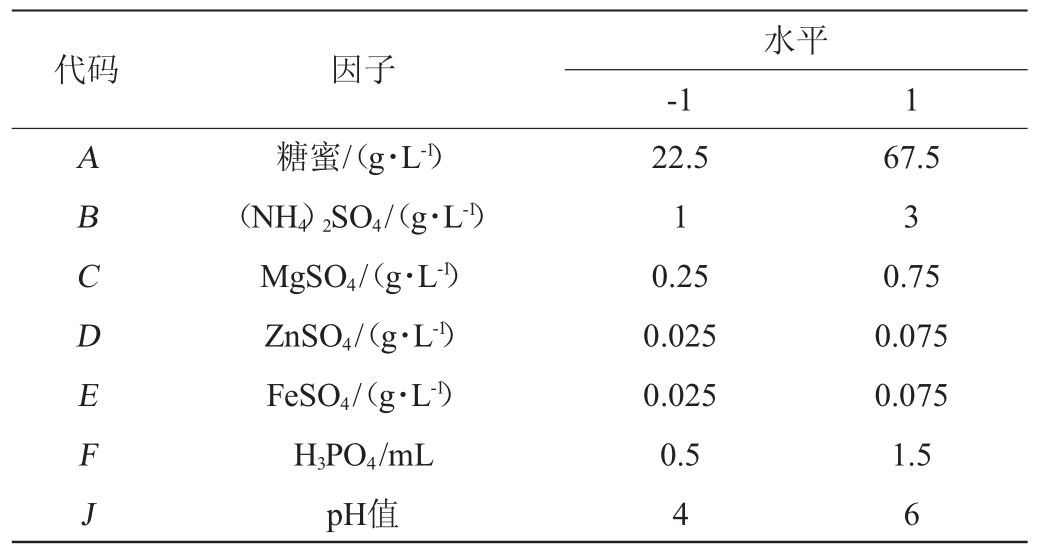
代码 因子 水平-1 1 ABCDEFJ糖蜜/(g·L-1)(NH4)2SO4/(g·L-1)MgSO4/(g·L-1)ZnSO4/(g·L-1)FeSO4/(g·L-1)H3PO4/mL pH值22.5 1 0.25 0.025 0.025 0.5 4 67.5 3 0.75 0.075 0.075 1.5 6
(2)最陡爬坡试验
依据Plackett-Burman试验结果,将显著影响核酸产量的因素:糖蜜、硫酸铵、pH,进行最陡爬坡优化。依据效应分析,以表1初始水平“0”为起点,正显著因素逐步提高含量,负显著影响因素逐步降低含量,其他非显著影响因素取初始水平,获得核酸含量最大时相应的糖蜜、硫酸铵、pH值。
(3)响应面试验设计
通过最陡爬坡试验获得核酸最大产量区域后,根据中心点确定显著因子的高、中、低水平,分别以-2、-1、0、1、2编码,响应面试验因素与水平见表2。
表2 响应面试验因素与水平
Table 2 Factors and levels of response surface tests
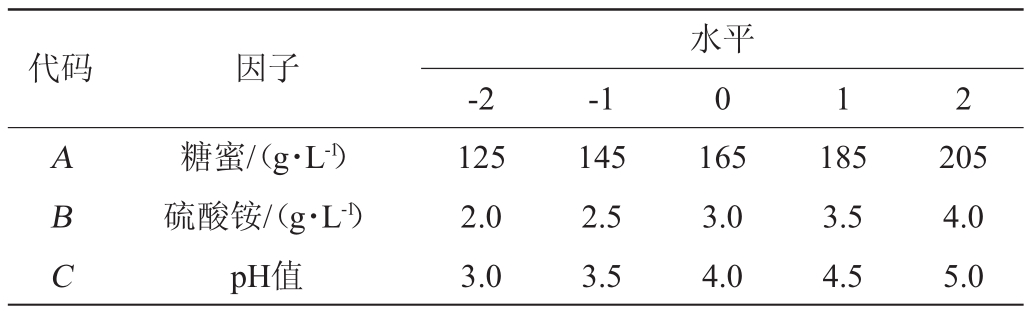
代码 因子-2 -1水平0 1 2 ABC糖蜜/(g·L-1)硫酸铵/(g·L-1)pH值125 2.0 3.0 145 2.5 3.5 165 3.0 4.0 185 3.5 4.5 205 4.0 5.0
1.3.8 接种量和发酵时间对核酸产量的影响
使用响应面优化得到的培养基,分别接种3%、5%、8%、10%、12%的种子培养液于装液量为30 mL/250 mL发酵培养基中,30℃、220r/min培养,分别于6 h、8 h、12 h、16 h、18 h检测核酸产量及生物量。
1.3.9 数据分析
响应面试验数据采用Design Expert10.0软件进行统计学分析,每组试验进行3个重复,取3个重复的平均值。
2 结果与分析
2.1 电子束辐射诱变
参考前期文献对铜绿微囊藻的[17]诱变剂量,及电子加速器剂量限制条件(辐射剂量最低为0.5 kGy可保障其准确性),辐照剂量分别为 0.5 kGy、1.0 kGy、1.5 kGy、2.0 kGy、3.0kGy、4.0kGy,以未照射的假丝酵母HY4-17作为对照组。诱变处理完毕后,分别用生理盐水稀释,涂布到YEPD固体培养基上,在30℃恒温培养48 h,结果见图1。

图1 诱变菌株的菌落形态
Fig.1 Colony morphology of mutant strains
由图1可知,经0.5 kGy剂量电子束辐射处理后稀释10-5平均存活48个单菌落,菌落形态较为均一,为乳白色球状,大小与出发菌株相近。分析致死率,0.5 kGy剂量为98%,辐照剂量≥1.0 kGy致死率接近100%。据文献报道[23],当致死率为85%~95%时,可获得较高的正突变率。选择致死率最低接近95%的0.5 kGy剂量筛选突变株。
2.2 突变菌株的筛选结果
本研究对0.5 kGy诱变剂量YEPD固体培养基挑选出的100个较大单菌落菌种培养,选择培养8 h,生长较快即OD562nm值>0.6的33株突变株测定核酸含量,结果见图2。

图2 电子束诱变初筛及复筛结果
Fig.2 Preliminary and secondary screening results after electron beam mutagenesis
“*”表示突变株与原始菌株HY4-17比较差异显著(P<0.05);“**”表示差异极显著(P<0.01)。
由图2A可知,筛选到15株核酸含量高于原始菌株HY4-17的突变株,其中7株菌株的核酸含量提高10%以上,显著高于HY4-17。选择这7株突变株进行复筛,图2B可知,复筛得到4株核酸含量显著提高的突变株,其中突变株EBI-21和EBI-22核酸含量最高,均达到20.8%,比出发菌株提高了25%。因此,选择菌株EBI-21和EBI-22作为为进一步研究的菌株。
2.3突变菌株的生长曲线
由于酵母核酸含量在对数生长期最高,随发酵时间延长会不断降低,最终达到稳定。选择生长速率快且核酸含量高的菌株尤为重要。以原始菌株HY4-17为对照,实验进一步研究了突变株EBI-21和EBI-22的生长曲线,结果见图3。由图3可知,3株菌在0~4 h为迟缓期,4~14 h为对数生长期,14~18h为稳定期,OD562nm值=0.6为对数中期。培养8 h,出发菌株HY4-17、突变菌株EBI-21和EBI-22的OD562nm值分别达到0.6、0.8和0.7,突变菌株EBI-21和EBI-22生长速率明显优于出发菌株HY4-17,更早的进入对数中期。而突变菌株EBI-21则是生长速率最快的菌株,培养7h,其OD562nm值达到0.6,比出发菌株HY4-17提前1h进入对数中期。突变菌株EBI-22约培养7.8h,OD562nm值达到0.6。因此,菌株EBI-21作为进一步研究的出发菌株。

图3 菌株EBI-21和EBI-22的生长曲线
Fig.3 Growth curves of strain EBI-21 and EBI-22
2.4 突变株EBI-21的遗传稳定性
突变株的遗传稳定性对于菌株的应用至关重要。对筛选出的突变菌株EBI-21进行遗传稳定性实验。连续传代8代,测定其每代摇瓶发酵核酸含量,结果见表3。
表3 菌株EBI-21多次传代后对核酸含量的影响
Table 3 Effect of multiple passage of strain EBI-21 on nucleic acid
content
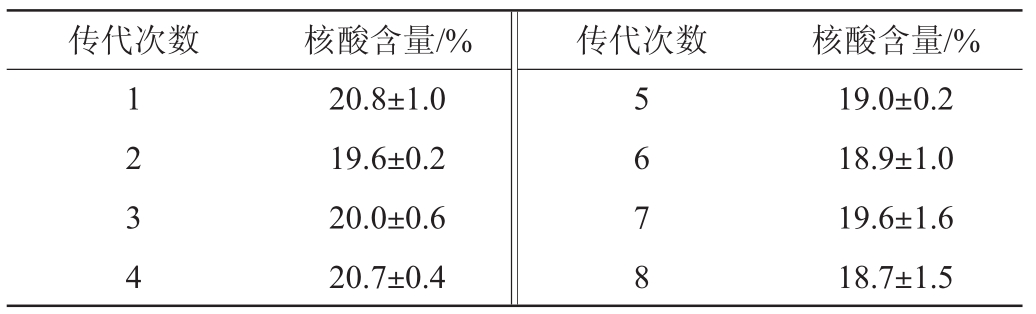
传代次数 核酸含量/% 传代次数 核酸含量/%1 2 3 4 20.8±1.0 19.6±0.2 20.0±0.6 20.7±0.4 5 6 7 8 19.0±0.2 18.9±1.0 19.6±1.6 18.7±1.5
由表3可知,突变菌株EBI-21经过8代遗传稳定性试验,核酸含量维持在(18.7±1.5)%~(20.8±1.0)%。经统计学分析,传代2~8次与第一代相比,差异不显著(P>0.05),表明突变菌株EBI-21遗传稳定性良好。因此,以EBI-21为出发菌优化发酵条件,进一步提高核酸产量。
2.5 响应面法优化发酵培养基
2.5.1 Plackett-Burman试验
尽管酵母核酸含量随发酵时间延长会不断降低[24],而随生物量的增加,核酸产量随时间延长在不断增加。在优化培养基之前,预实验以EBI-21为出发菌,摇瓶发酵培养22 h核酸产量达到最高。
Plackett-Burman试验设计结果见表4,用Minitab18.0软件对表4试验数据进行处理,并进行各因素效应分析,结果见表5。由表5可知,糖蜜、硫酸铵、pH对核酸的产量具有显著性影响(P<0.05),由P值可知,影响效应依次为糖蜜>pH值>硫酸铵。糖蜜和硫酸铵对核酸产量的影响呈正效应,pH值对核酸产量的影响呈负效应。
表4 Plackett-Burman设计与结果
Table 4 Design and results of Plackett-Burman tests
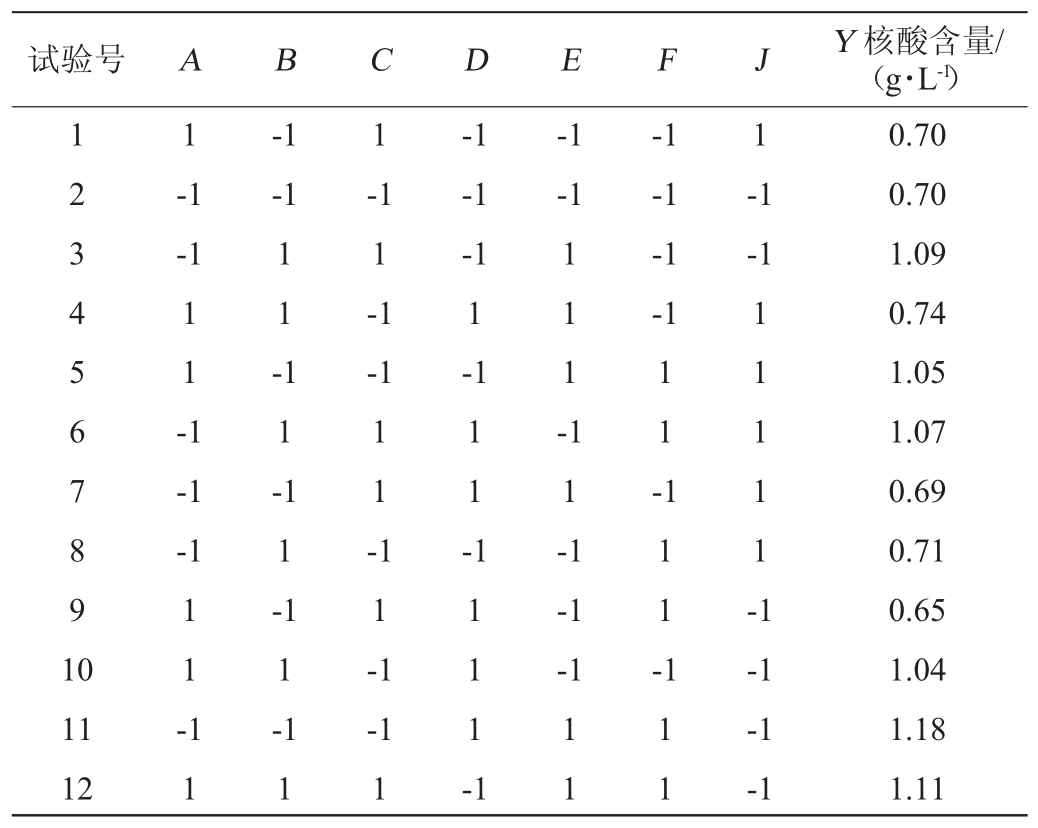
试验号 A B C D E F J Y核酸含量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 1 1 1-1-1-1-1-1-1-1-1 1 1 -1 1 1 --1 1-1-1-1-1-1 1-1 1 1 1 --1-1-1-1-1-1 1 1 -1 1 -1 1 -1 1 -1 1 -1 1 -1 1 1 -1 1 -1 1 -1-1-1 1 1 1 -1 1 1 1 1 -1 11 12 1 1 1 1-1 1 1 1 1 1 -1 1 1 1 1 1-1-1-1 0.70 0.70 1.09 0.74 1.05 1.07 0.69 0.71 0.65 1.04 1.18 1.11
表5 Plackett-Burman试验因素水平及效应分析
Table 5 Factor,levels and effect analysis of Plackett-Burman tests

注:“+”表示差异显著(P<0.05);“NS”表示无显著性差异。
编码 因子 T值 P值 显著性ABCDEFJ糖蜜(NH4)2SO4 MgSO4 ZnSO4 FeSO4 H3PO4 pH值40.07 4.28 1.25-1.38 0.99 1.64-5.72 0.000 0.013 0.279 0.239 0.380 0.175 0.005++N S NS NS NS+
2.5.2 最陡爬坡试验
根据PB试验结果的效应分析,通过最陡爬坡试验分别优化糖蜜,硫酸铵及pH值,试验设计及结果见表6。由表6可知,当糖蜜质量浓度为165 g/L,硫酸铵质量浓度为3 g/L,pH值为4时,核酸产量最高,因此选为中心点,进行响应面试验设计。
表6 最陡爬坡试验设计及结果
Table 6 Design and results of the steepest ascent tests

试验号ABJY核酸产量/(g·L-1)1 2 3 4 5 45 105 165 225 285 2 5 2.5 3 3.5 4 4.5 4 3.5 3 0.96 1.22 1.46 1.38 1.26
2.5.3 响应面试验预测最优培养基
根据最陡爬坡试验结果分析,结合试验需要,响应面试验设计与结果表7,非显著因子选用PB试验“0”对应的水平。将中心点设为糖蜜为165g/L,硫酸铵为3g/L,pH值为4。响应面二次回归模型方差分析结果见表8。
表7 响应面试验设计及结果
Table 7 Design and results of response surface tests
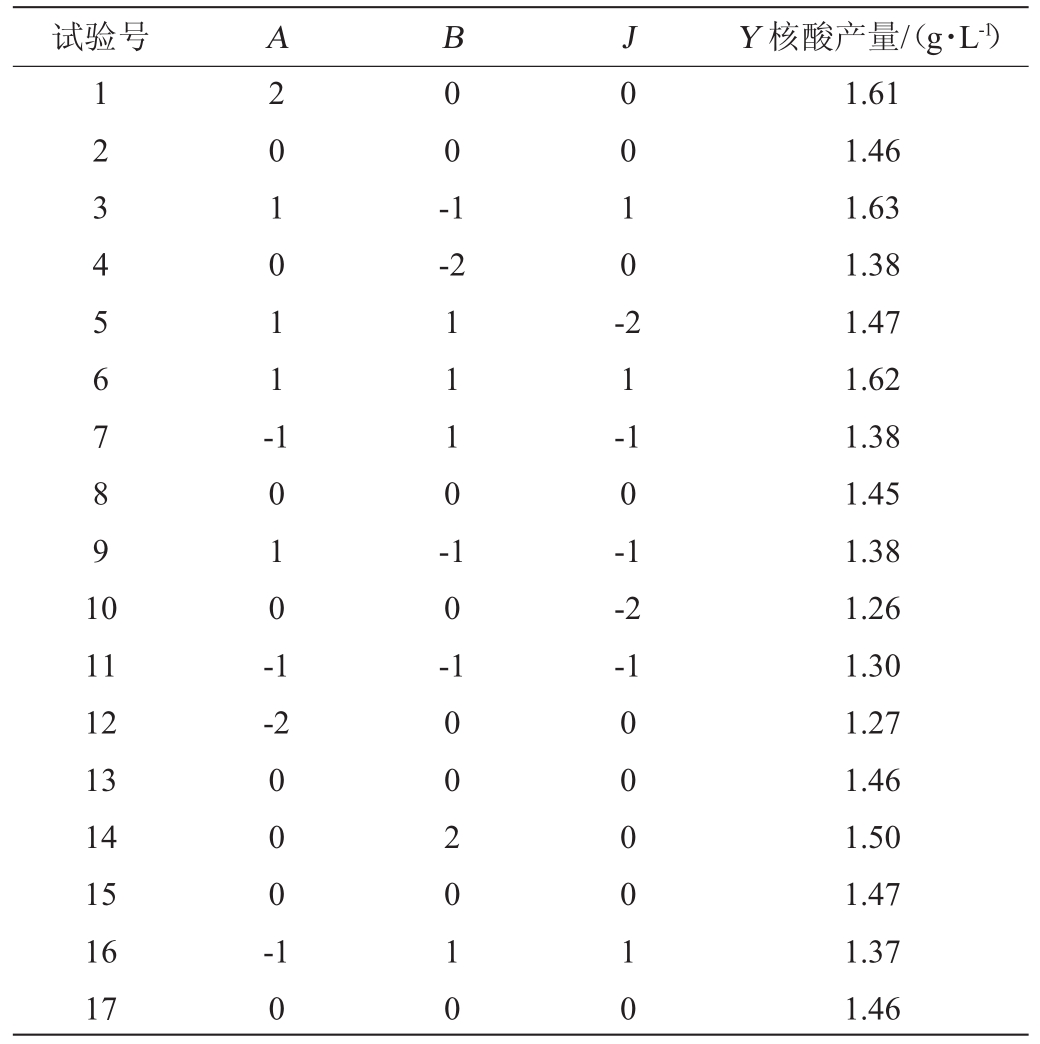
试验号ABJY核酸产量/(g·L-1)12345 6 7891 0 20101 1 -0 0 -1-2 1 1 10-0 0 1 0 -2 1 -1 0 -1 11 12 13 14 15 16 17 1 0 1 0 -1 1 0 --2-1-2 0 0 0 -10 1002010 000010 1.61 1.46 1.63 1.38 1.47 1.62 1.38 1.45 1.38 1.26 1.30 1.27 1.46 1.50 1.47 1.37 1.46
通过Design Expert分析软件对表8数据进行回归分析,得到核酸产量(Y)对糖蜜(A)、硫酸铵(B)及pH值(C)的二次回归方程如下:
Y=1.46+0.086A+0.026B+0.057C-0.004 34AB+0.047AC-
0.020 BC-0.003 75A2-0.005 44B2-0.021C2
表8 回归模型方差分析
Table 8 Variance analysis of regression model

注:“**”表示对结果影响极显著(P<0.01)。
变异来源 平方和 自由度 均方 F值 P值 显著性模型ABCA B********AC BC A2 B2 C2残差失拟项纯误差总回归0.2 0.095 8.67E-03 0.018 1.02E-04 0.012 2.25E-03 3.31E-04 6.93E-04 4.01E-03 1.24E-03 1.00E-03 2.40E-04 0.2 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.022 0.095 8.67E-03 0.018 1.02E-04 0.012 2.25E-03 3.31E-04 6.93E-04 4.01E-03 1.78E-04 3.35E-04 5.99E-05 124.73 532.94 48.76 98.55 0.57 66.41 12.63 1.86 3.9 22.57<0.000 1<0.000 1 0.000 2<0.000 1 0.473 4<0.000 1 0.009 3 0.214 9 0.088 8 0.002 1******5.590.064 9 R2=99.38%,R2adj=98.58%
由表8可知,模型的P值<0.000 1,表明模型极显著;失拟项的P值为0.064 9>0.05,表明差异不显著,残差由随机误差引起,可以判定该模型与样本具有较高的相关性。一次项A、B、C,交互项AC、BC,二次项C2对核酸产量均有极显著性影响(P<0.01)。决定系数R2=0.993 8,说明模型拟合性较好,调整决定系数R2adj=0.985 8,说明该模型能解释98.58%的响应值变化,表明该模型可行度高。
通过Minitab软件对回归方程计算,预测核酸含量最高时各因素水平如下:糖蜜185g/L,硫酸铵3g/L,pH值为4.5,核酸产量理论预测值为1.63 g/L。在此优化条件下进行3次平行验证试验,获得的核酸产量平均值为1.64 g/L,与理论预测值接近,说明该模型可行。
2.6 接种量对发酵时间和核酸产量的影响
除优化培养基外,还探索了最适接种量对培养时间及核酸产量的影响,结果见图4。由图4可知,核酸产量随时间延长而升高,达到稳定期不再增长,接种量为8%,核酸产量在12 h时达到最高,为1.73 g/L。接种量为3%和5%时,核酸产量分别在16 h、18 h时达到最高,相比接种量为8%时发酵时间增加4~6 h。所以相对较高的接种量能缩短发酵时间,但不影响核酸产量,并节约生产成本,利于工业生产。
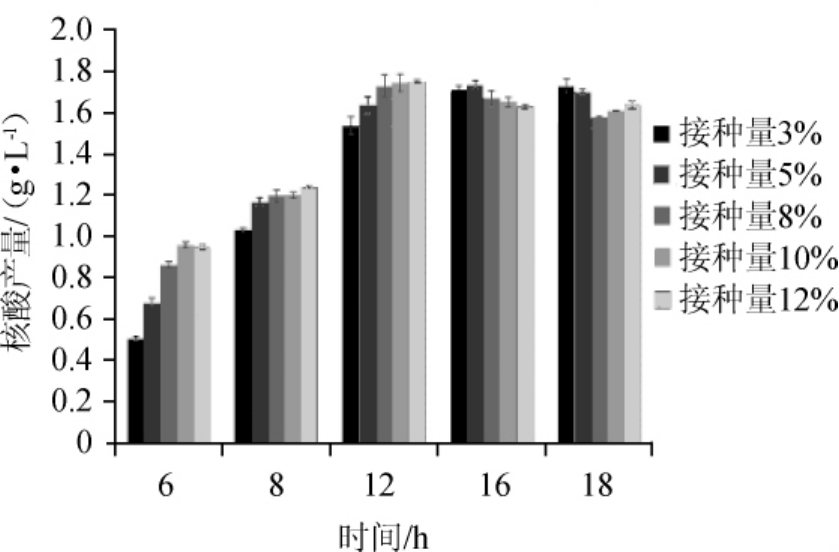
图4 不同接种量对发酵时间和核酸产量的影响
Fig.4 Effect of inoculum on fermentation time and nucleic acid production
3 结论
本研究采用电子束辐射诱变技术对高产核酸的热带假丝酵母HY4-17菌株进行处理,在0.5 kGy剂量诱变单菌落中成功地筛选得到核酸含量高达20.8%的突变株,比出发菌株提高了25.9%,是目前报道的菌株中核酸含量最高的。突变株EBI-21的生长速率明显提高,可提前1 h进入对数中期。通过PB试验,最陡爬坡试验及CCD试验等手段优化发酵培养基,培养基优化后组成为糖蜜185 g/L,硫酸铵3g/L,硫酸锌0.05g/L,硫酸镁0.5g/L,硫酸亚铁0.05g/L,磷酸1 mL/L,pH值为4.5。除了优化培养基,还探索了最适接种量。最优接种量为8%,发酵时间为12 h。在此优化条件下,核酸产量达到1.73g/L,与初始培养条件相比提高了80.21%,培养时间缩短了10 h。
[1]桂建芳.RNA加工与细胞周期调控[M].北京:科学出版社,1998:20-128.
[2]SLOBODIANIK N H.Dietary ribonucleotides and health[J].Nutrition,2003,19(1):68-69.
[3]RUDOLPH F B.Symposium:dietary nucleotides:a recently demonstrated requirement for cellular development and immune function[J].J Nutr,1994,124(8 Suppl):1431S-1432S.
[4]杨建松,曾雨雷,黄鑫.外源核苷酸在动物养殖中的应用[J].饲料研究,2014(23):37-39.
[5]UAUY R,QUAN R,GIL A.Role of nucleotides in intestinal development and repair:Implications for infant nutrition[J].J Nutr,1994,124(8 Suppl):1436S-1441S.
[6]程成,汪俊卿,王腾飞,等.热带假丝酵母ctpxa1基因缺失菌的构建及对长链二元酸积累的影响[J].生物工程学报,2017,33(2):237-246.
[7]崔媛媛,刘容,许琳琳,等.热带假丝酵母发酵甘蔗渣水解液生产木糖醇[J].食品工业,2018,39(7):14-18.
[8]王普,孙立明,何军邀.响应面法优化热带假丝酵母104菌株产羰基还原酶发酵培养基[J].生物工程学报,2009,25(6):863-868.
[9]李昆太,周佳,庞会忠,等.热带假丝酵母SG-1产单细胞蛋白的发酵培养基优化[J].中国饲料,2013(3):15-17,21.
[10]周震,邱蔚然,闫蓬勃.产核酸和乳糖酶的热带假丝酵母QZN0209培养条件研究[J].工业微生物,2002,32(3):28-32.
[11]张立涛.热带假丝酵母高产核糖核酸的连续发酵及提取纯化工艺研究[D].济南:山东大学,2013.
[12]YAMASHITA S,KADO H,MASUDA T.Ribonucleic acid-enriched brewer's yeast cells and process for producing the same:US,7135327 B2[P].2004-07-22.
[13]张志伟.唐菖蒲电子束及中子诱变育种基础研究[D].绵阳:西南科技大学,2007.
[14]林祖军,孙纪霞,迮福,等.电子束在花卉诱变育种上的应用[J].核农学报,2002(6):351-354.
[15]王明慧.降解亚硝酸盐的高效植物乳杆菌的电子束诱变育种[D].长春:吉林农业大学,2015.
[16]陈晓平,马千,谢晶,等.降解AFB1黑曲霉的电子束辐照诱变育种最佳工艺优选[J].食品科技,2016,41(8):23-26.
[17]LIU S Y,WU M H,JIANG Q P.Control and removal of microcystin production ofMicrocystis aeruginosaby irradiation of electron beam[J].Environ Sci,2012,33(5):1575-1578.
[18]田萍萍,曹鹏,常传友,等.阿维菌素生产菌的常压室温等离子体诱变育种及培养基优化[J].微生物学通报,2017(1):150-160.
[19]叶广彬,陈源红,王长丽,等.柠檬明串珠菌TD1产胞外多糖条件的响应面法优化及其抗氧化性研究[J].中国酿造,2018,37(11):70-75.
[20]SA-UTHC,RATTANASENAP,CHANDRAPATYAA,etal.Modification of medium composition for enhancing the production of antifungal activity fromXenorhabdus stockiaePB09 by using response surface methodology[J].Int J Microbiol,2018,2018:1-10.
[21]LI B,CHEN X,REN H,et al.Kinetic models of ribonucleic acid fermentation and continuous culture byCandida tropicalisno.121[J].Bioproc Biosyst Eng,2012,35(3):415-422.
[22]OHTA S,MAUL S,SINSKEY A J,et al.Characterization of a heat-shock process for reduction of the nucleic acid content ofCandida utilis[J].Appl Microbiol,1971,22(3):415-421.
[23]李慧玲,刘永梅.诱变选育高产DHA裂殖壶菌突变株[J].食品科技,2015(9):12-16.