葡萄汁中含氮化合物的含量和比例,因葡萄品种、栽培方式、采收时间等因素的不同而存在差异[1-2]。氮源的存在形式包括铵离子、氨基酸、多肽和蛋白质,但是只有铵离子和一些氨基酸可以被酵母吸收利用,此类氮源称为酵母可同化氮(yeast assimilable nitrogen,YAN)[3-4]。在无其他限制因素情况下,YAN决定酵母细胞生长速度和酒精发酵速率[1,5],影响发酵过程中微生物的代谢,导致葡萄酒中化学成分的差异[6-7]。
在葡萄酒酿造过程中,酿酒酵母除了进行酒精发酵外,还会利用其自身的硫酸盐还原途径,代谢生成H2S。H2S具有臭鸡蛋气味,且阈值很低,会严重损坏葡萄酒感官质量[8]。酿酒酵母的基因背景差异是造成H2S释放量不同的主要原因[9]。同时,还有很多因素影响酵母产H2S,如碳源、氮源、硫源、温度等不同的培养条件[10]。因此,酿酒酵母代谢产H2S受菌株遗传背景和环境的双重影响。研究发现[11-12],发酵过程中H2S的总产量与发酵液中的氮含量成反比。然而,SANTIAGO M等[13-14]研究发现,添加YAN不仅不会减少H2S的产生,甚至在某些情况下会加剧H2S的释放,并具有菌株依赖性。目前,最常见的处理H2S的方法是向葡萄醪中添加磷酸氢二铵或磷酸铵,不仅可以提高发酵速率,也能有效降低H2S的产量[15]。但是,若添加不当,也会产生适得其反的效果[16]。因此,了解每个菌株的具体氮需求,可有效降低发酵迟滞和H2S大量生成的风险[17]。
目前,葡萄酒酿造中使用的酵母多以中低产H2S酿酒酵母(Saccharomyces cerevisiae)为主,本研究以3株本土低产硫化氢的野生型酿酒酵母41y5、182y12和174y1为研究对象,利用Triple M培养基,即模拟葡萄汁,探索不同初始YAN质量浓度对酿酒酵母发酵特性的影响,并对各指标间的相关性进行分析。旨在筛选不同初始YAN质量浓度下低产或不产H2S的酿酒酵母,有助于本土酿酒酵母的应用,对生产有现实指导意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomycescerevisiae)41y5、182y12、174y1、112y4:由西北农林科技大学葡萄酒学院从陕西省咸阳市泾阳县自然发酵葡萄醪中筛选的本土野生型低产H2S酿酒酵母。
1.1.2 化学试剂
葡萄糖、果糖、无氨基酵母氮源(yeast-nitrogen-base withoutaminoacids,YNB)(均为生化试剂)、麦角固醇、L-脯氨酸、L-精氨酸(纯度均>99%):北京索莱宝科技有限公司;L-(+)酒石酸、L-(-)苹果酸、无水柠檬酸(纯度均>99%):阿拉丁试剂(上海)有限公司;水解酪蛋白、半乳糖(纯度均>99%):美国Sigma公司;其他试剂均为国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L;固体培养基中添加琼脂20 g/L,115℃高压灭菌30 min。
Triple M培养基(模拟葡萄汁):参照MARTÍNEZMORENO R等[18]的方法配制。Triple M培养基中的氮源质量浓度为300 mg/L(包括120 mg/L无机铵盐与180 mg/L混合氨基酸),参照BELTRAN G等[3]的方法将Triple M培养基中的无机铵盐与混合氨基酸按同样比例进行调节,将初始可同化氮的质量浓度分别调整为100 mg/L、200 mg/L、300 mg/L和400 mg/L,分别简写为N100、N200、N300和N400。Triple M培养基的正常pH值为3.25,因此,将N300的Triple M培养基的初始pH值用4 mol/L氢氧化钾分别调整为3.2、3.6和4.0。
1.2 仪器与设备
MJPS-250型恒温培养箱、DHG-9071A鼓风干燥箱、DK-S22电热恒温水浴锅:上海精宏实验设备有限公司;ZWY2102全温摇床:上海智诚分析仪器制造有限公司;UV1800紫外可见分光光度计:日本岛津公司;PB-10酸度计:北京赛多利斯仪器系统有限公司;BK1301生物显微镜:重庆光电仪器有限公司;SBA-40D型生物传感分析仪:山东省科学院生物研究所;YBL10-71103血球计数板:上海求精生化试剂仪器有限公司;H2S检测管:上海豫东电子科技有限公司。
1.3 方法
1.3.1 酿酒酵母发酵速率的测定
采用含4种质量浓度可同化氮源(N100、N200、N300和N400)的TripleM培养基发酵。酵母的接种量为5×106CFU/mL,装液量为300 mL/500 mL,发酵温度为20℃,静置发酵,每个实验组均重复3次。发酵期间每24h称质量,监测CO2质量损失,直到连续两次质量损失不变,发酵中止。
1.3.2 发酵过程中指标的测定
生物量的测定:每24 h取样,利用分光光度法测定样品在波长560nm处的吸光度值;H2S产量的测定[8]:每8 h取样,利用H2S检测管测定样品中H2S的产量。
1.3.3 发酵后指标的测定
挥发酸含量的测定:参照国标GB/T15038—2006《葡萄酒、果酒通用分析方法》进行测定。
1.3.4 数据分析
采用SPSS 20.0软件进行数据分析处理,采用Duncan检验法进行方差分析,采用Pearson相关分析进行相关性分析,双侧检验计算线性相关关系的显著性,每组实验重复3次。采用Origin 8.5软件进行绘图。
2 结果与分析
2.1 可同化氮质量浓度对酿酒酵母生长的影响
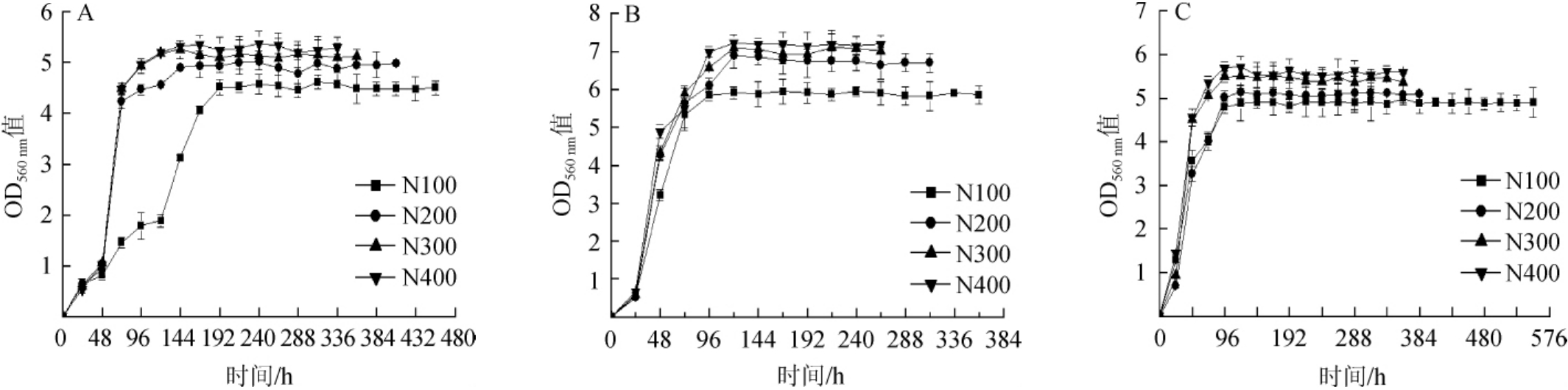
图1 可同化氮质量浓度对酿酒酵母41y5(A)、174y1(B)、182y12(C)生长的影响
Fig.1 Effect of different yeast assimilable nitrogen concentrations on the growth ofSaccharomyces cerevisiae41y5(A),174y1(B)and 182y12(C)
YAN的质量浓度对酿酒酵母41y5、174y1和182y12生长的影响结果见图1。由图1可知,酿酒酵母41y5、174y1和182y12的生物量均随初始YAN质量浓度的升高呈现先增加后稳定的趋势。当初始YAN质量浓度为100 mg/L时,菌株41y5在发酵初期生长缓慢,分析原因可能是YAN质量浓度过低,在发酵初期不能完全满足菌株41y5的生长需求;而菌株174y1和182y12在4个初始YAN质量浓度条件下,对数生长期的生物量均无明显差异。结果表明,不同菌株在对数生长期对YAN含量的需求存在差异。但是,当YAN质量浓度>200 mg/L时,继续增加YAN质量浓度,对菌株的生长速度无明显影响,这与TAILLANDIER P等[19]的研究结果一致。
2.2 可同化氮质量浓度对酿酒酵母发酵速率的影响
CO2释放速率可以间接反应菌株的发酵速率,YAN的质量浓度对酿酒酵母41y5、174y1和182y12发酵速率的影响结果见图2及表1。由图2可知,菌株41y5、174y1和182y12的发酵速率随着发酵时间的延长呈先快速升高,后缓慢降低直至稳定的趋势,且发酵速率在48~144 h内达最高。当初始YAN的质量浓度为400 mg/L时,3株菌株的发酵周期均最短,与BELTRAN G等[20]的研究结论一致,即增加初始YAN的质量浓度,有助于缩短发酵周期,加快发酵速率。当初始YAN的质量浓度(即300 mg/L和400 mg/L)较高时,菌株174y1和182y12在48 h左右进入快速发酵阶段,比菌株41y5提前48 h。由表1可知,在4个YAN质量浓度条件下,3株菌株的CO2平均释放速率是不同的。当YAN质量浓度>200 mg/L之后,菌株41y5的CO2平均释放速率无显著差异(P>0.05);而对于菌株174y1和182y12,各自的CO2平均释放速率在4个YAN质量浓度条件下均具有显著性差异(P<0.05),且当YAN质量浓度为400 mg/L时,CO2平均释放速率降低。
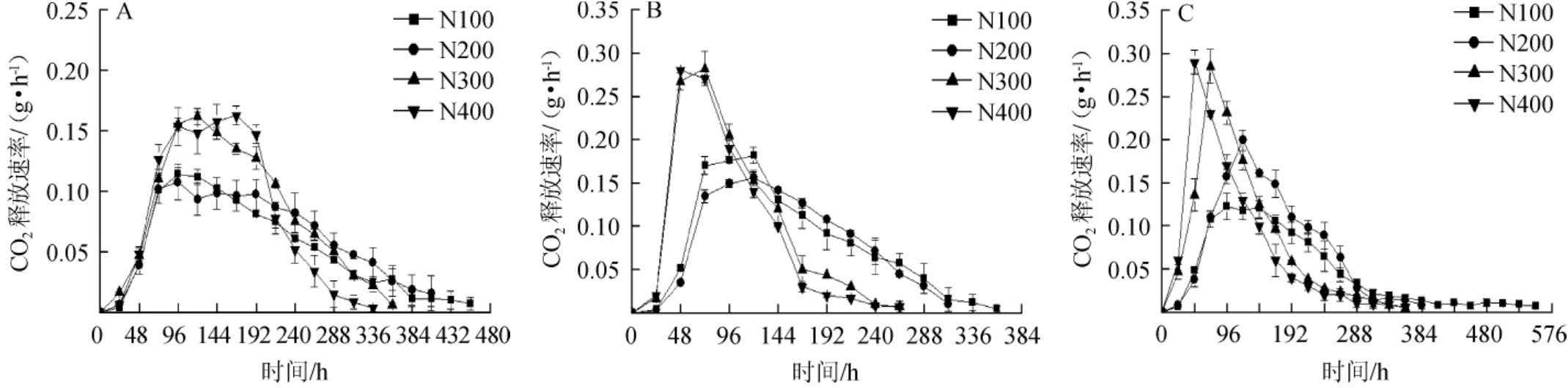
图2 不可可同化氮质量浓度对酿酒酵母41y5(A)、174y1(B)、182y12(C)CO2释放速率的影响
Fig.2 Effect of different yeast assimilable nitrogen concentrations on CO2release rate ofSaccharomyces cerevisiae41y5(A),174y1(B)and 182y12(C)
表1 不可可同化氮质量浓度条件下酿酒酵母41y5、174y1、182y12的CO2释放情况
Table 1 CO2release ofSaccharomyces cerevisiae41y5,174y1 and 182y12 under different yeast assimilable nitrogen concentrations
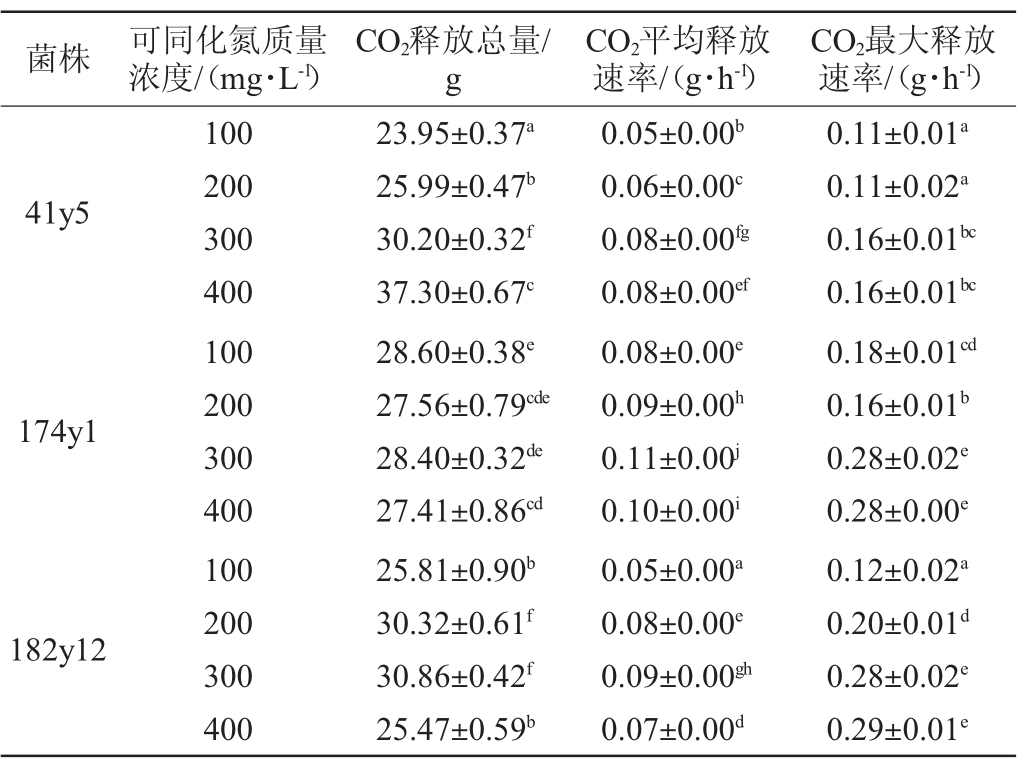
注:同列肩标不同小写字母表示差异显著(P<0.05)。
菌株 可同化氮质量浓度/(mg·L-1)CO2释放总量/g CO2平均释放速率/(g·h-1)CO2最大释放速率/(g·h-1)41y5 174y1 182y12 100 200 300 400 100 200 300 400 100 200 300 400 23.95±0.37a 25.99±0.47b 30.20±0.32f 37.30±0.67c 28.60±0.38e 27.56±0.79cde 28.40±0.32de 27.41±0.86cd 25.81±0.90b 30.32±0.61f 30.86±0.42f 25.47±0.59b 0.05±0.00b 0.06±0.00c 0.08±0.00fg 0.08±0.00ef 0.08±0.00e 0.09±0.00h 0.11±0.00j 0.10±0.00i 0.05±0.00a 0.08±0.00e 0.09±0.00gh 0.07±0.00d 0.11±0.01a 0.11±0.02a 0.16±0.01bc 0.16±0.01bc 0.18±0.01cd 0.16±0.01b 0.28±0.02e 0.28±0.00e 0.12±0.02a 0.20±0.01d 0.28±0.02e 0.29±0.01e
2.3 可同化氮质量浓度对模拟葡萄酒pH值的影响
YAN的质量浓度对模拟葡萄酒pH值的影响结果见图3。
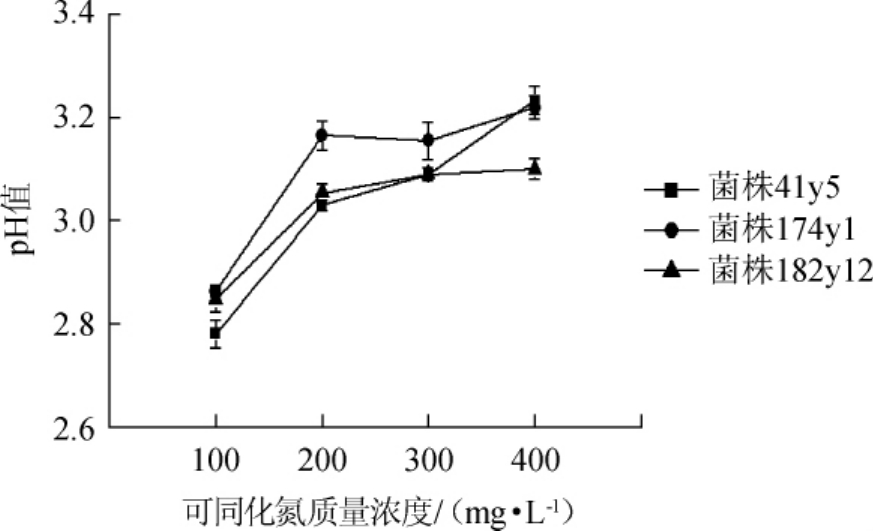
图3 不同可同化氮质量浓度对模拟葡萄酒pH值的影响
Fig.3 Effect of different yeast assimilable nitrogen concentrations on pH value of simulated wine
由图3可知,3株菌株发酵后,模拟酒的pH值均随初始YAN质量浓度的升高而增加,与AKINH等[4]的研究结果一致,即酒精发酵后,培养基的pH值与初始YAN质量浓度之间存在一定的相关性。在我国西北葡萄酒产区,葡萄酒的pH普遍偏高,而过高的pH会对葡萄酒在陈酿过程中的颜色和生物学稳定性造成不利影响。因此,若过多添加氮源,将进一步提高葡萄酒的pH值,加剧葡萄酒陈酿过程中面临的问题。
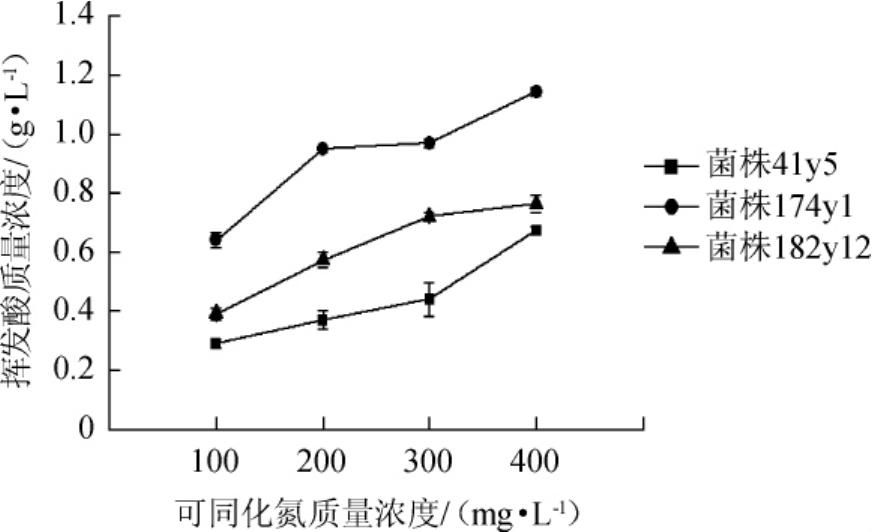
2.4 可同化氮质量浓度对模拟葡萄酒中挥发酸含量的影响
挥发酸含量可以反应葡萄卫生状况、葡萄酒生产过程及后期管理的状况。国标GB 15037—2006《葡萄酒》中对葡萄酒挥发酸含量做了限量要求,葡萄酒的挥发酸含量应≤1.2 g/L,过高的挥发酸带来的醋酸味会严重破坏葡萄酒的感官质量,降低葡萄酒的品质。因此,研究YAN的质量浓度对模拟葡萄酒中挥发酸含量的影响,结果见图4。由图4可知,3株菌株发酵后,模拟酒中的挥发酸含量随初始YAN质量浓度的升高而增加。其中,菌株174y1的挥发酸含量明显高于其余两株菌,且当YAN质量浓度为400 mg/L时,挥发酸含量已达1.14 mg/L。因此,要针对所使用菌株,合理调整初始YAN质量浓度,避免葡萄酒中挥发酸含量过高。2.5可同化氮质量浓度对酿酒酵母产H2S的影响
可同化氮质量浓度对酵母产H2S的影响见图5。与目前广泛使用的商业菌株UCD522(H2S产量达705 μL/L)[8]相比,3株菌株在4种初始YAN质量浓度下均为低产或不产H2S。当YAN质量浓度为300 mg/L时,3株菌株的H2S产量无显著差异(P>0.05)。对于同一株菌,菌株41y5在初始YAN质量浓度为400 mg/L条件下,H2S释放量显著增高(P<0.05);菌株174y1在初始YAN质量浓度为200 mg/L和400 mg/L条件下,H2S释放量显著增高(P<0.05),而菌株182y12在初始YAN质量浓度为100 mg/L条件下,H2S释放量显著增高(P<0.05),说明初始YAN质量浓度对菌株产H2S的影响不同,与STURGEON J Q等[12]的研究结果一致,即发酵过程中,H2S的产量由氮源和酵母菌株共同决定。
2.6 各指标间的相关性分析
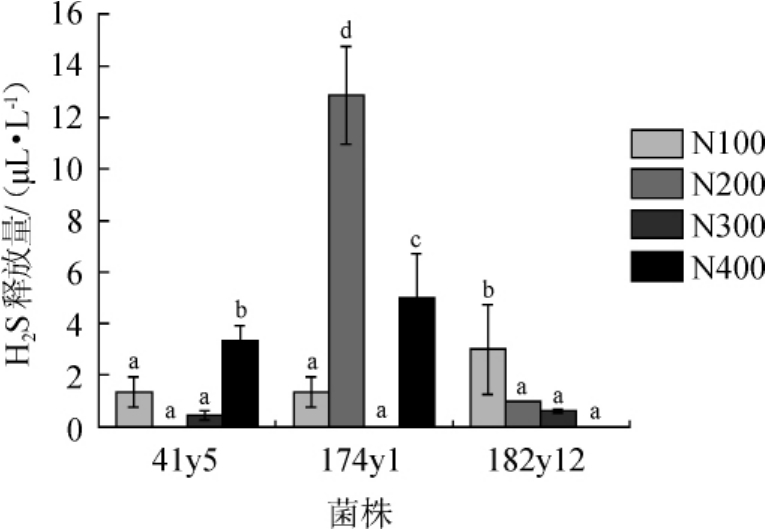
图5 可同化氮质量浓度对酿酒酵母41y5、174y1、182y12 H2S释放量的影响
Fig.5 Effect of different yeast assimilable nitrogen concentrations on H2S release amount ofSaccharomyces cerevisiae41y5,174y1 and 182y12
小写字母不同表示差异显著(P<0.05)。下同。
选取初始YAN质量浓度、最大生物量、CO2平均释放速率、挥发酸含量、pH值和H2S释放量6个指标进行相关性分析,结果见表2。由表2可知,在统计学上,初始YAN质量浓度与CO2平均释放速率、挥发酸含量、pH值呈极显著正相关(P<0.01),与最大生物量呈显著正相关(P<0.05),与H2S释放量无显著相关性(P>0.05)。pH值与H2S释放量呈显著正相关(P<0.05)。GIUDICI P等[10]研究表明,菌株的生长会影响H2S的释放,但是并没有研究证明pH值与发酵过程中H2S释放量之间的关系,仅GIUDICI P等[10]研究发现,葡萄酒装瓶后,pH越低,H2S含量越低。鉴于H2S的感官阈值极低,以及对葡萄酒质量的损伤的严重性,进一步考察pH值与发酵过程中H2S释放量之间的关系有重要的意义。
表2 3株菌株各指标间的相关性分析
Table 2 Correlation analysis of each index for 3 strains
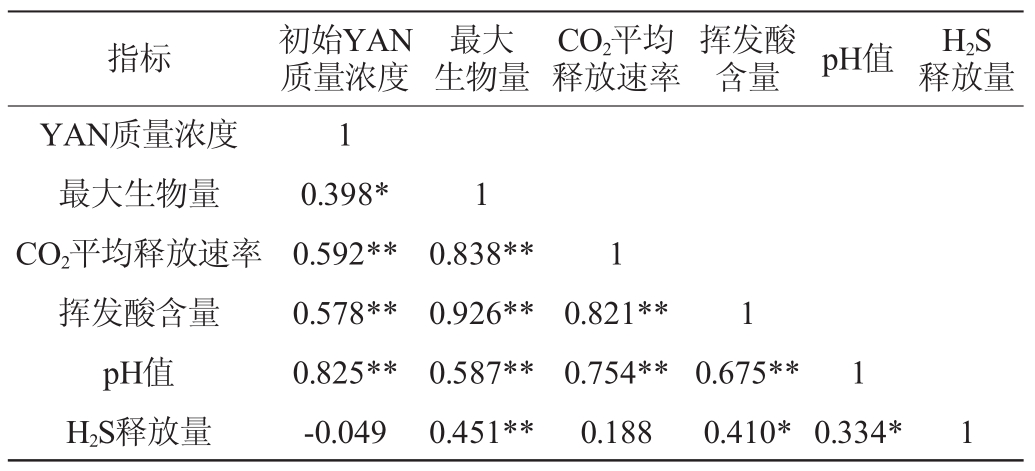
注:“*”表示显著相关(P<0.05);“**”表示极显著相关(P<0.01)。
指标 初始YAN质量浓度最大生物量CO2平均释放速率挥发酸含量pH值H2S释放量YAN质量浓度最大生物量CO2平均释放速率挥发酸含量pH值H2S释放量1 0.398*0.592**0.578**0.825**-0.049 1 0.838**0.926**0.587**0.451**1 0.821**0.754**0.188 1 0.675**0.410*1 0.334* 1
为考察pH值与酒精发酵期间H2S释放量的相关关系,本研究同时测定了低产H2S酿酒酵母112y4、41y5、182y12和174y1在不同初始pH的Triple M培养基中H2S的释放量,结果见图6。由图6可知,除菌株174y1在3个pH值下H2S释放量低于检出限,其余3株菌株的H2S释放量均随pH的升高而增加,说明pH值影响H2S释放量,且两者呈正相关关系。
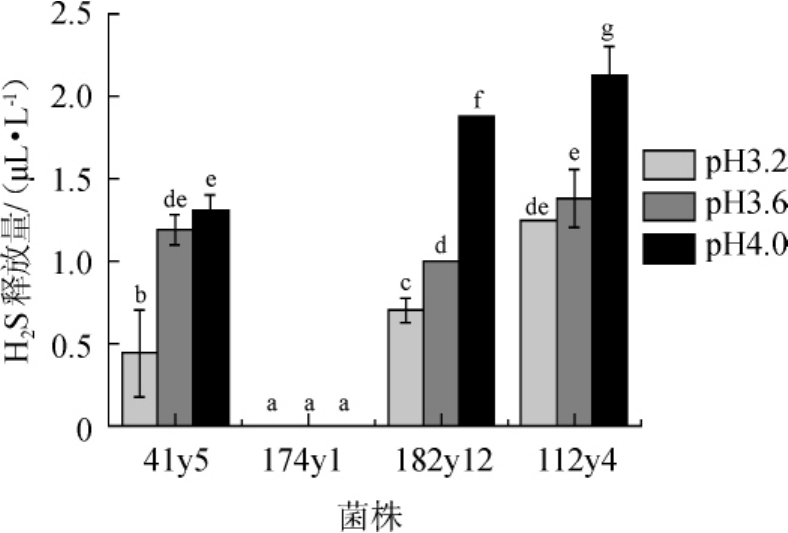
图6 不同pH值对酿酒酵母112y4、41y5、182y12和174y1 H2S释放量的影响
Fig.6 Effect of different pH value on H2S release amount of Saccharomyces cerevisiae112y4,41y5,174y1 and 182y12
3 结论
本研究以3株低产H2S酿酒酵母41y5、174y1、182y12为研究对象,研究不同初始可同化氮的质量浓度对3株酿酒酵母的生物量、发酵速率和H2S释放量等发酵特性的影响,并对不同菌株各指标间的相关性进行了分析。结果表明,初始可同化氮的质量浓度越高,酵母的生物量越大,发酵周期越短;发酵后模拟酒的挥发酸含量和pH值随初始YAN质量浓度的升高而增加;初始YAN质量浓度对菌株产H2S的影响不同。相关性分析结果表明,初始YAN质量浓度与CO2平均释放速率、挥发酸含量、pH值呈极显著正相关(P<0.01),与最大生物量呈显著正相关(P<0.05),与H2S释放量无显著相关性(P>0.05);在发酵过程中H2S的释放量与发酵后模拟酒的pH值存在显著的正相关关系(P<0.05)。与酿酒酵母41y5和182y12相比,酿酒酵母174y1在4个初始可同化氮质量浓度下,生物量均最高,发酵周期均最短,发酵性能优良,尽管其在N200和N400时,174y1的H2S释放量均显著高于其他菌株,但与商业菌株UCD522相较,其仍属于低产H2S菌株,因此,酿酒酵母174y1是极具生产应用价值的酿酒酵母。
[1]BELL S J,HENSCHKE P A.Implications of nitrogen nutrition for grapes,fermentation and wine[J].Aust J Grape Wine R,2010,11(3):242-295.
[2]缪成鹏,张晖,杨晓雁,等.可同化氮含量对赤霞珠葡萄酒发酵和香气成分的影响[J].中国酿造,2015,34(1):131-136.
[3]BELTRAN G,NOVO M,ROZÈS N,et al.Nitrogen catabolite repression in Saccharomyces cerevisiaeduring wine fermentations[J].Fems Yeast Res,2004,4(6):625-632.
[4]AKIN H,BRANDAM C,MEYER X M,et al.How modeling can help to discriminate assumptions on the influence of nitrogen consumption on pH during fermentation[J].Comput Aid Chem Eng,2009,27(9):1815-1820.
[5]GUTIÉRREZ A,BELTRAN G,WARRINGER J,et al.Genetic basis of variations in nitrogen source utilization in four wine commercial yeast strains[J].Plos One,2014,8(6):e67166.
[6]GOBBI M,COMITINI F,D'IGNAZI G,et al.Effects of nutrient supplementation on fermentation kinetics,H2S evolution,and aroma profile in Verdicchio DOC wine production[J].Eur Food Res Technol,2013,236(1):145-154.
[7]GUTIÉRREZ A,CHIVA R,GUILLAMÓN J M.Arginine addition in the stationary phase influences the fermentation rate and synthesis of aroma compounds in a synthetic must fermented by three commercial wine strains[J].LWT-Food Sci Technol,2015,60(2):1009-1016.
[8]WANG C X,LIU M L,LI Y,et al.Hydrogen sulfide synthesis in native Saccharomyces cerevisiaestrains during alcoholic fermentations[J].Food Microbiol,2018,70:206-213.
[9]KUMAR G R,RAMAKRISHNAN V,BISSON L F.Survey of hydrogen sulfide production in wine strains ofSaccharomyces cerevisiae[J].Am J Enol Viticult,2010,61(3):365-371.
[10]GIUDICI P,KUNKEE R E.The effect of nitrogen deficiency and sulfurcontaining amino acids on the reduction of sulfate to hydrogen sulfide by wine yeasts[J].Am J Enol Viticult,1994,45(1):107-112.
[15]JIRANEK V,LANGRIDGE P,HENSCHKE P A.Regulation of hydrogen sulfide liberation in wine-producingSaccharomyces cerevisiaestrains by assimilable nitrogen[J].Appl Environ Microbiol,1995,61(2):461-467.
[12]STURGEON J Q,BOHLSCHEID J C,EDWARDS C G.The effect of nitrogen source on yeast metabolism and H2S formation[J].J Wine Res,2013,24(3):182-194.
[13]SANTIAGO M,GARDNER R C.TheIRC7gene encodes cysteine desulphydrase activity and confers on yeast the ability to grow on cysteine as a nitrogen source[J].Yeast,2015,32(7):519-532.
[14]张玉洁,李莹,秦义,等.丝氨酸对葡萄酒酿造过程中酿酒酵母产H2S的形成研究[J].中国酿造,2017,36(6):121-125.
[15]GUTIÉRREZ A,CHIVA R,SANCHO M,et al.Nitrogen requirements of commercial wine yeast strains during fermentation of a synthetic grape must[J].Food Microbiol,2012,31(1):25-32.
[16]ARAQUE I,BORDONS A,REGUANT C.Effect of ethanol and low pH on citrulline and ornithine excretion and arc gene expression by strains ofLactobacillus brevisandPediococcus pentosaceus[J].Food Microbiol,2013,33(1):107-113.
[17]TESNIÈRE C,BRICE C,BLONDIN B.Responses ofSaccharomyces cerevisiaeto nitrogen starvation in wine alcoholic fermentation[J].Appl Microbiol Biot,2015,99(17):7025-7034.
[18]MARTÍNEZ-MORENO R,QUIRÓS M,MORALES P,et al.New insights into the advantages of ammonium as a winemaking nutrient[J].Int J Food Microbiol,2014,177(3):128-135.
[19]TAILLANDIER P,RAMON P F,FUSTER A,et al.Effect of ammonium concentration on alcoholic fermentation kinetics by wine yeasts for high sugar content[J].Food Microbiol,2007,24(1):95-100.
[20]BELTRAN G,ESTEVE-ZARZOSO B,ROZÈS N,et al.Influence of the timing of nitrogen additions during synthetic grape must fermentations on fermentation kinetics and nitrogen consumption[J].J Agr Food Chem,2005,53(4):996-1002.