马铃薯是我国当前最具发展前景的高产粮食作物之一,近年来国家一直提倡增加马铃薯深加工产品,提高马铃薯附加值[1-2],快速推动我国马铃薯产业的发展。马铃薯是宁夏优势特色农产品加工产业中的重点支持产业,具有品种优良、加工风味好、淀粉含量高等优势[3-6]。其包含了人体所需的各种营养素(如蛋白质、维生素、膳食纤维、矿物质元素等),具有预防肠胃疾病、抗衰老、抗氧化、降低胆固醇、防止动脉硬化、减少白内障、角膜炎等相关炎症、排毒、解毒等功能性作用[7]。
红茶菌是由多种醋酸菌、酵母菌和乳酸菌组成的共生体,俗称“海宝”、“胃宝”[8],具有抵抗癌症、提高消化能力、刺激免疫系统、减少发炎、清理肠胃、帮助消化、预防和治疗便秘和痔疮、预防“三高”、结石及一些心血管疾病、排毒、调节机体免疫力等作用[9-12]。到目前为止,从各种红茶菌中分离到的醋酸菌有萨克塔堤查仁杆菌(Tanticharoenia sakaeratensis)、罗旺醋酸杆菌(Acetobacter lovaniensis)、过氧化醋酸杆菌(Acetobacter peroxydans)、蒲桃醋酸杆菌(Acetobactersyzygii)、冲绳醋酸杆菌(Acetobacterokinawensis)、热带醋酸杆菌(Acetobacter tropicalis)、醋化醋杆菌(Acetobacter liquefy aciens)等;酵母菌有酿酒酵母(Saccha romyces cerevisiae)、克鲁斯假丝酵母(Candiada krusei)、弗洛接合有孢圆酵母(Zygotorulaspora florentina)、热带假丝酵母(Candida tropicalis)、博伊丁假丝酵母(Candida boidinii)、粟酒裂殖酵母(Schizosaccharomyces pombe)等[13];乳酸菌有保加利亚乳杆菌(Lactobacillus bulgaricus)等。
国内现在对红茶菌的研究主要集中于发酵条件优化,且都仅局限于摇瓶试验,在发酵罐发酵方面的优化少有涉及[14]。同时,马铃薯醋多为运用酵母菌和醋酸菌进行发酵而成。目前,国内关于利用红茶菌发酵马铃薯醋的研究尚未报道。人们对红茶菌作用机理的研究寥寥无几,且红茶菌功能性食品品种极少,市场化程度低[15]。
本研究以马铃薯(青薯9号)为原料,利用红茶菌进行马铃薯醋发酵,并以陈酿前马铃薯醋中总酸含量为响应值,初始糖度、红茶菌接种量及发酵温度为考察因素,采用响应面法优化马铃薯醋发酵工艺。加深对红茶菌的研究,拓宽马铃薯加工渠道,发展马铃薯加工业,实现增值。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
马铃薯(青薯9号):宁夏黄土地农业食品有限公司提供(淀粉含量15.1%,粗蛋白含量2.08%,维生素C含量18.6 mg/100 g鲜薯)[16];红茶菌:宁夏食品微生物应用技术与安全控制重点实验室。
1.1.2 试剂
α-淀粉酶(≥3 700 U/g)、糖化酶(≥10 000 U/g):北京奥博星生物技术有限责任公司;红茶、白砂糖、柠檬酸(均为食用级):市售。
1.2 仪器与设备
HH.S21-6型电热恒温水浴锅、BSP-250型生化培养箱:上海博迅实业有限公司医疗设备厂;SW-CJ-2FD型洁净工作台:苏州安泰空气技术有限公司;PB-10型酸度计:北京赛多利斯公司;WYT-4型手持糖度计:泉州中友光学仪器有限公司;T-1000型电子天平:美国双杰兄弟(集团)有限公司;H-1650型台式高速离心机:上海赵迪生物科技有限公司。
1.3 方法
1.3.1 红茶菌的活化与培养
按照糖∶红茶∶水为1∶15∶100的比例[17],将红茶加入沸水中,于85~90℃保持25 min,过滤得茶汁,加入溶化的糖水,接入40%红茶菌种母液,放入玻璃容器中,用单层纱布封口,于30℃静置发酵7 d,待液面产生数层菌膜即可。
用消毒后的镊子取出容器内残余的菌膜,去除菌膜上褐变的部分,用无菌水冲洗菌膜数遍。无菌水洗净容器后,倒入成熟的红茶菌菌液和新鲜的红茶糖水及处理好的红茶菌菌膜,再按上述方法继续培养红茶菌,直至扩大培养到所需用量。
1.3.2 马铃薯醋工艺流程及操作要点
马铃薯预处理→蒸煮→打浆→酶解→灭酶→过滤→调糖、调酸→高温灭菌→接红茶菌→红茶菌发酵→陈酿→过滤→灌装→灭菌→成品
(1)原料预处理、蒸煮、打浆[18]:将马铃薯进行清洗、去皮、切分,蒸熟晾凉后,加入马铃薯质量4倍的水进行打浆,制成马铃薯原液。
(2)酶解、灭酶、过滤:在马铃薯原液中加入0.23%α-淀粉酶、0.23%糖化酶,在60℃恒温水浴锅中进行液化、糖化4 h,90℃水浴10 min,灭酶并过滤,制成马铃薯糖化液。
(3)调糖、调酸:在马铃薯糖化液中加入白砂糖、柠檬酸,将糖度调至18.0%,pH调至3.80。
(4)高温灭菌:马铃薯糖化液在121℃条件下高压灭菌15 min,冷却待用。
(5)红茶菌接种与发酵:将冷却后的马铃薯糖化液接入活化后的红茶菌中,放入恒温培养箱中进行红茶菌发酵,测定总酸含量接近2.5 g/100 mL后结束发酵。
(6)陈酿、过滤:将发酵结束的原醋陈酿60 d,离心、过滤制得马铃薯醋。
(7)灌装、灭菌:选择合适的包装瓶,将马铃薯醋液灌装进去,封好进行巴氏杀菌。
1.3.3 马铃薯醋发酵工艺优化单因素试验
初始糖度:马铃薯糖化液过滤后,分别加白砂糖调糖度至12.0%、14.0%、16.0%、18.0%、20.0%,接入20%培养好的红茶菌液,于30℃恒温生化培养箱中深层发酵,测定陈酿前发酵液的总酸含量。
红茶菌接种量:马铃薯糖化液过滤后,调糖度至20%,分别接入5%、10%、15%、20%、25%红茶菌液,在30℃恒温生化培养箱中深层发酵,测定陈酿前发酵液的总酸含量。
发酵温度:马铃薯糖化液过滤后,调糖度至20%,接入20%红茶菌液,分别于28℃、30℃、32℃、34℃、36℃的恒温生化培养箱中深层发酵,测定陈酿前发酵液的总酸含量。
1.3.4 马铃薯醋发酵工艺优化响应面试验
在单因素试验的基础上,利用Box-Benhnken试验设计,以陈酿前马铃薯醋中的总酸含量(Y)为响应值,考察初始糖度(A)、红茶菌接种量(B)及发酵温度(C)3个因素对马铃薯醋发酵的影响。响应面试验设计的因素与水平见表1。
表1 马铃薯醋发酵工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for potato vinegar fermentation process optimization
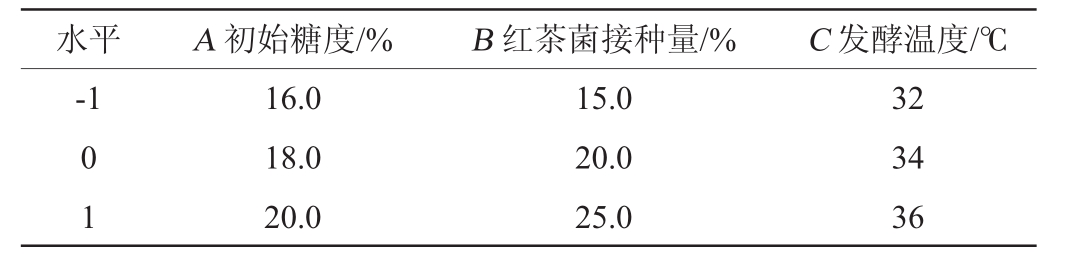
水平 A初始糖度/% B红茶菌接种量/% C发酵温度/℃-1 0 1 16.0 18.0 20.0 15.0 20.0 25.0 32 34 36
1.3.5 分析方法
总酸含量(以醋酸计)的测定:酚酞指示剂法[19];糖度的测定(以葡萄糖计):3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法[20];感官指标的测定:参照GB/T 5009.41—2003《食醋卫生标准的分析方法》;细菌总数的测定:参照GB 4789.2—2016《食品安全国家标准食品微生物学检验菌落总数测定》;大肠菌群的测定:参照GB 4789.3—2016《食品安全国家标准食品微生物学检验大肠菌群计数》;致病菌的测定:GB/T 4789.22—2003《食品卫生微生物学检验调味品检验》;可溶性固形物含量的测定:参照NY/T 2637—2014《水果和蔬菜可溶性固形物含量的测定折射仪法》。
2 结果与分析
2.1 马铃薯醋发酵工艺优化单因素试验
2.1.1 初始糖度对陈酿前马铃薯醋中总酸含量的影响
初始糖度对陈酿前马铃薯醋中总酸含量的影响结果见图1。
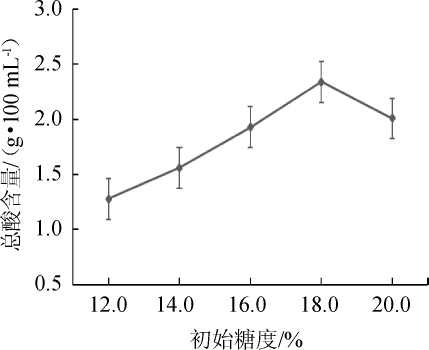
图1 初始糖度对陈酿前马铃薯醋中总酸含量的影响
Fig.1 Effect of initial sugar content on total acid content in potato vinegar before aging
由图1可以看出,在相同的发酵时间内,随着初始糖度的增大,陈酿前马铃薯醋中总酸含量呈先增大后减小的变化趋势。当初始糖度为18.0%时,陈酿前马铃薯醋中总酸含量最高,为2.34 g/100 mL。因此,确定最佳初始糖度为18.0%。
2.1.2 红茶菌接种量对陈酿前马铃薯醋中总酸含量的影响
红茶菌接种量对陈酿前马铃薯醋中总酸含量的影响结果见图2。

图2 红茶菌接种量对陈酿前马铃薯醋中总酸含量的影响
Fig.2 Effect of kombucha inoculum on total acid content in potato vinegar before aging
由图2可以看出,在相同发酵时间内,随着红茶菌接种量的增大,陈酿前马铃薯醋中总酸含量呈先增大后减小的变化趋势。当红茶菌接种量为20%时,陈酿前马铃薯醋中总酸含量最高,为2.32 g/100 mL。因此,确定红茶菌最佳接种量为20%。
2.1.3 发酵温度对陈酿前马铃薯醋中总酸含量的影响
发酵温度对陈酿前马铃薯醋中总酸含量的影响结果见图3。

图3 发酵温度对陈酿前马铃薯醋中总酸含量的影响
Fig.3 Effect of fermentation temperature on total acid content in potato vinegar before aging
由图3可以看出,在相同的发酵时间内,发酵温度在28~36℃的范围内,陈酿前马铃薯醋中总酸含量随发酵温度的升高呈先增大后减小的趋势。当发酵温度为32℃时,陈酿前马铃薯醋中总酸含量最高,为2.33 g/100 mL。因此,确定最佳发酵温度为32℃。
2.2 马铃薯醋发酵工艺优化响应面试验
在单因素试验的基础上,以陈酿前马铃薯醋中总酸含量(Y)为响应值,利用Box-Benhnken试验设计考察初始糖度(A)、红茶菌接种量(B)及发酵温度(C)3个因素对陈酿前马铃薯醋中总酸含量的影响,结果与分析见表2,方差分析见表3。
表2 Box-Benhnken试验设计及结果
Table 2 Design and results of Box-Benhnken tests
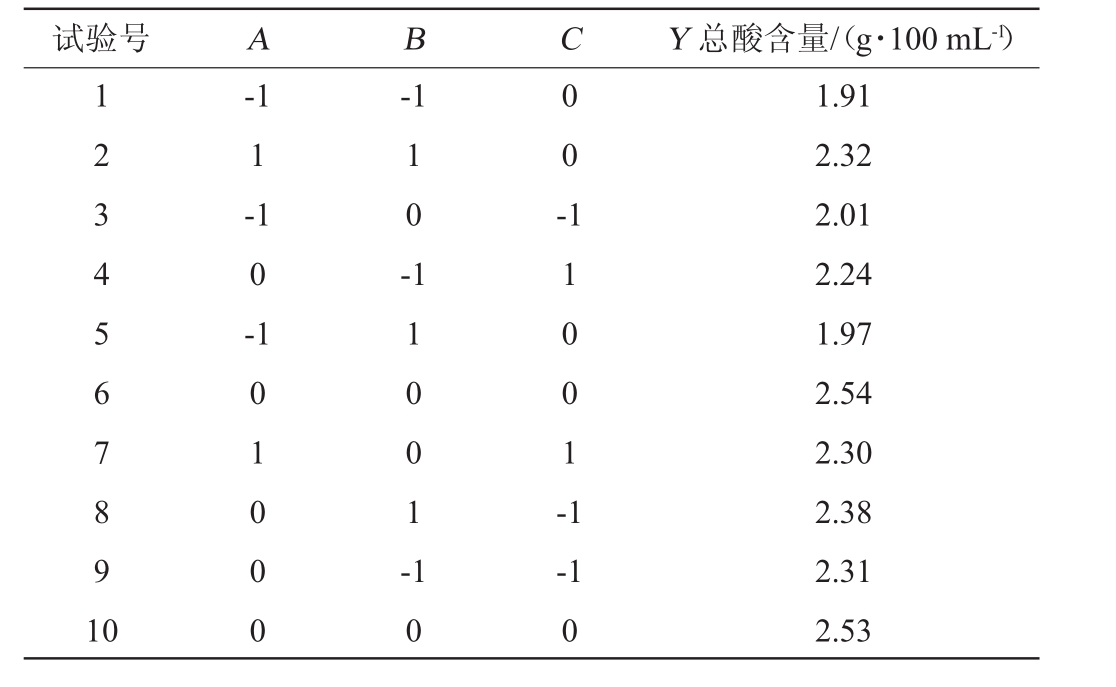
试验号A B C Y总酸含量/(g·100 mL-1)1 2 3 4 5 6 7 8 9 1 0-1 1-1 0-1-1 1 0 -0 0 -0 1 0 0 0 1 1 0 0 1 -1 1 0 0 1 -1 1 0-1 0 1.91 2.32 2.01 2.24 1.97 2.54 2.30 2.38 2.31 2.53
续表
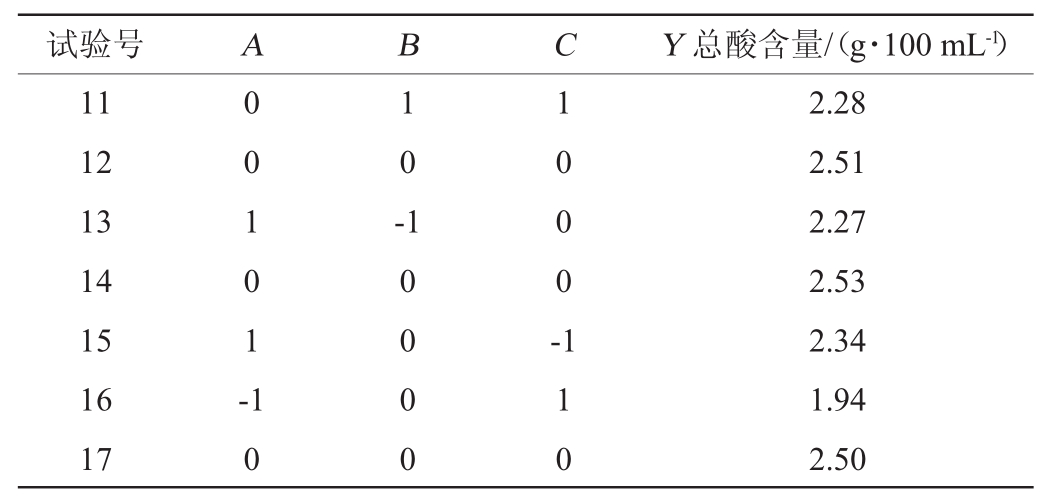
试验号A B C Y总酸含量/(g·100 mL-1)11 12 13 14 15 16 17 0 0 1 0 1 -1 0 -1 0 0 0 -1 0 1 0 0 0 0 1 1 0 2.28 2.51 2.27 2.53 2.34 1.94 2.50
表3 回归方程的方差分析
Table 3 Variance analysis of regression equation

注:“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F值 P值 显著性模型ABCA B********AC BC A 2 B2 C 2 359.93 1 085.44 26.80 43.42 0.11 1.00 1.00 1 459.88 290.31 167.47<0.000 1<0.000 1 0.001 3 0.000 3 0.749 0 0.351 3 0.119 2<0.000 1<0.000 1<0.000 1******残差失拟项误差总变异0.730 0.250 6.05×10-3 9.80×10-3 2.50×10-5 2.25×10-4 2.25×10-4 0.330 0.066 0.038 1.58×10-3 5.00×10-4 1.08×10-3 0.750 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.081 0.250 6.05×10-3 9.80×10-3 2.50×10-5 2.25×10-4 2.25×10-4 0.330 0.066 0.038 2.26×10-4 1.67×10-4 2.70×10-4 0.62 0.639 5
通过Design-Expert 8.0.6软件对表2的结果进行多元二次回归拟合,得到总酸含量(Y)与初始糖度(A)、红茶菌接种量(B)、发酵温度(C)的回归方程:
由表3可知,模型P<0.000 1,极显著;失拟项P>0.05,不显著,表明回归模型的拟合度较好,可以用该方程对试验结果进行分析。各因素对结果影响的主次顺序为A>C>B,即初始糖度>发酵温度>红茶菌接种量。由方差分析可知,因素一次项A、B、C和二次项A 2、B2、C 2对结果影响极显著(P<0.01),交互项AB、AC、BC对结果影响不显著(P>0.05)。
通过软件绘制响应面图进行可视化分析,初始糖度、红茶菌接种量、发酵温度间交互作用的响应面和等高线见图4。由图4可知,抛物面开口均向下,有极大值点;等高线均呈圆形,表明交互作用对结果影响不显著,与方差分析结果一致。
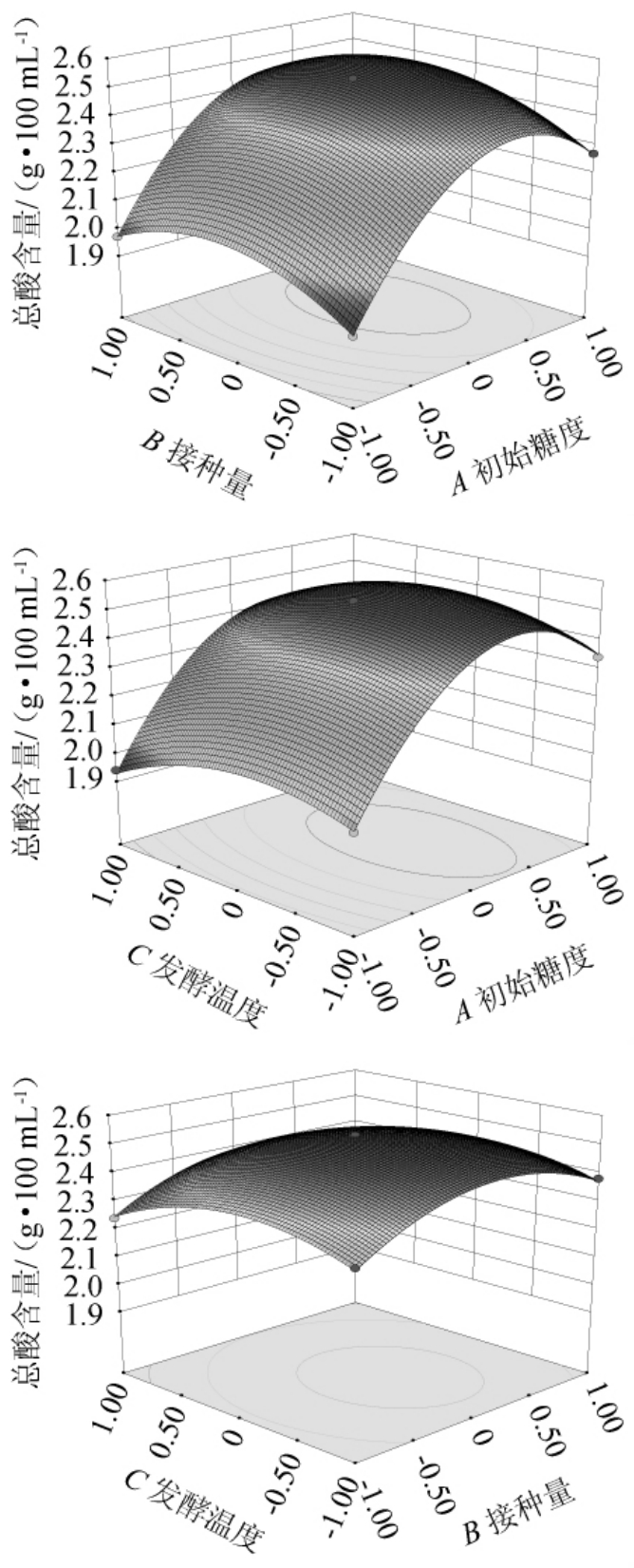
图4 各因素交互作用对陈酿前马铃薯醋中总酸含量影响的响应面图与等高线图
Fig.4 Response surface plots and contour line of effects of interaction between each factors on total acid content in potato vinegar before aging
运行软件的期望函数优化程序,以陈酿前马铃薯醋中总酸含量达到最大值为目标,获得优化发酵工艺参数为初始糖度18.62%、红茶菌接种量20.56%、发酵温度33.65℃,预测总酸含量可达到2.55 g/100 mL。考虑到实际操作的局限性,将最优发酵条件调整为初始糖度19%、红茶菌接种量21%、发酵温度34℃,在该条件下重复试验5次,获得陈酿前马铃薯醋中总酸含量为2.48 g/100 mL,与预测值基本符合,充分证明了该模型的准确性和实用性。综上所述,红茶菌发酵马铃薯醋的最优发酵条件为初始糖度19%、红茶菌接种量21%、发酵温度34℃。
2.3 马铃薯醋的质量指标
2.3.1 感官指标
色泽:浅黄色;香气:醇香,醋香香味协调;味道:酸中带甜,无不良气味;体态:澄清透亮,无沉淀,无浮膜。
2.3.2 理化指标
马铃薯醋陈酿后总酸含量(以乙酸计)为3.60 g/100 mL;可溶性固形物含量为10.50%,符合国家标准GB/T 18187—2000《酿造食醋》具体要求。
2.3.3 微生物指标
细菌总数≤500 CFU/mL;大肠杆菌未检出;其他致病菌未检出。符合GB 2719—2003《食醋卫生标准》具体要求。
3 结论
以新鲜马铃薯(青薯9号)为原料,利用红茶菌中丰富的酵母菌、醋酸菌、乳酸菌组成的共生菌系对马铃薯糖化汁进行发酵,制备马铃薯醋。马铃薯醋的最优发酵条件为:发酵液初始糖度19%,红茶菌接种量21%,发酵温度34℃。在此最优发酵条件下,陈酿前马铃薯醋中总酸含量为2.48 g/100 mL,较优化前提高20.4%。经陈酿后总酸可达3.60 g/100 mL,马铃薯醋澄清透亮,无沉淀,无浮膜;呈浅黄色;醋香香味协调;酸中带甜,无不良气味。微生物指标和理化指标均符合相关标准要求。
[1]李子涵,杨晓晶.世界及中国马铃薯产业发展分析[J].中国食物与营养,2016,22(5):5-9.
[2]SLOANA E.Top 10 trends to watch and work on:2003[J].Food Technol-Chicago,2003,57(4):30-32.
[3]吴利晓.不同栽培方式和种植密度对马铃薯产量及品质的影响[D].银川:宁夏大学,2016.
[4]者金兰,景治忠,于仙萍,等.全膜双垄覆盖沟播栽培条件下马铃薯品种比较研究[J].宁夏农林科技,2013,54(9):37-38.
[5]朱玉君.西吉县推广优质专用型马铃薯新品种[J].中国农业信息,2012(11):46.
[6]毛玉乾.干旱区马铃薯品种比较试验[J].宁夏农林科技,2013,54(12):7-8,12.
[7]周霞,刘敏,韩育梅.马铃薯发酵醋辅料的选择及酒精发酵工艺条件的优化[J].食品科技,2016(3):186-190.
[8]廖卢艳,蒋立文.红茶菌的研究进展[J].中国食物与营养,2006(9):22-23.
[9]BAUER-PETROVSKAB,PETRUSHEVSKA-TOZIL.Mineral and water soluble vitamin content in the Kombucha drink[J].Int J Food Sci Tech,2000,35(2):201-205.
[10]吴燕.红茶菌的研究和应用进展[J].食品工业科技,2012,33(8):436-438.
[11]赵平,范铁男,邹积宏,等.红茶菌的研究概况[J].黑龙江医药,2011(3):367-370.
[12]任亮.红茶菌发酵工艺的研究[D].合肥:安徽农业大学,2013.
[13]JAYABALAN R,MALBASˇA R V,LONCˇAR E S,et al.A review on kombucha tea-microbiology,composition,fermentation,beneficial effects,toxicity,and tea fungus[J].Compr Rev Food Sci Food Safety,2014,13(4):doi:10.1111/1541-4337.12073.
[14]梅瀚杰,胡文锋.国内外红茶菌研究进展[J].食品工业科技,2018,39(17):335-341.
[15]魏书蓉,张亚楠,吴春,等.红茶菌的研究进展[J].亚太传统医药,2018(11):97-99.
[16]青海省马铃薯主导品种—青薯9号[J].青海农技推广,2017(4):26.
[17]郭书贤,王冬梅,王庆洁,等.芦荟红茶菌复合发酵饮料的研制[J].食品科学,2006,27(12):940-944.
[18]张博,肖世娣,张惠玲,等.马铃薯格瓦斯工艺技术研究[J].食品研究与开发,2018,39(13):92-98.
[19]涂强,康宁,冬梅,等.甘薯格瓦斯饮料工艺条件的研究[J].中国酿造,2008,27(21):93-96.
[20]李和生.食品分析[M].北京:科学出版社,2014:41-42.