黄芪(Astragali radix)是由豆科植物蒙古黄芪或膜荚黄芪的根干燥而来,主要功效包括健脾补中、补气固元、保肝利尿、抗衰老、敛疮生肌、降血压、提高机体免疫力、抗菌等[1-3]。内生菌普遍存在于植物体内,但是由于其定植在健康植物组织的内部,不会产生感染等症状,因此长期以来被人们忽视[4]。黄芪中存在一定量的内生真菌,发酵过程中可以将黄芪中的大分子物质转化为具有生理活性的小分子物质,利于人体的吸收[5]。此外,内生真菌在发酵过程中还能够参与合成与黄芪功能成分相同或者相似的活性物质,从而提高黄芪的生理功能[6]。
目前,已有很多黄芪内生真菌的相关研究。曹丹丹等[7]研究发现,茎直黄芪内生真菌的优势种属为细极链格孢菌(Alternaria tenuissima)和棘豆弯曲牙管蠕孢菌(Undifilum oxytropis),相对含量分别为32.14%、19.05%;刘蓬蓬等[4]以18S rDNA NS1-Fung区域为信息序列通过Illumina MiSeq高通量测序技术对黄芪内生真菌的多样性进行了分析,结果表明,黄芪内生真菌主要为驼孢锈菌属(Hemileia)、赤霉菌属(Gibberella)、粪盘菌属(Ascobolus)、假裸囊菌属(Pseudogymnoascus)和曲霉属(Aspergillus),其中优势种群为驼孢锈菌属和赤霉菌属。植物通过发酵不仅可以将大分子物质转化成有利于人体吸收的生物活性小分子物质,也可以提高某些植物的抑菌活性[8-10]。牛明福等[11]研究发现,连翘内生菌发酵液能够有效的抑制金黄色葡萄球菌(Staphylococcus aureus)和肠炎沙门氏菌(Salmonella enteritidis)的生长。
本研究首先利用Illumina MiSeq高通量测序技术对不同发酵阶段的黄芪内生真菌发酵液进行多样性分析,揭示内生真菌在黄芪发酵过程中生物多样性的变化规律。在此基础上,对得到的黄芪内生真菌发酵液进行抗菌活性分析,并初步揭示其可能的抗菌机理,以期为拓展黄芪内生真菌发酵液的实际应用提供可供参考的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品及菌株
黄芪:于2018年5月采自内蒙古包头市土默特右旗,采集后放入自封袋中,避光保存,利用真空冷冻干燥技术对其进行脱水处理;大肠杆菌(Escherichia coli)O157∶H7、金黄色葡萄球菌(Staphylococcus aureus)ATCC 49775:美国菌种保藏中心(American type culture collection,ATCC)。
1.1.2 培养基及主要试剂
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、LB肉汤培养基、胰蛋白胨大豆琼脂(tryptic soy agar,TSA)培养基:青岛海博生物技术有限公司;无水乙醇、戊二醛、丙酮(均为分析纯):德州润昕实验仪器有限公司;1%饿酸固定液、醋酸铀(分析纯)、柠檬酸铅(分析纯):沧州卓亚化工有限公司;真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速提取试剂盒、核酸纯化试剂盒、2×Taq master mix:天根生化科技(北京)有限公司;真菌NS1-Fung通用引物:赛默飞世尔科技(中国)有限公司。
1.2 仪器与设备
AE523电子天平:上海舜宇恒平科学仪器有限公司;TGL-20M台式高速冷冻离心机:上海卢湘仪离心机仪器有限公司;DYY-10C型电泳仪:北京市六一仪器厂;JEOL JEM-2800高通量场发射透射电子显微镜:日本电子株式会社;T100梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐公司。
1.3 方法
1.3.1 黄芪内生真菌发酵液的制备
取20 g干燥的黄芪,对其进行粉粹处理后,加入100 mL无菌水中,混合均匀,在31℃、150 r/min条件下发酵8 d,得到黄芪内生真菌发酵液[6]。分别取发酵第0、1、3、5、8天的发酵液进行真菌多样性的研究。
1.3.2 发酵液DNA的提取及PCR扩增
按照真菌基因组DNA快速提取试剂盒说明书的步骤,提取不同发酵时间条件下黄芪内生真菌发酵液的基因组DNA,并利用琼脂糖凝胶电泳检测DNA的浓度及纯度。以真菌DNA为模板,以NS1(5′-CCTACACGACGCTCTTCCGATCTN(barcode)GTAGTCATATGCTTGTCTC-3′)和Fung(5′-GACTG GAGTTCCTTGGCACCCGAGAATTCCAATTCCCCGTTACCCGTTG-3′)为引物进行PCR扩增,PCR扩增体系及条件参考刘蓬蓬等[5]的方法步骤。利用核酸纯化试剂盒对得到的PCR扩增产物进行纯化、回收并测序。
1.3.3 测序及生物信息学分析
样品DNA的Illumina Miseq高通量测序委托北京诺禾致源生物信息科技有限公司进行。为了得到高质量的序列,对获得的原始序列进行适当的过滤和拼接,去除低质量的序列,使得最后的数据更准确可靠。利用微生物生态学的定量洞察(quantitative insights into microbial ecology,QIIME)分析平台对过滤后的DNA序列进行生物信息学分析,以操作分类单元(operational taxonomic unit,OTU)相似度97%为阈值,对不同发酵阶段样品真菌的丰富度(Chao指数)和多样性(Shannon指数)进行分析[12-14]。
1.3.4 发酵液抑菌效果的评估
根据PENG F等[15]的研究,利用牛津杯法测定黄芪内生真菌发酵液对E.coli O157∶H7和S.aureus ATCC 49775的抑菌效果,抑菌圈直径均>10 mm,被认为有抑菌活性;利用琼脂稀释法测定发酵液对受试菌株的最小抑菌浓度(minimum inhibitory concentration,MIC)。在此基础上,取100μL指示菌菌液(菌液浓度为108 CFU/mL)于浓度≥1MIC的发酵液中37℃处理1 h,处理后的菌液在TSA平板中,37℃培养24 h,使菌落无法长出的菌体浓度为发酵液的最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.5 受试细胞的透视电镜分析[15-17]
分别用菌体浓度为1 MIC的黄芪内生真菌发酵液处理E.coli O157∶H7和S.aureus ATCC 49775,振荡混合均匀后,在37℃条件下培养1 h,5 000 r/min离心15 min,得到菌体。加入2.5%戊二醛溶液固定2 h,8 000 r/min离心10 min,弃上清,用0.1 mol/L的磷酸缓冲液漂洗2次,每次15 min。用1%的饿酸固定液固定40 min。分别用体积分数为50%、70%、90%、100%的乙醇对样品进行脱水处理,包埋后用体积分数50%乙醇溶液配制成的4%醋酸铀染色20 min,双蒸水(ddH2O)冲洗后用柠檬酸铅染色20 min,采用电镜仪对制备好的样品切片进行拍照。
1.3.6 数据分析
实验均重复3次,利用SPSS20.0软件对数据进行处理,选择Tukey′s法检验,P<0.05时,差异显著。
2 结果与分析
2.1 测序数据合理性分析
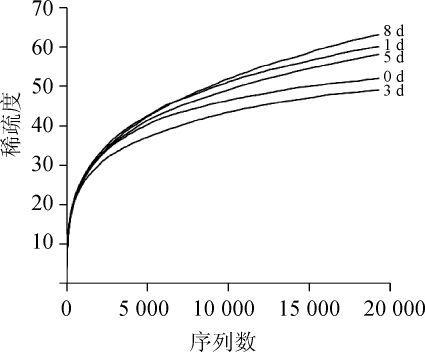
图1 黄芪内生真菌发酵液稀疏曲线
Fig.1 Rarefaction curves of fermentation liquid of endophytic fungi in Astragali radix
得到样品真菌序列后,绘制黄芪内生真菌发酵液稀疏曲线,对测序结果进行合理性分析,如图1所示。由图1可知,5个样品的稀疏度均随着测序序列数的增加而增加,在稀疏曲线的后端稀疏度受测序序列数目的影响越来越小,趋于平缓,这说明再继续增加测序序列的数目不会对OUT的数量产生显著的影响,样品的信息量能够进行真菌多样性的分析。
2.2 黄芪内生真菌发酵过程中真菌丰富度和多样性分析
对5个样品的序列进行OTUs计算、多样性及丰富度分析,结果如表1所示。
表1 黄芪内生真菌发酵液的真菌多样性和丰富度
Table 1 Fungal diversity and abundance of fermentation liquid of endophytic fungiin Astragaliradix
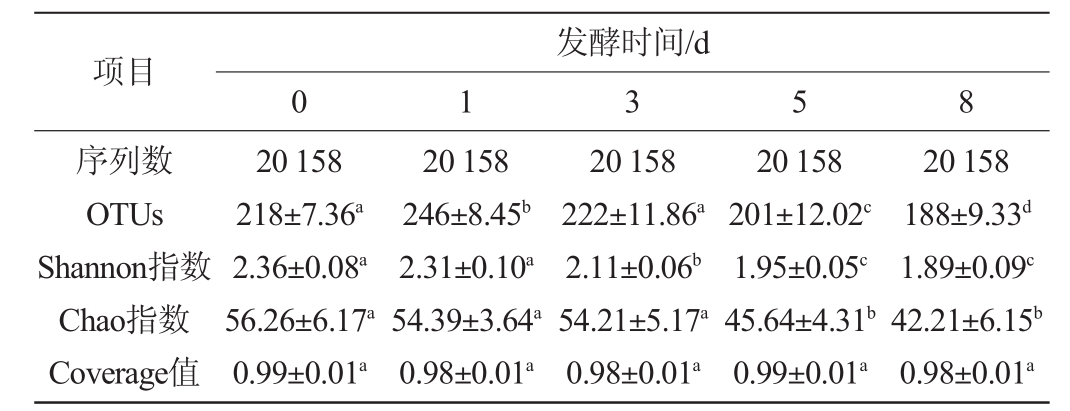
注:同一行字母不同代表差异性显著(P<0.05),字母相同代表差异性不显著(P>0.05)。下同。
项目序列数OTUs Shannon指数Chao指数Coverage值0 1发酵时间/d 3 5 8 20 158 218±7.36a 2.36±0.08a 56.26±6.17a 0.99±0.01a 20 158 246±8.45b 2.31±0.10a 54.39±3.64a 0.98±0.01a 20 158 222±11.86a 2.11±0.06b 54.21±5.17a 0.98±0.01a 20 158 201±12.02c 1.95±0.05c 45.64±4.31b 0.99±0.01a 20 158 188±9.33d 1.89±0.09c 42.21±6.15b 0.98±0.01a
由表1可知,5个样品中的有效序列均为20 158条,5个样品的Coverage值为0.98~0.99,说明所得到的序列覆盖了样品序列的98%以上,可以较为全面的揭示样品中真菌的多样性。发酵第0、1、3、5和8天的样品所对应的OUTs数分别为218±7.36、246±8.45、222±11.86、201±12.02、188±9.33,说明随着发酵时间的增加,样品中OTUs的数量先增加后减少。
Shannon指数和Chao指数分别用于衡量环境中微生物的多样性和丰富度,其中多样性越高,说明环境中微生物的种类越多;丰富度越高,表明环境中微生物的数量越多[18]。如表1所示,随着发酵的进行,Shannon指数和Chao指数逐渐减小(P<0.05),说明在整个发酵过程中真菌的种类和数量都呈现减少的趋势。
2.3 黄芪内生真菌发酵过程中真菌种群结构分析
利用Illumina Miseq高通量技术分析黄芪发酵过程中内生真菌种群结构的变化情况,结果如图2所示。由图2可知,在5个样品中,相对含量>0.01%的真菌包含12个属,分别为驼孢锈菌属(Hemileia)、赤霉菌属(Gibberella)、粪盘菌属(Ascobolus)、假裸囊菌属(Pseudogymnoascus)、附毛菌属(Trichaptum)、细极链格孢菌(Alternaria tenuissima)、未分类的(unclassified)、疯草内生真菌(Undifilum oxytropis)、Stagonosporosis cucurbiraceareum、派伦霉属(Peyronellaea pinnodella)、Leposphaerulina trifolii、镰刀真菌(Fusarium torulosum)。随着发酵时间的延长,发酵液中真菌的种群结构发生了显著的变化,未发酵的样品的优势菌属为驼孢锈菌属和赤霉菌属,在发酵过程中,这两种真菌逐渐减少,发酵8 d后,优势菌属为细极链格孢菌(Alternaria tenuissima)和疯草内生真菌(Undifilum oxytropis)。说明在黄芪发酵过程中,内生真菌的种群结构会发生变化,可能是发酵液的环境更适合细极链格孢菌(Alternaria tenuissima)和疯草内生真菌(Undifilum oxytropis)的生长繁殖。
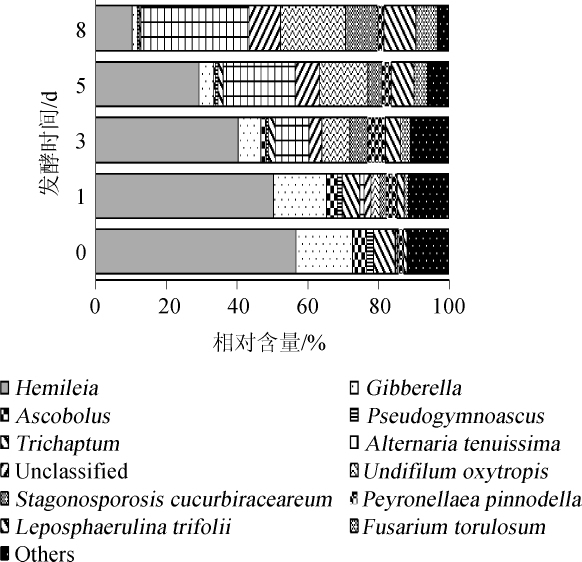
图2 不同发酵时间黄芪内生真菌发酵液中真菌群落结构分析
Fig.2 Fungal community structures ananlysis of fermentation liquid of endophytic fungiin Astragaliradix at different fermentation time
2.4 黄芪内生真菌发酵液抑菌效果评估
通过测定黄芪内生真菌发酵液对E.coli O157∶H7和S.aureus ATCC 49775的抑菌圈、MIC和MBC值,评估不同发酵液样品的抑菌能力,结果如表2所示。
表2 不同发酵时间黄芪内生真菌发酵液的抑菌效果
Table 2 Antibacterial effect of fermentation liquid of endophytic fungiin Astragali radix at different fermentation time
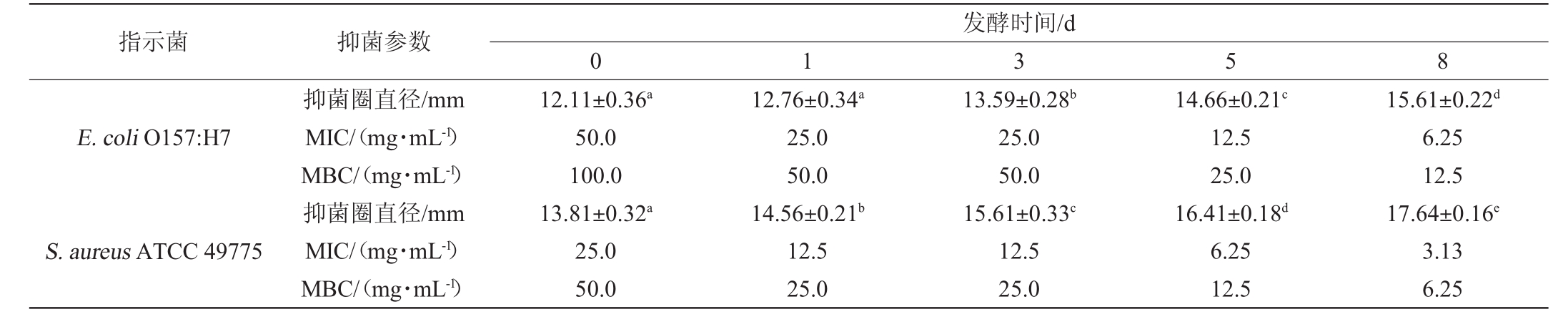
指示菌 抑菌参数发酵时间/d 0 1 3 5 8 E.coli O157:H7 S.aureus ATCC 49775抑菌圈直径/mm MIC/(mg·mL-1)MBC/(mg·mL-1)抑菌圈直径/mm MIC/(mg·mL-1)MBC/(mg·mL-1)12.11±0.36a 50.0 100.0 13.81±0.32a 25.0 50.0 12.76±0.34a 25.0 50.0 14.56±0.21b 12.5 25.0 13.59±0.28b 25.0 50.0 15.61±0.33c 12.5 25.0 14.66±0.21c 12.5 25.0 16.41±0.18d 6.25 12.5 15.61±0.22d 6.25 12.5 17.64±0.16e 3.13 6.25
由表2可知,随着发酵时间的延长,黄芪内生真菌发酵液对两种致病菌的抑菌效果显著增加(P<0.05)。当发酵8 d后,发酵液对E.coli O157∶H7的抑菌圈、MIC和MBC值分别为(15.61±0.22)mm、6.25 mg/mL和12.5 mg/mL,对S.aureus ATCC 49775的抑菌圈、MIC和MBC值分别为(17.64±0.16)mm、3.13 mg/mL和6.25 mg/mL,说明黄芪内生真菌发酵液对上述2种食源性致病菌具有较好的抑菌效果。
2.5 抑菌机理初探
利用1 MIC的黄芪内生真菌发酵液处理E.coli O157∶H7和S.aureus ATCC 49775细胞,并用无处理细胞作为对照,揭示发酵液对受试菌株细胞形态的影响,结果如图3所示。由图3可知,和正常细胞相比,在黄芪内生真菌发酵液的作用下,E.coli O157∶H7和S.aureus ATCC 49775的细胞形态都发生了变形、坍塌、细胞液外泄,这些是造成受试菌株死亡的重要原因之一,研究结果与一些天然产物抑菌机理的报道相似[16-18]。

图3 黄芪内生真菌发酵液对大肠杆菌O157:H7和金黄色葡萄球菌ATCC 49775细胞形态的影响
Fig.3 Effect of fermentation liquid of endophytic fungiin A stra gali radix on the cell morphology of Esch erichia coli O157:H7 and Staphylococcus aureus ATCC 49775
3 结论
本研究利用Illumina Miseq高通量测序技术揭示了黄芪发酵过程中内生真菌多样性的变化,同时对发酵液的抑菌效果进行分析,并对其抑菌机理进行初步探讨。结果表明,黄芪内生真菌发酵液中真菌的丰富度和多样性随着发酵时间的延长而减少,且真菌的种群组成也发生了变化。未发酵黄芪内生真菌的优势菌属为驼孢锈菌属(Hemileia)和赤霉菌属(Gibberella),而发酵8 d后,发酵液的优势菌属为Alternaria tenuissima和Undifilum oxytropis。同时,研究表明,黄芪内生真菌发酵液对E.coli O157∶H7的抑菌圈、MIC和MBC值分别为(15.61±0.22)mm、6.25 mg/mL和12.5 mg/mL,对S.aureus ATCC 49775的抑菌圈、MIC和MBC值分别为(17.64±0.16)mm、3.13 mg/mL和6.25 mg/mL。这种抑菌作用主要是通过破坏病原菌细胞形态,导致细胞塌陷和细胞液泄漏而造成。这一结果有助于拓展黄芪内生真菌发酵液的实用价值,并为黄芪类杀菌剂的开发提供理论依据。
[1]袁红,张淑芳,贾绍辉,等.黄芪生物活性及其在保健食品中的应用研究进展[J].食品科学,2014,35(15):330-334.
[2]姜琛璐,汤承,骞宇,等.黄芪多糖免疫调节作用研究进展[J].食品科学,2013,34(11):327-332.
[3]薛倩倩,刘晓节,李科,等.黄芪药材化学成分差异的研究进展[J].山西医科大学学报,2018,49(10):121-125.
[4]刘超,于春涛,陈俊荣.黄芪发酵菌种及发酵工艺研究进展[J].药物生物技术,2017(6):561-564.
[5]刘蓬蓬,陈江宁,贾天柱.基于IlluminaMiSeq高通量测序分析黄芪内生真菌的多样性[J].中国实验方剂学杂志,2018(12):2640-2645.
[6]马伟,孙丽英,张喜武,等.黄芪内生真菌发酵液中有效成分的初步研究[J].中医药学报,2012,40(3):118-121.
[7]曹丹丹,路浩,李小蒙,等.茎直黄芪内生真菌分离鉴定及其多样性分析[J].草地学报,2015,23(6):1252-1258.
[8]费鹏,杨同香,赵胜娟,等.怀山药酵素粉的制备及抗氧化作用[J].食品与机械,2018,34(8):203-206.
[9]费爽雯,白洁,文佳嘉,等.几种市售酵素中活性物质的比较[J].南昌大学学报:工科版,2017,39(1):27-31.
[10]KEENANDF,RÖßLE C,GORMLEY R,etal.Effect of high hydrostatic pressure and thermal processing on the nutritional quality and enzyme activity of fruitsmoothies[J].LWT-Food Sci Technol,2012,45(1):50-57.
[11]牛明福,杜梦璇,范逸文,等.连翘内生真菌的分离鉴定及其发酵液抑菌活性和HPLC测定[J].天然产物研究与开发,2018,30(4):597-602.
[12]胥伟,姜依何,吴丹,等.高通量测序研究霉变黑毛茶的真菌多样性[J].茶叶科学,2017,37(5):483-492.
[13]CAIG H,LEADBETTER C W,MUEHLBAUER M F,et al.Genomewide microsatellite identification in the fungus Anisogramma anomala using Illumina sequencing and genome assembly[J].Plos One,2013,8(11):e82408.
[14]肖礼,黄懿梅,赵俊峰,等.土壤真菌组成对黄土高原梯田种植类型的响应[J].中国环境科学,2017,37(8):3151-3158.
[15]PENG F,ASLAM A M,SHAOYING G,et al.Antimicrobial activity and mechanism of action of olive oil polyphenolsextractagainst Cronobacter sakazakii[J].Food Control,2018,94:289-294.
[16]LI R,FEI P,MAN C X,et al.Tea polyphenols inactivate Cronobacter sakazakii isolated from powdered infant formula[J].J Dairy Sci,2016,99(2):1019-1028.
[17]陈颖慧.紫甘蓝提取物对食源性致病菌的抑菌作用[J].食品研究与开发,2017,38(17):31-34.
[18]WU S,JIANG Y,LOU B,et al.Microbial community structure and distribution in the air of a powdered infant formula factory based on cultivation and high-throughput sequence methods[J].J Dairy Sci,2018,101(8):6915-6926.
[19]ZHAO Y,CHEN M,ZHAO Z,et al.The antibiotic activity and mechanisms of sugarcane(Saccharum officinarum L.)bagasse extract against food-borne pathogens[J].Food Chem,2015,185:112-118.
[20]LACOMBE A,WU V C H,TYLER S,et al.Antimicrobial action of the American cranberry constituents;phenolics,anthocyanins,and organic acids,against Escherichia coli O157:H7[J].Int J Food Microbiol,2010,139(1-2):102-107.
[21]XUY,SHIC,WUQ,et al.Antimicrobial activity of punicalagin against Staphylococcus aureus and its effect on biofilm formation[J].Foodborne Pathogens Dis,2017,14(5):282-287.