我国传统白酒的酿造是依靠大曲中菌系的繁殖代谢而进行的[1]。参与酿酒发酵的微生物种类很多,包括细菌、霉菌、酵母菌等。追踪其来源,主要是大曲发酵过程中网罗自然界的微生物,因而通过研究大曲中的微生物,了解大曲中微生物数量、种类和分布规律,从而明白白酒的发酵原理是很有必要的[2-5]。中温大曲是清香型大曲酒的糖化发酵剂,由于其发酵最高品温一般在50℃以下,故称中温大曲。
大曲的质量与培养、贮存过程有着密切的关系,主要体现在微生物的差异上,不同时期曲坯的微生物结构和数量有显著区别,影响着糖化酶、液化酶和蛋白酶等多种酶类以及有机酸等代谢产物的生成[6]。目前学者关于不同时期大曲研究中,苏畅等[7]对不同时期大曲中分离的霉菌采用ITS4/5 rRNA区序列进行分析比对,共分离鉴定了193株霉菌,分属于13个种,初步探究出大曲生产过程中不同时期霉菌的组成和变化规律。张丽等[8]对酱香型大曲贮存过程中发酵性能变化进行了研究,得到了高温大曲的最佳贮存期,为稳定基酒的产量和质量提供了参考。王玉霞等[9]对浓香型白酒大曲在发酵和成熟过程中主要功能酶活力进行了分析,为高产酶微生物的分离和筛选提供表征性指导作用,同时也为制曲工艺的改良和加强型特种大曲的研制提供基础数据。而目前关于不同发酵和贮存期清香型大曲的微生物群落结构还有未有报道。
本实验采用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术研究不同发酵期和贮存期中温大曲微生物多样性及其种群结构。不但解决了传统培养方法的缺点和局限性,而且从未培养观点出发全面系统地认识了中温大曲微生物群落结构,克服了现有大曲未培养研究中在方法选择、引物设计等方面的缺陷。同时也为基于培养方法的白酒功能微生物的深入开发及应用提供了有效的参考。运用PCR-DGGE方法研究不同发酵期和贮存期中温大曲的微生物群落结构,将其和大曲风味组成分析、传统的菌种分离鉴定等方法相结合,对鉴定和判断大曲制曲过程中与大曲风味物质形成相关的主要微生物、指导大曲生产,具有非常重要的意义[10-14]。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
中温大曲样品:取川南某酒厂制曲车间发酵期第0、2、4、6、8、10、12 天和贮存期第5、10、15、20天的中温大曲,粉碎后使20目过筛率在90%以上,即为大曲样品。
1.1.2 试剂
乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(分析纯)、Triton X-100、引物P2和P3、NS1和GC-fung:生工生物工程(上海)股份有限公司;Goldview染料、十二烷基硫酸钠(分析纯):上海赛百盛股份有限公司;氯化钠(分析纯)、去离子甲酰胺(分析纯)、琼脂糖、甲叉双丙烯酰胺(分析纯)、尿素(分析纯)、冰乙酸(分析纯)、Tris碱(分析纯):上海星火化工厂;SYBR Green荧光染料:美国Invitrogen公司;Plasmid Mini kit I:美国OMEGA BIo-Tek公司;PCR试剂:大连Takara公司。
1.2 仪器与设备
MyCycler型PCR仪、Dcode DGGE电泳仪:美国BIO-RAD公司;Bio-Best200E型凝胶成像分析系统:美国SIM公司;TY-80R型脱色摇床、JY-SP-C型水平电泳槽、DZF-6050B真空干燥箱、DK-S28电热恒温水浴锅、TGL-16G台式高速离心机:上海实验仪器厂有限公司;thermo 900超低温冰箱:Thermo Scientific;SW-CG-1F型超净工作台:苏州苏洁净化设备有限公司;Nano-200核酸浓度测定仪:通用(上海)有限公司。
1.3 方法
1.3.1 大曲微生物总脱氧核糖核酸的提取和纯化
(1)称取5 g大曲样品,加3 g石英砂充分研磨后装入离心管中,加12 mL 2%十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)抽提液和200μL巯基乙醇,充分振荡后65℃水浴约1 h。然后加入100μL蛋白酶k,振荡5 min后放入摇床(37℃、210 r/min)继续振荡30 min。
(2)将离心管放入离心机中6 000 r/min、4℃条件下离心10 min,取上清液加等体积的酚∶氯仿∶异戊醇(25∶24∶1,V/V)混合液充分振荡,然后再12 000 r/min、4℃条件下离心10 min,再取上清液加入等体积的氯仿∶异戊醇(24∶1,V/V)混合液,充分振荡后在相同条件下离心5 min,取上清液,重复两次,加入0.6倍体积的异丙醇在-20℃沉淀1 h后12 000 r/min离心10 min,倒掉液体。得到的沉淀物用体积分数70%的乙醇洗涤数次,将提取得到的脱氧核糖核酸(deoxyribonucleic acid,DNA)吹干后加50μL Elution Buffer溶解,-80℃保存。
1.3.2 PCR扩增
(1)细菌16S rDNA基因V3区PCR扩增
引物为P2和P3。扩增条件为94℃预变性4 min;94℃变性1 min,应用降落PCR,65℃开始退火,每两轮降低1℃,最终降至56℃,退火1 min;72℃延伸1 min;再94℃变性1 min;55℃退火1 min;72℃延伸1 min,共10个循环,72℃终延伸6 min。
(2)真菌18S rDNA基因PCR扩增
引物为NS1[15]和GC-fung[16]。扩增条件是95℃预变性4 min;93℃变性1 min,应用降落PCR,55℃开始退火,每两轮降低1℃,最终降至45℃;退火1 min;72℃延伸1 min;再94℃变性1 min;55℃退火1 min;72℃延伸1 min,共10个循环,72℃终延伸6 min,细菌、真菌PCR扩增体系见表1,本研究所用引物见表2。
表1 PCR扩增体系
Table 1 System of PCR amplification

PCR反应体系(50μL) 细菌PCR/μL 真菌PCR/μL 10×buffer Taq酶(5U/μL)dNTPs Mixture引物1(10 μmol/L)引物2(10 μmol/L)模板DNA灭菌双蒸水5.0 1.0 4.0 1.0 1.0 1.0 37 5.0 1.0 4.0 2.0 2.0 1.0 35
表2 本研究中用到的PCR引物
Table 2 PCR primers used in this study

注:*GC clamp(5'-CGCCCGCCGCGCGGCGGGCGGGGCGGGGGC-3')添加在引物的5'端。
名称序列(5'→3')细菌16S rRNA基因V3区的引物真菌18S rRNA基因的引物P2 P3*NS1 GC-fung*ATTACCGCGGCTGCTGG CCTACGGGAGGCAGCAG GTAGTCATATGCTTGTCTC ATTCCCCGTTACCCGTTG
1.3.3 DGGE分析
(1)灌制变性梯度凝胶
配制40%丙烯酰胺/甲叉双丙烯酰胺变性胶(37.5∶1)、50倍TAE缓冲液,配制好的试剂4℃保存。配制10%过硫酸铵分子溶液,于冰箱中4℃保存,溶液尽可能现配现用。冼净两块玻璃板,用电吹风吹干,将塑料夹条夹放十两块玻璃板两侧对齐,并用长尾夹夹牢于灌胶架上加入无菌水验证,确保不漏水之后待用。制作聚丙稀酰胺凝胶的规格为20 cm×20 cm,厚1 mm,凝胶浓度为8%,变性范围为30%~50%(100%的变性剂中含有去离子甲酰胺(40%)和尿素(7 mol/L))制备梯度胶,根据表3配制两种变性浓度的丙烯酰胺和双丙烯酰胺溶液,配制好后将凝胶吸入两个注射器中。
表3 变性梯度为30%~50%凝胶的配制[17]
Table 3 Preparation of gel with denaturation gradient 30%-50%
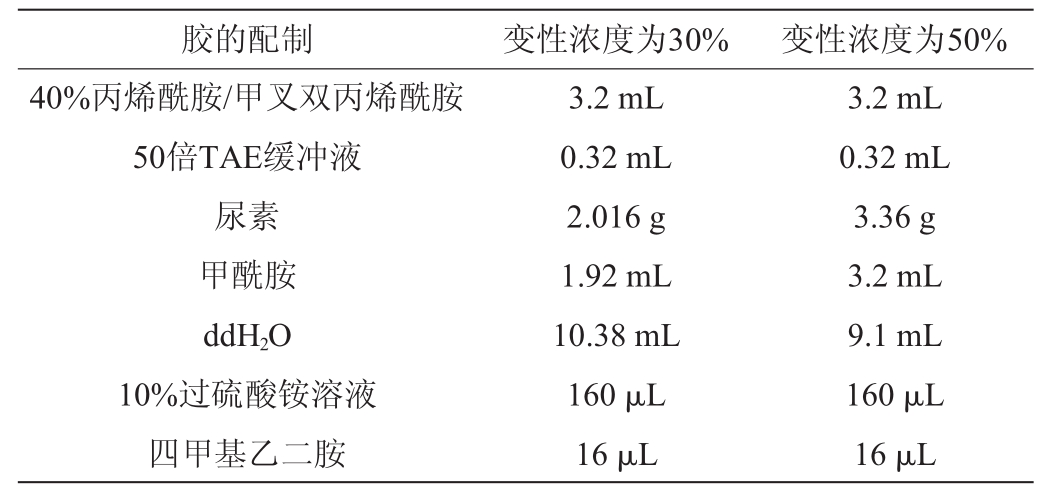
胶的配制 变性浓度为30% 变性浓度为50%40%丙烯酰胺/甲叉双丙烯酰胺50倍TAE缓冲液尿素甲酰胺ddH2O 10%过硫酸铵溶液四甲基乙二胺3.2 mL 0.32 mL 2.016 g 1.92 mL 10.38 mL 160μL 16μL 3.2 mL 0.32 mL 3.36 g 3.2 mL 9.1 mL 160μL 16μL
(2)电泳分析[18]
在电泳槽里加入1×TAE缓冲液,打开加热装置预热,使缓冲液的温度达到60℃。取30μL PCR产物加5μL10×loadding buffer,混匀4℃保存。聚丙烯酰胺凝胶凝固好以后拔掉梳子,将长尾夹固定在电泳槽内,将缓冲液的高度调节至刚刚超过加样孔,用蛋白胶加样针在加样孔中加入35μL混匀后的PCR产物。盖上电泳仪盖,200 V电压电泳3.5 h,电泳完后,用SYBR GreenⅠ染色45 min(在避光条件下每隔15 min染色1次),最后用凝胶成像系统拍照,并取出拍照保存DGGE图谱。
1.3.4 DGGE条带的克隆测序[19]
将DGGE图谱中优势条带标记后,切胶回收并纯化后连接到T载体并转入感受态细胞,蓝白斑筛选后,验证阳性克隆,最后送交测序公司测序。根据测序结果,利用BLAST在GenBank(NCBI)核酸序列数据库进行同源序列搜索,以比较代表菌株与已知相应序列的相似程度。
2 结果与分析
2.1 中温大曲细菌群落结构分析
2.1.1 细菌16S rRNA的DGGE分析
中温大曲细菌的16S rRNA[20]基因DGGE电泳图见图1,细菌DGGE图谱的分析结果见表4,细菌16S rRNA基因的DGGE切胶条带的测序结果分析见表5,细菌DGGE图谱的丰度及条带优势度见图2。
从图1和表4可以看出,共检测到22条不同的条带,这表明在清香型白酒大曲在制曲过程中存在有大量不同微生物菌株,说明大曲细菌种群结构较为复杂,且不同时期的大曲细菌组成存在明显差异。

图1 中温大曲细菌的DGGE指纹图谱
Fig.1 DGGE fingerprint of bacteria in medium temperature Daqu
表4 中温大曲细菌DGGE指纹图谱的分析结果
Table 4 Analysis results of DGGE fingerprint of bacteria in medium temperature Daqu%

注:“ND”表示未检出。
序号 1 2 3 4 5 6 7 8 9 1 0发酵期0 d 2 d 4 d 6 d 8 d 10 d贮存期5 d 10 d 15 d 20 d 11 12 13 14 15 16 17 18 19 20 21 22 16.2 21.8 27.3 0.7 ND ND 7.1 ND 1.7 ND 1.6 ND ND 0.8 ND ND ND 6.4 ND 8.1 1.7 6.7 3.5 8.9 7.8 26.7 ND 11.2 1.8 3.7 4.0 1.9 6.8 ND ND 1.4 ND 6.7 3.2 ND ND ND 12.3 0.2 5.9 7.8 10.2 27.2 ND 1.8 13.8 4.9 1.7 2.0 2.6 3.4 4.2 6.7 1.7 2.3 ND ND ND ND 1.7 2.0 0.8 0.6 8.4 26.6 2.3 3.4 ND ND ND ND 3.1 3.5 10 11.4 ND ND 3.8 8.1 7.8 6.6 2.4 1.2 3.2 4.2 3.5 20.2 ND ND ND 0.2 ND ND 6.6 2.4 14.9 13.1 13.5 10.2 2.4 ND ND 1.8 3.4 0.5 2.8 1.7 4.7 11.9 ND 4.2 ND ND ND 0.6 0.8 ND 7.7 6.6 4.5 6.1 6.6 14.1 8.3 9.2 6.1 4.3 12 d 3.3 0.4 2.3 17.1 16.3 8.1 1.7 ND 2.6 ND 1.1 0.8 20.1 0.8 1.3 7.1 6.3 8.1 1.7 ND 1.5 0.4 2.9 1.7 0.2 21.3 1.8 4.4 4.1 ND ND 2.2 2.6 0.9 18.9 13.7 ND 1.3 3.8 4.4 4.1 2.9 6.8 2.2 2.2 1.9 0.2 18.6 0.8 4.9 1.7 ND ND 8.4 3.2 2.9 16.2 8.9 ND 1.8 8.8 7.9 1.7 2.0 6.6 1.4 3.5 1.2 0.2 23.4 ND 2.8 8.4 ND ND 2.4 3.5 3.1 13.5 10.2 ND 1.3 6.4 4.8 0.6 7.8 4.6 2.4 4.7 6.1 0.4 21.6 1.2 9.3 2.1 ND ND 2.8 1.7 6.2 14.7 6.1 ND ND 0.7 9.8 2.1 1.3 6.5 2.8
从图1和表4可知,发酵到第4天时,条带8、9、10、11、12的亮度增加,说明这几条条带代表的细菌是大曲的优势菌群且数量增多,曲坯开始“穿衣”,品温达到40℃以上,细菌的生长繁殖开始活跃起来,淀粉类物质逐渐消耗,释放大量的热量,使曲块和曲房的温湿度迅速上升,同时抑制了不耐热微生物的生长。随着发酵的进行,第10天时细菌种类达到最大值,说明曲坯的细菌生长繁殖旺盛,微生物生长逐渐伸至曲块内部;分析原因是“大火”期间的高温环境使得微生物的生长受到了抑制,以芽孢杆菌为代表的耐热细菌数量增加,此过程微生物繁殖代谢仍十分旺盛。到贮存期,细菌种类数目开始明显减少,由于淀粉的消耗使细菌的生长处于末期,但1、13、14、16、17、18、19和21号条带亮度明显,成为中温大曲的主要细菌结构,不同贮存期大曲的细菌结构基本相同,数量上有所差异,这些细菌也是清香型大曲酒独特风味的重要来源。
2.1.2 中温大曲细菌群落DGGE图谱上条带的序列分析
根据中温大曲样品的细菌PCR-DGEE指纹图谱,将优势DGGE条带切胶回收、克隆测序后,经Blast比对,结果见表5。
表5 中温大曲细菌群落DGGE图谱条带的序列分析
Table 5 Sequence analysis of DGGE fingerprint band of bacteria in medium temperature Daqu

条带 相似序列 相似度/%1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 Bacillus sp.Ph-2 Bacillus sp.CZB5 Bacillus amyloliquefaciens strain Aec23 Bacillus subtilissub sp.subtilisstr BAB-1 Bacillus licheniformis strain CLM4-1 Bacillus subtilis strain NKY-1 Bacillus sonorensis strain 3ssss Uncultured bacterium clone15 Bacillus sp.Ph-2 Lactobacillus nodensis strain 6225206 Lactobacillus alimentarius strain DSM20249 Bacillus amyloliquefaciens strain gx-63 Uncultured Lactobacillus sp.CloneDMAR238 Lactobacillus curvatus strain KNOUC4148 Weissella koreensis KACC 15510 Pseudomonas sp.Y2-3-10 Weissella paramesenteroides Pseudomonas oryzihabitabs N1 Lactococcus lactis subsp.lactis strain EMC8 Lactobacillus farciminis Lactococcus lactis subsp.lactis strain EMC8 Pseudomonas oryzihabitabs N1 100 99 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 98 100 99 99 100
由表5可知,回收条带DNA序列比对的同源性均在98%以上,结合DGGE图谱可知,在制曲和制酒过程中细菌存在明显的动态变化。在所测22个条带中,其中未培养的细菌占较大的比重,说明大曲中还含有部分未知的细菌,其余细菌从属于芽孢杆菌属(Bacillus),假单胞菌属(Pseudomonas)、魏斯氏菌属(Weissella)和乳酸杆菌属(Lactobacillus)。芽孢杆菌包括解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)和索氏芽孢杆菌(Bacillus sonorensis),魏斯氏菌包括类肠膜魏斯氏菌(Weissella paramesenteroides)和高丽魏斯氏菌(Weissella koreensis),假单胞菌主要是以栖稻假单胞菌(Pseudomonas oryzihabitabs)为主,乳酸杆菌包括诺氏乳杆菌(Lactobacillus nodensis)、消化性乳酸杆菌(Lactobacillus alimentarius)、弯曲乳杆菌(Lactobacillus curvatus)、乳酸乳球菌亚种(Lactococcus lactis subsp)以及香肠乳杆菌(Lactobacillus farciminis)。其中以乳酸杆菌种类最多,芽孢杆菌次之。

图2 不同发酵期和贮存期的中温大曲细菌属水平的丰度
Fig.2 Abundance of bacterial in medium temperature Daqu in genus level in different fermentation and storage periods
由图2可知,不同发酵期和贮存期中温大曲细菌的组成基本相同,呈现动态变化的趋势,未培养的细菌都占了较大部分;发酵前期大曲中Lactobacillus含量最多,其次是Bacillus,Weissella含量随发酵时间的延长逐渐增大;发酵中后期大曲中Bacillus所占的比例最大,其次是Lactobacillus,和培养条件的变化密切相关;贮存第5天时Weissella和Lactobacillus含量较低,后期逐渐增大,贮存后期大曲已培养的细菌中Lactobacillus、Bacillus和Weissell所占比例基本相同;贮存20 d后大曲中已培养的细菌中Bacillus和Lactobacillus含量最大,占据绝对优势。
2.2 中温大曲真菌群落结构分析
2.2.1 真菌18S rRNA的DGGE分析
对大曲中真菌的18S rRNA基因DGGE电泳图见图3,真菌DGGE图谱的分析结果见表6。

图3 中温大曲真菌的DGGE指纹图谱
Fig.3 DGGE fingerprint of fungiin medium temperature Daqu
表6 中温大曲真菌DGGE图谱的分析结果
Table 6 Analysis results of DGGE fingerprint of fungiin medium temperature Daqu%

序号 1234567891 0发酵期0 d 2 d 4 d 6 d 8 d 10 d贮存期5 d 10 d 15 d 20 d 11 12 13 14 15 16 17 18 6.2 7.8 5.3 10.6 5.3 12.1 6.3 28.1 ND ND ND 1.2 2.9 0.8 ND ND 8.3 5.1 2.5 1.9 3.9 6.7 4.2 4.3 6.8 24.4 14 12.9 6.8 ND 1.6 0.9 7.9 ND ND 1.3 1.3 2.8 3.2 0.9 ND 1.8 9.8 14.9 11.7 12 2.6 6.4 5.2 18.9 5.2 ND 1.4 1.8 0.8 4.2 3.5 1.9 ND 2.7 6.2 8.8 9.4 10.8 6.6 2.4 10.9 3.1 18.5 10 0.3 ND ND 0.9 4.7 6.1 3.6 5.9 10.5 9.8 6.1 5.3 6.5 2.8 1.7 16.6 12.7 6.1 0.3 0.5 ND 0.6 ND ND ND 4.4 4 2.9 16.8 12.2 6.6 5.9 7.2 6.7 7.3 19.3 1.8 4.4 12 d ND ND ND ND 5.3 7.1 6.3 8.1 14.6 13.2 ND 8.2 2.9 7.8 2.3 14.5 4.5 5.1 ND ND ND ND 8.3 4.1 5.3 7.2 12.1 10.4 4.8 7.5 2.3 7.8 2.3 16.9 3.8 7.5 ND ND ND ND 5.3 4.1 7.8 8.1 17.6 15.2 ND 2.2 2.9 6.5 8.3 11.5 4.8 5.6 ND ND ND ND 4 6.2 5.4 8.7 14.6 13.2 ND 8.2 2.4 7.8 6.3 14.5 3.6 5.1 ND ND ND ND 7.2 4.7 6.3 4.6 12.3 14.2 0.8 4.4 2.9 7.8 2.3 17.2 9.5 5.9
由图3和表6可知,从不同发酵期和贮存期的中温大曲样品经过DGGE电泳可以分离出18条电泳条带,其中有6条是共有条带,大曲样品发酵开始时真菌数量较少,只有8号条带亮度较大,随着发酵的进行到第10天,真菌的数量逐渐增大,种类增多,说明曲坯开始“上霉”,温度逐渐升高。发酵后期由于温度过高抑制了部分不耐热真菌的生长,数量下降,适当控制这一时期的发酵时间,可为大曲积累更多的代谢产物。贮存期大曲的真菌种类和数量变化趋势基本一致,贮存第10天,部分真菌含量显著增加,但后期有下降。整体的变化趋势是刚开始发酵时真菌种类最多,贮存后期真菌数目逐渐减少。
2.2.2 中温大曲真菌群落DGGE图谱上条带的序列分析
根据不同发酵期和贮存期中温大曲样品的真菌PCRDGGE指纹图谱,将优势DGGE条带切胶回收、克隆测序后,经Blast比对,结果见表7,真菌DGGE图谱的丰度及条带优势度见图4。
表7 中温大曲真菌群落DGGE图谱上条带的序列分析
Table 7 Sequence analysis of DGGE fingerprint band of fungiin medium temperature Daqu

条带 相似序列 相似度/%1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 Rhizopus oryzae strain FSU 6165 Lichtheimia corymbifera strain MJ79 Kodamaea ohmeri strain CBS 5367 Wickerhamomyces anomalus strain TIBx229 Saccharomycopsis fibuligera strain YW12 Amylomyces rouxii isolate 35b Saccharomycopsis fibuligera strain YW12 Saccharomycopsis fibuligera strain YW12 Pichia kudriayzevii strain D1C Pichia kudriayzevii strain D1C Rhizopus microsporus Lichtheimia corymbifera strain MJ79 Wickerhamomyces anomalus strain TIBx229 Wickerhamomyces anomalus strain TIBx229 Amylomyces rouxii isolate 35b Talaromyces byssochlamydoides strain CBS 413.71 Talaromyces byssochlamydoides strain CBS 413.71 Pichia kudriayzevii strain Y16 99 100 100 99 100 99 100 100 100 99 99 96 100 99 99 99 99 100
从表7可以看出在共检测到18条不同条带,回收条带DNA序列比对的同源性均在99%以上,真菌从属于根霉菌属(Rhizopus)、横梗霉属(Lichtheimia)、海洋酵母属(Kodamaea)、维克霉菌属(Wickerhamomyce)、黄丝曲霉属(Talaromyces)、酵母菌属(Saccharomycopsi)、淀粉霉菌属(Amylomyce)和毕赤酵母属(Pichia)。其中以霉菌的种类最多,酵母菌次之。
其中淀粉霉(Amylomyces rouxii)、米根霉(Rhizopus oryzae)是重要的液化、糖化菌株;扣囊复膜酵母菌(Saccharomycopsis fibuligera)广泛分布于自然界中,能够分泌α-淀粉酶、蛋白酶在内的多种水解酶,异常威克汉姆酵母(Wickerhamomyces anomalus)也具有提高乙酸乙酯产量、分泌β-葡萄糖苷酶的能力,从而使得酒体风味更加协调、丰满。

图4 不同发酵期和贮存期的中温大曲真菌属水平的丰度
Fig.4 Abundance of fungal in medium temperature Daqu in genus level in different fermentation and storage periods
由图4可知,不同发酵期和贮存期的中温大曲真菌中的根霉菌属和酵母菌属占据绝对优势。发酵前大曲中Accharomycopsi、Rhizopus和Pichia是优势菌,有少部分的Amylomyce、Kodamaea和Lichtheimia,主要来自原料和环境中;当发酵进行时,随着培养条件的变化,Wickerhamomyce和Amylomyces大量繁殖,含量明显增大,到发酵第8天时,大曲真菌种类显著减少,只有Pichia、Rhizopus、Wickerhamomyce和Amylomyce后期逐渐增加。大曲贮存期间,酵母菌和霉菌数量比基本维持不变,各类真菌呈现动态变化的趋势,酵母菌的数量略高于霉菌。
3 结论
利用PCR-DGGE技术对不同发酵期和贮存期的中温大曲的微生物群落结构进行分析,全面了解了中温大曲中的微生物种类和微生物群落结构,可以有效避免传统培养方法固有局限,得到了大曲中细菌和真菌在不同时期的变化趋势,从而达到优化中温大曲的发酵的贮存条件,丰富微生物的种类的目的。
从分析结果来看,DGGE条带解析出的中温大曲细菌有19种,细菌从属于芽孢杆菌属(Bacillus),假单胞菌属(Pseudomonas)、魏斯氏菌属(Weissella)和乳酸杆菌属(Lactobacillus),其中芽孢杆菌属(Bacillus)和乳酸菌(Lactobacillus)属于优势菌群;中温大曲真菌有13种,从属于根霉菌属(Rhizopus)、横梗霉属(Lichtheimia)、海洋酵母属(Kodamaea)、维克霉菌属(Wickerhamomyce)、黄丝曲霉属(Talaromyces)、酵母菌属(Saccharomycopsi)、淀粉霉菌属(Amylomyce)和毕赤酵母属(Pichia),其中根霉属(Rhizopus)、毕赤酵母属(Pichia)和酵母属(Saccharomyces)属于优势菌群。不同的时期大曲微生物种类和数量呈动态变化的趋势,受培养条件(特别是温度)的影响较大,整体的趋势是发酵开始时微生物数量较少,到了发酵中期(4~8 d),微生物数量达到顶点,大量细菌和真菌旺盛繁殖,代谢产物不断积累,发酵后期由于培养环境的变化以及营养的消耗,微生物群落逐渐减少并趋于稳定;贮存期内,微生物的种类的趋于平稳,数量变化较大。
[1]张宿义.泸型酒技艺大全[M].北京:中国轻工业出版社,2011:24-29.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:41-46.
[3]明红梅,郭志,孙伟,等.浓香型大曲中产香微生物的筛选及鉴定[J].现代食品科技,2015(4):186-191.
[4]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[5]WANG C L,SHI D J,GONG G L.Microorganisms in Daqu:a starter culture of Chinese Maotai-flavor liquor[J].World J Microbiol Biot,2008,28:2183-2190.
[6]QINP,KONGZ,LIAOX,LIUY.Effectsof accelerated aging on physiological and biochemical characteristics of waxy and non-waxy wheat seeds[J].J Northeast Agr Univ,2011,18(2):7-12.
[7]苏畅,窦晓,叶新,等.基于ITS4/5 rRNA区序列对不同时期大曲中霉菌的分离与鉴定[J].现代食品科技,2018,34(3):54-58,211.
[8]张丽,卢红梅,陈莉,等.酱香型大曲贮存过程中发酵性能变化的研究[J].现代食品科技,2017,33(9):231-237.
[9]王玉霞,李兵,申孟林,等.浓香型白酒大曲在发酵和成熟过程中主要功能酶活力分析[J].食品工业科技,2018,39(11):107-111.
[10]GUIEYSSE B,WICKSTRÖM P,FORSMAN M,et al.Biomonitoring of continuous microbial community adaptation towards more efficient phenoldegradation in a fed-batch bioreactor[J].Appl Microbiol Biotechn,2001,56(5-6):780-787.
[11]张巧玲,吕锡斌,秦兴,等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造,2019,38(4):53-57.
[12]施思,张文学,邓宇,等.用DGGE技术构建白酒酿造微生物指纹图谱的初步研究[J].中国酿造,2010,29(1):118-120.
[13]刘琨毅,王琪,周书来,等.基于磷脂脂肪酸剖析不同老熟方法的窖泥微生物群落结构[J].中国酿造,2019,38(1):134-139.
[14]RENOUF V,FALCOU M,MIOT-SERTIER C,et al.Interactions between Brettanomyces bruxellensis and other yeast species during the initial stages of winemaking[J].J Appl Microbiol,2006,100(6):1208-1219.
[15]罗惠波,黄治国,李浩,等.浓香型大曲原核微生物群落的PCR-SSCP解析[J].微生物学报,2009,36(9):1363-1367.
[16]MAY L A,SMILEY B,SCHMIDT M G.Comparative denaturing gradient gel electrophoresis analysis of fungal communities associated with whole plant corn silage[J].Canad J Microbiol,2001,47(9):829-841.
[17]ZHANG W X,QIAO Z W,SHIGEMATSU T,et al.Analysis of the bacterial community in Zaopei during production of Chinese Luzhouflavor liquor[J].J Inst Brew,2005,111(2):215-222.
[18]SCHEIRLINCK I,VAN DE MEULEN R,VAN SCHOOR A,et al.Influence of geographical origin and flour type on diversity of lactic acid bacteria in traditional Belgian sourdoughs[J].Appl Environ Microbiol,2007,73(19):6262-6239.
[19]罗小叶,胥思霞,邱树毅,等.高酯化大曲催化增香技术在浓香型白酒生产上的应用[J].中国酿造,2018,37(10):141-144.
[20]MARTORELL P,QUEROL A,FERNANDEZ-ESPINAR MT.Rapid identification and enumeration of Saccharomyces cerevisiae cells in wine by real-time PCR[J].Appl Environ Microbiol,2005,71:6823-6830.