糖尿病是由高血糖引起的代谢疾病,当机体长期暴露于高血糖环境中,会导致各种组织(如眼、肾、肝、血管等)受到慢性氧化损伤而导致其功能障碍[1]。由于肝脏是调节糖代谢的重要器官,糖尿病更易加快肝脏损伤,并且绝大多数的Ⅱ型糖尿病患者通常伴有脂肪肝症状[2-3]。所以,保肝护肝对于糖尿病患者的治疗也相当重要。糖尿病肾病是由糖尿病引发的最常见也是最严重的并发症之一,并且已发展为糖尿病患者高死亡率的一个重要原因[4-5]。糖尿病会引起肾脏的恶化,其初期病理学表现为肾细胞基底膜增厚、系膜区扩张、足细胞损伤,后期发展为肾脏肥大、肾小球硬化[6]。
研究发现,氧化损伤是糖尿病并发症中最重要的损伤途径之一[7]。氧化应激是指体内氧化还原失衡,氧化作用显著强于还原作用,从而刺激机体产生并且积累大量有害的氧化中间产物。当机体长期处于高血糖状态会导致体内活性氧(reactive oxygen species,ROS)大量生成,ROS可对脏器造成直接或间接损伤[8]。因此,预防与改善高血糖导致的机体氧化应激对于缓解糖尿病肝肾损伤具有重要意义。
锁掷酵母(Sporidiobolus pararoseus)是一类自然界中广泛存在的红色担子菌门真菌[9]。研究发现,S.pararoseus JD-2酵母具有培养方式简单、易分离、宜高密度培养、高产类胡萝卜素[10]等营养代谢物的特点[11]。研究表明,类胡萝卜素有清除自由基[12]、保护细胞、增强细胞免疫功能,已被作为保健品功能因子广泛应用于食品、药品等行业[13]。S.pararoseus JD-2代谢产物富含类胡萝卜素,其中主要成分是γ-胡萝卜素、β-胡萝卜素、圆酵母素和红酵母红素,其是维生素A前体,具有抗氧化和抗衰老活性[14-15]。由于酵母粉独特的抗氧化作用,提示了其在Ⅱ型糖尿病及其并发症中有可能发挥积极作用。
本研究采用了Ⅱ型糖尿病模型小鼠作为研究对象,观察了锁掷酵母粉对糖尿病小鼠肝、肾病的保护作用,进一步研究了其可能的作用机制,为酵母粉治疗糖尿病肝、肾损伤提供了参考。
1 材料与方法
1.1 材料与试剂
锁掷酵母(Sporidiobolus pararoseus)JD-2-8:由本实验室自行筛选所得。
斜面培养基:蛋白胨10 g/L,葡萄糖20 g/L,酵母膏10 g/L,琼脂20 g/L,pH6.0;种子培养基:葡萄糖20 g/L,玉米浆20 g/L,MgSO4·7H2O 0.5 g/L,KH2PO4 1.0 g/L,pH 6.0;发酵培养基:葡萄糖40 g/L,玉米浆20 g/L,MgSO4·7H2O 0.5 g/L,KH2PO4 1.0 g/L,pH 6.0。
丙酮、氯化钠、柠檬酸、浓盐酸、柠檬酸钠(均为分析纯):国药集团上海化学试剂有限公司;盐酸二甲双胍(药品级):山东司邦得制药有限公司;蛋白定量试剂盒、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD):南京建成生物工程研究所;链脲佐菌素(streptozotocin,STZ):美国Sigma公司;无特定病原体(specific pathogen free,SPF)级C57BL/6小鼠[SCXK(沪)2013-0018]:上海斯莱克实验动物有限公司。
1.2 仪器与设备
ROCHE罗氏活力血糖仪及试纸:德国Roche罗氏生物技术有限公司;AB204-N电子天平:Mettler-Toledo Group;Scientz-10nd冷冻干燥机:宁波新芝生物科技有限公司;XSP-2C生物光学显微镜:苏州欧卡精密光学仪器有限公司;ZNCL-GS智能磁力搅拌器:郑州科华仪器设备有限公司;centrifugae5804R离心机:德国Eppendorf公司;WFJ7200可见分光光度计:龙尼柯上海仪器有限公司;HWS-24电热恒温水浴锅:上海齐欣科学仪器有限公司。
1.3 方法
1.3.1 锁掷酵母粉的制备
将液氮保存的菌种接入斜面培养基,28℃恒温培养48 h,分离得一环菌种接入装有50 mL种子培养基的500 mL锥形瓶中,28℃、100 r/min摇床培养24 h得种子液。再将10 mL种子液接入装有100mL发酵培养基的500 mL锥形瓶中,28℃、72 h连续培养后得到锁掷酵母发酵液。发酵液4 000 r/min离心15 min,沉淀部分冷冻干燥后即为锁掷酵母粉。
1.3.2 实验动物与模型的建立
48只雄性C57BL/6小鼠,常规饲料适应性喂养7 d,禁食16 h,测定小鼠的空腹血糖值,随机抽取8只为空白对照组(blank control,BC)。空白对照组小鼠喂养常规饲料,其余均喂养高脂肪饲料,喂养4周后所有小鼠均禁食过夜,给除空白组外的小鼠连续3 d腹腔注射100 mg/kg STZ柠檬酸缓冲液[16],空白组小鼠注射同等剂量的柠檬酸缓冲溶液。3 d后禁食不禁水过夜,小鼠尾静脉取血测空腹血糖值。若小鼠空腹血糖值≥11.1 mmol/L,即成功诱导40只小鼠糖尿病模型。
将以上40只Ⅱ型糖尿病小鼠随机分5组,每组8只,分别为糖尿病模型组(diabetes model,DM)、阳性组(positive contral,PC)(盐酸二甲双胍1.5 mg/kg)、酵母粉低剂量组(FL)(锁掷酵母粉1.5 g/kg)、酵母粉中剂量组(FM)(锁掷酵母粉3.0 g/kg)、酵母粉高剂量组(FH)(锁掷酵母粉6.0 g/kg),该5组均喂热量饲料,锁掷酵母粉溶于生理盐水后经口灌胃,灌胃周期为8周。
1.3.3 小鼠体质量、进食量、饮水量及脏器指数的测定
每周同一时间记录小鼠体质量;通过间隔2 d的饲料量与饮水量差值,计算小鼠每天的采食量、饮水量;实验结束后,摘取心脏、肝脏、肾脏、脾脏并准确称质量。
1.3.4 小鼠空腹血糖及血清生化指标的测定
每周同一时间禁食16 h不禁水,尾静脉取血,血糖仪测定小鼠的空腹血糖值。实验最后1 d,水合氯醛麻醉小鼠,摘取眼球收集血液,室温静置30 min,4℃、4 000 r/min离心15 min,分离得血清,-20℃储藏,1周内用试剂盒测定血清MDA、SOD指标。
1.3.5 测定肝、肾组织中SOD和MDA的测定
实验结束,快速取出肝、肾组织0.2 g,预冷生理盐水漂洗,滤纸吸干水分,加入9倍4℃的生理盐水,制备10%的组织匀浆液。组织匀浆液4℃、3 500 r/min离心10 min,测定上清液中的蛋白浓度、丙二醛、超氧化物歧化酶的含量。
1.3.6 肝、肾组织病理观察
制备病理切片。实验结束,快速取出小鼠部分肝、肾组织并用4%多聚甲醛固定1 d,不同浓度酒精梯度脱水、石蜡包埋,继续切成4μm的薄片。最后,切片脱蜡,苏木精-伊红(hematoxylin-eosin,HE)染色,脱水,树胶封片,以备观察。
1.4 数据统计与分析
选用统计学分析软件IBMSPSSStatistics21.0,one-way ANOVA方法及Duncan检验分析数据,数值以(平均值±标准误差)表示。当P<0.05时表示有显著性差异,且具有统计学意义。
2 结果与分析
2.1 锁掷酵母粉对小鼠脏器指数的影响
表1 锁掷酵母粉对小鼠脏器指数的影响
Table 1 Effect of Sporidiob olus pararoseus powder on visceral index of mice

注:与空白组相比,“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01);与模型组相比,“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。下同。
脏器心脏肝脏肾脏脾脏脏器系数/(g·kg-1)BC DM PC FL FM FH 5.91±0.63 43.56±4.19 7.58±1.55 2.88±0.51 4.58±0.97#64.21±2.74#17.83±0.78#3.47±0.83 5.46±0.15*61.09±2.98*12.75±0.25*3.15±0.43 5.23±0.11*62.90±3.42*11.91±0.90**3.07±0.30 5.19±0.70*67.06±4.24*13.15±0.63*2.75±0.56 5.37±0.46*59.31±3.55*12.01±0.76**3.32±0.51
由表1可知,相比于空白组,小鼠的脾脏系数无显著性差异(P>0.05),心脏系数减小,肝和肾的脏器系数却显著增大(P<0.05)。相比于模型组,阳性组可以缓解脏器损伤,不同剂量酵母粉组则可以更显著地减轻肾脏指数(P<0.01)。
2.2 锁掷酵母粉对小鼠体质量、进食进水量及空腹血糖的影响
由图1可知,空白组小鼠的体质量正常增长,并且饮水量、采食量无显著差异(P>0.05)。模型组小鼠在注射STZ后体质量明显降低,但饮水、采食量明显增多,这是糖尿病模型明显症状,即“三多一少”。而阳性和不同酵母粉剂量组小鼠情况有所改善。

图1 锁掷酵母粉对小鼠体质量(a)、饮水量(b)、采食量(c)、空腹血糖值(d)的影响
Fig.1 Effect of Sporidiobolus pararoseus powder on body weight(a),water intake(b),food intake(c),fasting blood glucose(d)of mice
小鼠的血糖水平在开始前都在4.7 mmol/L左右,当注射STZ造模,除空白组小鼠外,各组小鼠血糖值明显上升(≥11.1 mmol/L),此即糖尿病小鼠症状。阳性组和酵母粉组小鼠血糖水平较模型组相比有所下降,虽然可以保持稳定,但没有恢复到空白组水平。
众多研究表明,Ⅱ型糖尿病是一种长期的代谢紊乱疾病,且以高血糖、胰岛素抵抗和胰岛素分泌相对不足为特征[17-18]。本研究主要通过高热量饮食结合了STZ腹腔注射C57BL/6小鼠,诱导小鼠胰岛素代谢紊乱,造成Ⅱ型糖尿病模型。由于高热量饮食使小鼠产生胰岛素抵抗,并且连续3 d的STZ腹腔注射直接破坏了体内部分胰岛β细胞[19],导致胰岛素更加分泌不足,血糖代谢紊乱,因此,小鼠空腹血糖值上升。
2.3 锁掷酵母粉对小鼠血清SOD、MDA的影响
由表2可知,相对于空白组小鼠,模型组小鼠血清中超氧化物歧化酶(SOD)活性显著降低,丙二醛(MDA)浓度却显著上升(P<0.01)。阳性组和酵母粉组均可显著提高SOD含量,减少MDA的生成(P<0.05)。
表2 锁掷酵母粉对小鼠血清超氧化物歧化酶和丙二醛的影响
Table 2 Effect of Sporidiobolus pararoseus powder on superoxide dismutase and malondialdehyde in serum of mice

分组SOD活力/(U·mL-1)MDA含量/(μmol·L-1)BC DM PC FL FM FH 23.74±1.76 18.50±1.20##20.85±0.57*19.77±0.13*20.35±1.09*20.96±0.82*46.09±4.66 73.05±4.81##49.60±6.74*60.13±11.40 51.65±12.12*48.48±9.11**
2.4 锁掷酵母粉对小鼠肝、肾组织中SOD、MDA的影响
由表3可知,相比于空白组小鼠,模型组小鼠肝、肾组织中MDA含量显著增高(P<0.01),SOD活性明显降低(P<0.01)。与模型组相比,阳性组和酵母粉组不仅可以明显提高SOD活性(P<0.05),还可以降低MDA含量,其中酵母粉高剂量组效果最为显著(P<0.01)。
大量研究表明,糖尿病与氧化应激相关[20]。活性氧自由基(ROS)可以在机体各个组织中引起氧化应激,导致氧化还原平衡失衡,从而激活了一系列对氧化应激敏感的细胞因子,细胞内信号转导被激活,进一步紊乱糖、脂代谢等通路,最终导致一系列糖尿病慢性并发症,如糖尿病肝病、糖尿病肾病等[21]。自由基不仅可以造成生物膜的脂质过氧化损伤,直接或间接破坏细胞蛋白质、核酸、脂肪,而且会损伤内脏器官、免疫系统的形态功能,引起机体疾病[22]。
表3 锁掷酵母粉对小鼠肝、肾超氧化物歧化酶和丙二醛的影响
Table 3 Effect of Sporidiobolus pararoseus powder on superoxide dismutase and malondialdehyde in liver and kidney of mice

分组肝脏组织SOD/(U·mg-1 prot)MDA/(mmol·mg-1 prot)肾脏组织SOD/(U·mg-1 prot)MDA/(nmol·mg-1 prot)BC DM PC FL FM FH 128.31±39.60 81.91±10.20##128.01±27.21**119.48±18.46*120.76±11.60*128.30±13.79**198.65±55.10 383.90±67.28##276.27±44.23*313.29±65.14 267.75±82.27*240.82±59.11**97.23±11.60 73.31±9.20##80.21±10.01*82.28±10.46*84.46±9.60*82.60±8.59*1.53±0.21 2.84±0.22##2.18±0.15*2.16±0.14*1.97±0.27*1.72±0.11**
由于机体糖代谢紊乱,葡萄糖进行自身氧化,Ⅱ型糖尿病患者体内产生大量活性氧,并常伴有脂肪肝等[23-24]。当活性氧增加,机体内存在酶系抗氧化系统-超氧化物歧化酶(SOD)活性就会下降,导致机体不能及时清除自由基,产生了大量的脂质过氧化产物,最终使末端产物丙二醛含量升高[25]。由表2可知,Ⅱ型糖尿病小鼠经不同剂量的酵母粉干预后,均能够不同程度地恢复小鼠机体的抗氧化抵御能力,清除脂质过氧化产物,小鼠血清中SOD活性水平有所上升,与模型组有显著性差异(P<0.05);MDA浓度显著下降,阳性对照组、中剂量组、高剂量组与模型对照组均有显著差异(P<0.05),高剂量组可恢复至空白组正常水平。表明酵母破壁粉可以提高小鼠体内抗氧化酶SOD的活性,显著降低MDA水平。通过对表3中肝脏和肾脏数据分析,与空白组小鼠比较,模型组小鼠的肝脏、肾脏SOD和MDA水平均有极显著差异(P<0.01),说明糖尿病对肝、肾造成了实质性的损伤,组织内抗氧化酶系活力降低了,清除自由基能力减弱,产生氧化应激。但通过阳性药物和不同剂量的酵母粉的治疗,糖尿病小鼠的SOD活性水平均有所提高,除了低剂量酵母粉的肝脏MDA没有显著差异(P>0.05),其余组的MDA含量均得到了有效的清除。由于剂量效应,高剂量组的治疗效果比阳性药物二甲双胍有极显著差异(P<0.01),这也证明了酵母粉具有独特的抗氧化性。
2.5 小鼠肝、肾病理观察
由图2可知,HE切片染色结果显示,空白组小鼠肾病理切片结构清晰,系膜细胞与细胞外基质分布正常,无增生及纤维化现象。糖尿病组小鼠肾小球细胞数量增多,细胞间无明显的间隙,细胞水肿,肾小球的系膜细胞基底膜增厚,系膜区扩张;阳性组和酵母粉组小鼠组织损伤较糖尿病组小鼠减轻,肾小球结构较为清晰,肾小管排列清楚,酵母粉高剂量组小鼠肝肾组织病理情况最佳。
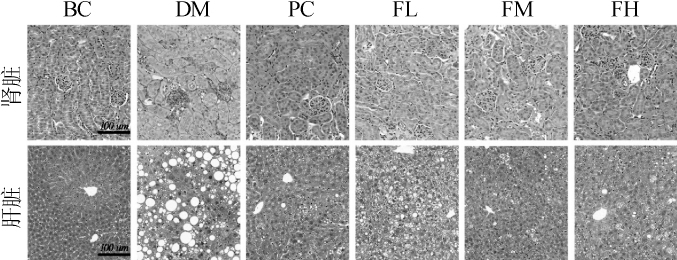
图2 小鼠肾脏、肝脏病理形态(HE染色,×200)
Fig.2 Pathological morphology of kidney and liver of mice(HE staining,×200)
肝病理切片显示,空白组小鼠肝细胞形态正常,无脂肪变性现象。模型组的小鼠肝脏明显有各种脂肪空泡,出现大量双核肝细胞。阳性组小鼠肝细胞脂肪性变基本消失,但仍可见少量肝细胞坏死碎片,酵母粉低组小鼠肝脏仍存在小泡性脂肪形变,并且伴有肝细胞碎片,酵母粉中、高剂量组小鼠肝细胞仅可见少量脂肪变性。
通过病理切片观察,模型组小鼠肝组织结构紊乱,大部分肝细胞内出现大脂肪空泡与小脂肪空泡。二甲双胍治疗组可以明显减轻Ⅱ型糖尿病造成的脂肪肝症状,而经锁掷酵母粉治疗后,中剂量与高剂量组的糖尿病小鼠的肝细胞排列基本规则,肝细胞内大脂肪空泡减少,尤其是高剂量的酵母粉的作用效果更为显著。此结果表明,锁掷酵母粉对糖尿病小鼠的肝脏有保护作用,并且高剂量的酵母粉与阳性药物二甲双胍治疗效果类似。在本项研究中,糖尿病小鼠经酵母粉治疗8周后,病理检查发现,肾小球系膜区增生减轻,肾小管恢复至正常状态。
3 结论
本研究证明了锁掷酵母(Sporidioboluspararoseus)JD-2-8粉能提高Ⅱ型糖尿病小鼠血清、肝和肾的抗氧化能力,提高肝肾内抗氧化酶SOD活性,加快清除氧化应激产物MDA含量,减少高血糖对肝、肾组织的损害,从而延缓Ⅱ型糖尿病的发展,其机制可能是通过改善肝、肾氧化应激、提高肝、肾抗氧化能力。
[1]SHAO N,KUANG H Y,WANG N,et al.Relationship between oxidant/antioxidant markers and severity of microalbuminuria in the early stage of nephropathy in type 2 diabetic patients[J].J Diabetes Res,2013:232404.
[2]KUCHAY M S,KRISHAN S,MISHRA S K,et al.Effect of empagliflozin on liver fat in patients with type 2 diabetes and nonalcoholic fatty liver disease:A randomized controlled trial(E-LIFT Trial)[J].Diabetes Care,2018,41(8):1801-1808.
[3]AHMADIEH H,AZAR S T.Liver disease and diabetes:Association,pathophysiology,and management[J].Diabetes Res Clin Pr,2014,104(1):53-62.
[4]CHOW F,OZOLS E,NIKOLIC-PATERSON D J,et al.Macrophages in mouse type 2 diabetic nephropathy:correlation with diabetic state and progressive renal injury[J].Kidney Int,2004,65(1):116-128.
[5]STOLAR M.Glycemic control and complications in type 2 diabetes mellitus[J].Am J Med,2010,123:S3-S11.
[6]ANJANEYULU M,CHOPRA K.Nordihydroguairetic acid,a lignin,prevents oxidative stress and the development of diabetic nephropathy in rats[J].Pharmacology,2004,72(1):42-50.
[7]BANDEIRA S D,DA FONSECA L J S,GUEDES G D,et al.Oxidative stress as an underlying contributor in the development of chronic complications in diabetes mellitus[J].Int J Mol Sci,2013,14(2):3265-3284.
[8]KASHIHARA N,HARUNA Y,KONDETIV K,et al.Oxidative stress in diabetic nephropathy[J].Curr Med Chem,2010,17(34):4256-4269.
[9]DU C,LIY C,GUO Y H,et al.Torularhodin,isolated from Sporidiobolus pararoseus,inhibits human prostate cancer LNCaP and PC-3 cell growth through Bcl-2/Bax mediated apoptosis and AR down-regulation[J].Rsc Adv,2015,5(129):106387-106395.
[10]KOT A M,BLAZEJAK S,GIENTKA I,et al.Torulene and torularhodin:"new"fungal carotenoids for industry?[J].Microb Cell Fact,2018,17(1):49.
[11]韩梅,徐致远,钱和,等.锁掷酵母油中营养成分的分离和鉴定[J].微生物学通报,2016,43(1):60-68.
[12]ABDEL-RAHMAN H G,ABDELRAZEK H M A,ZEIDAN D W,et al.Lycopene:Hepatoprotective and antioxidant effects toward bisphenol A-induced toxicity in female wistar rats[J].Oxid Med Cell Long,2018,2018:https://doi.org/10.1155/2018/5167524.
[13]CHEWB P,PARK J S.Carotenoid action on the immune response[J].J Nutr,2004,134(1):257s-261s.
[14]MOLINE M,LIBKIND D,BROOCK M V.Production of torularhodin,torulene,and beta-carotene by Rhodotorula yeasts[J].Meth Mol Biol,2012,898:275-283.
[15]ERSHOV IV,DMITROVSKIIA A,POLULIAKHOV,et al.Enzymatic conversion of torulene and torularhodine into retinal[J].Prikl Biokhim Mikrobiol,1992,28(5):680-684.
[16]GUO Y,LIU Y H,WANGY X.Beneficial effect of lycopene on anti-diabetic nephropathy through diminishing inflammatory response and oxidative stress[J].Food Funct,2015,6(4):1150-1156.
[17]WANGX,XIAN T,JIA X,et al.A cross-sectional study on the associations of insulin resistance with sex hormone,abnormal lipid metabolism in T2DM and IGT patients[J].Medicine(Baltimore),2017,96(26):e7378.
[18]PARKINSON J,HAMREN B,KJELLSSON M C,et al.Application of the integrated glucose-insulin model for cross-study characterization of T2DM patients on metformin background treatment[J].Brit J Clin Pharmaco,2016,82(6):1613-1624.
[19]BAO L,LI J,ZHA D,et al.Chlorogenic acid prevents diabetic nephropathy by inhibiting oxidative stress and inflammation through modulation of the Nrf2/HO-1 and NF-kB pathways[J].Int Immunopharmacol,2018(54):245-253.
[20]YASSA H D,TOHAMY A F.Extract of Moringa oleifera leaves ameliorates streptozotocin-induced diabetes mellitus in adult rats[J].Acta Histochem,2014,116(5):844-854.
[21]WANG X,GU C S,HE W,et al.Glucose oxidase induces insulin resistance via influencing multiple targets in vitro and in vivo:The central role of oxidative stress[J].Biochimie,2012,94(8):1705-1717.
[22]AKASH M S,REHMAN K,CHEN S.Spice plant Allium cepa:dietary supplement for treatment of type 2 diabetes mellitus[J].Nutrition,2014,30(10):1128-1137.
[23]KARUNAKARAN U,PARK K G.A systematic review of oxidative stress and safety of antioxidants in diabetes:focus on islets and their defense[J].Diabetes Metab J,2013,37(2):106-112.
[24]STANCAKOVA A,PAANANEN J,SOININEN P,et al.Effects of 34 risk loci for type 2 diabetes or hyperglycemia on lipoprotein subclasses and their composition in 6,580 nondiabetic finnish men[J].Diabetes,2011,60(5):1608-1616.
[25]YE G,METREVELI N S,DONTHI R V,et al.Catalase protects cardiomyocyte function in models of type 1 and type 2 diabetes[J].Diabetes,2004,53(5):1336-1343.