酿酒葡萄果实品质是决定葡萄酒质量的主要因素[1]。影响葡萄果实品质的因素很多,可分为内部因素和外部因素,内部因素包括品种特性、树龄、地形、内源激素等[2-3],外部因素包括环境因素、栽培措施、内源激素等[4-5]。葡萄所处的环境包括大气候、小气候和微气候三个层次,大气候和小气候对特定的酿酒产区是无法改变的,但果际微环境可通过栽培措施进行调节和改变[6],从而对葡萄果实品质产生一定的影响。微环境调控栽培措施包括疏穗、套袋、叶幕厚度、行间生草、摘叶等[7-11]。近年来,摘叶处理作为一种常规技术广泛应用于一些长势强、着色不良的葡萄品种,得到广大学者的认可,通过适时适量摘除果穗周围的叶片能够减少叶片间的相互遮挡,不仅增加光照和冠层内空气流通,同时能够使果穗接受更多的光照,提高果实的色泽和品质[11-14]。
晋中南地区是我国一个新兴的葡萄酒产区,赤霞珠和品丽珠作为该地区主栽酿酒葡萄品种,存在果实着色不良等现象。本试验通过研究摘除老叶对赤霞珠和品丽珠果实酚类物质的影响,以期筛选出最佳的摘叶强度和时期,为晋中南地区酿酒葡萄与葡萄酒的生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
赤霞珠(Vitis vinifera L.cv.Cabernet Sauvignon)、品丽珠(Vitis vinifera L.cv.Cabernet Franc):2012年定植,株行距1 m×3 m,单篱架斜拉“厂”字形,南北行向栽培。
1.1.2 化学试剂
福林-酚试剂(分析纯):美国Sigma公司;NaCl、酒石酸、NaOH、色谱甲醇、乙酸乙酯(均为分析纯):北京化学试剂公司;试验用水均为去离子水。
1.2 仪器与设备
KQ500E超声波振荡器:昆山禾创超声仪器有限公司;AUW220D电子天平、LC-2030型岛津高效液相色谱仪:日本岛津公司;GL-20G-H型高速冷冻离心机:上海安亭科学仪器厂;FD-1C-50型真空冷冻干燥机:北京博医康实验仪器有限公司。
1.3 方法
1.3.1 试验设计
在葡萄果实转色初期(5%果粒着色)和转色末期(100%果粒着色)分别摘除结果枝基部的2片、4片和6片叶,以不摘除叶处理为对照(CK),共7个处理,具体如表1。每个处理共45株,随机分布,3次重复。每隔10 d采样一次,各处理随机选取40穗果,进行相关理化指标的测定,采收期取样测定非花色苷单体酚类物质。
表1 摘叶处理试验设计
Table 1 Leaf removal treatment test design

注:“√”表示摘叶处理。
处理编号 转色初期摘叶程度2片 4片6片转色末期摘叶程度2片 4片 6片VB2 VB4 VB6 VC2 VC4 VC6 CK√√√√√√不摘叶
1.3.2 果实酚类物质测定
果皮总花色苷、总酚和单宁含量的测定均参照孟江飞[15]的方法,总花色苷含量(以二甲花翠素计)测定采用pH示差法;总酚含量(以没食子酸计)测定采用福林-肖卡法;单宁含量(以儿茶素计)测定采用甲基纤维素法。非花色苷单体酚类物质采用高效液相色谱-电喷雾-质谱(high performance liquid chromatogram-electrospray ionization-mass spectrum,HPLC-ESI-MS)分析,具体参照HE J J等[16]的方法。
1.3.3 数据处理
数据处理采用Office Excel 2010和SPSS 20.0软件,绘图采用Origin Pro 2016和Office Excel 2010软件。显著性分析采用Duncan's进行方差检验,P<0.05表示差异达到显著水平。
2 结果与分析
2.1 摘叶处理对葡萄成熟度进程的影响

图1 不同摘叶处理对赤霞珠(A)及品丽珠(B)葡萄果实成熟度的影响
Fig.1 Effects of different leaf removal treatments on maturity of Cabernet Sauvignon(A)and Cabernet Franc(B)grape fruit
由图1可知,赤霞珠在转色后0~10 d,摘叶处理还原糖含量变化趋势基本相似,到转色后40 d增长趋势放缓,而后VC4处理还原糖含量呈下降趋势,其余摘叶处理呈持续增长趋势,转色后50 d,VC6处理的还原糖含量最高,为210.0 g/L,VB6和VB4次之,分别为206.29 g/L和198.74 g/L,VC4和CK处理的最低,约为187.0 g/L。而成熟过程中摘叶处理的可滴定酸含量变化趋势基本相似,转色后0~30 d均先急速下降,转色后30~40 d,除VB2、VB4、VB6略有降低外,其余处理均呈上升趋势,转色后40~50 d,所有处理均趋于平稳,其中CK的可滴定酸含量最高,为6.09 g/L,显著高于摘叶处理(P<0.05),且摘叶处理间的可滴定酸含量无显著差异(P>0.05)。品丽珠果实成熟过程中还原糖含量先升高后趋于稳定,转色后20~30 d,部分摘叶处理还原糖含量上升缓慢,转色后40~50 d,VC6处理含量最高,为228.26 g/L,VC2处理次之,为216.51g/L,而其余处理还原糖含量均显著低于对照(P<0.05)。品丽珠各处理的果实可滴定酸含量随着还原糖含量的升高迅速降低,后趋于稳定,在转色后50 d,VC6处理的可滴定酸含量最低,为3.08 g/L。
2.2 摘叶处理对葡萄成熟过程中果皮总花色苷含量的影响
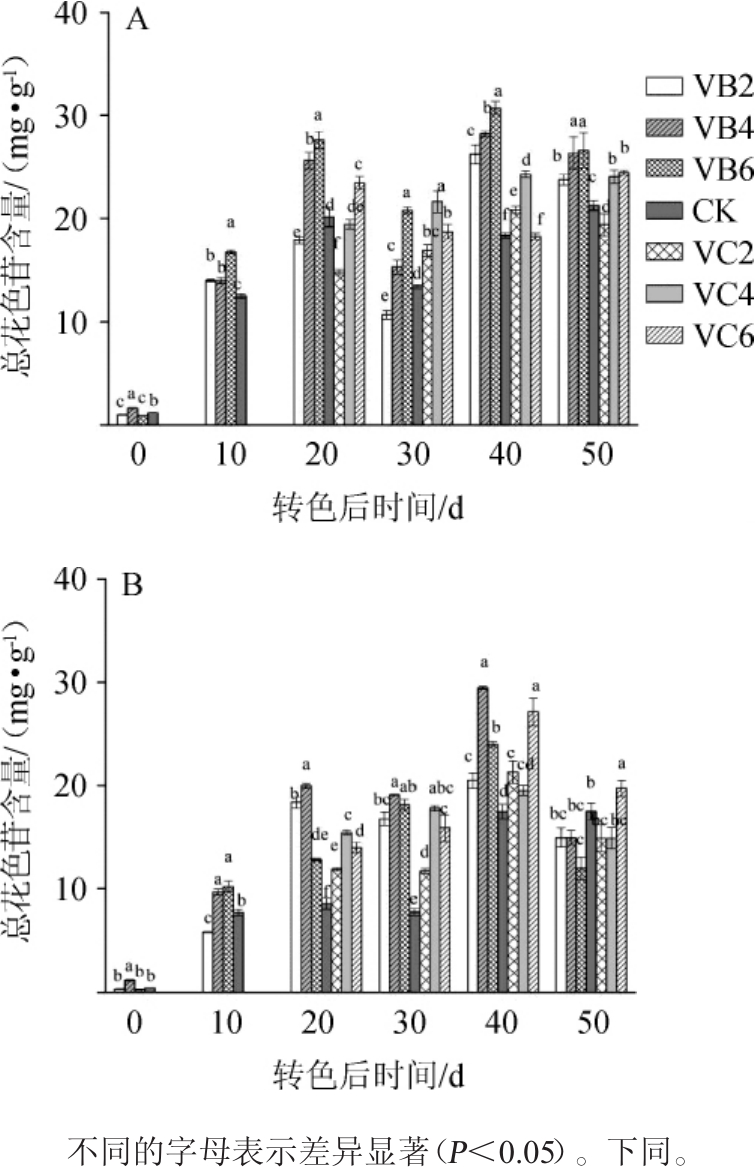
图2 不同摘叶处理对赤霞珠(A)及品丽珠(B)葡萄果实总花色苷含量的影响
Fig.2 Effects of different leaf removal treatments on total anthocyanins contents of Cabernet Sauvignon(A)and Cabernet Franc(B)grape fruit
由图2可知,赤霞珠在果实成熟过程中果皮总花色苷含量波动较大,整体先上升后下降并趋于稳定或略有降低,转色后40 d,总花色苷含量达到峰值。转色开始时VB4处理花色苷含量最高,且显著高于CK(P<0.05),转色后10~50 d VB6处理总花色苷含量均高于其他处理,且CK均最低,在采收时(转色后50 d)VB6处理总花色苷含量为26.64 mg/g,与VB4处理无显著差异(P>0.05),但显著高于VB2、VC2、VC4、VC6处理及CK(P<0.05),分别提高了12.12%、37.18%、10.72%、8.91%及25.19%。品丽珠在成熟过程中果实总花色苷含量整体呈先上升后下降的趋势,转色后0~40 d,VB4处理葡萄果皮总花色苷持续增长且显著高于其他处理(P<0.05),且在转色后40 d达到峰值,为29.44 mg/g,采收期(转色后50 d)各处理组总花色苷含量均略有降低,其中VC6处理总花色苷含量最高,为19.75 mg/g,CK次之,为17.51 mg/g。
2.3 摘叶处理对葡萄成熟过程中果皮总酚含量的影响
由图3可知,赤霞珠在转色开始时总酚含量出现最高峰,而后呈缓慢下降的趋势,采收期(转色后50 d)VB2、VB4和VB6处理总酚含量分别为43.34 mg/g、43.58 mg/g和43.52 mg/g,三个处理间无显著差异(P>0.05),但均显著高于VC2、VC4、VC6处理和CK(P<0.05)。与赤霞珠不同的是,品丽珠葡萄果实在成熟过程中的总酚含量呈逐渐上升后略微下降的趋势,在转色后50 d,除VC2处理外,其余摘叶处理的总酚含量均高于CK,其中,VC6处理的总酚含量最高,为29.02 mg/g。
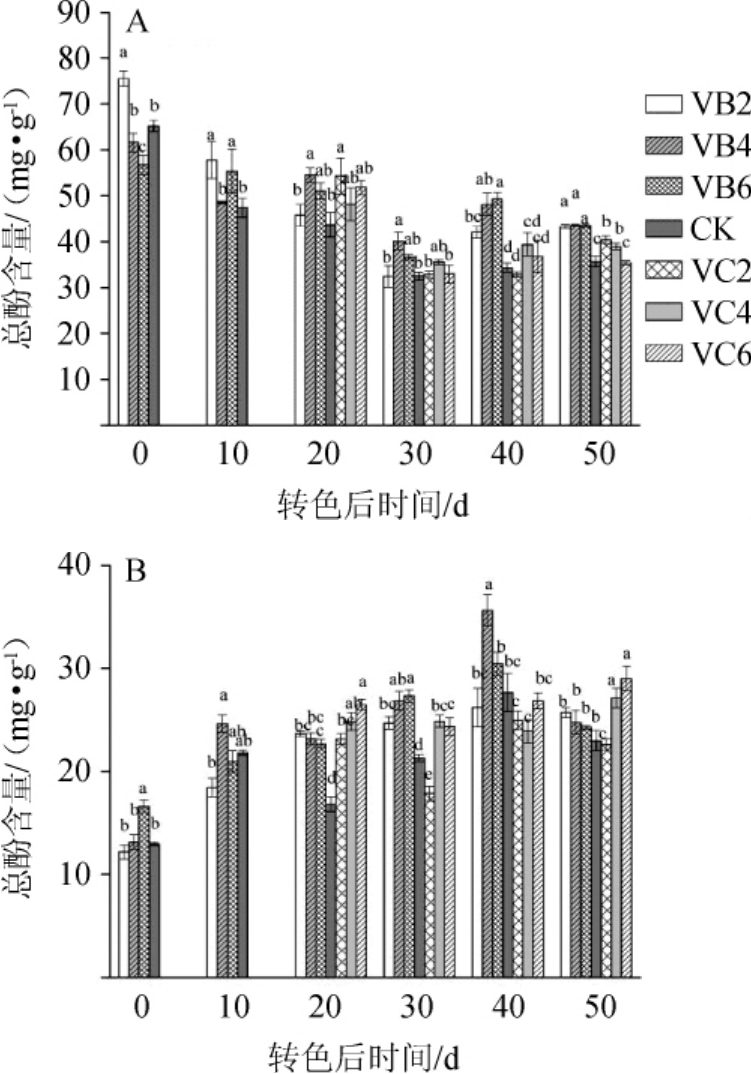
图3 不同摘叶处理对赤霞珠(A)及品丽珠(B)葡萄果实总酚含量的影响
Fig.3 Effects of different leaf removal treatments on totalphenolcontents of Cabernet Sauvignon(A)and Cabernet Franc(B)grape fruit
2.4 摘叶处理对葡萄成熟过程中果皮单宁含量的影响
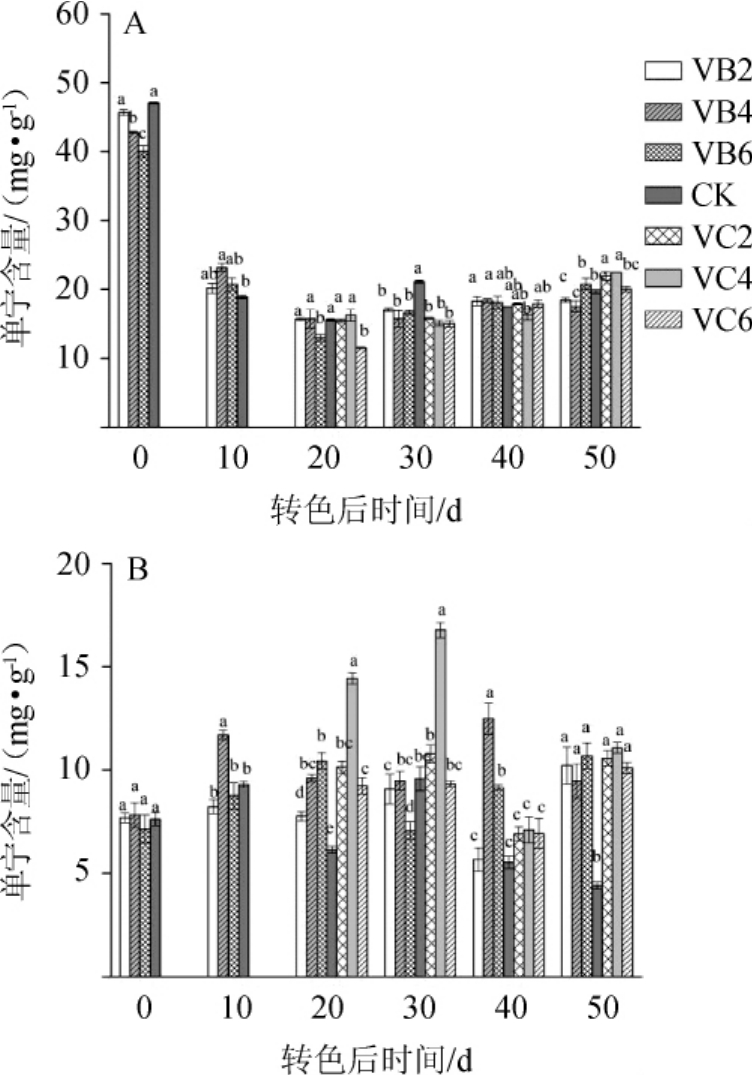
图4 不同摘叶处理对赤霞珠(A)及品丽珠(B)葡萄果实单宁含量的影响
Fig.4 Effects of different leaf removal treatments on tannin contents of Cabernet Sauvignon(A)and Cabernet Franc(B)grape fruit
由图4可知,赤霞珠在成熟过程中单宁含量呈先下降后趋于平稳的趋势,在转色后50 d与对照相比,VB6、VC2和VC4处理的单宁含量显著提升(P<0.05),VB2和VB4处理显著降低(P<0.05),而VC6处理无显著差异(P>0.05)。与赤霞珠不同,品丽珠在成熟过程中单宁含量变化波动较复杂,在开始转色时处理组的单宁含量与CK无显著差异(P>0.05),在转色后30 d,单宁含量达到峰值,VC4处理的单宁含量显著高于其他处理和对照组(P<0.05),在转色后50 d,各摘叶处理组的单宁含量无显著差异(P>0.05),但均显著高于对照组(P<0.05)。
2.5 摘叶处理对葡萄成熟期果实非花色苷单体酚类物质的影响
2.5.1 摘叶处理对赤霞珠葡萄果实非花色苷单体酚类物质的影响
摘叶处理对赤霞珠葡萄非花色苷单体酚类物质含量和组分的影响见表2。
表2 不同摘叶处理对赤霞珠葡萄果皮非花色苷单体酚类物质种类和含量的影响
Table 2 Effects of different leaf removal treatments on non-anthocyanins monomer phenolic compounds type and contents of Cabernet Sauvignon grape skin μg/g

注:“--”表示未检出。下同。
非花色苷酚类物质 VB2 VB4 VB6 VC2 VC4 VC6 CK黄烷醇类Flavan-3-ols原花色素B1棓儿茶素表棓儿茶素儿茶素原花色素B2种类小计比例/%羟基苯甲酸类表没食子儿茶素没食子酸酯种类小计比例/%黄酮醇类杨梅酮-半乳糖苷杨梅酮-葡萄糖苷槲皮素-3-O-葡萄糖醛酸酐槲皮素-3-O-半乳糖苷槲皮素-3-O-葡萄糖苷二氢山萘酚丁香亭-葡萄糖苷鼠李糖素-3-O-葡萄糖苷槲皮素-3-O-鼠李糖苷山萘酚-3-O-半乳糖苷山萘酚-3-O-葡萄糖苷杨梅酮丁香亭异鼠李亭槲皮素种类小计比例/%种类总数总量19.43±0.17c 1.20±0.05d 0.59±0.00ab 1.55±0.01cd 0.08±0.01ab 5 22.84 4.32 24.70±0.16b 2.75±0.02a 0.60±0.00a 2.03±0.15bc 0.10±0.01a 5 30.18 4.30 16.70±0.00d 1.98±0.03b 0.61±0.00ab 1.05±0.06de 0.08±0.01ab 5 20.41 3.14 14.90±0.03e 1.68±0.05c 0.59±0.00a 0.83±0.07e 0.05±0.01b 5 18.04 4.16 12.33±0.05f 0.98±0.02d 0.59±0.00ab 1.28±0.01de 0.10±0.01a 5 15.26 2.46 16.18±0.41de 1.20±0.04d 0.66±0.01b 4.65±0.10a--4 22.69 3.68 34.78±0.05a 2.15±0.03b 0.61±0.00ab 2.50±0.00b 0.08±0.00ab 5 40.11 10.46 1.35±0.00b 1 1.35 0.26 1.38±0.00a 1 1.38 0.20 1.35±0.00b 1 1.35 0.21 1.35±0.00b 1 1.35 0.31 1.35±0.00b 1 1.35 0.22--0 0 1.38±0.01ab 1 1.38 0 11.25±0.02e 56.95±0.05e 27.38±0.01d 57.30±0.01e 161.68±3.30c 0.30±0.01a 42.20±0.19b 93.05±0.07e 4.45±0.00c 9.10±0.02d 33.98±0.01e 1.00±0.02d 2.43±0.00a 2.45±0.03a 0.68±0.04a 15 504.18 95.42 21 528.36 17.63±0.07a 88.20±0.07a 39.75±0.02a 75.40±0.04 215.40±3.09a 0.23±0.01b 42.73±0.38b 115.98±0.32c 6.10±0.01a 13.65±0.03a 47.90±0.06b 1.93±0.01a 1.98±0.00c 2.45±0.00a 1.10±0.14a 15 670.40 95.51 21 701.95 16.18±0.05b 83.08±0.02b 31.35±0.04b 70.38±0.02b 200.60±0.19ab 0.20±0.01bc 42.80±0.06b 109.05±0.02d 5.43±0.04b 13.93±0.02a 49.50±0.17a 1.63±0.05b 1.80±0.01e 1.90±0.01c 0.33±0.03a 15 628.13 96.65 21 649.89 8.25±0.02f 44.93±0.08g 28.38±0.07c 45.43±0.06f 142.13±0.23d 0.18±0.00bc 27.88±0.05d 71.38±0.06f 2.78±0.02d 9.13±0.00d 30.28±0.05f 0.93±0.00d 1.23±0.00f 1.43±0.04d--14 414.28 95.53 20 433.66 14.30±0.02c 71.70±0.04c 28.53±0.06c 64.95±0.17c 196.95±0.24b 0.15±0.01c 47.00±0.15a 120.00±0.13a 0.90±0.00f 11.00±0.09c 41.98±0.08d 1.08±0.01d 2.10±0.01b 2.30±0.03ab--14 602.93 97.32 20 619.54 13.30±0.02d 68.80±0.03d 26.05±0.03e 63.60±0.09d 199.20±0.99ab 0.15±0.01bc 42.80±0.24b 117.83±0.09b 0.28±0.02g 11.83±0.06b 43.53±0.02c 1.45±0.02c 1.90±0.01d 2.23±0.02b--14 592.93 96.32 18 615.61 7.23±0.04g 45.90±0.04f 23.05±0.01f 33.45±0.01g 117.05±0.49e 0.30±0.01a 31.38±0.07c 56.15±0.01g 1.98±0.02e 3.83±0.02e 17.20±0.08g 1.00±0.02d 1.98±0.01c 1.58±0.02d--14 342.05 89.18 20 383.54
由表2可知,赤霞珠不同摘叶处理的葡萄共检测到21种非花色苷单体酚类物质,其中黄烷醇类5种,羟基苯甲酸类1种,黄酮醇类15种,VB2、VB4和VB6处理有21种非花色苷单体酚类物质,VC2、VC4处理和CK有20种,VC6处理仅有18种,说明转色初期摘叶处理能增加赤霞珠葡萄非花色苷单体酚类物质组分。黄烷醇类占非花色苷酚类物质总量的比例仅有10%左右,其中原花色素B1所占比重最大,所有摘叶处理的原花色素B1均显著低于CK(P<0.05),说明摘叶处理影响原花色素B1的合成;羟基苯甲酸类物质含量占非花色苷酚类物质总量的比例更低,仅为0.2%左右,而黄酮醇类占总量的89%以上,以槲皮素-3-O-葡萄糖苷和鼠李糖素-3-O-葡萄糖发挥着主要作用,7种处理表现出显著差异(P<0.05),VB4处理的槲皮素-3-O-葡萄糖苷含量最高,达215.40μg/g,较VB2、VB6、VC2、VC4、VC6和CK分别提高了33.23%、7.38%、51.55%、9.37%、8.13%和84.02%,鼠李糖素-3-O-葡萄糖苷在VC4处理上表现最好,含量为120.00μg/g,依次显著高于VC6(117.83 μg/g)、VB4(115.98 μg/g)、VB6(109.05 μg/g)、VB2(93.05 μg/g)、VC2(71.38 μg/g)处理和CK(56.15 μg/g)(P<0.05);摘叶处理对黄酮醇类总量提升较大,含量依次为VB4(670.40 μg/g)>VB6(628.13 μg/g)>VC4(602.93μg/g)>VC6(592.93μg/g)>VB2(504.18μg/g)>VC2(414.28 μg/g)>CK(342.05 μg/g)。
2.5.2 摘叶处理对品丽珠葡萄果实非花色苷单体酚类物质的影响
摘叶处理对品丽珠葡萄非花色苷单体酚类物质含量和组分的影响见表3。
表3 不同摘叶处理对品丽珠葡萄果皮非花色苷单体酚类物质种类和含量的影响
Table 3 Effects of different leaf removal treatments on non-anthocyanins monomer phenolic compounds type and contents of Cabernet Franc grape skin μg/g

非花色苷酚类物质 VB2 VB4 VB6 VC2 VC4 VC6 CK黄烷醇类原花色素B1棓儿茶素表棓儿茶素儿茶素原花色素B2原花色素C1种类小计比例/%羟基苯甲酸类表没食子儿茶素没食子酸酯香草酸种类小计比例/%黄酮醇类杨梅酮-半乳糖苷杨梅酮-葡萄糖苷槲皮素-3-O-葡萄糖醛酸酐槲皮素-3-O-半乳糖苷槲皮素-3-O-葡萄糖苷二氢山萘酚丁香亭-半乳糖苷丁香亭-葡萄糖苷鼠李糖素-3-O-葡萄糖苷槲皮素-3-O-鼠李糖苷山萘酚-3-O-半乳糖苷山萘酚-3-O-葡萄糖苷杨梅酮49.75±0.09a 1.33±0.04a 0.58±0.01a 1.55±0.05a 0.10±0.01ab 1.75±0.28b 6 55.05 8.20 1.35±0.00a 10.53±0.11a 2 11.88 1.77 5.05±0.03e 25.20±0.02d 31.43±0.08f 90.60±0.09e 224.93±0.93d 0.05±0.01ab 0.40±0.02b 19.40±0.09d 138.40±0.21e--14.93±0.01d 49.23±0.03e 0.65±0.01b 33.00±0.57de 0.90±0.04b 0.55±0.00a 1.33±0.01abc 0.10±0.01ab 1.90±0.02b 6 37.78 4.96 1.35±0.10a 12.43±0.00a 2 13.78 1.81 6.18±0.03c 27.20±0.04c 36.75±0.02d 107.30±0.11d 250.70±1.45c 0.03±0.01b 0.43±0.01b 24.13±0.05b 169.98±0.03d--19.90±0.05c 63.33±0.04d 0.58±0.01b 37.73±0.26c 0.60±0.01cd 0.55±0.00a 1.15±0.01bc 0.10±0.01ab 1.13±0.17b 6 41.25 4.32 1.35±0.01a 11.05±0.11a 2 12.40 1.30 5.70±0.02d 23.65±0.04e 33.90±0.02e 158.83±0.23a 304.65±0.38a 0.10±0.01a 0.45±0.00b 21.85±0.19c 214.50±0.09b 2.35 15.63±0.22d 114.10±0.15a 0.48±0.00c 33.80±0.19d 0.68±0.00c 0.55±0.00a 1.10±0.04c 0.08±0.01b 2.75±0.20ab 6 38.95 5.97 1.35±0.00a 11.60±0.33a 2 12.95 1.99 5.93±0.05cd 25.20±0.06d 45.15±0.08a 90.23±0.16f 219.10±0.31d 0.05±0.01ab 0.45±0.001b 19.55±0.10d 135.05±0.21f--12.60±0.04e 41.85±0.07f 0.75±0.01a 24.85±0.15f 1.03±0.01b 0.55±0.00a 0.65±0.02d 0.10±0.01ab--5 27.18 3.41 1.35±0.00a 10.25±0.66a 2 11.60 1.46 7.78±0.04b 31.28±0.09b 38.18±0.22c 115.80±0.52c 256.08±0.06c 0.05±0.01ab 0.53±0.05ab 21.20±0.4cd 177.23±0.63c--26.73±0.12a 77.88±0.27c 0.60±0.00b 43.33±0.31b 1.25±0.01a 0.58±0.01a 1.40±0.02ab 0.15±0.01a 4.88±0.56a 6 51.58 5.32 1.35±0.00a 11.60±0.33a 2 12.95 1.34 16.68±0.12a 65.60±0.17a 41.53±0.07b 131.25±0.32b 281.63±0.76b 0.10±0.01a 0.65±0.00a 32.23±0.00a 219.18±0.15a--25.43±0.12b 82.83±0.13b 0.78±0.00a 30.70±0.12e 0.48±0.01d 0.55±0.00a 1.45±0.05a 0.08±0.00b 1.43±0.01b 6 34.68 8.62 1.35±0.01a 11.60±0.33a 2 12.95 3.22 3.13±0.02f 17.33±0.15f 16.88±0.09g 47.2±0.16g 130.45±0.25e--0.40±0.01b 20.45±0.21d 89.25±0.39g--5.25±0.01f 20.70±0.09g 0.73±0.02a
续表
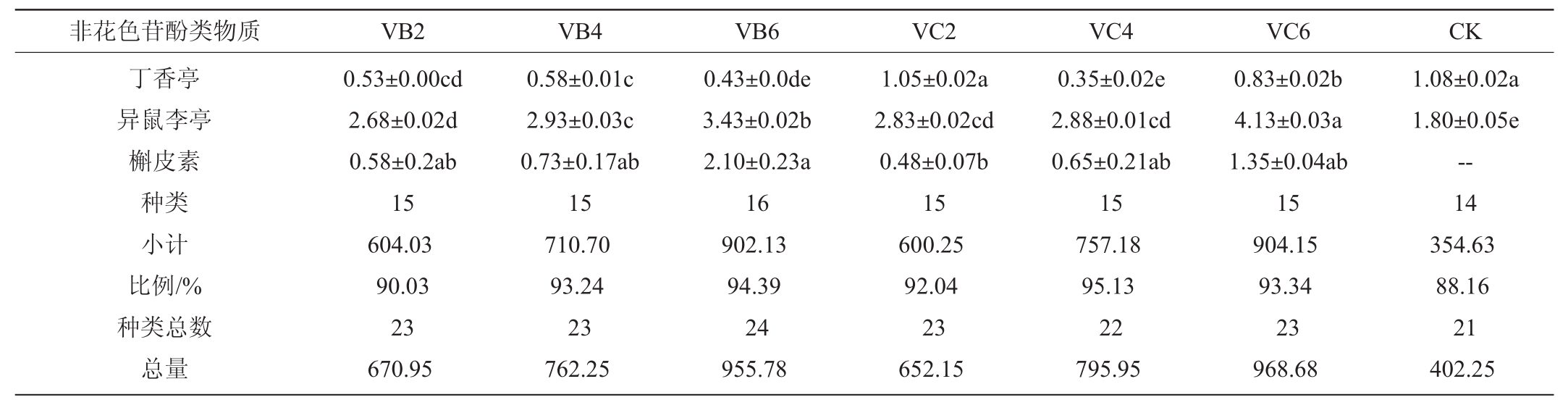
非花色苷酚类物质 VB2 VB4 VB6 VC2 VC4 VC6 CK丁香亭异鼠李亭槲皮素种类小计比例/%种类总数总量0.53±0.00cd 2.68±0.02d 0.58±0.2ab 15 604.03 90.03 23 670.95 0.58±0.01c 2.93±0.03c 0.73±0.17ab 15 710.70 93.24 23 762.25 0.43±0.0de 3.43±0.02b 2.10±0.23a 16 902.13 94.39 24 955.78 1.05±0.02a 2.83±0.02cd 0.48±0.07b 15 600.25 92.04 23 652.15 0.35±0.02e 2.88±0.01cd 0.65±0.21ab 15 757.18 95.13 22 795.95 0.83±0.02b 4.13±0.03a 1.35±0.04ab 15 904.15 93.34 23 968.68 1.08±0.02a 1.80±0.05e--14 354.63 88.16 21 402.25
由表3可知,品丽珠不同摘叶处理的葡萄果实检测出的非花色苷单体酚类物质组分不同,VB6处理共检测出24种,包括6种黄烷醇类物质,2种羟基苯甲酸类物质,16种黄酮醇类物质,VB2、VB4、VC2和VC6处理均检测出23种,与VB6处理相比少了槲皮素-3-O-鼠李糖苷,VC4处理仅检测出22种,比VB6处理少检测出槲皮素-3-O-鼠李糖苷和原花色素C1两种物质。7种处理中,除VC4处理外,其他摘叶处理均能显著提高黄烷醇类物质含量,表现为VB2(55.05 μg/g)>VC6(51.58 μg/g)>VB6(41.25 μg/g)>VC2(38.95 μg/g)>VB4(37.78 μg/g)>CK(34.68 μg/g)>VC4(27.18 μg/g)(P<0.05);各摘叶处理葡萄果实羟基苯甲酸类物质无显著差异(P>0.05);7种摘叶处理中,黄酮醇类物质差异显著(P<0.05),相比于对照,均显著提升(P<0.05),分别提升了70.33%(VB2)、100.41%(VB4)、154.29%(VB6)、689.26%(VC2)、113.51%(VC4)以及154.96%(VC6),其中VC6处理表现最好,能够显著提高黄酮醇类物质含量(P<0.05),因此,建议在转色末期摘除6片叶。
3 讨论
通过摘除果穗周围的挡光叶片增加果实层的通透性,使光照充足,气体流通,在一定程度上改善了果实微环境,从而提高葡萄果实品质。摘叶程度的变化主要通过改变光照和温度来间接影响植株生长,光照强度改变对蛋白质、酶、核酸、细胞的形态、结构和功能均能产生影响[17],可以使酿酒葡萄产生更多的能够吸收紫外线的次生代谢物质,这些代谢物质包括黄酮类化合物(花色素、黄烷-3-醇、黄酮醇类、各种酚酸及芪类化合物等)、氨基酸和类胡萝卜素等,其含量的增加使酿酒葡萄及葡萄酒的酚类物质构成增加,也使葡萄酒香气更加丰富,在很大程度上提高了葡萄酒的质量[18]。
花色苷是葡萄酒的呈色物质,也是葡萄酒中的重要保健成分,其含量和组成决定了葡萄酒的色泽[19],本研究中,摘叶处理对果实总酚和总花色苷含量均有较大提升,其中转色初期摘6片叶处理对赤霞珠提升效果最佳,而对品丽珠而言,转色末期摘6片叶处理提升效果最佳,造成这一差异的原因可能是品种不同,这与前人研究结果[11,20-21]相一致。单宁不仅赋予葡萄酒涩味以及收敛性,而且是保障葡萄酒陈年潜力的重要多酚类物质,因此,单宁含量的多少对一款葡萄酒至关重要,一些研究发现摘叶能显著提高葡萄单宁含量[13,22],但另有研究认为摘叶对果实单宁并无提升作用[23],本研究结果表明,部分摘叶处理对赤霞珠葡萄单宁含量无提升作用,而所有摘叶处理对品丽珠葡萄单宁含量均有提升作用,所以对于单宁含量与摘叶的关系还有待于进一步研究。
非花色苷单体酚类物质包括黄烷醇类、羟基苯甲酸类及黄酮醇类化合物等,其中黄烷醇类具有苦味和涩感,对葡萄酒结构和层次感有较大影响,同时还具有降低胆固醇、活血、降血压等功效,黄酮醇类对酒的涩感也有一定影响,同时具有保护皮肤免受紫外线伤害和消除人体自由基的功能,是葡萄酒的重要保健成分[24]。本研究结果表明,在转色初期摘除结果枝4片叶及摘6片叶有利于赤霞珠葡萄果皮非花色苷单体酚类物质的积累,而在转色完成期摘除4片叶和6片叶更有利于品丽珠葡萄果皮非花色苷单体酚类物质的合成,这可能与品种差异有关,在叶片摘除后的葡萄藤对光抑制的耐受性增加,所结出的葡萄果实糖积累加速,所酿出的葡萄酒酚类物质和花青素浓度含量更高且更稳定[25],MARÍA P D等[26-27]也得到类似的结论,即摘叶有利于黄酮醇等酚类物质的积累。
4 结论
综合考虑,转色初期摘除结果枝基部4片叶对于赤霞珠葡萄效果最好,能显著提高采收期成熟度、总花色苷(增加了23.92%)、总酚(增加了22.00%)以及非单体花色苷物质含量(增加了83.02%)(P<0.05)。而转色末期摘除结果枝基部6片叶对品丽珠葡萄效果最好,能显著提升采收期成熟度、总花色苷(增加了12.79%)、总酚(增加了26.17%)和单宁(增加了128.80%)含量以及非花色苷单体酚类物质含量(增加了140.82%)(P<0.05)。
[1]华玉波.整形方式对赤霞珠病害和果实品质的影响[D].杨凌:西北农林科技大学,2010.
[2]FANG F,LIJ M,ZHANG P,et al.Effects of grape variety,harvest date,fermentation vessel and wine ageing on flavonoid concentration in red wines[J].Food Res Int,2008,41(1):53-60.
[3]温鹏飞,郑宏佳,牛铁泉,等.延迟采收对葡萄果实多酚类物质含量的影响[J].山西农业大学学报(自然科学版),2011,31(5):446-450.
[4]刘金串,孟江飞,郭志君,等.膨大处理对红地球葡萄酚类物质及抗氧化活性的影响[J].食品科学,2012,33(5):7-12.
[5]YAMAMOTO L Y,ASSIS A M D,ROBERTO S R,et al.Application of abscisic acid(S-ABA)to cv.Isabel grapes(Vitis vinifera×Vitis labrusca)for color improvement:effects on color,phenolic composition and antioxidant capacity of their grape juice[J].Food Res Int,2015,77:572-583.
[6]雷玉娟,管雪强.果穗曝光对酿酒葡萄果实品质影响的研究进展[J].中国农学通报,2018,34(20):79-84.
[7]杨哲,成果,高媛,等.疏穗处理对‘赤霞珠’葡萄果粒大小及花色苷积累的影响[J].西北农业学报,2015,24(2):111-121.
[8]赵亚蒙,尹春晓,梁攀,等.负载量及套袋对酒用刺葡萄果实酚类物质和香气的影响[J].中国酿造,2018,37(6):114-118.
[9]赵婷,王珍,侍朋宝,等.机械修剪方式下不同叶幕厚度对晋中地区赤霞珠葡萄酒香气的影响[J].食品科学,2018,39(20):190-196.
[10]惠竹梅,李华,张振文,等.行间生草对葡萄园微气候和葡萄酒品质的影响[J].西北农林科技大学学报(自然科学版),2004,32(10):33-37.
[11]张国涛,毛如志,陈绍林,等.香格里拉高海拔地区不同时间摘叶处理对“赤霞珠”葡萄果实品质的影响[J].北方园艺,2015(12):15-19.
[12]王安妮,肖慧琳,张超杰,等.不同时期摘叶对马瑟兰花色苷的影响[J].中国酿造,2018,37(8):97-100.
[13]于咏,孟江飞,惠竹梅,等.反光膜和摘叶处理对“红地球”葡萄光合特性及果实品质的影响[J].北方园艺,2017(11):33-40.
[14]刘迪迪,王珍,谢沙,等.‘西拉’葡萄转色期疏除果穗对果实酚类物质的影响[J].西北农林科技大学学报(自然科学版),2018,46(7):124-131.
[15]孟江飞.外源褪黑素调控葡萄抗旱的机制及其对葡萄与葡萄酒品质的影响[D].杨凌:西北农林科技大学,2015.
[16]HE J J,LIU Y X,PAN Q H,et al.Different anthocyanin profiles of the skin and the pulp of Yan 73(Muscat Hamburg×Alicante Bouschet)grape berries[J].Molecules,2010,15(3):1141-1153.
[17]周瑞莲,王刚.水分胁迫下豌豆保护酶活力变化及脯氨酸积累在其抗旱中的作用[J].草业学报,1997(4):39-43.
[18]杨晓帆,高媛,韩梅梅,等.云南高原区酿酒葡萄果实香气物质的积累规律[J].中国农业科学,2014,47(12):2405-2416.
[19]GARCIA-ALONSO M,MINIHANE A M,RIMBACH G,et al.Red wine anthocyanins are rapidly absorbed in humans and affect mono-cyte chemoattractant protein levels and antioxidant capacity of plasma[J].J Nutr Biochem,2009,20(7):521-529.
[20]BRAVETTIB,LANARIV,MANNIE,et al.Canopy density modification and crop control strategies on'Montepulciano'(Vitis vinifera L.)[J].Acta Hortic,2012,931(931):331-338.
[21]PONIS,BERNIZZONIF,CIVARDIS,et al.Effects of pre-bloom leaf removal on growth of berry tissues and mustcomposition in two red Vitis vinifera L.cultivars[J].Aust J Grape Wine Res,2010,15(2):185-193.
[22]TESSARIN P,BOLIANIA C,BOTELHO R V,et al.Effects of late defoliations on chemical and sensory characteristics of cv.Uva Longanesi wines[J].J Soil Sci Plan Nutr,2015,14(4):1021-1038.
[23]高嵩,何莉莉,陈俊琴,等.不同光强对辣椒果实中辣椒素及其竞争物质的影响[J].河南农业科学,2008,26(4):83-86.
[24]KENNEDY J A,SAUCIER C,GLORIES Y.Grape and wine phenolics:history and perspective[J].Am J Enol Viticult,2006,57(3):239-248.
[25]ALBERTO P,MATTEO G,and STEFANO P.Early leaf removal to improve vineyard efficiency:gas exchange,source-to-sink balance,and reserve storage responses[J].Am J Enol Viticult,2011,62(2):219-228.
[26]MARIA P D,BELEN A,ZENAIDA G,et al.Impact of prebloom and fruit set basal leaf removal on the flavonol and anthocyanin composition of tempranillo grapes[J].Am J Enol Vitic,2012,63(3):367-376.
[27]RUNZE Y,MICHAEL G.C,RALPH S.Y,et al.Effects of leaf removal and applied water on flavonoid accumulation in grapevine(Vitis vinifera L.cv.Merlot)berry in a hot climate[J].J Agr Food Chem,2016,64(43):8118-8127.