葡萄酒是以新鲜葡萄或葡萄汁为原料,经过部分或全部发酵而成的一类酒饮料,可分为红葡萄酒和白葡萄酒、桃红葡萄酒3种[1-2]。其酿造过程的本质是从葡萄收集、葡萄破碎成汁、葡萄酒一次、两次发酵直到包装、储藏整个酿造过程中多种微生物的代谢过程[3]。葡萄酒的酿造离不开微生物(酵母菌、霉菌等)[4],其中,酵母菌是葡萄酒酿造过程中的主要微生物[5],其在发酵过程中对葡萄酒的品质有重要的影响,且对葡萄酒的特色和风格具有突出贡献[6]。
我国的葡萄酒产业发展迅速,但是关于葡萄酒酵母的研究与国内葡萄酒产业规模之间的差距较大。目前,国内大部分葡萄酒厂所用的酵母菌都是从国外引进的商业酵母,此种酵母的大量使用,使得国内本土酵母在酿造过程中失去主导地位,从而导致所生产出的葡萄酒风格单一,体现不出产区特色[7-8]。因此,虽然有商业葡萄酒酵母可供使用,但产区酵母已经适应了当地的微生物环境,易于在葡萄酒发酵中占主导地位,形成产区的典型特色,大部分葡萄酒生产商更倾向于选育葡萄产区酵母来生产具有产区特色的葡萄酒[9-10]。
传统的酵母菌分类主要是参照《酵母菌的特征和鉴定手册》[11]和《微生物分类学》[12],该分类方法不仅工作量大、周期长、操作复杂且鉴定结果的重复性差[13]。而现代分子生物学鉴定法主要以核酸作为研究对象,研究的是基因型,能反映其遗传本质[14-16],不仅鉴定结果更准确,而且缩短了鉴定时间[17]。
安阳、长垣、漯河分别位于河南的北部、中部以及南部,关于这3个地区的赤霞珠葡萄表皮酵母菌尚未有所研究。因此,本研究以安阳、长垣、漯河3个地区葡萄种植园的成熟赤霞珠葡萄表皮为原料,对表皮酵母菌进行富集分离、鉴定及多样性研究[18]。通过比较这3个地区赤霞珠葡萄表皮酵母菌的多样性,可以有效地揭示不同地理位置对表皮酵母菌分布的影响,从而为不同地区选育合适酿酒酵母提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
赤霞珠葡萄原料:于2017年9月21~29日采自安阳、长垣及漯河的葡萄种植园,分别标记为AY、CY、LH。采样方法:每个地点选择3个葡萄园,标记为1、2、3,每个葡萄园随机采集3串健康的葡萄,并在采集当天置于冷冻盒中运回实验室,备用。
1.1.2 主要培养基及试剂
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基、YEPD琼脂培养基和WL营养琼脂培养基、Ezup柱式基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、26S rDNA D1/D2区扩增引物NL-1和NL-4、5.8S ITS区扩增引物ITS-1和ITS-4:生物工程(上海)股份有限公司。
1.2 仪器与设备
SW-CJ-2D超净工作台:苏州净化安泰公司;DH-600生化培养箱:北京中兴伟业仪器有限公司;TGL-16G台式离心机:上海安亭科学仪器厂;C1000聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国BIO-RAD公司;JY02S紫外分析仪:北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 赤霞珠葡萄表皮酵母菌的富集、分离及纯化
参见贾春凤等[19]的方法对赤霞珠葡萄表皮的酵母菌进行富集、分离及纯化。具体方法如下:在无菌条件下,用无菌生理盐水洗涤赤霞珠葡萄表皮,并接种于YEPD培养基(含10μg/mg氯霉素)中,28℃、180 r/min条件下振荡培养48 h。随后,对富集液进行梯度稀释(10-1、10-2、10-3、10-4、10-5、10-6),选取稀释度为10-3、10-4、10-5的稀释液均匀涂布于YEPD琼脂培养基,28℃条件下培养至长出单菌落,随机从平板上挑取单菌落进行纯化和保藏。
1.3.2 分离酵母菌的形态观察
挑取保藏在斜面上的酵母菌以三次划线的方式接种至WL营养琼脂培养基,于28℃条件下培养5 d,对所有酵母菌的单菌落形态进行观察。根据WL培养基上的表型差异,对分离菌株进行初步分类并从每个类型中随机挑选代表菌。然后,采用40倍光学显微镜对代表菌株进行显微观察。
1.3.3 代表酵母菌的分子生物学鉴定
参照DNA提取按照试剂盒说明书提取代表菌株的DNA,以其为模板,使用正向引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和反向引物NL4(5′-GGTCCCGTGTTTCAAGACGG-3′)PCR扩增26S rDNA Dl/D2区基因序列。同理,使用正向引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和反向引物ITS4(5′-TCCTCCGCTATTGATATGC-3′)PCR扩增5.8S ITS区基因序列。PCR扩增体系及程序参照刘爱国[20]的方法。采用1%琼脂糖凝胶电泳检测PCR扩增产物,电泳参数为100 V、30 min。
PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genbank数据库中进行BLAST同源性搜索,选取同源性较高的菌株的26S rDNA Dl/D2和5.8S ITS区基因序列,采用MEGA 6软件中的邻接(neighbor-joining,NJ)法构建系统发育树[20]。
1.3.4 酵母菌不同种群数量分布
通过形态观察和分子生物学鉴定确定了各个代表菌株所属种群,采用Excel软件统计不同地区的不同酵母菌种群分布情况。
2 结果与分析
2.1 赤霞珠葡萄表皮酵母菌的分离及纯化
通过YEPD培养基的富集及YEPD琼脂培养基的分离和纯化,分别从安阳、长垣、漯河葡萄种植园的赤霞珠葡萄表皮分离纯化到70、66和57株酵母菌,即共分离得到193株酵母菌株。
2.2 酵母菌的形态学及初步聚类分析
根据193株酵母菌在WL营养琼脂培养基上的表型特征,可分为10种不同表型(I~X),然后,对每个表型代表菌株的细胞形态进行观察,结果如图1及表1所示。由图1可知,共得到4种显微形态:柠檬形两端出芽(表型Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅸ、Ⅹ)、柠檬形单端出芽(表型Ⅲ)、椭圆形单端出芽(表型Ⅳ和Ⅶ)、梭形单端出芽(表型Ⅷ)。
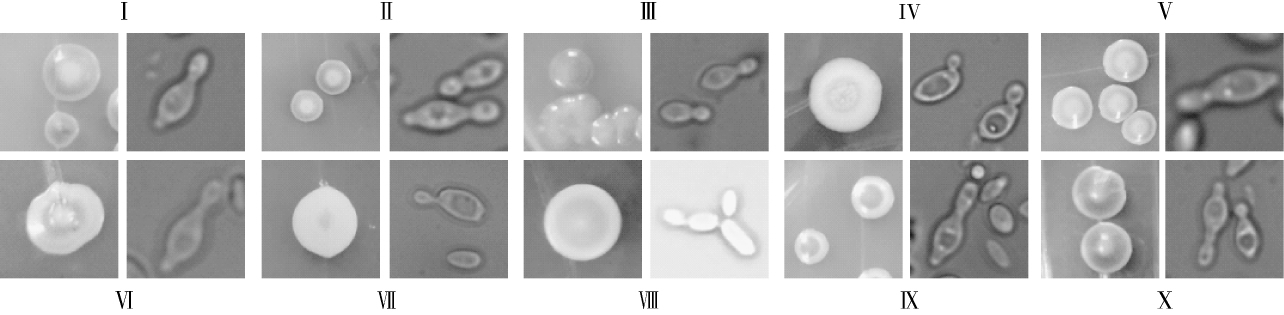
图1 各类型代表菌株在WL营养琼脂培养基上的菌落形态(左)和细胞形态(右)
Fig.1 Colonial morphology(left)and cell morphology(right)of different types of representative strains on WL nutrient agar medium
表1 各类型代表酵母菌基于WL营养琼脂培养基的表型聚类分析结果
Table 1 Phenotypes clustering analysis results of different types of representative yeasts on WL nutrient agar medium

表型 菌落颜色 菌落形态 细胞形态 菌株编号Ⅰ Ⅱ Ⅲ Ⅳ ⅤⅥⅦⅧⅨⅩ黄色边,草绿色顶黄色边,绿色顶黄色边,深绿色顶白色边,浅绿色顶白色边,蓝色顶白色边,绿色顶白色边,草绿色顶白色边,蓝色顶白色边,青绿色顶白色边,碧绿顶中部突起,表面光滑,有光泽,干燥中部突起,表面光滑,有光泽,干燥中部突起,表面光滑,有光泽,干燥表面光滑,无光泽,干燥中部突起,表面光滑,有光泽,干燥中部突起,表面光滑,有光泽,干燥表面光滑,无光泽,干燥表面光滑,有光泽,干燥中部突起,表面光滑,有光泽,干燥中部突起,表面光滑,有光泽,干燥柠檬形柠檬形柠檬形椭圆形柠檬形柠檬形椭圆形梭形柠檬形柠檬形单生单生单生单生单生单生单生单生单生单生两端芽殖两端芽殖单端芽殖单端芽殖两端芽殖两端芽殖单端芽殖单端芽殖两端芽殖两端芽殖AY2-1~20,23,24;LH1-1,4,7,12,16,17;LH2-3,4,7,8,10,14,15,19 AY1-1,7~12,18~22;AY2~21,22,CY2-4,8,11,12,16,17,18,21,22;CY3-1,2,3,5,6,9,10,14,15,19,20;LH3-2,4,12 AY1-2,5,6,13,14,15,17;AY3-3~15,17~23;LH2-1,18,20;LH3-3,15,16,18,19,20 AY1-4,16,23;CY1-3,4,6,11,13,14,16~21;CY2-1,2,3,5,6,7,9,10,13,14,15,19,20,24;CY3-4,7,8,11,12,13,16,17,18 LH2-2,12;LH3-10,11,17 AY1-3;AY3-1,16 LH1-19;LH2-5,6,9,11,13,16,17;LH3-1,5,7,8,9,13,14 AY3-2;CY2-23 LH1-3,5,6,8,9,13,14,15,18,21,22 CY1-1,2,5,7,8,9,10,12,15,22
2.2 酵母菌的分子生物学鉴定
2.2.1 代表菌株26S rDNA D1/D2区序列分析
从10类菌株中挑选14株代表菌株AY1-3、AY1-16、AY1-22、AY3-2、AY3-11、CY1-7、CY2-23、CY3-8、LH1-5、LH1-7、LH2-9、LH3-4、LH3-17和LH3-19,对14株代表菌株的26S rDNA D1/D2区序列进行PCR扩增,PCR扩增产物碱基长度约为600 bp。将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果提交至NCBI的Genbank数据库中进行BLAST搜索,选取同源性高的序列,采用NJ法构建系统发育树,自展值设为1 000,结果见图2。

图2 基于26S rDNA D1/D2区序列代表菌株的系统发育树
Fig.2 Phylogenetic tree of representative strains based on 26S rDNA D1/D2 region sequences
由图2可知,代表菌株CY1-7和LH1-7分别属于类型Ⅹ和类型Ⅰ,但却都与葡萄有孢汉逊酵母(Hanseniaspora uvarum)聚为同一分支,两种类型的菌株均被鉴定为H.u varum;代表菌株LH1-5属于类型Ⅸ,与葡萄酒有孢汉生酵母(Hanseniaspora vineae)聚于同一分支,且序列相似性为100%,被鉴定为H.vineae;而代表菌株CY2-23和AY3-2同属于类型Ⅷ,且都与橡树假丝酵母(Candida quercitrusa)聚为同一分支,被鉴定为C.quercitrusa;代表菌株AY1-3属于类型Ⅵ,菌株AY1-16和CY3-8属于类型Ⅳ,但均与陆生伊萨酵母(Issatchenkia terricola)聚于同一分支,序列相似性为100%,被鉴定为I.terricola;代表菌株LH2-9属于类型Ⅶ,与Pichia terricola聚为同一分支,且序列相似性为100%,被鉴定为P.terricola。然而代表菌株AY1-22、AY3-11和LH3-4、17、19与Hanseniaspora guillemondii和仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)共聚为同一分支,因此,仅依靠26SrDNA D1/D2序列分析结果不能将这些菌株准确地鉴定到种水平,故对这些菌株进行5.8SITS序列测序分析。
2.2.2 代表菌株5.8S ITS序列分析
代表菌株AY1-22、AY3-11和LH3-4、17、19的5.8S ITS序列在NCBI的Genbank数据库中进行BLAST搜索,结果如表2。选取同源性较高的模式菌株构建系统发育树,结果见图3。
表2 代表菌株与已知菌株的5.8S ITS序列相似性
Table 2 5.8S ITS sequences similarity between representative strains and known strains
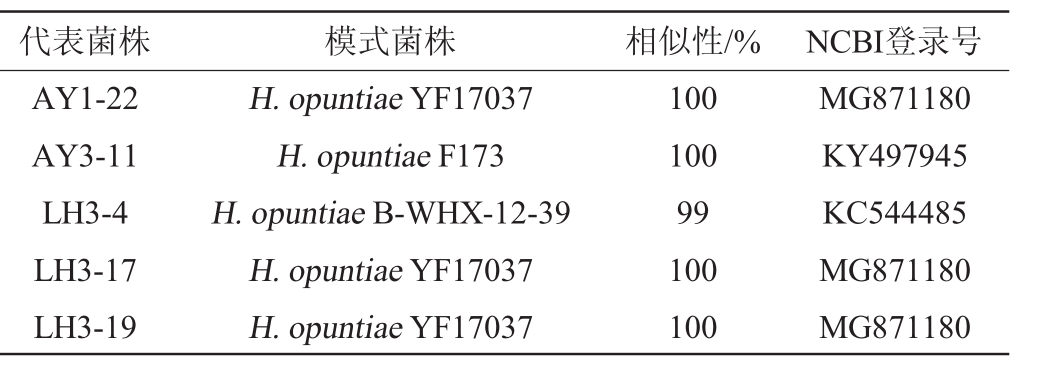
代表菌株 模式菌株 相似性/% NCBI登录号AY1-22 AY3-11 LH3-4 LH3-17 LH3-19 H.opuntiae YF17037 H.opuntiae F173 H.opuntiae B-WHX-12-39 H.opuntiae YF17037 H.opuntiae YF17037 100 100 99 100 100 MG871180 KY497945 KC544485 MG871180 MG871180
由表2及图3可知,5株代表菌株均与H.opuntiae的序列相似性>99%,因此,被确定为H.opuntiae。这几株菌是类型Ⅱ、Ⅲ和Ⅴ的代表菌株,因此,类型Ⅱ、Ⅲ和Ⅴ的菌株可以被确定为H.opuntiae。

图3 基于5.8S ITS区序列代表菌株的系统发育树
Fig.3 Phylogenetic tree of representative strains based on 5.8S ITS region sequences
结合形态观察、26S rDNA D1/D2和5.8S ITS测序结果得出,193株菌株为4个属的6个种群。类型Ⅰ和类型Ⅹ的菌株都可以被鉴定为H.uvarum;类型Ⅱ、类型Ⅲ和类型Ⅴ的菌株都可以被鉴定为H.opuntiae;类型Ⅳ和类型Ⅵ的菌株都可被确定为I.terricola;类型Ⅶ的菌株被鉴定为P.terricola;类型Ⅷ的菌株为C.quercitrusa;类型Ⅸ的菌株为H.vineae。
酿酒酵母(Saccharomyces cerevisiae)广泛存在于葡萄表皮,但是本次实验却完全未分离出,分析原因可能是由于该种群的数量较少,且本研究中分离总菌株数目较少;本研究未统计WL营养琼脂上表型为单一菌株的相关酵母;该种群可能不是这些研究地区葡萄表皮的主要酵母类群。
2.3 酵母菌不同种群的分布
各个地点的不同种群菌株数量分布如图4所示。由图4可知,安阳地区的主要酵母菌是H.opuntiae和H.uvarum,且H.opuntiae菌株数最多,为41株;长垣地区的主要酵母菌为I.terricola;而漯河地区的酵母菌种类最多,不同种群的酵母菌株数量均>10株,但是漯河地区未发现酵母种群C.quercitrusa,其只在安阳和长垣地区发现,且数量极少。

图4 不同种群酵母菌的分布
Fig.4 Distribution of yeasts of different species
3 结论
该研究研究河南省内不同地区赤霞珠葡萄表皮酵母菌的多样性,从3个地区的成熟葡萄表皮共分离得到193株酵母菌,根据形态观察,分为10个表型;在此基础上,根据26S rDNA D1/D2区序列和5.8S ITS序列分析,酵母菌被鉴定为4个属6个种,分别为H.opuntiae、H.uvarum、I.terricola、C.quercitrusa、H.vineae和P.terricola。其中H.opuntiae和H.uvarum分布于3个地区,且数量较多,即这两个种群的酵母菌分布范围广;而P.terricola和H.vineae仅分布于漯河地区,但漯河地区未发现I.terricola和C.quercitrusa;C.quercitrusa仅分布于安阳和长垣地区,且数量极少。因此,不同地区的酵母菌种类及数目上的分布存在一定的差异。
[1]隋明.葡萄酒的自然酿造的加工工艺研究[J].酿酒,2007,44(3):80-82.
[2]张春芝,江志国.微生物对葡萄酒香气的影响综述[J].中国酿造,2013,32(9):28-31.
[3]孙炜宁,张巧格,李兴兴,等.葡萄酒酿造过程中微生物多样性的研究现状[J].食品研究与开发,2014(18):365-368.
[4]张众,顾沛雯,张军翔,等.葡萄酒病害相关酵母的分离与鉴定[J].中国酿造,2017,36(10):56-60.
[5]张俊杰,杨旭,郭晨,等.不同株系梅鹿辄葡萄果皮酵母菌的分离鉴定与差异分析[J].酿酒科技,2016(10):22-26.
[6]史涛涛.云南德钦产区冰葡萄自然发酵过程中酵母的动态变化以及优良酿酒酵母的筛选[D].济南:齐鲁工业大学,2013.
[7]NIKOLAOU E,SOUFLEROS E H,BOULOUMPASIE,et al.Selection of indigenous Saccharomyces cerevisiae strains according to their oenological characteristics and vinification results[J].Food Microbiol,2006,23(2):205-211.
[8]王志恒,冯翠娥,王冲,等.宁夏玉泉营地区酿酒葡萄酵母菌的分离筛选及分子鉴定[J].中国酿造,2018,37(1):112-115.
[9]JEMEC K P,RASPOR P.Initial Saccharomyces cerevisiae concentration in single or composite cultures dictates bioprocess kinetics[J].Food Microbiol,2005,22(4):293-300.
[10]MERCADO L,DALCERO A MASUELLIR,et al.Diversity of Saccharomyces strains on grapes and winery surfaces:Analysis of their contribution to fermentative flora of Malbec wine from Mendoza(Argentina)during two consecutive years[J].Food Microbiol,2007,24(4):403-412.
[11]巴尼特.酵母菌的特征与鉴定手册[M].青岛:海洋大学出版社,1991:17-28.
[12]张纪忠.微生物分类学[M].上海:复旦大学出版社,1990:377-388.
[13]张鹰,曾新安,温其标.脉冲电场处理对酿酒酵母细胞膜的影响[J].陕西科技大学学报,2006(6):28-33.
[14]GIAEVER G,ANGLA M,CHU L N,et al.Functional profiling of the Saccharomyces cerevisiae genome[J].Nature,2002,418(6896):387-391.
[15]FRUTOS R D L,FERNÁNDEZ-ESPINAR M T,QUEROL A.Identification of species of the genus Candida by analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J].Anton Leeuw,2004,85(3):175-185.
[16]FELL J W,BOCKHOUT T,FONSECA A.Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J].Int J Syst Evol Microbiol,2010,50(3):1351-1371.
[17]王卫国,张仟伟,赵永亮,等.酿酒酵母的选育及其应用研究进展[J].河南工业大学学报,2015,36(6):105-111.
[18]张俊杰,杨旭,焦健,等.不同株系赤霞珠葡萄表皮酵母菌的多样性研究[J].中国酿造,2017,36(6):126-130.
[19]贾春凤,贾志军,朱维红,等.红提葡萄酒发酵酵母菌的分离纯化及耐受性研究[J].中国酿造,2016,35(6):80-84.
[20]刘爱国.宁夏贺兰山东麓葡萄酿酒酵母菌的分离及其分类鉴定[D].杨凌:西北农林科技大学,2008.