豆酱为我国传统发酵豆制品,具有风味独特、营养丰富、口感鲜咸协调,柔和而回味悠长,易于消化吸收的特点,深受中外消费者的青睐[2]。随着改革开放的进程,米曲霉(Aspergillus oryzae)、酱油曲霉(Aspergillus sojae)、酵母菌等纯菌种应用技术在传统酿造中得到了广泛应用[2]。但是目前绝大多数的厂家还是采取的半开放式酿造工艺[3],不可避免的会接入天然酿造微生物。因此,实际上的酿造过程仍然属于多菌种共酵的工艺[4-6]。在豆酱制曲过程中,枯草芽孢杆菌(Bacillus subtilis)[7]的生长会消耗原料中的碳水化合物、有机酸和氨基酸,产生不良气味,还会产生抗真菌性物质且迅速消耗氧气,从而抑制曲霉生长,降低曲霉的蛋白酶活,严重影响后续发酵质量。同时,芽孢杆菌还是造成酱、酱油产品变质的主要微生物。乳酸菌能够产生一些抑菌成分[8],对微生物起到抑制作用[9-11],比如说Nisin,是一种由34个氨基酸组成的多肽类物质[12],目前已经作为一种天然防腐剂被广泛应用于食品加工业之中,对多种革兰氏阳性菌有较强的抑菌作用[13]。另外,研究表明[14-15],乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、片球菌属(Pediococcus)、明串珠菌属(Leuconostoc)、肉食杆菌属(Carnobacterium)等乳酸菌均能产生成分不同、性质各异的抑菌成分。目前,对于豆酱酿造过程中的微生物菌群组成研究比较多,而对于不同微生物间的拮抗调控关系研究比较少,更缺乏应用方面的报道。
本实验采用豆酱作为培养基。研究并加以富集、筛选、鉴定及强化对豆酱风味有明显提升的乳酸菌,对枯草芽孢杆菌(Bacillus subtilis)等有害微生物进行拮抗调控,不仅对于促进曲霉生长、提升成曲酶活、改善发酵程度有重要贡献[16-19],还能够改善产品煮制阶段的工艺设计,降低产品煮制杀菌加热强度,节约能源消耗,提升产品感官风味质量[20],对于实际生产具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌种
豆酱:佛山市海天(高明)调味食品有限公司发酵晒场;米曲霉(Aspergillus oryzae)As3.042:佛山市海天(高明)调味食品有限公司菌种保藏中心;乳酸片球菌(Pediococcus acidilactici)、枯草芽孢杆菌(Bacillus subtilis)YB1、枯草芽孢杆菌(Bacillus subtilis)YB2:佛山市海天(高明)调味食品有限公司实验室筛选。
1.1.2 化学试剂
CaCO3(分析纯):国药集团化学试剂有限公司;大豆、面粉、精制食用盐(均为食品级):佛山市海天(高明)调味食品有限公司;琼脂粉(生化试剂):广东环凯生物科技有限公司。
1.1.3 培养基
MRS肉汤培养基、LB液体培养基、LB固体培养基、MRS培养基、平板计数琼脂(plate count agar,PCA)培养基:广东环凯生物科技有限公司。
1.2 仪器与设备
SHP-250型生化培养箱:广东环凯生物科技有限公司;DL-CJ-2N型超级洁净工作台:北京东联哈尔仪器制造有限公司;S-18K组织匀浆器:常州市金坛晨阳电子仪器厂;2K15离心机:德国Sigma公司;ZHPW-70台式振荡培养箱:天津莱玻特瑞仪器设备有限公司。
1.3 方法
1.3.1 目标豆酱收集
选取氨基酸态氮含量<0.50 g/100 g,总酸含量>2.50 g/100 g的豆酱进行感官鉴评,结果显示口感酸味明显、鲜味较弱、酱香风味不显著且有异味的发酵豆酱为劣质豆酱。选取氨基酸态氮含量>1.50 g/100 g,总酸含量<1.30 g/100 g的豆酱进行感官鉴评,结果显示酸甜协调、鲜咸柔和、酱香突出纯正的豆酱为优质豆酱。分析劣质豆酱和优质豆酱中的芽孢杆菌和乳酸菌的含量。
1.3.2 特征微生物培养及验证
有害微生物菌群培养及验证:将LB培养基140 g,发酵豆酱60 g匀浆,加入食盐10 g,121℃灭菌20 min。冷却至室温后接入2 g劣质豆酱,于37.0℃条件下150 r/min摇瓶培养40 h,菌种成熟。取成熟菌液按1%(V/V)接种量,按该培养方案传代3次,得有害微生物菌群培养液。
将有害微生物菌群培养液于10 000×g条件下离心10 min,收集菌体。将1 g离心收集的菌体添加至1 000 g豆酱中进行30℃恒温静置发酵。发酵60 d后取出豆酱测定其总酸、氨基酸态氮含量,并进行感官鉴评。
有益微生物菌群培养及验证:将MRS肉汤培养基140 g,发酵豆酱60 g匀浆,加入食盐10 g,121℃灭菌15 min。冷却至室温后接入2 g优质豆酱,于35.0℃条件下静置培养40 h,菌种成熟。取成熟菌液按1%(V/V)接种量,按该培养方案传代3次,得有益微生物菌群培养液。
将有益微生物菌群培养液于10 000×g条件下离心10 min,收集菌体。将1 g离心收集的菌体添加至1 000 g豆酱中进行30℃恒温静置发酵。发酵60 d后取出豆酱测定其总酸、氨基酸态氮含量,并进行感官鉴评。
1.3.3 目标菌株初筛
将有害微生物菌群培养液稀释10 000倍后,取100μL涂布至LB平板。37.0℃培养至菌落直径约1 mm时,进行3次划线纯化。纯化后的单菌株接种至含盐量5%的LB培养基,37.0 ℃、150 r/min条件下培养40 h。菌种成熟后10 000×g条件下离心10 min,取1 g菌体添加至1 000 g豆酱进行发酵。选能造成豆酱总酸升高至2.5 g/100 g,且豆酱产生异味的菌株标定为有害菌株,以YB命名。
通常认为能对其他微生物形成抑制的乳酸菌都有一定的产酸能力,因此,采用CaCO3水解圈直径作为初筛评价指标。有益微生物菌群培养液稀释10 000倍后,取100μL加至平板,将含5%盐及0.5%CaCO3的MRS培养基倾注至平板内。35.0℃培养至菌落直径约1 mm时,进行3次划线纯化。纯化后的单菌株接种至含盐量10%的MRS肉汤,35.0℃培养40 h,获得初筛乳酸菌[21],以ZF命名。
1.3.4 目标菌株复筛
由于筛选能对豆酱风味形成破坏的菌株相对容易,但是筛选能对豆酱产生明显品质提升的乳酸菌则相对困难,且工作量极大。因此,将已获得的芽孢杆菌YB菌株作为验证手段,若该菌株能够对YB菌株形成抑制的,则说明有一定的抑菌能力,可能对豆酱发酵形成正向作用,以此来促进目标乳酸菌的筛选。采用杯碟法进行抑菌试验筛选,操作如下:采用1%的K 2HPO4的改良LB培养基作为指示菌生长培养基,采用两株有害微生物单菌(YB1、YB2来源于1.3.3筛选所得)作为指示菌,将15 mL指示菌生长培养基倒入直径9 cm的培养皿中,待冷却凝固后,加入0.2 mL指示菌悬液,涂布均匀,待干燥后用无菌镊子放置牛津杯,静置20 min后取发酵液0.1 mL加入牛津杯内。40℃培养48 h,测量抑菌圈直径,挑选抑菌圈直径>1.30 cm的菌悬液对应的菌株作为复筛目标菌株。
1.3.5 菌种鉴定
提取优良菌株的脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板进行16S rDNA PCR扩增,PCR扩增产物进行测序鉴定。对检测所得的基因序列进行比对,按照基因片段相识度辨别目标菌株的种属关系。
1.3.6 菌种应用验证
将筛选得到的有害菌株单菌和有益菌株单菌扩培后,成熟菌种10 000×g条件下离心10 min取沉淀。将1 g菌体沉淀混入1 000 g豆酱进行30℃恒温发酵。对成熟豆酱进行总酸、氨基酸态氮含量的检测和感官鉴评。
1.3.7 分析检测
总酸含量的测定采用国标GB/T 12456—2008《食品中总酸的测定》;氨基酸态氮含量的测定采用国标GB 5009.235—2016《食品安全国家标准食品中氨基酸态氮的测定》;枯草芽孢杆菌的检测采用国家出入境检验检疫行标SN/T 2728—2010《枯草芽孢杆菌检测鉴定方法》;乳酸菌的检测采用国标GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》。样品的感官鉴评由30位有1年以上豆酱鉴评经验的人员从色泽、口感及香气方面采用5分制评分法进行鉴评。
2 结果与分析
2.1 目标豆酱收集
对豆酱样品进行理化检测及感官鉴评,结果如表1所示。
表1 不同豆酱样品理化分析和感官鉴评结果
Table 1 Physical and chemical analysis and sensory evaluation results of different soybean paste samples
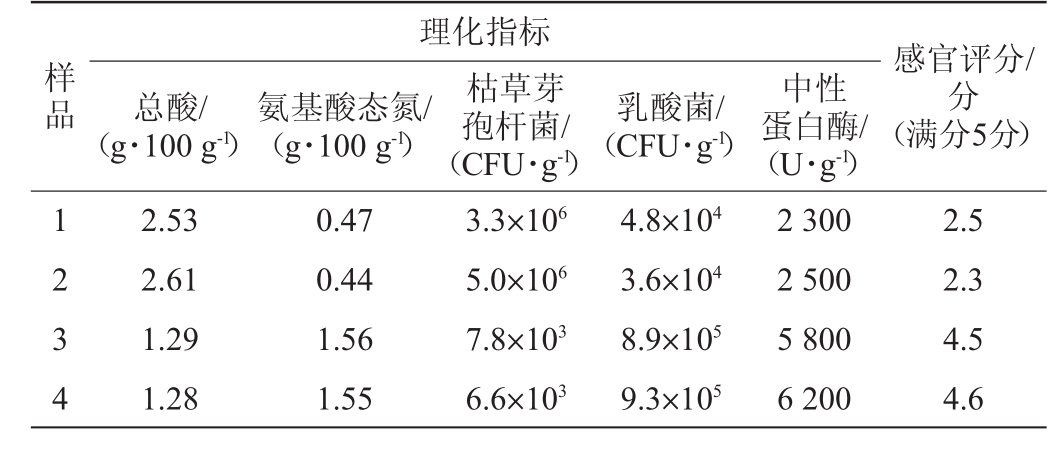
样品理化指标总酸/(g·100 g-1)氨基酸态氮/(g·100 g-1)枯草芽孢杆菌/(CFU·g-1)乳酸菌/(CFU·g-1)中性蛋白酶/(U·g-1)感官评分/分(满分5分)1 2 3 4 2.53 2.61 1.29 1.28 0.47 0.44 1.56 1.55 3.3×106 5.0×106 7.8×103 6.6×103 4.8×104 3.6×104 8.9×105 9.3×105 2 300 2 500 5 800 6 200 2.5 2.3 4.5 4.6
由表1可知,1号样品和2号样品在风味感官上较低,综合评分均值2.3~2.5分,其酸味较重,鲜味弱而微有异味。而3号样和4号样在风味感官上较优,综合评分均值4.5~4.6分,其鲜咸协调,酱香浓郁。分析原因是由于1号和2号豆酱中枯草芽孢杆菌大量生长,争夺了豆酱发酵过程中的营养资源,同时当枯草芽孢杆菌数量增殖到1.0×106 CFU/g后,会抑制豆酱发酵关键微生物米曲霉的生长,导致米曲霉产生的以中性蛋白酶为代表的酶活力明显下降,使豆酱中的蛋白质分解明显偏离正常水平,使其氨基酸态氮含量明显低于较优的3号和4号豆酱。微生物体系、酶系的失衡,导致产酸微生物的生长。造成豆酱总酸高,氨基酸态氮低的情况,形成了豆酱酸而不鲜的口感。而芽孢菌的生长会产生异味,使豆酱的气味较差。而乳酸菌的生产,由于其菌体总量并不高,并没有因为其是产酸菌而导致总酸升高。同时乳酸菌通过其生长活动抑制了芽孢杆菌等有害菌的生长,使豆酱发酵的微生物体系达到正常水平。
综上所述,是某种产酸的乳酸菌对以芽孢杆菌为代表的有害菌形成抑制,使豆酱发酵微生物体系向形成良好风味的方向转变。因此,设计一种以CaCO3为初筛模型,以芽孢杆菌为复筛方案的筛选模型,来筛选目标乳酸菌。
2.2 特征微生物培养及验证
将有害及有益的微生物菌群进行富集后,采用LB固体培养基和MRS平板检测其中的芽孢杆菌数和乳酸菌含量。枯草芽孢杆菌的数量从初始的1.0×104 CFU/g上升至6.8×107 CFU/g。乳酸菌数从初始的1.0×104 CFU/g上升至培养后的3.5×108 CFU/g。将富集培养液回添至豆酱发酵体系中后,考察富集菌株对其风味的影响,结果见图1。

图1 添加富集菌种对发酵的影响
Fig.1 Effect of adding enriched strains on fermentation
由图1可知,目标豆酱(优质豆酱和劣质豆酱)扩大培养传代3次后,离心收集菌体,排除原有豆酱中的风味成分对豆酱的添加菌株产生的影响。通过添加试验发现:添加了有害微生物菌液离心菌体的豆酱表现出品质劣化的特性,添加了有益微生物菌液离心菌体的豆酱表现出豆酱品质更优良的特性。且该特性流加至其他空白豆酱具有传染性,说明是某些微生物对豆酱的品质形成了显著影响。口感表现为添加有益微生物菌群豆酱产品较未添加目标菌种的发酵豆酱香气更加浓郁、协调。口感更加协调,表现出酸、甜、咸、鲜糅合在一起的丰富感,而未添加富集菌种的发酵酱则口感较为平淡。分析原因可能是由于有益的乳酸菌得到快速的增殖,对有害的芽孢杆菌形成了竞争性抑制。同时乳酸菌可能通过产生的乳酸也有效抑制了其他杂菌的生长。如果从豆酱体系中获得能明显改善豆酱品质的纯种乳酸菌菌株,扩大培养后添加至豆酱发酵中,则可以整体提升豆酱品质。
2.3 目标菌株初筛
从富集的有害微生物菌液中,共计筛选到32株可以造成不良影响的芽孢杆菌。其中菌株YB1和YB2添加后发酵体系产酸及气味变臭最明显。于是将对这两株菌的抑菌效果作为目标乳酸菌筛选的验证条件。通过对有益微生物菌液进行分离,共挑选获得了59株菌,培养24 h时可在含CaCO3的MRS培养基形成2 mm以上水解圈。对59株初筛乳酸菌进行传代稳定性验证,观察3次传代过程中菌种的生长情况及水解圈形成情况,挑选其中生长比较快,水解圈较大(>2 mm)的9株菌为初筛菌株。
2.4 目标菌种株复筛
9株初筛菌对两株枯草芽孢杆菌YB1和YB2的抑菌试验结果见图2。
由图2可知,9株初筛菌对两株枯草芽孢杆菌YB1和YB2都具有一定抑菌活性,其抑菌圈直径在1.30~1.60 cm之间。其中菌株ZF559和ZF757的抑菌圈直径在1.50~1.60 cm之间,较其他菌株更强,且对芽孢杆菌YB1和YB2的抑菌能力相似,确定菌株ZF559和ZF757为目标菌株。
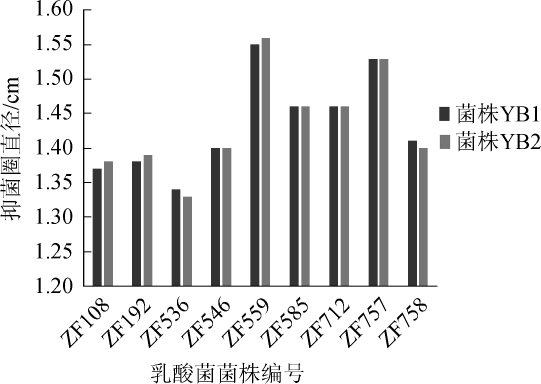
图2 9株菌对枯草芽孢杆菌的抑菌效果
Fig.2 Antibacterial effect of 9 strains on Bacillus subtilis
2.5 目标菌株鉴定
对菌株ZF559进行16S rDNA测序鉴定,序列如下:
CTTCCGTTAATTGATTATGACGTGCTTGCACTGA ATGAGATTTTAACACGAAGTGAGTGGCGGACGGGTG AGTAACACGTGGGTAACCTGCCCAGAAGCAGGGGA TAACACCTGGAAACAGATGCTAATACCGTATAACAG AGAAAACCGCCTGGTTTTCTTTTAAAAGATGGCTCT GCTATCACTTCTGGATGGACCCGCGGCGCATTAGCT AGTTGGTGAGGTAACGGCTCACCAAGGCGATGATG CGTAGCCGACCTGAGAGGGTAATCGGCCACATTGGG ACTGAGACACGGCCCAGACTCCTACGGGAGGCAGC AGTAGGGAATCTTCCACAATGGACGCAAGTCTGATG GAGCAACGCCGCGTGAGTGAAGAAGGGTTTCGGCT CGTAAAGCTCTGTTGTTAAAGAAGAACGTGGGTGAG AGTAACTGTTCACCCAGTGACGGTATTTAACCAGAA AGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAAT ACGTAGGTGGCAAGCGTTATCCGGATTTATTGGGCG TAAAGCGAGCGCAGGCGGTCTTTTAAGTCTAATGTG AAAGCCTTCGGCTCAACCGAAGAAGTGCATTGGAAA CTGGGAGACTTGAGTGCAGAAGAGGACAGTGGAAC TCCATGTGTAGCGGTGAAATGCGTAGATATATGGAA GAACACCAGTGGCGAAGGCGGCTGTCTGGTCTGTAA CTGACGCTGAGGCTCGAAAGCATGGGTAGCGAACA GGATTAGATACCCTGGTAGTCCATGCCGTAAACGAT GATTACTAAGTGTTGGAGGGTTTCCGCCCTTCAGTG CTGCAGCTAACGCATTAAGTAATCCGCCTGGGGAGT ACGACCGCAAGGTTGAAACTCAAAAGAATTGACGG GGGCCCGCACAAGCGGTGGAGCATGTGGTTTAATTC GAAGCTACGCGAAGAACCTTACCAGGTCTTGACATC TTCTGCCAACCTAAGAGATTAGGCGTTCCCTTCGGG GACAGAATGACAGGTGGTGCATGGTTGTCGTCAGCT CGTGTCGTGAGATGTTGGGTTAAGTCCCGCAACGAG CGCAACCCTTATTACTAGTTGCCAGCATTCAGTTGG GCACTCTAGTGAGACTGCCGGTGACAAACCGGAGG AAGGTGGGGACGACGTCAAATCATCATGCCCCTTAT GACCTGGGCTACACACGTGCTACAATGGATGGTACA ACGAGTCGCGAAACCGCGAGGTTTAGCTAATCTCTT AAAACCATTCTCAGTTCGGACTGTAGGCTGCAACTC GCCTACACGAAGTCGGAATCGCTAGTAATCGCGGAT CAGCATGCCGCGGTGAATACGTTCCCGGGCCTTGTA CACACCGCCCGTCACACCATGAGAGTTTGTAACACC
对菌株ZF757进行16S rDNA测序鉴定,序列如下:
ATGCAGTCGAACGCAATCTTTTAACAATGAGTG CTTGCACTCAGCGTTTTAAGTGCGAGTGGCGAACGG GTGAGTAACACGTGGGCAATCTGCCCGAAAGTGGG GGATAACACTTGGAAACAGGTGCTAATACCGCATCA ACCGACTGACCGCCTGGTCGGTCGGGCAAAGACGG CGTCAGCTGTCGCTTTTGGATGAGCCCGCGGCGTAT TAACTAGTTGGTAAGGTAACGGCTTACCAAGGTGAT GATACGTAGCCGAACTGAGAGGTTGATCGGCCACAT TGGGACTGAGACACGGCCCAAACTCCTACGGGAGG CAGCAGTAGGGAATCTTCCACAATGGACGCAAGTCT GATGGAGCAACGCCGCGTGTATGAAGAAGGTCTTCG GATCGTAAAATACTGTTGTCAGAGAAGAACACGGGA TAAAGTAACTATTGTTCCGCTGACGGTATCTGACCA GCAAGTCACGGCTAACTACGTGCCAGCAGCCGCGG TAATACGTAGGTGGCAAGCGTTGTCCGGATTTATTG GGCGTAAAGGGAACGCAGGCGGTCTTTTAAGTCTGA TGTGAAAGCCTTCGGCTTAACCGGAGAAGTGCATTG GAAACTGGGAGACTTGAGTGCAGAAGAGGAGAGTG GAACTCCATGTGTAGCGGTGAAATGCGTAGATATAT GGAAGAACACCAGTGGCGAAAGCGGCTCTCTGGTCT GTAACTGACGCTGAGGTTCGAAAGCGTGGGGAGCG AACAGGATTAGATACCCTGGTAGTCCACGCTGTAAA CGATGAATGCTAGGTGTTGGAGGGTTTCCGCCCTTC GGTGCCGCAGTTAACGCACTAAGCATTCCGCCTGGG GAGTACGATCGCAAGATTGAAACTCAAAGGAATTG ACGGGGGCCCGCACAAGCGGTGGAGCATGTGGTTT AATTCGAAGCAACGCGAAGAACCTTACCAGGTCTTG ACATCTTTTGACCATCTGAGAGATCAGAATTTCCCTT CGGGGACAAAATGACAGGTGGTGCATGGCTGTCGTC AGCTCGTGTCGTGAGATGTTGGGTTAAGTCCCACAA CGAGCGCAACCCTTATTGTCAGTTGCCAGCATTGAG TTGGGCACTCTGGCGAGACTGCCGGTGACAAACCGG AGGAAGGTGGGGATGACGTCAAGTCATCATGCCCC TTATGACCTGGGCTACACACGTGCTACAATGGACGA TACAACGAGTCGCGAGACCGCGAGGTTTAGCTAATC TCTGAAAGTCGTTCTCAGTTCGGATTGTAGGCTGCA ACTCGCCTACATGAAGTCGGAATCGCTAGTAATCGC GGATCAGCATGCCGCGGTGAATACGTTCCCGGGCCT TGTACACACCGCCCGTCACACCATGAGAGTTTGTAA CACCCAAAGCCGGTGCGGTAACCATTTGGAGCCAGC CGTCTAAGGTGGGACAGATGA
对鉴定序列进行比对发现,菌株ZF559与乳酸片球菌(Pediococcus acidilactici)的同源性为99.9%,菌株ZF757与破布子乳酸杆菌(Lactobacillus tatum)的同源性为99.9%。卫生部刊发的《可用于食品的菌种名单(卫办监督发〔2010〕65号)》中明确规定乳酸片球菌(Pediococcus acidilactici)为可用于食品的微生物,而破布子乳杆菌未列入其中。说明菌株ZF559作为一株安全且可稳定提升豆酱风味的乳酸菌,可以用于实际豆酱制作。而菌株ZF757则缺乏明确的允许使用依据,不能用于实际生产。因此,选择菌株ZF559进行豆酱应用试验。
2.6 菌种应用验证
将菌株YB1、ZF559在含10%食盐的培养基中扩培后添加至豆酱体系中,发酵后指标变化见表2。
表2 豆酱中添加菌株YB1及ZF559的应用效果
Table 2 Application effect of adding strain YB1 and ZF559 in soybean paste
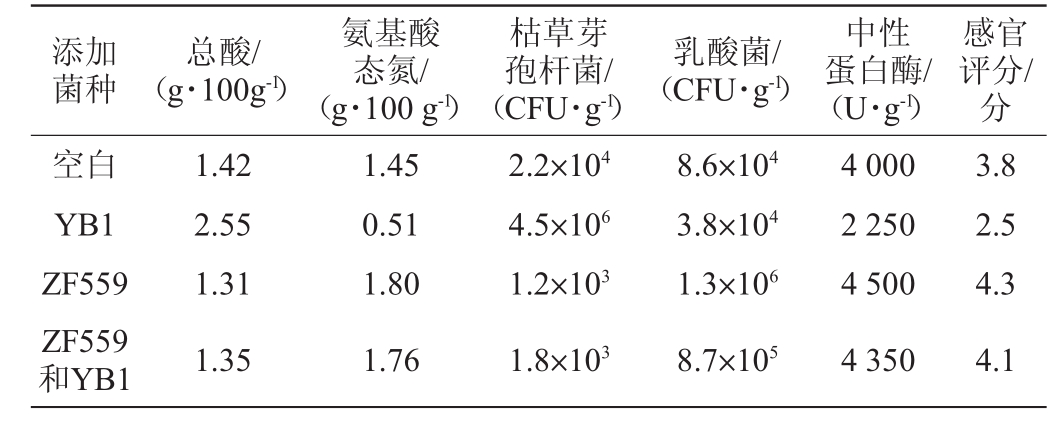
添加菌种总酸/(g·100g-1)氨基酸态氮/(g·100 g-1)枯草芽孢杆菌/(CFU·g-1)乳酸菌/(CFU·g-1)中性蛋白酶/(U·g-1)感官评分/分空白YB1 ZF559 ZF559和YB1 1.42 2.55 1.31 1.35 1.45 0.51 1.80 1.76 2.2×104 4.5×106 1.2×103 1.8×103 8.6×104 3.8×104 1.3×106 8.7×105 4 000 2 250 4 500 4 350 3.8 2.5 4.3 4.1
由表2可知,通过在豆酱体系中添加0.1%乳酸菌ZF559至豆酱体系中,其总酸从1.42 g/100 g降低至1.31 g/100 g,下降了7.7%;氨基酸态氮从1.45 g/100 g上升至1.80 g/100 g,提升了24%;枯草芽孢杆菌数量从2.2×104 CFU/g下降至1.2×103 CFU/g,降低了94.54倍。特别是当豆酱体系中有枯草芽孢杆菌时,引入同等数量级乳酸菌ZF559后,可以将总酸从2.55 g/100 g的降低至1.35 g/100 g,下降了47%,氨基酸态氮从0.51 g/100 g上升至1.76 g/100 g,提升245%。同时这种趋势也表现在乳酸菌数和中性蛋白酶上,枯草芽孢杆菌会造成乳酸菌数量和中性蛋白酶活力下降。这说明枯草芽孢杆菌可以通过使豆酱中的酶活力下降,造成氨基酸态氮下降,同时会造成品质的劣化。通过在豆酱中引入乳酸菌ZF559后,可以抑制枯草芽孢菌的生长,提升豆酱中的氨基酸态氮,降低总酸,同时通过抑制有害微生物的生长,避免不良气味、口感的产生,使豆酱的整体风味从3.8分上升至4.3分,提升13%。
3 结论
从豆酱发酵体系中筛选得到菌株ZF559,通过16S rDNA测序鉴定其是一株乳酸片球菌(Pediococcus acidilactici)。该菌在10%以上的盐分以及35℃的环境中可以快速生长。该耐盐的乳酸片球菌加入豆酱发酵体系后,可以抑制枯草芽孢杆菌等微生物的生长,使米曲霉的生长及产酶能力更强。使豆酱总酸降低7.7%,氨基酸态氮提升24%,使枯草芽孢杆菌(B.subtilis)的数量降低94.54%,显著增强豆酱的风味。
[1]张鹏飞,乌日娜,武俊瑞.传统发酵大豆制品挥发性成分和微生物多样性的研究进展[J].中国酿造,2018,37(12):1-6.
[2]丁娟芳,杨嘉,朱淑云,等.扬州酱菜中降解亚硝酸盐乳酸菌的筛选、鉴定及性能研究[J].中国酿造,2018,37(12):87-91.
[3]WU R,YU M,LIU X,et al.Changes in flavour and microbial diversity during natural fermentation of suan-cai,a traditional food made in Northeast China[J].Int J Food Microbiol,2015,211:23-31.
[4]尚雪娇,代程洋,王玉荣,等.腌菜中细菌多样性研究及乳酸菌分离鉴定[J].中国酿造,2018,37(11):40-44.
[5]郭旭凯,杨玲,刘聪,等.山西老陈醋酿造过程中乳酸菌和醋酸菌的分离鉴定及高粱单宁对其生长的影响[J].中国酿造,2018,37(8):37-44.
[6]姚荷,谭兴和,张春艳,等.发酵蔬菜中乳酸菌降解亚硝酸盐的研究进展[J].中国酿造,2018,37(7):22-25.
[7]刘琪,张佩娜,陈静,等.发酵豆制品中安全风险因子的研究现状及对策[J].中国酿造,2018,37(2):1-5.
[8]XIONG T,LIJ,LIANG F,et al.Effects of salt concentration on Chinese sauerkraut fermentation[J].LWT-Food Sci Technol,2016,69:169-174.
[9]蔺志颖.乳酸发酵杏鲍菇酱的加工及其风味物质研究[D].杨凌:西北农林科技大学,2018.
[10]王磊,张洁,赵国忠.东北酸菜优良乳酸菌筛选及其抑菌特性研究[J].中国酿造,2017,36(7):48-52.
[11]曾承露,李锋,黄德娜.盐酸菜中降胆固醇、亚硝酸盐乳酸菌筛选及功能特性研究[J].中国酿造,2017,36(7):37-41.
[12]李明松.乳酸菌发酵大麦提取物的制备及其降脂活性研究[D].镇江:江苏大学,2017.
[13]XIONG T,GUAN Q,SONG S,et al.Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J].Food Control,2012,26(1):178-181.
[14]刘宗敏,周红丽,谭兴和,等.一株植物乳杆菌的分离鉴定及应用[J].中国酿造,2017,36(7):95-99.
[15]李文军.德氏乳杆菌发酵大豆及其功能特性研究[D].天津:天津科技大学,2017.
[16]张可可,王雅棋,张莉,等.红薯淀粉废水中乳酸菌的筛选及其对食源性致病菌的抑制作用[J].中国酿造,2017,36(10):32-35.
[17]韦宗卉.乳酸菌发酵对辣椒酱品质影响的研究[D].扬州:扬州大学,2017.
[18]何艳霞.抑真菌乳酸菌的筛选及其在蒸蛋糕中的应用[D].无锡:江南大学,2017.
[19]杨菊.益生菌发酵鱼糜制品的安全品质的研究[D].湘潭:湘潭大学,2017.
[20]YAO Y,PAN S,FAN G,et al.Evaluation of volatile profile of Sichuan dongcai,a traditional salted vegetable,by SPME-GC-MS and E-nose[J].LWT-Food Sci Technol,2015,64(2):528-535.
[21]杨承剑,谢芳,梁辛,等.木薯渣中乳酸菌的分离鉴定及其产酸能力分析[J].中国酿造,2017,36(2):89-92.
[22]王雪雅,吴华丽,丁筑红,等.纯种乳酸菌接种发酵辣椒综合品质特性研究[J].中国酿造,2016,35(9):119-124.