霉菌是一类丝状真菌,广泛分布于自然环境中[1]。霉菌污染导致水果、蔬菜、粮食作物和动物饲料等发生霉变,使食品和农产品失去价值[2-4]。其中扩展青霉(Penicillium expansum)是梨果采后腐烂病害的主要致病菌,其分泌产生的毒素对人体具有致癌、致畸、致突变等潜在威胁[5]。控制食品和农产品中霉菌的方法包括物理法、化学法和生物法。物理法(加热、紫外照射、微波等)[6]通常会影响食品的感官性状,造成营养物质流失。化学法应用山梨酸盐和丙酸盐等化学防腐剂控制霉菌的生长,但存在一定的安全隐患。生物法主要应用茶多酚、壳聚糖、溶菌酶等生物制剂抑制霉菌的生长,具有绿色、安全、高效的特点,已成为食品防腐领域研究的热点[7]。
乳酸菌作为一种新型生物制剂广泛应用于肉制品、乳制品、果蔬制品等防腐保鲜,其主要通过产生的有机酸、细菌素、过氧化氢等代谢物质抑制食品中腐败微生物的生长[8]。李院等[9]从酱菜中分离得到3株对青霉拮抗作用较强的乳酸菌L511、L520、L544,抑菌圈直径均>18.0 mm,并推测抑菌物质是有机酸类;李晓婷[10]从内蒙古传统发酵食品中分离得到对黄曲霉拮抗活性较强的乳酸菌ALAC-1、ALAC-4,最低抑菌浓度(minimum inhibitory concentration,MIC)分别为62.50 mg/mL、31.25 mg/mL;尹雪等[11]从新疆传统发面面肥中分离得到3株对黄曲霉抑制效果较好的乳酸菌F3、F11、F12,抑菌圈直径分别为23.0 mm、45.0 mm、18.0 mm;EBRAHIMIM等[12]从传统发酵食品中分离得到1株拮抗活性较强的小球菌,对黄曲霉和黑曲霉的抑制率分别为70.32%和98.8%。目前,关于从朝鲜辣白菜中分离出抗扩展青霉乳酸菌的相关报道较少。
朝鲜辣白菜是以中国大白菜为主要原料,利用天然微生物发酵而成的传统发酵食品,在发酵过程和产品中含有丰富的乳酸菌资源[13-14]。因此,本研究采用菌饼法从朝鲜辣白菜中分离对扩展青霉具有拮抗活性的乳酸菌,通过形态观察、生理生化试验及分子生物学技术对其进行鉴定,并对其抑菌物质的特性及抑菌机理进行初步研究,为研发一种控制霉腐微生物的乳酸菌生物防腐剂奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌株
朝鲜辣白菜:锦州市金凌商场、锦州白楼农贸市场、锦州牡丹农贸市场等;扩展青霉(Penicillium expansum)CMCC 3.3703:中国医学细菌菌种保藏管理中心。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、PDA液体培养基:北京奥博星生物技术有限责任公司。
MRS固体培养基:蛋白胨10.0 g,酵母粉4.0 g,牛肉粉5.0 g,乙酸钠5.0 g,葡萄糖20.0 g,磷酸氢二钾2.0 g,柠檬酸三铵2.0 g,硫酸锰0.05 g,硫酸镁0.2 g,吐温-80 1.0 mL,琼脂粉15.0 g,蒸馏水1.0 L,pH 6.0~6.4,121 ℃灭菌15 min。MRS液体培养基中不添加琼脂粉。
1.1.3 试剂
乳酸、乙酸、丙酸、苯乳酸(均为分析纯):美国Sigma公司;胃蛋白酶(15 000 U/g)、木瓜蛋白酶(200 000 U/g)、中性蛋白酶(200 000 U/g)、胰蛋白酶(250 000 U/g):上海华蓝化学科技有限公司;Taq PCR Master mix、细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速抽提试剂盒、DNA Marker:生工生物工程(上海)股份有限公司;乳酸菌生化鉴定管:杭州天合微生物试剂有限公司。
1.2 仪器与设备
DL-CJ-2N型超级洁净工作台:东联哈尔(北京)仪器制造有限公司;DYY-8C电泳仪:北京市六一仪器厂;ABI stepone plus聚合酶链式反应(polymerase chain reaction,PCR)仪、5804R冷冻高速离心机:德国艾本德股份有限公司;Cheimdox XRS凝胶成像仪:美国Bio-Rad公司;S-4800扫描电镜:日本日立公司;SPX-250智能生化培养箱:宁波海曙赛福实验仪器厂;UV2550紫外可见分光光度计:日本岛津公司;PHSJ-3F pH计:上海仪电科学仪器股份有限公司;FA1004精密电子天平:上海恒平科学仪器有限公司;IKA Vortex GENIUS 3振荡器:德国IKA公司;GI54DS立式高压蒸汽灭菌锅:致微(厦门)仪器有限公司;KJELTEC 8000凯氏定氮仪:丹麦福斯公司;DZF-6050型真空干燥箱:上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 乳酸菌的分离
参照文献[15]并稍作修改。无菌条件下取出适量朝鲜辣白菜样品,采用接种环挑取每个样品汁液1环,划线于含1.0%CaCO3的MRS固体培养基,37℃条件下培养48 h,选取有溶钙圈的乳白色典型菌落进行过氧化氢酶试验和革兰氏染色。
1.3.2 乳酸菌抗扩展青霉活性的测定
乳酸菌无细胞上清液(cell free supernatant,CFS)的制备:参照文献[16]并稍作修改。在MRS液体培养基中接种乳酸菌菌株,37℃培养并传代2次,再以2%(V/V)的接种量接种于1.0 LMRS液体培养基中,37℃培养12~24 h。4℃、6 000 r/min条件下离心15 min,上清液经0.45μm的滤膜过滤除菌,得到乳酸菌CFS,4℃保存备用。
抗扩展青霉活性的测定:参照文献[17]中的菌饼法并稍作修改。在无菌条件下,挑取1环扩展青霉于PDA培养基中,25℃避光培养5 d。用直径为7.0 mm专用打孔器从培养5 d的扩展青霉菌落边缘制取菌饼,接种于含10%乳酸菌CFS的PDA培养基中央。25℃避光培养,以接种扩展青霉的PDA培养基为空白对照,计算乳酸菌对扩展青霉的抑菌率,其计算公式如下:
式中:d0为对照组扩展青霉菌落直径,mm;d x为实验组扩展青霉菌落直径,mm。
1.3.3 乳酸菌菌株鉴定
形态学鉴定:将分离的乳酸菌划线于MRS培养基,30℃培养24 h,观察菌落形态。采用革兰氏染色法染色并在显微镜下观察。
生理生化鉴定:参照《常见细菌系统鉴定手册》[18]和《乳酸细菌分类鉴定及实验方法》[19]对乳酸菌菌株进行生理生化鉴定。
分子生物学鉴定:参照文献[20]对分离乳酸菌的16S rRNA进行PCR扩增。PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST同源性搜索,选取同源性较高的模式菌株的16S rRNA序列,采用MEGA 5.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 乳酸菌对扩展青霉的拮抗机理研究
pH对乳酸菌抗扩展青霉活性的影响:采用1.0 mol/L NaOH和1.0 mol/L HCl将乳酸菌CFS的pH分别调至2.5、3.0、4.0、5.0、6.0,以未处理的乳酸菌CFS作对照。
温度对乳酸菌抗扩展青霉活性的影响:将乳酸菌CFS分别在50℃、70℃、100℃处理30 min、121℃处理15 min,以未处理的乳酸菌CFS作为对照组。
蛋白质对乳酸菌抗扩展青霉活性的影响:采用1.0 mol/L NaOH和1.0 mol/L HCl将乳酸菌CFS的pH分别调至胃蛋白酶(pH 2.0)、木瓜蛋白酶(pH 7.0)、中性蛋白酶(pH 7.0)、胰蛋白酶(pH 7.5)的最适pH,再分别加入相应的蛋白酶,使其最终浓度为1.0 mg/mL,室温条件下处理4 h,以未处理的乳酸菌CFS作为对照组。
测定乳酸菌CFS中乳酸、乙酸、丙酸、苯乳酸的含量,采用MRS液体培养基配制与乳酸菌CFS中相同浓度的乳酸、乙酸、丙酸、苯乳酸以及四种混合酸,测定其对扩展青霉的抑菌活性。
1.3.5 乳酸菌CFS对扩展青霉细胞结构的影响
参照文献[21]并稍作调整,研究乳酸菌CFS对扩展青霉细胞结构的影响。以不加乳酸菌CFS为对照组,5.0 mL乳酸菌CFS中加入200μL指示菌,30℃、150 r/min条件下培养12 h。4℃、6 000 r/min离心10 min,收集菌体。在2.5%戊二醛溶液中4℃固定过夜,用0.1 mol/L pH 7.2磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤2次,除去残留戊二醛,洗涤后菌体用无菌水悬浮,用胶头滴管取适量滴于洁净盖玻片,真空干燥12 h,喷金镜检。
1.3.6 测定方法
乙酸、乳酸、丙酸的测定:参照文献[22];苯乳酸的测定:参照文献[23]。
2 结果与分析
2.1 抗扩展青霉乳酸菌的分离和初筛
从朝鲜辣白菜中共分离得到62株具有白色溶钙圈的典型菌落,经革兰氏染色和过氧化氢酶试验确认45株为乳酸菌。采用菌饼法从45株乳酸菌中筛选出5株对扩展青霉拮抗活性较强的乳酸菌,分别编号为PC-1、PC-2、PC-3、PC-4、PC-5,其对扩展青霉的抑制率分别为60.37%、61.53%、68.62%、59.97%、63.44%。其中,乳酸菌PC-3的抑菌率最高,因此,选择菌株PC-3进行下一步研究。
2.2 乳酸菌PC-3对扩展青霉的抑菌效果
菌株PC-3对扩展青霉的抑菌效果见图1。
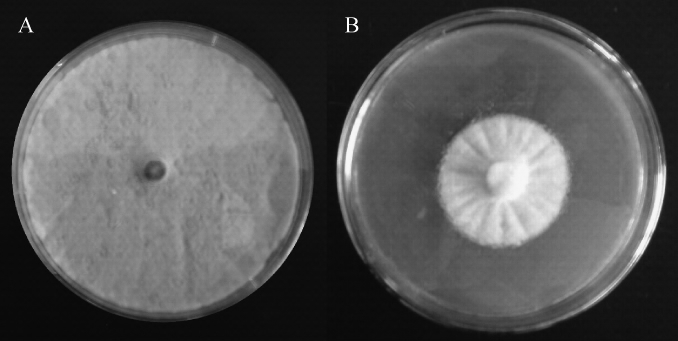
图1 扩展青霉的生长情况(A)及菌株PC-3对其的抑菌作用(B)
Fig.1 Growth situation of Penicillium expansum(A)and antimycotic activity of strain PC-3 on it(B)
由图1可知,无乳酸菌PC-3 CFS添加,扩展青霉生长茂盛,布满整个平板;添加乳酸菌PC-3 CFS后,扩展青霉的生长受到明显的抑制,抑菌率为68.62%。
2.3 乳酸菌PC-3的鉴定
2.3.1 形态学鉴定
菌株PC-3的菌落形态及细胞形态见图2。
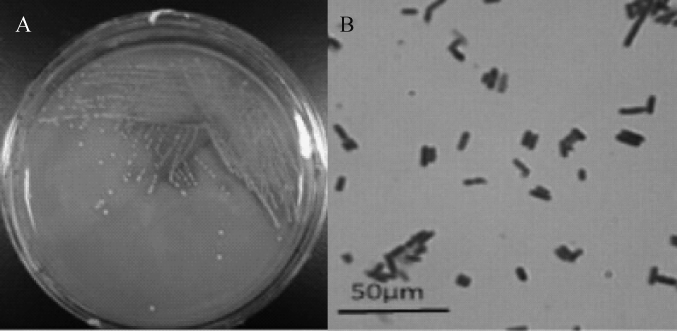
图2 菌株PC-3的菌落形态(A)及细胞形态(B)
Fig.2 Colony(A)and cell(B)morphology of strain PC-3
由图2A可知,菌株PC-3的菌落呈乳白色,不透明,中央凸起,边缘整齐,表面光滑,菌落直径为0.5~2.0 mm,具有典型乳酸菌生长特征。由图2B可知,菌体PC-3为革兰氏阳性菌,菌体为短杆状排列,无鞭毛,无芽孢。
2.3.2 生理生化试验结果
菌株PC-3的生理生化试验结果见表1。
表1 菌株PC-3的生理生化试验结果
Table 1 Physiological and biochemical tests results of strain PC-3

注:“-”表示结果呈阴性;“+”表示结果呈阳性。
项目 结果 项目 结果 项目 结果 项目 结果蔗糖甘露醇甘露糖山梨醇纤维二糖+++++麦芽糖水杨苷葡萄糖棉籽糖鼠李糖+ + + - -木糖蜜二糖阿拉伯糖乳糖半乳糖- ++ ++果糖七叶苷明胶液化葡萄糖酸盐+ + - -
由表1可知,菌株PC-3不能液化明胶,不能发酵葡萄糖酸盐,能发酵利用除棉籽糖、鼠李糖、木糖以外的其他糖类。根据《常见细菌系统鉴定手册》[18]和《乳酸细菌分类鉴定及实验方法》[19]初步鉴定菌株PC-3为乳杆菌属(Lactobacillus)。
2.3.3 分子生物学鉴定
菌株PC-3的16S rRNA PCR扩增产物电泳图见图3。由图3可知,在碱基长度为1 500 bp处有特异性条带,与目的基因相符,表明目标片段被成功扩增。PCR扩增产物测序结果在NCBI的GenBank数据库中进行BLAST同源性比对,选取同源性较高的模式菌株的16S rRNA序列,采用MEGA5.0软件中的NJ法构建系统发育树,结果见图4。由图4可知,菌株PC-3和清酒乳杆菌(Lactobacillus sakei)CP022709.1聚于一支,亲缘关系最近,相似度达96%。因此,鉴定菌株PC-3为清酒乳杆菌(Lactobacillus sakei)。

图3 菌株PC-3 16S rRNA基因的琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of 16S rRNA gene of strain PC-3
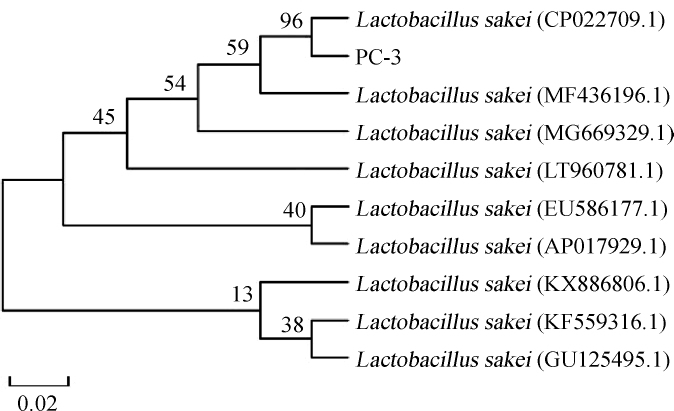
图4 基于16S rRNA基因序列菌株PC-3的系统发育树
Fig.4 Phylogenetic tree of strain PC-3 based 16S rRNA gene sequences
2.4 乳酸菌拮抗作用及机理的研究
2.4.1 pH对乳酸菌PC-3 CFS抗扩展青霉的影响
不同pH值对菌株PC-3 CFS抑制扩展青霉的影响见图5。
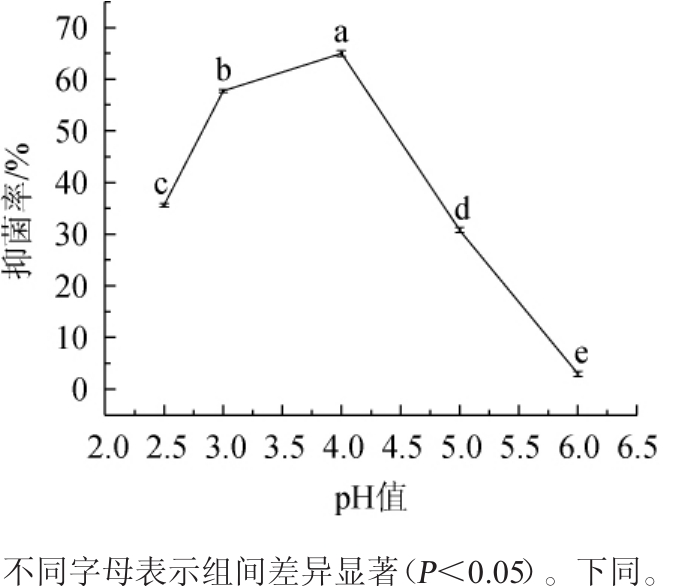
图5 不同pH值对菌株PC-3 CFS抗扩展青霉的影响
Fig.5 Effect of different pH on the antimycotic activity of strain PC-3 CFS on Penicillium expansum
由图5可知,随pH值逐渐升高,菌株PC-3 CFS对扩展青霉的抑菌率呈先上升后下降趋势。当pH值为4.0时,菌株PC-3 CFS对扩展青霉抑菌效果最好,抑菌率为64.97%;当pH值为6.0时,菌株PC-3 CFS基本失去对扩展青霉的抑菌作用。
2.4.2 温度对乳酸菌PC-3 CFS抗扩展青霉的影响
温度对菌株PC-3 CFS抑制扩展青霉影响见图6。
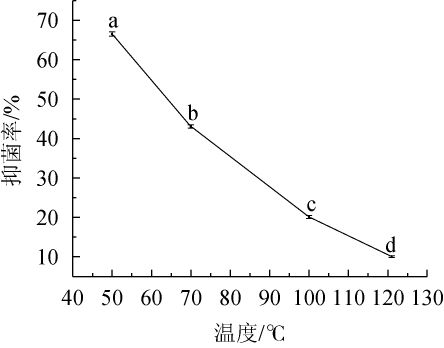
图6 温度对菌株PC-3 CFS抗扩展青霉的影响
Fig.6 Effect of temperature on the antimycotic activity of strain PC-3 CFS on P enicillium expansum
由图6可知,菌株PC-3 CFS经50℃处理30 min,对扩展青霉的抑菌率为66.54%,抑菌效果最强;经70℃、100℃处理30 min和121℃处理15 min后抑菌率分别下降至43.07%、20.13%和10.07%,表明菌株PC-3 CFS对扩展青霉的抑菌率随温度的升高而逐渐减弱,温度对抑菌活性具有显著的影响(P<0.05)。
2.4.3 蛋白质酶对乳酸菌PC-3 CFS抗扩展青霉的影响
乳酸菌PC-3 CFS分别经木瓜蛋白酶、胃蛋白酶、中性蛋白酶、胰蛋白酶室温下处理4 h,菌株PC-3 CFS对扩展青霉的抑菌率分别为60.66%、60.37%、60.44%、59.96%,无显著差异(P>0.05)。因此,初步推测其抑菌活性物质为非蛋白类。
2.4.4 乳酸菌抗扩展青霉的活性物质分析结果
乳酸菌CFS中乳酸、乙酸、丙酸和苯乳酸的含量分别为6.52μg/mL、2.62μg/mL、0.05μg/mL和1.86μg/mL,含相同质量浓度乳酸、乙酸、丙酸、苯乳酸以及四种混合酸的MRS液体培养基对扩展青霉的抑菌结果见表2。
表2 乳酸、乙酸、丙酸、苯乳酸及混合酸对扩展青霉的抑菌率
Table 2 Anti-mycotic rate of lactic acid,acetic acid,propionic acid,phenyl lactic acid and mixed acids on Penicillium expansum
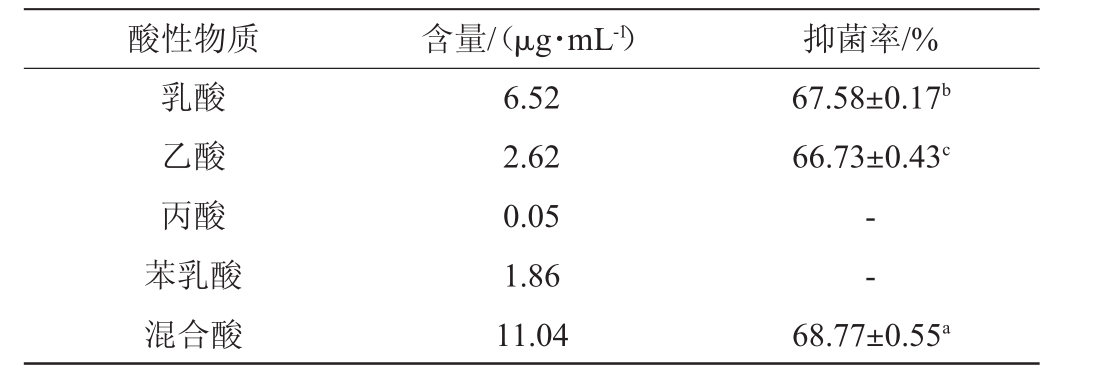
注:“-”表示无抑菌活性。不同字母表示差异显著(P<0.05)。
酸性物质含量/(μg·mL-1)抑菌率/%乳酸乙酸丙酸苯乳酸混合酸6.52 2.62 0.05 1.86 11.04 67.58±0.17b 66.73±0.43c- -68.77±0.55a
由表2可知,乳酸和乙酸对扩展青霉的抑菌率分别为67.58%和66.73%,丙酸和苯乳酸对扩展青霉均没有抑菌效果;将乳酸、乙酸、丙酸和苯乳酸按比例组合成混合酸,抑菌率为68.77%。结果表明,菌株PC-3 CFS中的主要抑菌活性物质为乳酸和乙酸。ANA G等[24]研究发现,乳酸菌抑制真菌的活性物质为有机酸类物质,与本研究结果相似。
2.5 乳酸菌PC-3 CFS对扩展青霉细胞结构的影响
菌株PC-3 CFS对扩展青霉细胞结构的影响见图7。

图7 扩展青霉分生孢子形态(A)及菌株PC-3 CFS对其的影响(B)
Fig.7 Conidial morphology of Penicillium expansum(A)and effect of strain PC-3 CFS on it(B)
由图7A可知,未经菌株PC-3 CFS抑制的扩展青霉分生孢子圆润,表面光滑,结构完整。由图7B可知,经菌株PC-3 CFS处理后,扩展青霉分生孢子胞壁结构不完整,边缘模糊,胞内物质外泄。结果表明,菌株PC-3 CFS对扩展青霉分生孢子胞壁结构具有较强损伤作用,其作用机理和对扩展青霉分生孢子胞壁结构的破坏过程需进一步研究。DA R N A等[25]研究表明,用水杨酸处理扩展青霉,细胞结构溶解,蛋白质泄露,与本研究结果相似。
3 结论
本研究从朝鲜辣白菜中分离出对扩展青霉拮抗作用较强的乳酸菌PC-3,经形态观察、生理生化和分子生物学鉴定为清酒乳杆菌(Lactobacillus sakei)。菌株PC-3 CFS对扩展青霉的抑菌活性随pH值的升高呈现先上升后下降的趋势,随温度的升高而下降。蛋白酶的添加对其抑菌活性没有影响,初步证明抑菌成分为非蛋白类物质。菌株PC-3 CFS中乳酸和乙酸的含量为6.52μg/mL、2.62μg/mL,对扩展青霉抑菌率分别为67.58%和66.73%,乳酸和乙酸为菌株PC-3抑制扩展青霉的主体活性成分。经扫描电镜观察,菌株PC-3抑制扩展青霉活性的机制主要使其为细胞壁结构失去完整性,导致细胞原生质泄露。该研究为研发一种控制食品和农产品中霉菌的生物防腐剂奠定基础。
[1]柴竹林,王岩,王庆峰,等.食品中常见霉菌毒素的污染及其检测技术[J].食品安全导刊,2015(27):109.
[2]刘程惠,吴祎男,胡文忠,等.苹果腐败霉菌的拮抗酵母菌筛选鉴定及拮抗机理初探[J].食品工业科技,2018,39(12):132-136.
[3]和肖营,都立辉,陈达民,等.东北稻谷储藏期间霉菌生长趋势研究[J].粮食储藏,2018,47(1):28-31.
[4]张牧臣,郑楠,王加启.食品中黄曲霉毒素B1污染研究进展[J].食品科学,2018,39(7):312-320.
[5]段腾飞,李昭,岳田利,等.反式-2-己烯醛对猕猴桃贮藏过程扩展青霉生长的抑制作用[J].农业工程学报,2019,35(2):293-301.
[6]冯建蕾.黄曲霉毒素的危害和防治[J].中国畜牧兽医,2005,32(12):70-72.
[7]单珂,郭全友,姜朝军,等.生物保鲜剂在水产品保鲜中的应用[J].食品与发酵科技,2018,54(3):4-8.
[8]ZHU X,ZHAO Y Z,SUN Y L,et al.Purification and characterisation of plantaricin ZJ008 a novel bacteriocin against Staphylococcus spp.from Lactobacillus plantarum ZJ008[J].Food Chem,2014,165(3):216-223.
[9]李院,魏新元,王静,等.抑制青霉菌乳酸菌的分离、鉴定及抑菌物质分析[J].食品科学,2015,36(21):150-155.
[10]李晓婷.具有抑霉菌作用乳杆菌的特性研究及发酵条件优化[D].呼和浩特:内蒙古农业大学,2017.
[11]尹雪,郭雪峰,帕提古丽·毛拉红,等.抑制黄曲霉菌的乳酸菌的分离及鉴定[J].西北农林科技大学学报(自然科学版),2018,46(5):16-22.
[12]EBRAHIMIM,KHOMEIRIM,MASOUDI-NEJAD A,et al.Inhibitory effects of lactic acid bacteria isolated from traditional fermented foods against aflatoxigenic Aspergillus spp.[J].Comp Clin Pathol,2017,26(5):1083-1092.
[13]赵圣明,曹雪珂,赵岩岩,等.抑制芽孢杆菌乳酸菌的筛选鉴定及其抗菌物质的分离纯化[J].食品工业科技,2018,39(11):144-150.
[14]孟令帅,张颖,邹婷婷,等.辣白菜中乳酸菌的分离鉴定[J].食品科学,2015,36(11):130-133.
[15]王昱敬,黄艾祥,刘雪英,等.德宏水牛乳饼中乳酸菌的分离鉴定及发酵性能研究[J].食品工业科技,2017,38(2):226-230.
[16]VARSHA K K,PEIYA S,DEVENDRA L,et al.Control of spoilage fungiby protective lactic acid bacteria displaying probiotic properties[J].Appl Biochem Biotech,2014,172(7):3402-3413.
[17]单文荣,刘花粉,李俊霞,等.菌饼法筛选不同活性物对棉花黄萎病菌抑制效果研究[J].中国棉花,2010,37(8):16-18.
[18]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:289-294.
[19]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:130-137.
[20]林洋,马欢欢,吕欣然,等.传统发酵蔬菜中拮抗温和气单胞菌的乳酸菌的筛选与鉴定[J].食品工业科技,2017,38(4):231-235.
[21]BUENO D J,SILVA J O,OLIVER G,et al.Lactobacillus casei CRL 431 and Lactobacillus rhamnosus CRL 1224 as biological controls for Aspergillus flavus strains[J].J Food Protect,2006,69(10):2544-2548.
[22]YUAN K,KONG H,GUAN Y,et al.A GC-based metabonomics investigation of type 2 diabetes by organic acids metabolic profile[J].J Chromatogr B,2007,850(1-2):236-240.
[23]ZHANG K,ZUO Y.GC-MS determination of flavonoids and phenolic and benzoic acids in human plasma after consumption of cranberry juice[J].J Agr Food Chem,2004,52(2):222-227.
[24]ANA G,ARMANDO V,ABRUNHOSA L.Antifungal effect of organic acids from lactic acid bacteria on Penicillium nordicum[J].Food Addit Contam,2018,35(4):1803-1818.
[25]DA R N A,MARASCHIN M,DI P R.Antifungal activity of salicylic acid against Penicillium expansum and itspossible mechanismsof action[J].Int J Food Microbiol,2015,215:64-70.