胆固醇是医学诊断中极为重要的指标[1],在正常的生理条件下,血液中胆固醇的浓度保持在一定的合理范围内[2]。而当出现肝脏病变情况下,其浓度有一定幅度的降低[3-4]。相关研究还发现,黄疸和肾病综合征患者血清的胆固醇水平存在一定幅度的增加,因而就可根据血清胆固醇水平来进行肝脏功能检测[5-6],胆固醇氧化酶是一种常用于这方面检测的酶[7]。不仅如此,胆固醇氧化酶还在其他许多领域有着极为重要的意义,如用于杀虫与许多甾醇和非甾醇的生物转化[8-9]及抗真菌传感器中[10-11]。
虽然产胆固醇氧化酶的菌株已经在一些微生物中有发现,但大部分都是中、高温酶,且酶活性不高,一定程度上限制了酶的应用。相对于陆源生物,海洋生物因其特殊的栖息环境,其产生的酶类具有显著特异性(如耐压、耐碱、耐盐及耐冷等),其更符合现代生物技术和不同加工产业的应用要求。
本研究利用本实验室所保藏的一株来源于海洋的蜡样芽孢杆菌(Bacillus cereus)XLH059作为出发菌株进行紫外诱变、化学诱变及复合诱变,研究诱变菌株胆固醇氧化酶的酶学性质,为扩大胆固醇氧化酶的应用范围奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
蜡样芽孢杆菌(Bacillus cereus)XLH059:辽宁省海洋微生物工程技术研究中心保藏。
1.1.2 化学试剂
蛋白胨、酵母浸粉、胰蛋白胨(均为生化试剂)、4-氨基-安替比林、氯化钠(均为分析纯):吉林东博生物公司;琼脂(生化试剂)、硫酸镁、磷酸二氢钾(均为分析纯):北京赛德科技有限公司;胆固醇(分析纯):阿拉丁试剂(上海)有限公司。
1.1.3 培养基
液体富集培养基:胆固醇0.1%,NH4NO3 0.1%,KH2PO4 0.025%,MgSO4 0.025%,FeSO4 0.000 1%,pH 7.0。
筛选培养基:酵母粉0.5%,胆固醇0.1%,吐温-80 0.1%,琼脂2%,NH4NO3 0.1%,KH2PO4 0.025%,MgSO4 0.025%,FeSO4 0.000 1%,pH 7.0。
种子培养基:葡萄糖2%,牛肉膏0.5%,蛋白胨1%,NaCl 0.5%,pH 7.0。
发酵培养基:酵母粉0.5%,胆固醇0.1%,吐温-80 0.1%,NH4NO3 0.1%,KH2PO4 0.025%,MgSO4 0.025%,FeSO4 0.000 1%,pH 7.0。
上述培养基灭菌条件:121℃灭菌20 min。
1.2 仪器与设备
GS-158低温台式离心机、J21-M高速冷冻离心机:美国BECKMAN公司;CH1015超级恒温水浴槽:上海恒平科学仪器有限公司;Inazge MlasterRVDS电泳成像系统:美国Parmacia Biotech公司;PB-10型精密pH计:上海精密仪器厂;DZF-6052真空干燥箱:上海风棱实验设备有限公司;HVE-50超高压灭菌锅:日本Hirayama公司。
1.3 实验方法
1.3.1 细胞悬浮液制备
将活化的XLH059菌种接种于种子培养基中培养,培养至对数生长末期,4 ℃离心(4 000 r/min、5 min),收集沉淀得菌体。用0.85%无菌生理盐水将菌体洗涤2次,配制成菌悬浮液,备用。
1.3.2 紫外诱变
取10 mL上述菌悬液加入平板中,并将平板置于磁力搅拌器上,在30 W紫外灯下距离20 cm,处理30 s、60 s、90 s、120 s、150 s、180 s。紫外线照射前后的菌悬液同时稀释,取0.1 mL涂布在筛选培养基上,26℃黑暗条件下培养24 h[13-14]。以诱变时间为横坐标,致死率为纵坐标,绘制致死率曲线。致死率计算公式如下:
1.3.3 化学诱变
取0.4 mL上述菌悬液,加入0.5 mL醋酸缓冲液(0.2 mol/L,pH 4.4),再加入0.1 mL(5 mg/mL)的亚硝酸钠溶液,于26 ℃条件下处理一定时间(10 min、20 min、30 min、40 min、50 min)后,加入5倍的磷酸缓冲液(pH8.6)解毒,各诱变时间的菌悬液同时稀释,各取0.1 mL涂布在筛选培养基上,在26℃条件下培养24 h[16]。以诱变时间为横坐标,致死率为纵坐标,绘制致死率曲线。
1.3.4 复合诱变
复合诱变即先在诱变效果最好的紫外条件下处理菌体,再在避光下继续进行化学诱变[17],经过复合诱变的菌株进行液体摇瓶发酵试验,测定其产胆固醇氧化酶活力。
1.3.5 优良突变菌株的传代试验
将得到的具有高产胆固醇氧化酶的优良突变菌株在平板上转移5次。通过发酵测定胆固醇氧化酶活力,考察其遗传稳定性。
1.3.6 粗酶液制备
将诱变得到的单菌落接种到种子培养基中,装液量为100 mL/250 mL,在25℃、200 r/min条件下培养12 h。然后,将1mL液体种子接种到发酵培养基中,装液量为100mL/250mL,在25℃、200 r/min条件下培养48 h。发酵液经8 000 r/min离心10 min,取上清液作为粗酶液。
1.3.7 胆固醇氧化酶酶活的测定[18]
(1)H2O2标准曲线的绘制
取酶活显色体系3 mL(pH7.5磷酸钾缓冲液0.1 mol/L 1 mL,4-氨基安替比林3 mmol/L 1 mL,苯酚溶液18 mmol/L 1 mL,过氧化物酶7 000 U/L 200μL)于试管中,37℃恒温水浴中保温3 min,分别加入浓度为2.5 mmol/L的H2O2溶液50μL、100μL、150μL、200μL、250μL,反应5 min后测定OD500 nm值。以OD500 nm值(x)为横坐标,H2O2浓度(y)为纵坐标,绘制H2O2标准曲线。H2O2对OD500 nm值的回归方程为y=0.413x-0.127 9,相关系数R2=0.999 4,线性关系良好,可用于胆固醇氧化酶活力的测定。
(2)胆固醇氧化酶活性的测定
在试管中取3 mL酶活化显色系统,在试管中加入胆固醇/异丙醇溶液(含Triton-100 4.36%)150μL。在37℃恒温水浴中孵育3 min,加入100μL发酵上清液,并在5 min后测量OD500 nm值。根据H2O2标准曲线回归方程计算胆固醇氧化酶酶活。
胆固醇氧化酶活力定义:在37℃、pH 7.5条件下,1 min催化1μmol胆固醇氧化成胆甾-4-烯-3-酮所需的酶量为一个酶活力单位(U)。
1.3.8 胆固醇氧化酶酶学性质研究
(1)酶最适作用温度
根据胆固醇氧化酶酶活测定方法,将酶液分别置于不同温度条件下(10~60℃,间隔5℃)测定其酶活,并绘制温度-相对酶活折线图。相对酶活:以该组最大酶活为100%,其他酶活占其的百分比为该酶活的相对酶活。
(2)酶的热稳定性
根据胆固醇氧化酶酶活测定方法,将酶液分别置于不同温度条件下(10~60℃,间隔10℃)保温5 min、10 min、15 min、20 min、25 min、30 min,测定其酶活,并绘制时间-相对酶活折线图。
(3)酶最适作用pH值
根据胆固醇氧化酶酶活测定方法,将不同pH值(3.0~9.0)的缓冲液代替酶活显色体系中的磷酸钾缓冲液(0.1 mol/L,pH 7.5),37℃保温5 min后加入20μL酶液,反应5 min,置于沸水浴中终止反应,测定OD500 nm值变化,测定其酶活,并绘制pH值-相对酶活折线图。
(4)酶的pH值稳定性
将酶液分别置于0.1 mol/L pH值(3.0~9.0)的缓冲液中适当稀释,在25℃条件下静置1 d,根据胆固醇氧化酶酶活测定方法测定其酶活,并绘制pH值-相对酶活折线图。
不同pH缓冲液:pH 3.0~5.0磷酸氢二钠-柠檬酸缓冲液0.1 mol/L;pH 6.0~7.5磷酸钾缓冲液0.1 mol/L;pH 8.0~9.0 Tris-HCl 0.1 mol/L。
(5)金属离子对酶活的影响
在酶最适作用条件下,向酶反应体系中各加入各种金属阳离子Cu2+、Mn2+、Fe3+、Zn2+、Hg+、Na+、K+、Ca2+、Mg2+,使各反应体系中金属离子终浓度为0.003 5 mol/L,测定胆固醇氧化酶相对酶活,做3组平行试验。
2 结果与分析
2.1 菌株诱变结果
2.1.1 紫外诱变结果
(1)紫外诱变致死率曲线
紫外诱变致死率实验结果见图1。由图1可知,当诱变时间为30 s时,致死率为29.6%,随着诱变时间的增加,致死率不断变大,在诱变时间达到120 s时,菌体致死率达到了88.6%;而当诱变时间为150 s时,致死率为94.6%,诱变180 s时,致死率为98.7%。一般认为诱变后菌株的致死率在80%~90%之间,诱变效果较好,可以保证菌株最大程度的突变[19]。因此,选取致死率88.6%时的诱变时间120 s对原始菌株进行紫外诱变。

图1 紫外诱变菌株致死率曲线
Fig.1 Lethality curve of ultraviolet mutated strains
(2)紫外诱变结果
将紫外诱变后得到的67株菌株接种于筛选固体培养基平板,并在25℃条件下静置培养24 h。之后选取菌落,采用点种法点在两个新的平板上,菌落之间留有充分的间隙,两个平板要完全一致做好标记。其中一个平板的菌落染色,将其浸入含有0.5%胆固醇的100 mmol/L磷酸钾缓冲液(pH 7.0)中;3 000 U/L辣根过氧化物酶;1.7%4-氨基安替吡啶和6%苯酚的滤纸平铺在平板上,在室温下避光温育24 h。通过观察菌落周围形成的粉红色的大小及颜色的深浅[20-21]筛选得到17株菌株,将这些菌株进行摇瓶液体发酵24 h,测定胆固醇氧化酶活力,计算酶活提升率。
5株紫外诱变菌株产酶活力与出发菌株XLH059比较有较大提高,结果见表1。由表1可知,突变菌株XL-a21的产酶活力提高最大,是原始菌株的1.83倍。由此可证明紫外诱变可以有效地提高菌株产胆固醇氧化酶的活性。
表1 紫外诱变菌株筛选结果
Table 1 Screening results of ultraviolet mutated strains
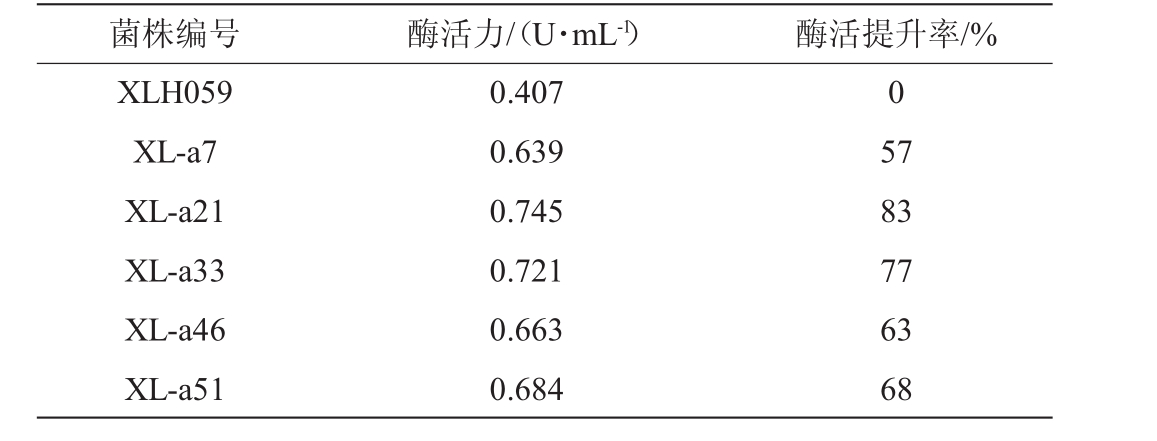
菌株编号酶活力/(U·mL-1)酶活提升率/%XLH059 XL-a7 XL-a21 XL-a33 XL-a46 XL-a51 0.407 0.639 0.745 0.721 0.663 0.684 0 57 83 77 63 68
2.1.2 化学诱变结果
(1)化学诱变致死率曲线
化学诱变致死率实验结果见图2。由图2可知,随着处理时间的增加,菌株的致死率不断提高。处理时间为10 min时,致死率仅为29.5%;而当处理时间达到30 min时,菌株致死率达到了85.1%;处理时间为40 min时,致死率>90%,达到了94.6%。为了保证菌株的存活率不至于过低,又能使菌株得到最大程度的诱变,本实验最终选择30 min为最佳化学诱变处理时间。

图2 化学诱变菌株致死率曲线
Fig.2 Lethality curve of chemical mutated strains
(2)化学诱变结果
选择最佳诱变时间30 min,稀释涂布培养共得到菌株52株。对这52株菌株进行菌落染色法筛选,得到粉红色明显的菌株13株,将这13株目的菌株作为重点观察对象,进行液体摇瓶发酵试验以考察其产胆固醇氧化酶活性,其中酶活提升率高的3株菌的酶活力与酶活提升率结果见表2。
表2 化学诱变菌株筛选结果
Table 2 Screening results of chemical mutated strains
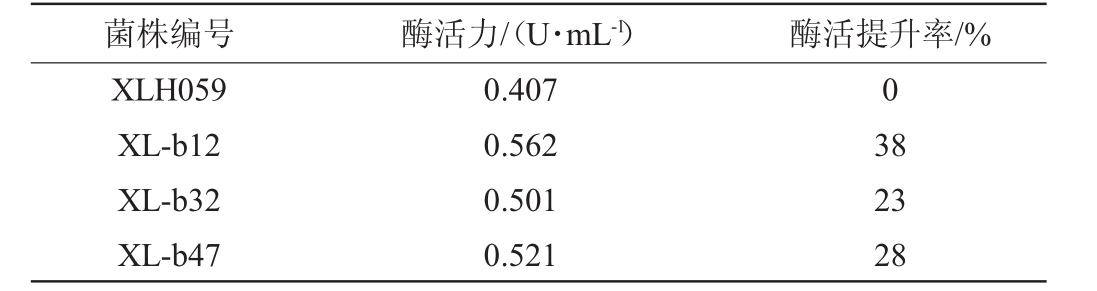
菌株编号酶活力/(U·mL-1)酶活提升率/%XLH059 XL-b12 XL-b32 XL-b47 0.407 0.562 0.501 0.521 0 38 23 28
由表2可知,菌株XL-b12酶活力最高,经化学诱变后酶活性是出发菌株的1.38倍。相较于紫外诱变,化学诱变无论是菌株数量还是酶活提升都有一定差距。
2.1.3 复合诱变结果
出发菌株先在紫外条件下处理120 s,再在避光条件下化学处理30 min。涂布筛选,得到菌株63株,得到粉红色明显的菌株14株,将这14株目的菌株作为重点观察对象,进行液体摇瓶发酵试验,测定产胆固醇氧化酶活力,其中有5株菌株的产酶活力有较大提高结果见表3。由表3可知,菌株XL-c23胆固醇氧化酶活是出发菌株的2.43倍,高于其他菌株。结果表明,复合诱变效果优于紫外诱变和化学诱变单一处理效果。
表3 复合诱变菌株筛选结果
Table 3 Screening results of compound mutated strains
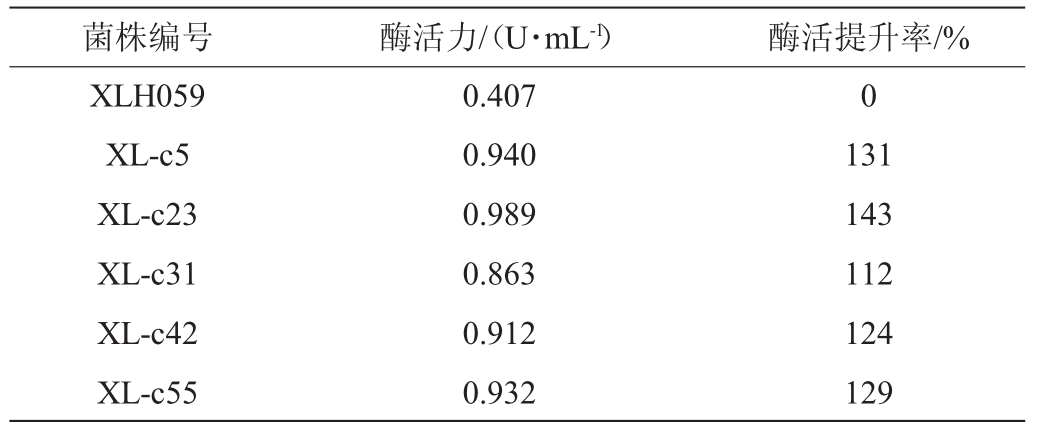
菌株编号酶活力/(U·mL-1)酶活提升率/%XLH059 XL-c5 XL-c23 XL-c31 XL-c42 XL-c55 0.407 0.940 0.989 0.863 0.912 0.932 0 131 143 112 124 129
2.2 突变菌株遗传稳定性
对产酶活力提高较大的5株突变菌株XL-c5、XL-c23、XL-c31、XL-c42和XL-c55进行传代稳定性考察。将突变菌株分别在LB培养基平板上连续传5代后,摇瓶发酵考察其遗传稳定性,结果见表4。由表4可知,菌株XL-c31经5次传代后,酶活呈现衰退,而菌株XL-c5、XL-c23、XL-c42、XL-c55经传代后酶活稳定,并且菌株XL-c23酶活力最高,为1.026 U/mL。
表4 突变株遗传稳定性试验
Table 4 Genetic stability of mutant strains

菌株编号初代酶活力/(U·mL-1)5代酶活力/(U·mL-1)XL-c5 XL-c23 XL-c31 XL-c42 XL-c55 0.940 0.989 0.863 0.912 0.932 0.951 1.026 0.632 0.936 0.923
2.3 酶学性质分析
2.3.1 酶最适作用温度
由图3可知,菌株XL-c23产胆固醇氧化酶的最适反应温度为30℃,30℃后酶活力逐渐下降,10~45℃酶活力保持在50%以上,其中20~40℃酶活力可以保持在80%以上,符合海洋细菌低温酶特性。
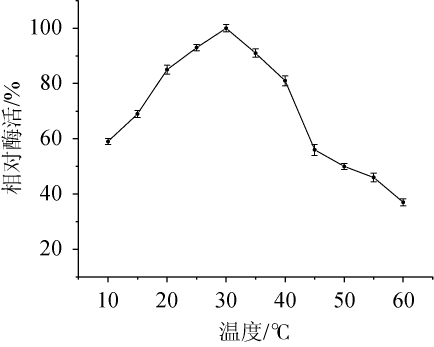
图3 温度对胆固醇氧化酶酶活的影响
Fig.3 Effect of temperature on cholesterol oxidase activity
2.3.2 酶的热稳定性
由图4可知,温度在10~40℃范围内的菌株XL-c23产胆固醇氧化酶活性在20 min后还可以保持>50%的酶活性,并且10~30℃可以保持>80%的活力。说明该酶在较低的温度(10~30℃)条件下能保持良好的稳定性,温度>40℃之后,酶活力迅速下降。

图4 胆固醇氧化酶的热稳定性
Fig.4 Thermal stability of cholesterol oxidase
2.3.3 酶最适作用pH值
由图5可知,当pH值<6.0或>8.0时,菌株XL-c23产胆固醇氧化酶活性急剧降低。胆固醇氧化酶最适pH值为7.0。
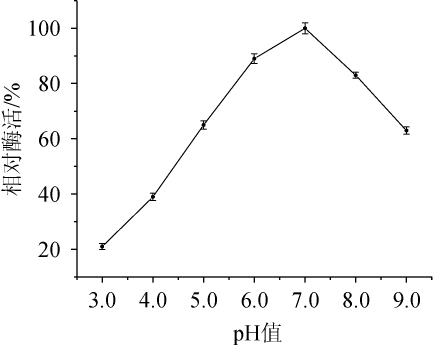
图5 pH值对胆固醇氧化酶酶活的影响
Fig.5 Effect of pH on cholesterol oxidase activity
2.3.4 酶的pH值稳定性
由图6可知,菌株XL-c23产胆固醇氧化酶在pH 6.0~8.0有较好的稳定性,相对酶活均可以达到80%以上。
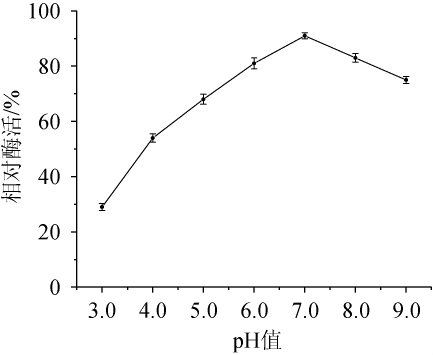
图6 胆固醇氧化酶的pH稳定性
Fig.6 p H stability of cholesterol oxidase
2.3.5 金属离子对酶活的影响
由图7可知,大部分的金属离子都对菌株XL-c23产胆固醇氧化酶的活性有明显抑制作用;Cu2+对胆固醇氧化酶有促进作用。Mn2+对胆固醇氧化酶活性有一定抑制作用,但仍能保持90%以上的酶活;Hg+对胆固醇氧化酶活性有严重抑制作用,相对酶活<40%。

图7 金属离子对胆固醇氧化酶活的影响
Fig.7 Effect of metal ions on cholesterol oxidase activity
3 结论
利用实验室保藏产胆固醇氧化酶蜡样芽孢杆菌(Bacillus cereus)XLH059作为研究对象,运用紫外诱变、化学诱变、紫外-化学复合诱变3种方法对其进行诱变育种以提高其产酶活力。结果表明,虽然各种诱变方法都可以提高菌株产胆固醇氧化酶的能力,但诱变效果却有很大差异。从实验结果可以看出复合诱变得到的突变菌株整体产酶水平又优于紫外诱变与化学诱变。本试验最终获得产酶活力最高的复合突变菌株XL-c23,其产酶活力最高为0.989 U/mL,是原始菌株的2.43倍,并且通过5代传代试验证明其产酶能力稳定。确定菌株XL-c23作为发酵条件优化实验的出发菌株。经试验得到该酶的最适pH值为7.0,酶活力在pH6.0~8.0有较好的稳定性。该酶的最适温度为30℃,30℃以下酶活力较为稳定,在20~40℃酶活力可以保持在80%以上,符合海洋细菌低温酶特性。
[1]曹琦.血脂检测在肺血栓栓塞症中的应用价值[D].济南:山东大学,2018.
[2]邓君明.动植物蛋白源对牙鲆摄食、生长和蛋白质及脂肪代谢的影响[D].青岛:中国海洋大学,2006.
[3]茅益民.肝脏病学药物临床试验[J].中国继续医学教育,2010,2(3):66-74,88.
[4]姚光弼,江绍基.临床肝脏病学进展[J].国外医学(内科学分册),1982(6):261-270.
[5]范建高.2018年《实用肝脏病杂志》精彩回顾[J].实用肝脏病杂志,2019,22(1):1-3.
[6]吴秀秀.尿肾功能及血脂与糖尿病视网膜病变的相关性研究[D].南昌:南昌大学,2018.
[7]肖勇,肖长烨.微生物在不同环境下的进化机制研究进展[J].华侨大学学报(自然科学版),2019,40(1):1-8.
[8]VRIELINK A,GHISLA S.Cholesterol oxidase:biochemistry and structural features[J].FEBS J,2009,276(23):6826-6843.
[9]DOUKYU N.Characteristics and biotechnological applications of microbial cholesterol oxidase[J].Appl Microbiol Biot,2009,83(5):825-837.
[10]PURCELL J P,GREENPLATE J T,JENNINGS M J,et al.Cholesterol oxidase:A potent insecticidal active against boll weevil larvae[J].Biochem Bioph Res Commun,1993,196(3):1406-1413.
[11]VRIELINK A,GHISLA S.Cholesterol oxidase:biochemistry and structuralfeatures[J].FEBS J,2009,276(23):6826-6843.
[12]马礼敦.X射线晶体学的百年辉煌[J].物理学进展,2014,34(2):47-117.
[13]王子天.紫外光/纳米银引起的胁迫刺激下RNR基因调控变化的研究[D].长沙:湖南大学,2014.
[14]李珊.核辐射诱发水稻基因组变异的特征及定向选择技术研究[D].杭州:浙江大学,2016.
[15]刘朝兴.核酸中5-醛基尿嘧啶的合成与检测[D].武汉:武汉大学,2018.
[16]杨震,彭选明,彭伟正.作物诱变育种研究进展[J].激光生物学报,2016,25(4):302-308.
[17]骆行岚.紫外光生电子与顺铂药物协同作用对DNA的损伤及其机理研究[D].福州:福州大学,2014.
[18]季文明,陈毅力,张和春,等.比色法测定胆固醇氧化酶酶活[J].无锡轻工学报,2000,19(3):251-254.
[19]诸葛健.工业微生物实验技术手册[M].北京:中国轻工出版社,1994:35-70.
[20]EI-NAGGAR N E,SOLIMAN H M,El-SHWEIHY N M.Extracellular cholesterol oxidase production by Streptomyces aegyptia,in vitro anticancer activities against rhabdomyosarcoma,breast cancer cell-linesand in vivo apoptosis[J].Sci Rep,2018,8(1):2760.
[21]LASHKARIAN H E.Isolation and identifcation of a native Rhodococcus strain producing cholesterol oxidase from soil[J].Int J Biotechnol Biochem,2010,8(1):205-217.