肌氨酸氧化酶(sarcosine oxidase,SOX)属于黄素蛋白氧化酶类,在自然界中分布广泛。其是酶法测定肌酐中研究较多的一种酶,可催化肌氨酸中的N-甲基氧化,可偶联肌酐酶和肌酸酶降解肌酐。作为一种重要的诊断酶制剂,是测定血清或尿液中肌酐含量的关键酶之一,应用于肾脏的健康程度的诊断[1]。
为了满足工业用酶的需求,赵更锋等[2-9]已从肌氨酸氧化酶的分布、酶学性质以及分子生物学方面进行了大量研究。SUZUKIM[10]最早发现棒状杆菌属(Corynebacterium sp.)可以产肌氨酸氧化酶,随后相继发现假单胞菌(Pseudomonas)、链霉菌(Streptomyces)、芽孢杆菌(Bacillus)和节杆菌(Arthrobacter)等微生物均可产肌氨酸氧化酶[11-16]。但目前依然存在着许多不足之处,如热稳定性普遍较差,使其在一些领域的应用中受到限制。MORIN等[17]从土壤中筛选出一株产单聚体肌氨酸氧化酶的铵镨柱胞霉菌(Cylindrocarpon didymium)M-1,测得该单聚体肌氨酸氧化酶分子质量为48 kDa,最适pH值为7.5,最适温度为40℃,将该酶在45℃处理10 min,残余酶活力为75%。
本研究从渤海海泥中分离、筛选一株高产低温肌氨酸氧化酶菌株,采用形态观察、生理生化试验及分子生物学技术对其进行鉴定,并对其所产的肌氨酸氧化酶酶学性质进行初步研究,为肾脏疾病诊断试剂盒的研发提供优质的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
海泥样品:辽宁省大连渤海湾(N:39°7′,S:121°41′)。
1.1.2 试剂
肌酸:大连凯美化工工程配套有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)纯化试剂盒:大连宝生物有限公司;酵母膏、硫酸镁、磷酸氢二钾、磷酸二氢钾、碘化钾、淀粉、牛肉膏、胰蛋白胨、氯化钠:生工生物工程(上海)股份有限公司;所有试剂均为国产分析纯或生化试剂。
1.1.3 培养基[18]
富集培养基:肌酸5.0 g/L,酵母膏0.5 g/L,硫酸镁0.5 g/L,磷酸氢二钾0.5 g/L,磷酸二氢钾2 g/L,海水1 L,pH 7.0。
分离培养基:肌酸5.0 g/L,酵母膏5 g/L,硫酸镁0.5 g/L,磷酸氢二钾0.5 g/L,磷酸二氢钾2 g/L,碘化钾1.7 g/L,淀粉10 g/L,海水1 L,pH 7.0。
种子培养基:胰蛋白胨10 g/L,牛肉膏5 g/L,NaCl 10 g/L,海水1 L,pH 7.0。
发酵培养基:肌酸5.0 g/L,酵母膏5 g/L,硫酸镁0.5 g/L,磷酸氢二钾0.5 g/L,磷酸二氢钾2 g/L,海水1 L,pH 7.0。
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L。
以上固体培养基中加入20 g/L琼脂,培养基均在0.1 MPa、121℃条件下高压蒸汽灭菌20 min。
1.2 仪器与设备
HZP-256全温振荡培养箱:上海智诚分析仪器制造有限公司;CX21FS3显微镜:日本OLYMPUS公司;NB-1630超净工作台、UV-H232可见紫外分光光度计:菲迪康乐(广州)科学仪器有限公司;LDFX-50BI立式压力蒸汽灭菌锅:兰州方盛生物科技有限公司;APL-204电子天平、pH-3G pH计:陕西鼎盛仪器设备有限公司;MBS聚合酶链式反应(polymerase chain reaction,PCR)仪:上海普迪生物技术有限公司。
1.3 试验方法
1.3.1 产肌氨酸氧化酶菌株的筛选
菌株初筛:取大连渤海海湾海泥10 g于100 mL富集培养基中,在20℃、150 r/min条件下振荡培养,每天测肌酸含量。待肌酸完全降解后,富集培养液经10倍梯度稀释至10-6,将稀释液涂布于固体分离培养基,25℃条件下倒置培养24 h,挑取变为蓝绿色的菌落进行分离、纯化。将分离得到的菌株接种到新鲜的分离培养基中,20℃、150 r/min条件下培养72 h,测定肌酸的降解情况。
菌株复筛:将可降解肌酸的菌株接种于发酵培养基中,20℃、150 r/min条件下培养48 h,测定其肌氨酸氧化酶活力。
1.3.2 肌酸降解率的测定[19]
在0.5 mL的样品中,加入1 mL含有1%α-萘酚的1.5 mol/L NaOH、0.5 mL 0.05%的双乙酰,显色30 min,再加入3 mL蒸馏水,于波长530 nm处测定吸光度值。计算肌酸降解率,计算公式如下:
1.3.3 肌氨酸氧化酶活力的测定[19]
将待测菌体进行超声破壁后,于4℃、8 000 r/min条件下离心15 min,取上清酶液0.1 mL于0.9 mL含有0.1 mol/L肌氨酸的焦磷酸钠缓冲液(pH 7.4)中,37℃反应10 min,再加入0.25 mL 0.1 mol/L的醋酸终止反应,并加入1.5 mL含有0.04%乙酰丙酮的20%乙酸铵溶液,于37℃反应40 min后,在波长410 nm处测定吸光度值。
肌氨酸氧化酶活力定义:在37℃、pH 7.0条件下每分钟分解1μmol肌氨酸的酶量为一个酶活力单位(U)。
1.3.4 菌株的鉴定
形态观察:将试验菌株划线于固体LB平板上,20℃恒温培养24 h,观察菌株的菌落形态特征,并挑取单菌落,进行革兰氏染色,观察菌株的细胞形态。
生理生化试验[20]:对试验菌株进行V-P反应、接触酶反应、硝酸盐还原试验、产生吲哚试验、淀粉水解试验、明胶水解试验、含碳化合物的利用等试验。
分子生物学鉴定:将试验菌株接种于富集培养基中,20 ℃、150 r/min条件下培养48 h,8 000 r/min离心15 min后弃上清,加入100μL无菌重蒸水(ddH2O)中,混匀,沸水处理10 min,12 000 r/min离心10 min,以上清液为模板对试验菌株的16S rDNA基因序列进行PCR扩增[19]。正向引物为BSF8/20(5'-AGAGTTTGATCCTGGCTCAG-3');反向引物为BSR1541/20(5'-AAGGAGGTGATCCAGCCGCA-3')。采用DNA纯化试剂盒对PCR扩增产物进行纯化,并送至北京诺禾致源生物技术有限责任公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,与已知菌种的16S rDNA序列进行BLAST同源性比对,选择若干条同源性较高的模式菌株的16S rDNA序列,采用MEGA 5.0软件中的邻接(neighbor joining,NJ)法构建系统发育树,确定其分类地位。
1.3.5 肌氨酸氧化酶酶学性质的初步研究
最适作用温度:按照肌氨酸氧化酶活力的测定方法,分别在不同作用温度条件下(5~70℃,梯度为5℃),测定肌氨酸氧化酶活力,确定酶的最适反应温度;将同组实验中最高酶活力设为100%,计算相对酶活。
热稳定性:将粗酶液分别在不同温度条件下(25℃、30℃、40℃、50℃、60℃、70℃)处理60 min,测定酶活力。
最适作用pH:分别在不同pH值条件下(4.0~11.0,梯度为0.5)测定肌氨酸氧化酶酶活力,确定酶的最适反应pH。其中pH 4.0~6.0为0.1 mol/L柠檬酸-柠檬酸钠缓冲液;pH 6.0~8.5为0.1 mol/L磷酸盐缓冲液;pH 8.5~9.5为0.05 mol/L硼砂-硼酸缓冲液;pH 9.5~11.0为0.05 mol/L硼砂-NaOH缓冲液。
pH稳定性:将粗酶液分别于不同pH值(4.0~11.0,梯度为0.5)的缓冲液中,37℃保温18 h,测定酶活力。
不同金属离子对肌氨酸氧化酶活性的影响:将粗酶液分别加入含有1 mmol/L或10 mmol/L不同金属离子(Co2+、Ca2+、K+、Fe2+、Zn2+、Mn2+、Mg2+、Ni2+、Cu2+)的溶液中,37 ℃保温30 min,测定酶活力。将未加入金属离子的酶液活力设为100%,计算各组的相对酶活。
2 结果与分析
2.1 产肌氨酸氧化酶菌株的初筛
通过初筛发现,27个菌落周围变成蓝绿色,其中10株菌株(LYH03、LYH09、LYH18、LYH36、LYH44、LYH45、LYH83、LYH106、LYH186、LYH221)可降解肌酸(对照菌株肌酸降解率为4.5%),结果见表1。由表1可知,菌株LYH18降解肌酸的能力最强,培养72 h后,肌酸降解率达75%。
表1 菌株的肌酸降解率
Table 1 Creatine degradation rate of strains
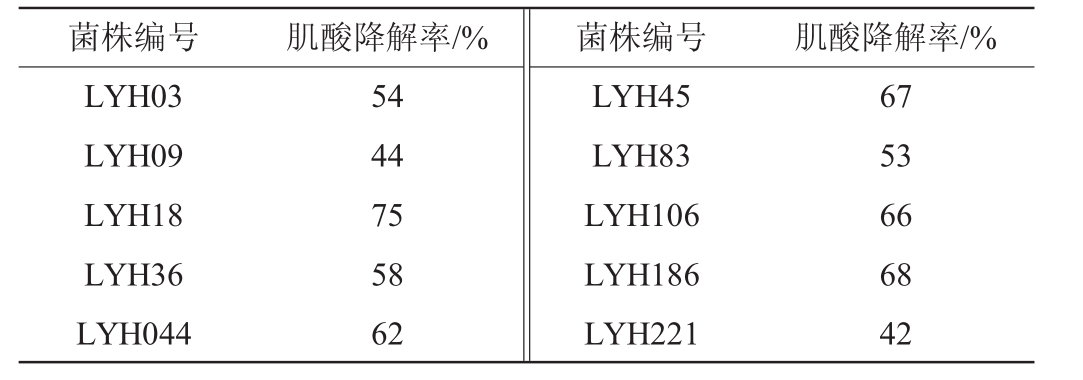
菌株编号 肌酸降解率/% 菌株编号 肌酸降解率/%LYH03 LYH09 LYH18 LYH36 LYH044 54 44 75 58 62 LYH45 LYH83 LYH106 LYH186 LYH221 67 53 66 68 42
2.2 产肌氨酸氧化酶菌株的复筛
将初筛获得的10株菌进行摇瓶发酵,测定其肌氨酸氧化酶活力,结果如表2所示。
表2 菌株产肌氨酸氧化酶的酶活比较
Table 2 Comparison of enzyme activities of sarcosine oxidase produced by strains
菌株编号 LYH03 LYH09 LYH18 LYH36 LYH44 LYH45 LYH83 LYH106 LYH186 LYH221酶活/(U·mL-1)0.15 0.67 1.65 1.02 0.89 1.12 0.85 1.14 1.21 0.18
由表2可知,菌株LYH18的肌氨酸氧化酶活力最高,为1.65 U/mL,与肌酸降解情况一致。因此,选取菌株LYH18为目标菌株,对其进行菌种鉴定。
2.3 菌株的鉴定
2.3.1 形态观察
菌株LYH18的菌落与细胞形态见图1。由图1a可知,菌株LYH18在LB固体培养基上,菌落呈圆形,隆起,表面光滑,湿润,边缘整齐,无色,易挑取;由图1b可知,革兰氏染色呈阳性,在LB固体培养基上生长3 d后形成芽孢,芽孢形状为椭圆形,菌体呈杆状。这些特征表明,菌株LYH18呈现出典型的细菌特征。
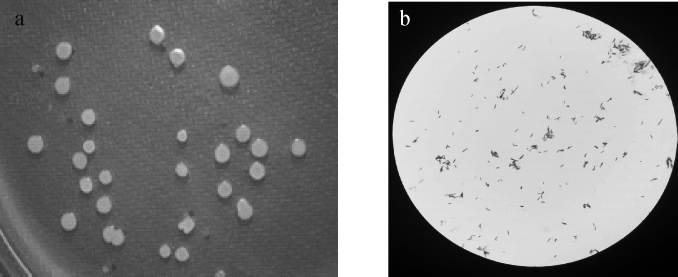
图1 菌株LYH18的菌落(a)和细胞(b)形态
Fig.1 Colony(a)and cell(b)morphology of strain LYH18
2.3.2 生理生化鉴定
参照《常见细菌系统鉴定手册》(第8版)[21]对菌株LYH18进行生理生化试验,生理生化特征结果见表3。
由表3可知,菌株LYH18在无氧条件下不能生长,接触酶试验呈阳性,V-P反应呈阴性,对氯化钠有较强的耐受性,在10%NaCI条件下能够生长;不能分解酪酛、明胶及淀粉;可将硝酸盐还原为亚硝酸盐;能利用多种碳水化合物,如D-半乳糖、L(+)-鼠李糖、纤维二糖、葡萄糖、蔗糖、松三糖,但不能利用D-木糖、棉子糖和D-甘露糖;不能产吲哚。结合形态观察,根据《常见细菌系统鉴定手册》(第8版)初步鉴定菌株LYH18为芽孢杆菌属(Bacillus)。
表3 菌株LYH18的生理生化特征
Table 3 Physiological and biochemical characteristics of strain LYH18

注:“+”表示为阳性反应;“-”表示为阴性反应。
项目 结果 项目 结果接触酶V-P反应2%NaCI 5%NaCI 7%NaCI 10%NaCI酪酛水解明胶水解淀粉水解硝酸盐还原+ - + + + + - - - +D-半乳糖L(+)-鼠李糖纤维二糖葡萄糖蔗糖松三糖D-木糖棉子糖D-甘露糖吲哚+ + + + + + - - - -
2.3.3 分子生物学鉴定
为了进一步鉴定分离菌株LYH18,将其16S rDNA序列在GenBank数据库中进行同源性比对。结果表明,菌株LYH18与Bacillus的多个菌种的序列相似性>97%,采用MEGA5.0软件中的NJ法构建系统发育树,结果如图2。由图2可知,菌株LYH18与海泥芽孢杆菌(Bacillus oceanisediminis)H2同源性(99%)较高,亲缘关系最近。结合形态观察及生理生化试验结果,将菌株LYH18鉴定为海泥芽胞杆菌(Bacillus oceanisediminis)。

图2 基于16S rDNA序列菌株LYH18的系统发育树
Fig.2 Phylogenetic tree of strain LYH18 based on 16S rDNA sequences
2.4 酶学性质研究
2.4.1 肌氨酸氧化酶的最适作用温度
不同作用温度条件下测定肌氨酸氧化酶活力,结果见图3。由图3可知,当作用温度在10~15℃时,肌氨酸氧化酶的活性随着作用温度的升高而急剧增大;当作用温度为25℃时,肌氨酸氧化酶活力最高;当作用温度在15~45℃时,相对酶活力基本保持在80%以上,说明在室温条件下,该酶即可保持较高酶活,这一特点可节省能源的消耗;当作用温度高于45℃后,酶活性急剧下降;当作用温度高于50℃后,相对酶活<60%。结果表明,肌氨酸氧化酶的最适作用温度为25℃,该酶对高温条件比较敏感,更适合低温条件。
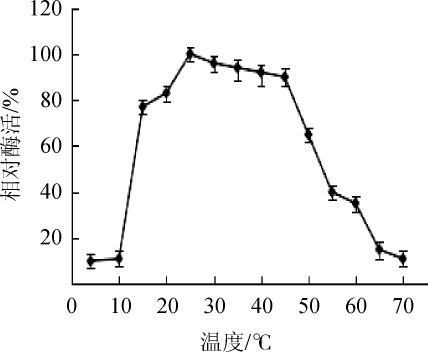
图3 肌氨酸氧化酶的最适反应温度
Fig.3 Optimal reaction temperature of sarcosine oxidase
2.4.2 肌氨酸氧化酶的热稳定性
肌氨酸氧化酶的热稳定性如图4所示。由图4可知,肌氨酸氧化酶在25~40℃条件下处理60 min后,相对酶活>80%,保持高酶活性,说明该酶在室温条件下,较稳定;当处理温度高于40℃以后,相对酶活力逐渐下降,符合海洋低温酶的特性[23];该酶在50℃处理60 min后,相对酶活力急速下降,仅保留30%的相对酶活力;在60℃、70℃处理60 min,相对酶活力均<10%,说明该酶热稳定性较弱。

图4 肌氨酸氧化酶的热稳定性
Fig.4 Thermal stability of sarcosine oxidase
2.4.3 肌氨酸氧化酶的最适作用pH值
不同作用pH值条件下测定肌氨酸氧化酶活力,结果如图5所示。由图5可知,该肌氨酸氧化酶作用的最适作用pH为8.0,且pH值在7.5~9.0之间时,相对酶活性较高,可保持在80%以上;当pH值≤7.0或≥9.0时,相对酶活性较低。

图5 肌氨酸氧化酶的最适作用pH值
Fig.5 Optimal reaction p H of sarcosine oxidase
2.4.4 肌氨酸氧化酶的pH稳定性
肌氨酸氧化酶的pH稳定性结果如图6所示。由图6可知,该酶在pH值≤6.0时,相对酶活<40%;在pH值7.0~10.0之间时,酶活可保持在80%以上,较稳定;由此可以得出,在中性至弱碱性条件下,肌氨酸氧化酶活性较高,较稳定,说明该酶耐弱碱性。
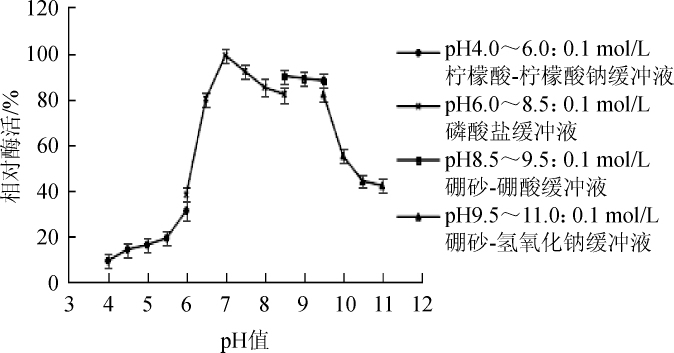
图6 肌氨酸氧化酶的pH稳定性
Fig.6 pH stability of sarcosine oxidase
2.4.5 不同金属离子对肌氨酸氧化酶活性的影响
不同金属离子对肌氨酸氧化酶活力的影响见图7。

图7 不同金属离子对肌氨酸氧化酶活性的影响
Fig.7 Effect of different metal ions on sarcosine oxidase activity
由图7可知,不同金属离子对酶的作用不同;同种金属离子在不同终浓度条件下对酶的作用也不同。其中Ca2+、Fe2+、Ni2+、Cu2+能使该酶失活,而K+对酶活性几乎没有影响;Co2+、Zn2+、Mg2+对酶活性有一定促进作用,其中Co2+对酶活性促进作用最强。
3 结论
本研究从渤海湾海泥样品中分离到一株高产肌氨酸氧化酶的菌株LYH18,肌氨酸氧化酶活力为1.65 U/mL。通过形态观察、生理生化分析和分子生物学技术鉴定菌株LYH18为海泥芽胞杆菌(Bacillus oceanisediminis)。经初步探索其产肌氨酸氧化酶的酶学性质,结果表明,该菌株所产的肌氨酸氧化酶的最适作用温度和pH值分别为25℃和8.0,在温度25~40℃和pH 7.0~10.0范围内,酶活性较稳定,该酶属于低温酶类。菌株LYH18作为一株产肌氨酸氧化酶的新菌源,具有潜在的开发价值。
[1]贾国辉,王耀荣.酶法肌酐检测的方法学改进探讨[J].中国冶金工业杂志,2015,32(3):369-270.
[2]赵更锋,马晓航.产肌氨酸氧化酶菌株的分离及发酵条件研究[J].微生物学报,2003,42(2):235-240.
[3]侯赣生.肌酐检测工具酶的高效表达及其酶学性质分析[D].广州:华南理工大学,2017.
[4]SUZUKI K,OGISHIMA M,SUGIYAMA M,et al.Molecular cloning and expression of a Streptomyces sarcosine oxidase gene in Streptomyces lividans[J].Biosci Biotech Bioch,1992,56(3):432-436.
[5]INOUYE Y,NISHIMURA M,MATSUDA Y,et al.Purification and characterization of sarcosine oxidase of Streptomyces origin[J].Chem Pharm Bull,1987,35(10):4194-4202.
[6]MATSUDA Y,HOSHIKA H,INOUYE Y,et al.Purification and characterization of sarcosine oxidase of Bacillus origin[J].Chem Pharm Bull,1987,35(2):711-717.
[7]NISHIYA Y,IMANAKA T.Cloning and sequencing of the sarcosine oxidase gene from Arthrobacter sp.TE1826[J].J Ferment Bioeng,1993,75(4):239-244.
[8]HASSAN-ABDALLAH A,ZHAO G H,ESCHENBRENNER M,et al.Cloning,expression and crystallization of heterotetrameric sarcosine oxidase from Pseudomonas maltophilia[J].Protein Expres Purif,2005,43(1):33-43.
[9]LEE S,JIA B,PHAM P,et al.Architecture and characterization of sarcosine oxidase from Thermococcus kodakarensis KOD1[J].Extremophiles,2012,16(1):87-93.
[10]SUZUKIM.Purification and some properties of sarcosine oxidase from Corynebacterium sp.U-96[J].J Biochem,1981,89(2):599-607.
[11]刘辉,孙桂琴,马晓航,等.芽胞杆菌BSD-8肌氨酸氧化酶的纯化与性质[J].生物工程学报,2010,26(3):335-340.
[12]KAPLAN A,NAUGLAR D.Creatinine hydrolase and creatine amidinohydrolase:I.Presence in cell-free extracts of Arthrobacter ureafaciens[J].Mol Cell Biochem,1974,3(1):9-15.
[13]IDA K,MORIGUCHIT,SUZUKIH.Crystal structure of heterotetrameric sarcosine oxidase from Corynebacterium sp.U-96[J].Biochem Bioph Res Co,2005,333(2):359-366.
[14]NAGATA K,SASAKIH,HUA M,et al.Crystal structure of monomeric sarcosine oxidase from Bacillus sp.NS-129 reveals multiple conformations at the active-site loop[J].P Jpn Acad B-Phys,2005,81(6):220-224.
[15]KIM J M,SHIMIZU S,YAMADA H.Sarcosine oxidase involved in creatinine degradation in Alcaligenes denitrificans subsp.denitrificans J9 and Arthrobacter sp.J5 and J11[J].J Agr Chem Soc Jpn,1986,50(11):2811-2816.
[16]KIM J M,SHIMIZU S,YAMADA H.Crystallization and characterization of sarcosine oxidase from Alcaligenes denitrificans subsp.denitrificans[J].Agr Biol Chem,1987,51(4):1167-1168.
[17]MORIN,KAWAKAMIB,HYAKUTOME K,et al.Characterization of betaine aldehyde dehydrogenase from Cylindrocarpon didymum M-1[J].J Agr Chem Soc Jpn,1980,44(12):3015-3016.
[18]郭康平.Bacillus sp.BSD-8肌酐降解酶系的研究[D].杭州:浙江大学,2008.
[19]孙桂芹.Bacillus sp.BSD-8肌氨酸氧化酶的研究[D].杭州:浙江大学,2004.
[20]任楠楠,迟乃玉,张庆芳.海洋低温甾醇酯酶菌株的筛选鉴定及其酶学特性研究[J].中国酿造,2019,38(1):37-41.
[21]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-65.