豆酱是中国传统的调味品,是经自然发酵而成的半流动状态的发酵食品,也称黄豆酱、黄酱或大豆酱[1]。中国是世界上最早发明酱制作方法的国家,制酱技术的起源可以追溯到公元前一千余年,《周礼》和《论语》中都有记载[2]。传统发酵豆酱除了作为调味品之外,其含有异黄酮类、多酚类、大豆皂苷、类黑精、肽类、维生素等大量对人体有益的生理活性物质,具有较好的保健功能[3-6]。
传统发酵豆酱采用开放式生产,空气中各种微生物混入后共同生长,通过发酵、后熟等阶段,形成了发酵豆酱特有的风味[7]。这些微生物主要包括霉菌、细菌和酵母菌,其中,霉菌起主要作用[8]。威宁豆酱也是经过特殊的工艺自然发酵而成,具有特殊的色、香、味、形,是当地人们生活中不可或缺的调味品。其传统工艺为:炒豆、磨豆、捏团、制曲发酵,加入辅料、后发酵。威宁豆酱传统的生产多为家庭作坊式生产,生产工艺落后,发酵周期长,原料及设备利用率低,产品质量不稳定,不能满足市场需求。为了提高豆酱发酵风味品质,可以选择人工接种纯种发酵的方式进行发酵,这也是目前发酵食品研究中的热点和主要趋势。
目前,高秀芝等[9-13]采用多种方法对豆酱中微生物进行研究,并对豆酱发酵工艺进行研究,但是对威宁豆酱发酵的研究鲜见报道,关于威宁豆酱纯种发酵的研究尚未见报道。因此,本研究从威宁豆酱中分离并鉴定主要的发酵菌株,分别将菌种应用在威宁豆酱纯种发酵工艺上,以期为威宁豆酱的纯种发酵提供优良菌种,为威宁豆酱的发酵及工艺化生产提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
威宁豆酱酱曲样品:威宁地区;威宁豆酱成品:威宁地区农户自酿。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L,pH自然,121℃灭菌20 min。
LB培养基:胰蛋白胨10 g,酵母浸粉 5 g,NaCl 10 g,蒸馏水1 L,pH 7.0,121℃灭菌20 min。
马丁氏培养基:葡萄糖10 g,蛋白胨5 g,KH2PO4 1 g,MgSO4·7H2O 0.5 g,1/3 000孟加拉红溶液100 mL,琼脂15 g,蒸馏水800 mL,pH自然,121℃灭菌20 min,临用前加入0.03%链霉素稀释液100 mL。
1.1.3 试剂
Mix、载体pMD 18-T、Hind III限制性核酸内切酶(15 U/μL)、EcoR I限制性核酸内切酶(15 U/μL):宝日医生物技术(北京)有限公司。
1.2 仪器与设备
GZX-GF101-3-BS-II电热鼓风恒温干燥箱、DNP-9082电热恒温培养箱:上海精宏实验设备有限公司;GR 60 DA高压灭菌锅:致微(厦门)仪器有限公司;BX 53显微镜:日本Olympus公司;MB90水分测定仪:奥豪斯仪器(常州)有限公司;VITEK2 Compact全自动微生物鉴定系统:梅里埃诊断产品(上海)有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪、Universial Hood Ⅱ凝胶成像系统:美国Bio-Rad公司。
1.3 实验方法
1.3.1 菌株的分离纯化
称取5 g样品于45 mL无菌生理盐水中,室温、180 r/min条件下振荡培养30 min,悬液用无菌生理盐水以10倍梯度稀释至10-8,取稀释度为10-5、10-6、10-7的稀释液100 μL分别涂布于PDA培养基、马丁氏培养基和LB培养基,将涂布好的PDA、马丁氏培养基置于28℃培养箱中倒置培养36 h,LB培养基置于37℃培养箱中倒置培养18 h,观察生长情况。挑取菌落形态不同的菌株纯化3次,将纯化后的菌种4℃保存备用。
1.3.2 威宁豆酱发酵工艺流程及操作要点
选豆→烘焙→磨豆→接种→主(前)发酵→加入辅料→后发酵→豆酱
操作要点:将黄豆在140℃条件下烘焙1.5 h,磨成细粉状,通过60目筛,称取50 g黄豆粉于500 mL锥形瓶中,121℃灭菌20 min,将前期分离纯化的菌株分别制成菌悬液(1×107 CFU/mL),以1%(V/V)的接种量接种于黄豆粉中,再以黄豆粉∶水=5∶4(g∶mL)的料水比加入无菌水,搅拌均匀。接种真菌的物料置于28℃发酵15 d,接种细菌的物料置于37℃发酵15 d。前发酵好的物料中加入辅料(辣椒粉、五香粉、食盐),再以物料∶水=5∶3(g∶mL)加入无菌水,搅拌均匀,接种真菌的物料置于28℃、接种细菌的物料置于37℃各发酵3个月。
1.3.3 感官评价和主酵菌株筛选
采用10人品尝小组综合计分,参照国标GB/T 24399—2009《黄豆酱》对豆酱的色泽、气味、滋味、体态进行感官评分,总分以100分记,具体评分标准见表1。以得分值较高者作为主酵菌株。采用主酵菌株发酵制备威宁豆酱,并与威宁豆酱成品风味对比。
表1 威宁豆酱的感官评分标准
Table 1 Sensory evaluation standards of Weining soybean paste

指标 评分标准 分值/分色泽气味滋味体态褐色、有光泽红褐色、有光泽褐色、无光泽红褐色、无光泽酱香浓郁、酯香浓郁、无不良气味有酱香、有酯香、无不良气味有酱香、有不良气味酱香淡、有不良气味鲜味突出、咸淡适宜、无异味有酱鲜味、咸淡适宜、无异味有鲜味、无异味有酸、苦、涩、焦糊及其他异味黏稠适度、质地均匀黏稠适度偏稀或偏干偏稀或偏干20~18 17~15 15~11 10~0 30~27 26~23 22~19 18~0 40~36 35~31 30~26 25~0 10~9 8~7 6~5 5~0
1.3.4 菌株鉴定
形态学鉴定:将筛选出的主酵菌株分别划线接种于LB或PDA培养基上,细菌37℃培养12 h,真菌28℃培养36 h,观察菌株菌落形态。细菌进行革兰氏染色、真菌进行美兰染色,观察细胞形态。然后参照《真菌鉴定手册》[14]和《伯杰氏细菌手册》[15]进行初步鉴定。
分子生物学鉴定[16-17]:提取主酵菌株的基因组,然后采用通用引物(见表2)进行聚合酶链式反应(PCR)扩增,PCR扩增体系:DNA模板2μL,上游引物0.5μL,下游引物0.5μL,2×Mix 10μL,双蒸水(ddH2O)7μL,共20μL。PCR扩增程序:95℃预变性8 min;95℃变性30 s,55℃退火1 min,72℃延伸40 s,30个循环;72℃再延伸8 min。反应结束后PCR扩增产物经1.0%琼脂糖凝胶电泳分离后在凝胶成像系统上观察分析。
PCR扩增产物分别与pMD 18-T载体连接,导入DH5a感受态细胞,提取重组质粒,酶切验证后送至上海生工生物工程技术服务有限公司进行测序。测序结果在美国国立生物技术信息中心(nationalcenter for biotechnology information,NCBI)的Genbank数据库中进行Blast比对,选取同源性高的模式菌株,采用MEGA 5软件中的邻接(neighbor joining,NJ)法构建系统发育树。
表2 通用引物序列
Table 2 Sequences of universal primer

产物引物名称引物序列(5'-3')ITS 16S rDNA ITS1 ITS4 27F 1492R TCCGTAGGTGAACCTGCGG TCCTCCGCTTATTGATATGC AGAGTTTGATCCTGGCTCAG GGTTACCTTGTTACGACTT
VITEK 2全自动微生物鉴定系统鉴定:将筛选出的主酵菌株纯化后,制成菌悬液备用。选择相应鉴定卡,按照操作说明用VITEK 2 Compact全自动微生物分析系统进行分析。
1.3.5 主酵菌株生长曲线的绘制
将筛选出的主酵菌株按1%接种量接入LB或PDA液体培养基中进行培养,每隔2 h取样,测定培养液的OD600nm值。以培养时间(x)为横坐标,OD600 nm值(y)为纵坐标,绘制主酵菌株的生长曲线。
1.3.6 主酵菌株发酵豆酱理化指标的测定
氨基酸态氮含量:参照国标GB/T 24399—2009《黄豆酱》进行测定;总酸含量:参照国标GB/T 12456—2008《食品中总酸的测定》中的酸碱滴定法进行测定;水分含量:参照国标GB 5009.3—2016《食品安全国家标准食品中水分的测定》中直接干燥法进行测定。
2 结果与分析
2.1 菌株的分离纯化
从威宁地区采集的豆酱样品中共分离纯化出10株真菌(DZ-1~DZ-10)和22株细菌(DX-1~DX-22),将分离的菌株纯化后,4℃保存备用。
2.2 主酵菌株的筛选
分别采用分离到的10株真菌和22株细菌进行纯种发酵制备豆酱,参照评分标准对其进行感官评价,结果见表3和表4。由表3可知,22株细菌中,细菌DX-9发酵的豆酱综合评分最高,为94分。由表4可知,10株真菌中,真菌DZ-3发酵的豆酱综合评分最高,为90分。且2株菌发酵豆酱风味与威宁豆酱成品风味相似,对威宁豆酱发酵过程中滋味和气味的贡献较大。因此,确定菌株DX-9和菌株DZ-3为主要发酵菌株。
表3 细菌发酵豆酱的感官评价
Table 3 Sensory evaluation of soybean paste fermented by bacterium
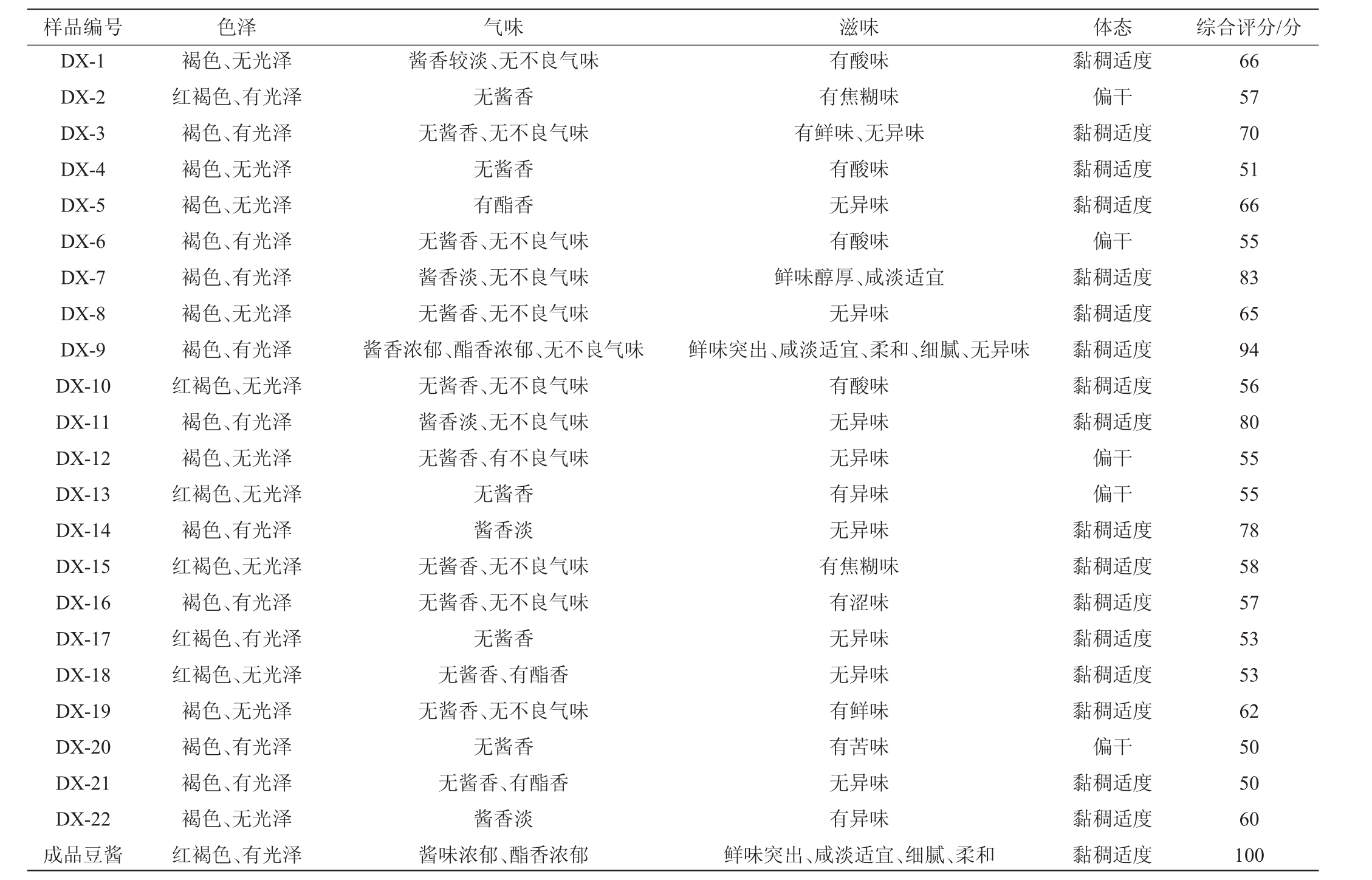
样品编号 色泽 气味 滋味 体态 综合评分/分DX-1 DX-2 DX-3 DX-4 DX-5 DX-6 DX-7 DX-8 DX-9 DX-10 DX-11 DX-12 DX-13 DX-14 DX-15 DX-16 DX-17 DX-18 DX-19 DX-20 DX-21 DX-22成品豆酱褐色、无光泽红褐色、有光泽褐色、有光泽褐色、无光泽褐色、无光泽褐色、有光泽褐色、有光泽褐色、无光泽褐色、有光泽红褐色、无光泽褐色、有光泽褐色、无光泽红褐色、无光泽褐色、有光泽红褐色、无光泽褐色、有光泽红褐色、有光泽红褐色、无光泽褐色、无光泽褐色、有光泽褐色、有光泽褐色、无光泽红褐色、有光泽酱香较淡、无不良气味无酱香无酱香、无不良气味无酱香有酯香无酱香、无不良气味酱香淡、无不良气味无酱香、无不良气味酱香浓郁、酯香浓郁、无不良气味无酱香、无不良气味酱香淡、无不良气味无酱香、有不良气味无酱香酱香淡无酱香、无不良气味无酱香、无不良气味无酱香无酱香、有酯香无酱香、无不良气味无酱香无酱香、有酯香酱香淡酱味浓郁、酯香浓郁有酸味有焦糊味有鲜味、无异味有酸味无异味有酸味鲜味醇厚、咸淡适宜无异味鲜味突出、咸淡适宜、柔和、细腻、无异味有酸味无异味无异味有异味无异味有焦糊味有涩味无异味无异味有鲜味有苦味无异味有异味鲜味突出、咸淡适宜、细腻、柔和黏稠适度偏干黏稠适度黏稠适度黏稠适度偏干黏稠适度黏稠适度黏稠适度黏稠适度黏稠适度偏干偏干黏稠适度黏稠适度黏稠适度黏稠适度黏稠适度黏稠适度偏干黏稠适度黏稠适度黏稠适度66 57 70 51 66 55 83 65 94 56 80 55 55 78 58 57 53 53 62 50 50 60 100
表4 真菌发酵豆酱的感官评价
Table 4 Sensory evaluation of soybean paste fermented by fungus

样品编号 色泽 气味 滋味 体态 综合评分/分DZ-1 DZ-2 DZ-3 DZ-4 DZ-5 DZ-6 DZ-7 DZ-8 DZ-9 DZ-10褐色、无光泽褐色、有光泽褐色、有光泽红褐色、无光泽褐色、无光泽褐色、有光泽褐色、有光泽褐色、无光泽红褐色、有光泽红褐色、有光泽无酱香、无不良气味酱香浓郁、酯香浓郁酱香浓郁、酯香浓郁无酱香、无不良气味酱香淡、无不良气味有酱香、无不良气味无酱香、有不良气味无酱香、无不良气味无酱香、无不良气味无酱香、无不良气味无异味无异味鲜味突出、柔和、细腻、无异味有糊味无异味无异味有酸味无异味无异味有酸味黏稠适度黏稠适度黏稠适度偏干黏稠适度黏稠适度黏稠适度黏稠适度黏稠适度黏稠适度53 83 90 52 63 77 49 50 53 50
2.3 菌株的鉴定
2.3.1 形态学观察
对主酵菌株DZ-3和DX-9进行形态观察,结果分别见图1、图2。由图1可知,菌株DZ-3的菌落呈乳白色、菌落表面光滑、有光泽、边缘整齐,细胞呈椭圆形。由图2可知,菌株DX-9的菌落呈白色、无光泽、表面褶皱、边缘不整齐,细胞呈杆状,为革兰氏阳性菌。因此,参照《真菌鉴定手册》[14]和《伯杰氏细菌手册》[15]初步判定菌株DZ-3属于酵母属,菌株DX-9属于芽孢杆菌属。

图1 菌株DZ-3的菌落形态(a)和细胞形态(b)
Fig.1 Colony morphology(a)and cell morphology(b)of strain DZ-3
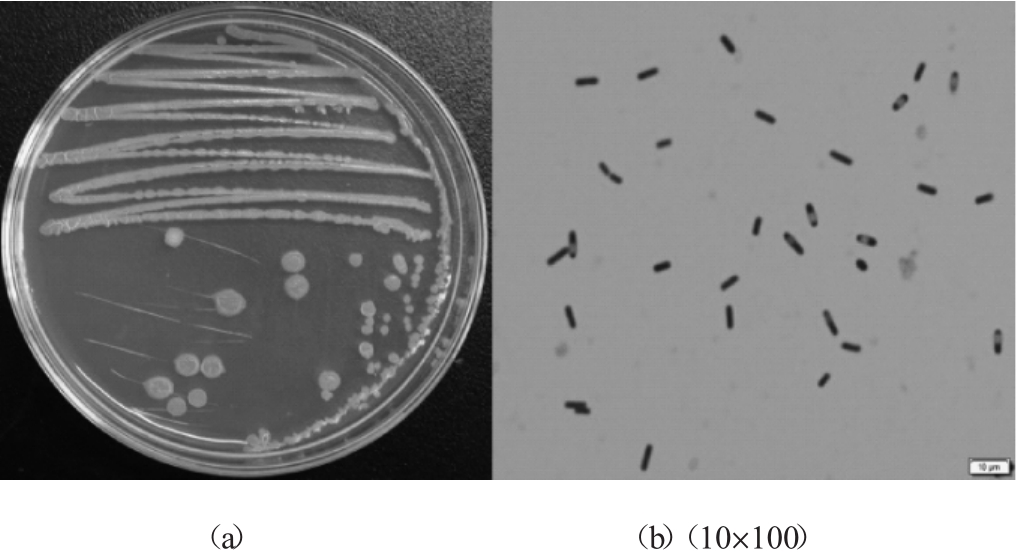
图2 菌株DX-9的菌落形态(a)和细胞形态(b)
Fig.2 Colony morphology(a)and cell morphology(b)of strain DX-9
2.3.2 分子生物学鉴定
菌株DZ-3和DX-9的PCR扩增产物见图3。由图3可知,菌株DX-3的ITS PCR扩增产物碱基长度为610 bp左右,菌株DX-9的16SrDNAPCR扩增产物碱基长度为1 410 bp左右,均与预期片段大小一致。PCR扩增产物与载体pMD18-T连接后,送去测序。
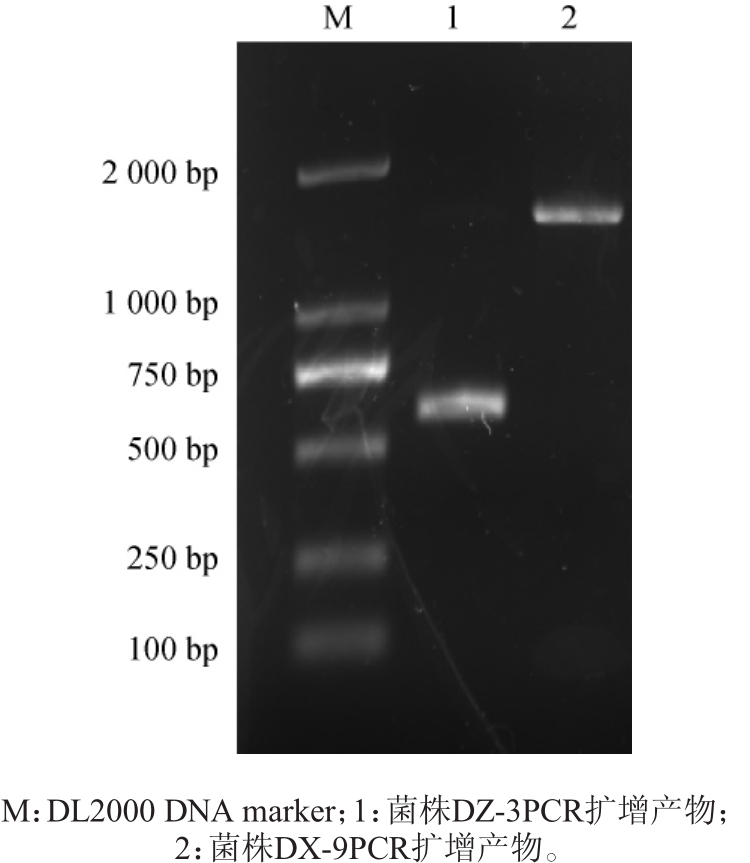
图3 菌株DZ-3和DX-9 PCR扩增产物的琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of PCR amplified products of strain DZ-3 and DX-9
测序结果在NCBI的Genbank数据库中进行比对,选取同源性较高的序列构建系统发育树,结果见图4和图5。由图4可知,菌株DZ-3与异常威克汉姆(Wickerhamomycesanoma lus anomalus)CBS:1978聚于一支,亲缘关系最近,因此,初步判定菌株DZ-3为异常威克汉姆(Wickerhamomyces anomalus)。由图5可知,菌株DX-9与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近,因此,初步判定菌株DX-9为枯草芽孢杆菌(Bacillus subtilis)。

图4 基于ITS序列分析菌株DZ-3的系统发育树
Fig.4 Phylogenetic tree of strain DZ-3 based on ITS sequences analysis

图5 基于16S rDNA序列分析菌株DX-9的系统发育树
Fig.5 Phylogenetic tree of strain DX-9 based on 16S rDNA sequences analysis
2.3.3 VITEK 2全自动微生物鉴定系统鉴定
通过VITEK 2全自动微生物鉴定系统对菌株DZ-3和DX-9进行鉴定,结果表明,鉴定菌株DZ-3为异常威克汉姆酵母(Wickerhamomyces anomalus),菌株DX-9为枯草芽孢杆菌(Bacillus subtilis),结果与分子生物学鉴定结果一致。
酵母菌在豆酱发酵过程中发酵糖类产生小分子醛、酸、酯等物质,增加酱的风味[18-21]。枯草芽孢杆菌也是豆酱发酵过程中的主要优势菌株[22-23],与豆酱滋味的形成密切相关。
2.4 主酵菌株的生长曲线
菌株DZ-3及菌株DX-9的生长曲线见图6。由图6可知,菌株DZ-3的迟滞期为0~4 h,对数生长期为6~28 h,28 h后进入稳定期,32 h后开始进入衰亡期。菌株DX-9的迟滞期为0~4 h,对数生长期为4~18 h,18 h后进入稳定期,26 h后进入衰亡期。生长曲线的测定为两种菌的培养时间和豆酱发酵过程中的接种量提供参考依据。

图6 菌株DZ-3(A)及菌株DX-9(B)的生长曲线Fig.6 Growth curve of strain DZ-3(A)and DX-9(B)
2.5 纯种发酵豆酱理化指标的测定
氨基酸态氮是调味品中主要的增味物质,也是发酵产品发酵程度的特性指标,氨基酸态氮含量越高,氨基酸含量越高,营养成分也越高[24-25]。豆酱中的总酸高低也会直接影响豆酱风味、色泽、稳定性和品质的高低。
采用筛选获得的主酵菌株DZ-3和DX-9分别纯种发酵制备威宁豆酱,对豆酱的理化指标进行测定,并与威宁豆酱成品理化指标结果进行比较,结果见表5。
表5 菌株DZ-3和菌株DX-9发酵豆酱理化指标测定结果
Table 5 Determination results of physicochemical index of soybean paste fermented by strain DZ-3 and DX-9

样品编号 总酸含量/(g·100 g-1)氨基酸态氮含量/(g·100 g-1)水分含量/%菌株DX-3发酵豆酱菌株DZ-9发酵豆酱威宁豆酱1.53 1.96 1.85 0.64 0.96 1.02 55 59 52
由表5可知,菌株DZ-3发酵的豆酱的总酸、氨基酸态氮、水分含量分别为1.53 g/100 g、0.64 g/100 g、55%。菌株DX-9发酵的豆酱的总酸、氨基酸态氮、水分含量分别为1.96 g/100 g、0.96 g/100 g、59%。威宁豆酱的总酸、氨基酸态氮、水分含量分别为1.85 g/100 g、1.02 g/100 g、52%。结果表明,两种菌发酵豆酱的总酸、氨基酸态氮、水分含量均达到国家标准GB/T 24399—2009《黄豆酱》的要求。菌株DX-9发酵豆酱的总酸、氨基酸态氮含量和水分含量比菌株DZ-3发酵的豆酱分别高0.46 g/100 g、0.32 g/100 g和4%,且菌株DZ-3和DX-9纯种发酵的豆酱氨基酸态氮含量均比威宁豆酱成品低,但菌株DX-9纯种发酵的豆酱仅比威宁豆酱成品低0.06 g/100 g。综合来看,菌株DX-9在威宁豆酱的发酵过程中发酵能力比菌株DZ-3强。
3 结论
本研究从威宁地区采集的酱曲样品中初步分离得到22株细菌和10株真菌。采用分离菌株进行纯种发酵制备豆酱,并进行感官评价。结果表明,细菌中,菌株DX-9发酵豆酱的感官评分最高,为94分;真菌中,菌株DZ-3发酵豆酱的感官评分最高,为90分,且均与传统威宁豆酱风味相似。因此,确定这两株菌为主酵菌株。通过形态观察、分子生物学技术及VITEK 2全自动微生物鉴定系统对主酵菌株进行鉴定。结果表明,菌株DX-9为枯草芽孢杆菌(Bacillus subtilis),菌株DZ-3为异常威克汉姆酵母(Wickerhamomyces anomalus)。对菌株DX-9及DZ-3纯种发酵豆酱的理化指标进行测定,结果表明,菌株DX-9发酵豆酱的氨基酸态含量为0.96 g/100 g、总酸含量为1.96 g/100 g、水分含量为59%;菌株DZ-3发酵豆酱的氨基酸态含量为0.64 g/100 g、总酸含量为1.53 g/100 g、水分含量为55%,均达到国家相关标准要求,且菌株DX-9发酵豆酱优于菌株DZ-3。
[1]魏艳丽,鲁绯.中国传统发酵酱的演变[J].中国酿造,2019,38(2):7-10.
[2]贡汉坤.传统豆酱自然发酵的动态分析及人工接种多菌种发酵研究[D].无锡:江南大学,2004.
[3]武俊瑞,王晓蕊,唐筱扬,等.辽宁传统发酵豆酱中乳酸菌及酵母菌分离鉴定[J].食品科学,2015,36(9):78-83.
[4]JUNG K O,PARK S Y,PARK K Y.Longer aging time increases the anticancer and antimetastatic properties of Doenjang[J].Nutrition,2006,22(5):539-545.
[5]ZHAO J,DAI X,LIU X,et al.Changes in microbial community during Chinese traditional soybean paste fermentation[J].Int J Food Sci Tech,2010,44(12):2526-2530.
[6]KWON D Y,HONG S M,AHN I S,et al.Isoflavonoids and peptides from meju,long-term fermented soybeans,increase insulin sensitivity and exert insulinotropic effects in vitro[J].Nutrition,2011,27(2):244-252.
[7]AMARAL C,TOLOIM R T,VASCONCELOS L D,et al.The role of soybean extracts and isoflavones in hormone-dependent breast cancer:aromatase activity and biological effects[J].Food Funct,2017,8(9):3064-3074.
[8]张巧云,孟祥晨.几种发酵豆酱的微生物组成及理化性质分析[J].食品科技,2013,38(8):266-271.
[9]高秀芝,易欣欣,刘慧,等.东北传统豆酱发酵过程中微生物的多样性[J].生物技术通报,2016,32(4):251-255.
[10]樊敏,胡萍,陈仕梯,等.贵州大方豆酱中优势细菌种群分析与分离鉴定[J].中国酿造,2016,35(12):25-30.
[11]张颖,乌日娜,孙慧君,等.豆酱不同发酵阶段细菌群落多样性及动态变化分析[J].食品科学,2017,38(14):30-35.
[12]KIM T W,LEE J H,KIM S E,et al.Analysis of microbial communities in doenjang,a Korean fermented soybean paste,using nested PCR-denaturing gradient gel electrophoresis[J].Int J Food Microbiol,2009,131(2-3):265-271.
[13]NAM Y D,LEE S Y,LIM S I.Microbial community analysis of Korean soybean pastesby next-generation sequencing[J].Int J Food Microbiol,2012,155(1-2):36-42.
[14]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:102-105.
[15]RE布坎南,NE吉布斯.伯杰氏细菌手册[M].北京:科学出版社,1994:241-287.
[16]程昌泽,吴拥军,龙菊,等.腐乳毛霉高产蛋白酶菌株的分离与鉴定[J].山地农业生物学报,2008(2):127-133.
[17]贾东旭,吴拥军,李耀中,等.细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J].食品科学,2009,30(5):217-221.
[18]柴洋洋,葛菁萍,宋刚,等.传统发酵豆酱中酵母菌的分离、筛选及功能酵母的鉴定[J].中国食品学报,2013,13(3):183-188.
[19]王新,白琴琴,金清.朝鲜族传统大酱中酵母菌的分离及其产酶特性分析[J].食品工业,2015,36(5):166-169.
[20]SUN X,LYU G,LUAN Y,et al.Analyses of microbial community of naturally homemade soybean pastes in Liaoning province of China by Illumina Miseq Sequencing[J].Food Res Int,2018,111(9):50-57.
[21]KIM T W,LEE J H,PARK M H,et al.Analysis of bacterial and fungal communities in Japanese-and Chinese-fermented soybean pastes using nested PCR-DGGE[J].Curr Microbiol,2010,60(5):315-320.
[22]唐筱扬.自然发酵豆酱酱醅微生物多样性分析[D].沈阳:沈阳农业大学,2017.
[23]JEOON A R,LEE J H,MAH J H.Biogenic amine formation and bacterial contribution in Cheonggukjang,a Korean traditional fermented soybean food[J].LWT-Food Sci Technol,2018,92(6):282-289.
[24]黎瑞珍,符素芳,苏小妹,等.儿童酱油中氨基酸态氮含量的测定[J].食品安全导刊,2018(27):120-121.
[25]CHEN Z Y,FENG Y Z,CUIC,et al.Effects of kojimaking with mixed strains on physicochemical and sensory properties of Chinese-type soy sauce[J].J Sci Food Agr,2015,95(10):2145-2154.