吡咯喹啉醌(pyrroloquinoline quinine,PQQ)是继吡啶核苷酸和黄素核苷酸之后,在许多细菌脱氢酶中发现的第3种氧化还原酶的辅酶。PQQ可作为细菌脱氢酶(醇脱氢酶、醛脱氢酶、D-葡萄糖脱氢酶以及甲氨脱氢酶等)的辅因子,是一种高度可溶及热稳定的化合物,能促进革兰氏阴性菌周质中醇类和糖类的氧化。X-射线对PQQ结构进行解析显示[1],该辅因子3个羧基和2个相邻醛基的醌类结构,喹啉环C4和C5位置上的醌在发生氧化还原反应时,可以被还原为酚,吡咯喹啉醌分子结构及3D立体结构如下:
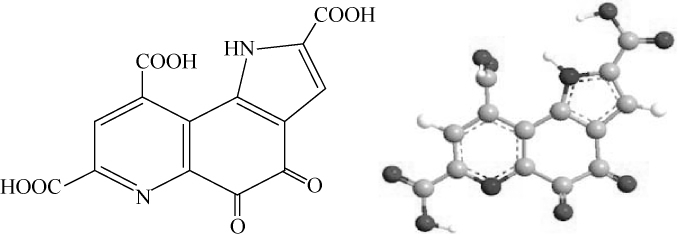
PQQ广泛存在于革兰氏阴性菌及动植物体内,可以影响生物体的生理生化过程。研究表明,PQQ具有以下作用:(1)刺激微生物、人体细胞生长和植物发育[2-3];(2)作为动物体的生长因子[4-7];(3)防治肝损伤[8];(4)清除自由基,保护机体[9-10];(5)促进神经生长因子产生[11-12];(6)信号转导的调节与脱氧核糖核酸(deoxyribonucleic acid,DNA)修复功能[13-17];(7)生物电化学中的应用[18-19]。由此可见,PQQ在医药、化妆品、保健品、环境和食品领域具有广泛的应用潜力,需求空间巨大。因此,大规模制备PQQ具有重要意义。据新思界产业研究中心统计,2014~2016年期间,中国PQQ产量呈逐年缓慢递增趋势。2014年产量为1 540.3 kg,2016年的产量为2 056.5 kg,价格超过5万元/kg[20]。
随着医药、食品、农业等行业的发展及人们对PQQ认识程度的加深,PQQ产品的市场需求量将增加。另外,由于技术的进步,其应用范围也将扩大,进一步促使PQQ产品的市场需求量增加。目前,全球市场需求100多吨,主要供应商是日本的三菱瓦斯化学。我国有部分企业做植物提取,但是PQQ提取纯化难度非常高,而化学合成则程序繁杂、污染严重、产率低、对环境易造成污染,应用于药物或食品添加剂成本高,不适于推广。相比之下,生物法合成PQQ具有反应条件温和、合成过程易于控制、对环境无污染等优点,是未来工业化生产PQQ的发展方向。氧化葡萄糖酸杆菌(Gluconobacter oxydans)为革兰氏阴性菌,广泛存在于自然界中,该菌含有大量膜结合脱氢酶,并与呼吸链耦合作用,氧化有机物和醇类作为PQQ的生产菌,因此在工业上很适合作为研究的模式菌株。本文对氧化葡萄糖酸杆菌生物合成PQQ过程中涉及的遗传背景、分子机制以及代谢途径进行综述,并对未来研究重点进行展望,为工业化生产PQQ做铺垫。
1 自然界PQQ的分布
自从发现PQQ以来,它在自然界的分布引起了研究者的关注。PQQ几乎存在于所有的食品中,人体内脏、睾丸和体液中都存在PQQ,脾脏含量最高,达到5.9 ng/g,母乳中PQQ及其衍生物总含量高达140~180 ng/mL,比一般食物含量多几十倍,但目前还无法证实高等生物能自身合成PQQ[21]。自然界中一些革兰氏阴性菌具有合成PQQ的能力,研究发现,在不同的革兰氏阴性菌中PQQ合成量有所不同,有些细菌,如恶臭假单胞菌(Pseudomonas putida),仅满足自身的生理代谢需求[22];有些细菌却能大量合成PQQ并分泌到胞外。迄今发现的野生菌包括:甲烷单胞菌属(Methanomonas)、交替单胞菌属(Alteromonas)、黄色杆菌属(Xanthobacter)、不动杆菌属(Acinetobacter)、甲基杆菌属(Methylobacterium)、醋杆菌属(Acinetobacter)、葡萄糖杆菌属(Gluconobacter)、硫杆菌属(Thiobacillus)、枝动菌属(Mycoplana)、弯杆菌属(Ancylobacter)、嗜甲基菌属(Methylophilus)、生丝微菌属(Hyphomicrobium)、精朊杆菌属(Protaminobacter)等[23]。在这些微生物中,PQQ作为葡萄糖脱氢酶和乙醇脱氢酶的辅基,在底物与电子受体之间参与呼吸链电子传递作用,如氧化葡萄糖酸杆菌(Gluconobacter oxydans)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、绿脓假单胞菌(Pseudomonas aeruginosa)、乙酸不动杆菌(Acinetobacter calcoaceticus)、扭脱甲基杆菌(Methylobacterium extorquens)、嗜有机甲基杆菌(Methylobacteriumo organophilum)、鞭毛甲基菌(Methyldbacteriu fagellatum)、耐辐射球菌(Deinococuus radiodurans)等[24]。另外,自然界中还存在一些细菌,仅能合成醌蛋白酶类,而不合成PQQ,如大肠杆菌(Escherichia coli),醌酶只有结合PQQ后才具有活性。由此可见,微生物具有合成PQQ的应用条件,而如何开发构建高效PQQ生物合成的微生物是当前研究者需要重点解决的问题。
2 氧化葡萄糖酸杆菌中PQQ的相关研究
2.1 PQQ生物合成相关基因
PQQ合成途径的研究已有二十余年,期间已对多种微生物的PQQ合成途径进行了基因簇标记,发现不同的微生物间存在一定的差异,如Klebsiella pneumonia中PQQ基因簇为pqq ABCDEF;Pseudomonas aeruginosa中pqq ABCDE与pqq F相互分离;Methylobacterium extorquens AM1含有pqq ABC/DE操纵子,其中pqq C与pqq D为嵌套基因,另外pqq FG与其他基因独立成操纵子;Acinetobactercalcoaceticus中仅有pqq ABCDE基因簇,而不含有pqq F基因等,PPQ生产菌及其基因簇排列情况具体见表1。
表1 吡咯喹啉醌生产菌及其基因簇排列情况[22]
Table 1 Pyrroloquinoline quinone production strain and its genes cluster arrangement

PQQ生产菌 合成基因簇皮氏罗尔斯顿菌(Ralstonia pickettii)鲍氏不动杆菌(Acinetobacter baumannii)肺炎克雷伯菌(Klebsiella pneumonia)氧化葡萄糖酸杆菌(Gluconobacter oxydans)醋酸钙不动杆菌(Acinetobacter calcoaceticus)恶臭假单胞菌(Pseudomonas putida)台湾贪铜菌(Cupriavidus taiwanensis)塔斯马尼亚欧文氏菌(Erwinia tasmaniensis)洋葱伯克霍尔德菌(Burkholderia cenocepacia)甲基扭脱杆菌(Methylobacterium extorquens)pqq A、pqq D与pqq ABCD pqq E与pqq ABCD pqq ABCDEF pqq ABCDE pqq ABCDE pqq F与pqq ABCDE pqq A、pqq B2、pqq D2E2与pqq ABCD pqq F与pqq BCDE pqq E与pqq ABCD pqq ABCDE与pqq FG
2005年,PRUST C等[25]对氧化葡萄糖酸杆菌G.oxydans 621H基因组进行测序,发现其PQQ主要是由pqq ABCDE基因簇所编码,HOLSCHER T等[26]通过荧光定量聚合酶链式反应(polymerase chain reaction,PCR)证实了pqq A的启动子为整个基因簇唯一的启动子。不同菌种pqq A基因编码氨基酸肽链有所不同,一般为23~29个氨基酸残基,如K.pneumoniae中为23个氨基酸组成;M.extorquens含有29个氨基酸;G.oxydans中包含27个氨基酸。即便如此,pqq A编码的短肽链结果仍比较保守,其中谷氨酸Glu和酪氨酸Tyr为两种保守残基氨基酸,结构为Glu-X-X-X-Tyr(X为任意氨基酸)[27]。另外,在A.calcoaceticus中,pqq A基因保守序列的定点突变,以及K.pneumoniae中pqq A基因的移码突变都能终止PQQ的合成,进一步证实pqq A基因中包含PQQ合成的骨架序列。pqq B基因编码一个300个左右氨基酸的蛋白,对其序列分析发现,该蛋白为锌指结构蛋白,属于金属-β-内酰胺酶类,且与磷酸二酯酶Phnp同源性最高。在PqqB蛋白活性中心与锌指结构之间还有一段甘氨酸序列,且包含一个常见于非血红素铁蛋白结构。研究表明,pqq B基因编码蛋白与Tyr的氧化[28]及PQQ的分泌[29]相关,但PqqB蛋白无疏水结构,不属于膜蛋白,因此,PqqB蛋白可能是间接参与PQQ转运。缺失PqqC蛋白的突变体中无法检测到PQQ,而体外实验表明,在在缺失PqqC蛋白的突变体无细胞体系中加入单独表达的PqqC,温育后则能检测到PQQ,说明pqq C基因编码的蛋白主要负责催化最后一步反应,形成PQQ[30]。经序列比对发现,PqqE蛋白与S-腺苷甲硫氨酸酶家族的蛋白具有较高的同源性,由此推测PqqE蛋白为Glu和Tyr形成C-C键提供活性能量,这也是PQQ合成的第一步反应,在此过程中,还需要PqqD蛋白参与激活PqqE的活性位点。在G.oxydans 621H中不含有pqq F基因,而在其远下游端有一基因GOX1104,其与E.coli的tldD基因有很大同源性[26]。将GOX1104基因敲除后发现,宿主的生长非常缓慢,并且不能在以甘露醇为碳源的培养基上生长,同时,PQQ的合成受到抑制。通过GOX1104回补实验确定,其与PQQ的生物合成相关。在G.oxydans中PQQ合成基因簇如图1所示。
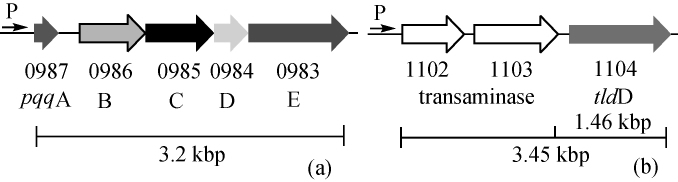
图1 氧化葡萄糖酸杆菌621H中pqq ABCDE基因簇(a)及GOX1104基因簇(b)
Fig.1 Gene cluster of pqq ABCDE(a)and GOX1104(b)in Gluconobacter oxydans 621H
2.2 PQQ生物合成途径
研究人员虽已发现G.oxydans基因组中PQQ合成有关的基因簇,然而,PQQ整个生物合成途径及代谢调控机制仍不清楚。KLEEF M A等[27,31]在培养PQQ生产菌的过程中,利用13C同位素标记,对培养基的碳源进行跟踪,并结合核磁共振进行分析,结果发现谷氨酸(Glu)和酪氨酸(Tyr)是合成PQQ的重要氨基酸,这与PqqA的保守肽段相符合,并在此基础上提出了PQQ合成途径,如图2所示。

图2 谷氨酸和酪氨酸合成吡咯喹啉醌途径
Fig.2 Pyrroloquinoline quinone synthesis pathway from glutamic acid and tyrosine
2004年,MAGNUSSON O T等[32]在大肠杆菌中表达来自K.pneumoniae的pqq C基因,并经过蛋白结晶、X-衍射确认PqqC的空间结构及反应活性位点。在体外催化反应中发现,PQQ合成途径的最后一步由PqqC蛋白酶负责完成,如pqq C基因功能缺失将无法合成PQQ,且有一中间代谢物质累积。该中间产物再经过PqqC的氧化作用,在其结构的不同位置脱去8个氢而最终又可以合成PQQ。2008年,PUEHRINGER S等[33]利用氨基酸序列及蛋白质同源建模,分析各参与PQQ合成相关酶的催化功能并提出其合成代谢途径。首先以pqq A基因产物为前体,在PqqE作用下,将前体肽链的谷氨酸和酪氨酸相连;然后在PqqF蛋白酶的催化作用下切除多余的肽链;再经过脱水环化和加氧羰基化,随后在PqqC蛋白酶作用之下,经过多步加水和脱氢反应形成PQQ。
蛋白质家族和生物合成途径的结构表征,阐明PQQ生物合成的演变,对于其他天然产品及其生物合成所需的途径是有意义的。确定每一个基因在PQQ生物合成途径的作用,也可能有助于了解某些蛋白质家族中肽构象改变形成的天然生物活性产物。
2.3 氧化葡萄糖酸杆菌生物合成PQQ潜在优势
氧化葡萄糖酸杆菌(Gluconobacter oxydans)是一类椭圆形或杆状的革兰氏阴性细菌,相比于其他细菌,G.oxydans细胞膜上存在大量的脱氢酶,能将多元醇不完全氧化为醛或酮,这吸引了众多研究者研究其生物化学及分子生物学性质。
据研究显示,G.oxydans有32个膜结合的脱氢酶,其中的11个已经非常清楚,剩余的21个脱氢酶功能还不是很明确,特别是底物特异性方面[25]。在这些脱氢酶中,大部分为依赖于辅酶PQQ作为配基,部分依赖于黄素核苷酸。PQQ是一种高度可溶和热稳定的化合物,作为辅基与蛋白非共价结合,促使细菌周质中糖和醇的氧化,过程中担负着传递电子、质子和化学基团的功能。2014年,GAO L L等[34]在G.oxydans WSH-003中融合表达PQQ合成基因簇及途径关键基因,使得2-酮基-L-古龙酸的产量达32.4 g/L;YUAN J F等[35]在G.oxydans DSM2343中过表达PQQ基因簇,使得PQQ水平提升3.8倍。可见,PQQ是G.oxydans的关键因子,可以影响目标产物的生成,而最主要的是PQQ直接影响宿主菌的生长。据报道[26],如缺失PQQ合成基因,G.oxydans将无法在D-甘露醇、D-葡萄糖及甘油为唯一碳源的培养基上生长。
由此可见,PQQ对G.oxydans有重要的生理意义。另外,G.oxyadan膜结合蛋白酶的催化活性中心面向于周质外,有着非常高的氧化速率和氧化产率,不需要氧化底物运送到细胞内部,就可以将大量的氧化产物释放到培养基中。而PQQ是在细胞内合成,并转运到胞外产生功能的物质,所以认为,氧化葡萄糖酸杆菌的这种生理特性表明其具有超越其他合成PQQ微生物的优势,具有进一步开发生产PQQ的潜力。因此,若能够利用基因工程技术使其构建成基因工程菌,就能够提高其生物量和酶活力,从而以提高经济效益。
3 影响氧化葡萄糖酸杆菌中PQQ合成的因素
3.1 基因表达调控
在氧化葡萄糖酸G.oxydans中,pqq ABCDE基因簇对PQQ生物合成进行调控,所有基因共用一个启动子,即受pqq A基因的启动子所调控。因此,PQQ合成的所有基因表达的比例必须适当,另外,pqq A基因末端还有抑制转录的发卡结构,可以调控之后的基因的表达[25]。此外,在pqq ABCDE基因簇之间也存在相互的促进或抑制作用,对PQQ的合成也有重要的调控作用。如孙继国[36]利用不同启动子在大肠杆菌及肺炎克雷伯氏菌中表达PQQ基因簇,在优化培养基的条件下,PQQ产量为1 700 nmol/L。
其次,基因的拷贝数对PQQ合成量影响很大,利用高拷贝质粒表达PQQ基因时,几乎没有PQQ的合成[35],相反地,利用低拷贝质粒时却有大量PQQ合成并被分泌至培养基中。另外,PQQ的酶蛋白表达量对PQQ合成也存在一定的影响[36],当酶蛋白没有合成时,PQQ无法合成,但酶蛋白量与PQQ的合成并不是正相关的关系,当提高酶蛋白的合成量时,PQQ合成量并没有明显的增加[34]。
3.2 培养基
据氧化葡糖杆菌的生长特征,其培养基中最基本的碳、氮源、无机盐、生长因子、水、溶氧、pH等的种类及其含量对PQQ合成会有影响。司振军[23]利用等离子诱变,结合Plackett-Burman法优化培养基,Methylobacillus sp.ZJU323产PQQ达450 mg/L。另外,培养基中的添加如谷氨酸、酪氨酸等的种类和含量也会影响氧化葡萄糖酸杆菌的生长速率,进而会影响PQQ的生产速率和产量。李盼盼[37]利用氧化葡萄糖酸杆菌(G.oxydans)621H作为出发菌株,单因素及正交试验优化培养基,并优化前体物质Glu和Tyr的添加,最终PQQ产量为0.813 mL/L。金属离子对PQQ的合成也有一定的影响[38],目前发现Fe2+与Mg2+对PQQ合成量影响最大。URAKAMIT等[39]利用Hyphomicrobium sp.TK0441合成PQQ时,适量的柠檬酸铁和硫酸镁对PQQ的合成具有促进作用。特别是亚铁离子浓度,当亚铁离子浓度过髙时,不利于PQQ的积累。杨诗颖等[40]还发现,磷元素对其产量也具有显著的影响,钟杉杉[41]在实验中同样也发现,提高磷元素和钾元素能提高假单胞杆菌合成PQQ的能力。
3.3 培养条件
最后,对氧化葡萄糖酸杆菌的培养方式、培养基中的有毒有害物质包括代谢的副产物也会影响PQQ的生产速率和产量。经过实验可知,当其他条件相同,pH值为6.5,发酵温度为30℃,发酵转速为200 r/min左右时,PQQ的生产速率和产量较为理想[37]。郑璞等[42]研究发现,在甲基营养菌(Methylopila sp.)YHT-1中35℃时更有利于PQQ的合成。对于Methylovorus sp.MP688来说,当pH从7.0降至5.5时可以诱导PqqA2基因启动子启动,从而提高PQQ合成量[43]。
4 展望
氧化葡萄糖酸杆菌具有独特的不完全氧化多羟基物质的特性,而使其应用特别广泛,并吸引众研究者的关注。氧化葡萄糖酸杆菌的细胞膜上具有大量依赖于PQQ的脱氢酶,而关于PQQ各个相关合成基因的功能研究也有一定的进展,但仍有许多问题无法解决,如是否存在其他的相关合成基因,这些基因的转录与表达调控,以及各基因的准确功能,生物合成中各步骤的中间产物与基因产物的结构、性质等将是下一步研究的重点和突破口。关于生物制造PQQ的研究处于刚起步阶段,本文所论述的只是研究领域的小部分,今后的研究重点从以下两个方面展开:
(1)代谢工程改造。如过表达前体肽基因pqq A,提高PQQ水平。另外,表达调控元件,如启动子、基因拷贝数等对合成PQQ水平具有一定的调控作用,通过对mRNA二级结构调节等,有效提升PQQ合成基因簇的表达水平。
(2)从PQQ分泌表达角度出发。孔蛋白是一类膜转运蛋白,能形成非特异的跨膜通道,允许相对分子质量<10 kDa的小分子自由通过,可将细胞内物质转运至胞外,如大肠杆菌ompA、phoE、LamB及ompC这4种蛋白。PqqB蛋白参与PQQ的转运,但不能直接起作用,主要是其结构缺少疏水序列,而信号肽之所以能促进蛋白质的跨膜转运,主要是其结构中含有疏水序列,因此,可以利用孔蛋白或信号肽以提升PQQ的跨膜转运。
[1]SALISBURY S A,FORREST HS,CRUSE WB,et al.A novel coenzyme from bacterial primary alcohol dehydrogenase[J].Nature,1979,280:843-844.
[2]YASUSHISA N,TAKESHIK,ISAMU K,et al.Effects of pyrroloquinoline quinone(PQQ)and PQQ-oxazole on DNA synthesis[J].Life Sci,1993,52:1909-1915.
[3]AMEYAMA M,SHINAGAWA E,MATSUSHITA K,et al.Growth stimulating activity for microorganisms in naturally occurring substances and partial characterization of the substance for the activity as pyrroloquinoline quinone[J].Agr Biol Chem,1985,49:699-709.
[4]KUMAZAWA T,SATO K,SENO H,et al.Levels of pyrroloquinoline quinone in various foods[J].Biochem J,1995,307(2):331-333.
[5]STEINBERG F,STITES T E,ANDERSON P,et al.Pyrroloquinoline quinone improves growth and reproductive performance in mice fed chemically defined diets[J].Exp Biol Med,2003,228(2):160-166.
[6]KUMAZAWA T,SENO H,URAKAMIT,et al.Trace levels of pyrroloquinoline quinone in human and rat samples edteceted by gas chromatoraphy/mass spectrometry[J].BBA-Gen Subj,1992,1156(1):62-66.
[7]MITCHELL A E,JONES A D,MERCER R S,et al.Characterization of pyrroloquinoline quinone amino acid derivatives by electrospray ionization mass spectrometry and detection in human milk[J].Anal Biochem,1999,269(2):317-325.
[8]AKIHARU W,NORIO H,TAKAO T.Protective effect of pyrroloquino-line quinone against experimental liver injury in rats[J].Curr Therap Res,1988,44:896-901.
[9]AKAIKE T.PQQ as a generator and a scavenger of oxygen radicals determination with ESR spectroscopy using a spin trap agent.In:FUKUI,T,et al.Enzymes dependent on pyridoxal phosphate and other carbonyl compounds as factor.Oxford,New York,Seoul,Tokyo:Pergamon Press,1991:511-513.
[10]MA K,CUI J Z,YE J B,et al.Pyrroloquinoline quinone from Gluconobacter oxydans fermentation broth enhances superoxide anion-scavenging capacity of Cu/Zn-SOD[J].Food Chem,2017,230:291.
[11]AIZENMAN E,KAREN A H,ZHONG C,et al.Interaction of the putative essential nutrient PQQ with the N-methyl-D-aspartate receptor redox modulatory site[J].J Neurosci,1992,12:2362-2369.
[12]KOHJIY,AKERIS,TEIZIU,et al.Stimulation of nerve growth factor production by pyrroloquinoline quinone and its derivatives in vitro and in vivo[J].Biosci Biotech Biochem,1993,57:1231-1233.
[13]KUMAZAWA T,HIWASA T,TAKIGUCHIM,et al.Activation of ras signaling pathways by pyrroloquinoline quinone in NIH3T3 mouse fibroblasts[J].Int J Mol Med,2007,19(5):765-770.
[14]李皓桓,贺斌,彭昊,等.吡咯喹啉醌对许旺细胞增殖及c-fos、c-jun、CREB和PCNA表达的影响[J].中华整形外科杂志,2011,27(4):298-301.
[15]贺斌,陶海鹰,卫爱林,等.吡咯喹啉醌对氧化应激诱导雪旺细胞凋亡的保护作用及其机制[J].中华整形外科杂志,2014,30(2):111-117.
[16]KHAIRNAR N P,KAMBLE V A,MANGOLIS H,et al.Involvement of a periplasmic protein kinase in DNA strand break repair and homologous recombination in Escherichia coli[J].Mol Microbiol,2007,65(2):294-304.
[17]RAJPUROHIT Y S,GOPALAKROSHNAN R,MISRA H S.Involvement of a protein kinase activity inducer in DNA double strand break repair and radioresistance of Deinococcus radiodurans[J].J Bacteriol,2008,190(11):3948-3954.
[18]TANNE C,GOBEL G,LISDAT F,et al.Development of a PQQ-GDH-anode based on MWCNT modified gold and its application in a glucose/O2-biofuel cell[J].Biosens Bioelect,2010,26(2):530-535.
[19]YUHASHIN,TOMIYAMA M,OKUDA J,et al.Development of a novel glucose enzyme fuel cell system employing protein engineered PQQ glucose dehydrogenase[J].Biosens Bioelect,2005,20(10):2145-2150.
[20]新思界.吡咯喹啉醌市场前景分析[EB/OL].http://www.newsijie.com/chanye/huagong/jujiao/2017/0830/11241280.html.
[21]唐靓,张岭,李林子,等.吡咯喹啉醌研究新进展[J].食品科学,2015,36(19):287-291.
[22]GUO Z,MURPHY L,STEIN V,et al.Engineered PQQ-glucose dehydrogenase as a universal biosensor platform[J].J Am Chem Soc,2016,138(32):10108-10111.
[23]司振军.微生物高效生产吡咯喹啉醌和聚苹果酸的研究[D].杭州:浙江大学,2017.
[24]王朝绚.吡咯喹啉醌工程菌构建及关键基因研究[D].北京:北京化工大学,2013.
[25]PRUST C,HOFFMEISTER M,LIESEGANG H,et al.Complete genome sequence of the acetic acid bacterium Gluconobacter oxydans[J].Nature Biotechnol,2005,23:195-200.
[26]HOLSCHER T,GORISCH H.Knockout and overexpression of pyrroloquinoline quinone biosynthetic genes in Gluconobacter oxydans 621H[J].J Bacteriol,2006,188:7668-7676.
[27]KLEEF M A,DUINE J A.L-tyrosine is the precursor of PQQ biosynthesis in Hyphomicrobium X[J].FEBS Lett,1988,237:91-97.
[28]SHEN Y Q,BONNOT F,IMSAND E M,et al.Distribution and properties of the genes encoding the biosynthesis of the bacterial cofactor,pyrroloquinoline quinone[J].Biochem,2012,51(11):2265-2275.
[29]VELTEROP J S,SELLINK E,MEULENBERG J J,et al.Synthesis of pyrroloquinoline quinone in vivo and in vitro and detection of an intermediate in the biosynthetic pathway[J].J Bacteriol,1995,177:5088-5098.
[30]MEYER J B,FRAPOLLI M,KEEL C,et al.Pyrroloquinoline quinone biosynthesis gene pqq C,a novel molecular marker for studying the phylogeny and diversity of phosphate-solubilizing pseudomonads[J].Appl Environ Microbiol,2011,77(20):7345-7354.
[31]HOUCK D R,HANNERS JL,UNKEFER C C.Biosynthesisof pyrroloquinoline quinine.Identification of biosynthetic precursors using 13C labeling and NMR spectroscopy[J].J Am Chem Soc,1988,110:6020-6021.
[32]MAGNUSSON O T,TOYAMA H,SAEKI M,et al.Quinone biogenesis:Structure and mechanism of PqqC,the final catalyst in the production of pyrroloquinoline quinone[J].P Natl Acad Sci USA,2004,101(21):7913-7918.
[33]PUEHRINGER S,METLITZKY M,SCHWARZENBACHER R.The pyrroloquinoline quinone biosynthesis pathway revisited:A structural approach[J].BMC Biochem,2008,9:8-17.
[34]GAO L L,HU Y D,LIU J,et al.Stepwise metabolic engineering of Gluconobacter oxydans WSH-003 for the direct production of 2-keto-L-gulonic acid from D-sorbitol[J].Metab Eng,2014,24:30-37.
[35]YUAN J F,WU M B,LIN J P,et al.Combinatorial metabolic engineering of industrial Gluconobacter oxydans DSM2343 for boosting 5-keto-D-gluconic acid accumulation[J].BMC Biotechnol,2016,16(1):42.
[36]孙继国.利用不同启动子在大肠杆菌与肺炎克雷伯氏中合成PQQ的研究[D].北京:北京化工大学,2013.
[37]李盼盼.氧化葡萄糖酸杆菌合成吡咯喹啉醌的研究[D].郑州:郑州轻工业学院,2016.
[38]MEULENBERG J J M,SELLINK E,RIEGMAN N H,et al.Nucleotide sequence and structure of the Klebsiella pneumoniae pqq operon[J].Mol General Genetics Mgg,1992,232(2):284-294.
[39]URAKAMI T,YASHIMA K,KOBAYASHI H,et al.Production of pyrroloquinoline quinone by using methanol-utilizing bacteria[J].Appl Environ Microbiol,1992,58(12):3970-3976.
[40]杨诗颖,陈佳,柯崇榕,等.吡咯喹啉醌产生菌的筛选及其培养基优化[J].药物生物技术,2014(5):429-432.
[41]钟杉杉.吡咯喹啉醌高产菌的筛选、诱变、发酵及基因克隆[D].北京:北京化工大学,2013.
[42]郑璞,姚红涛.一种甲基营养菌及其发酵生产吡咯喹啉醌的方法:CN201410087026.4[P].2014-07-02.
[43]XIONG X H,ZHAO Y,GE X,et al.Production and radioprotective effects of pyrroloquinoline quinone[J].Int J Mol Sci,2011,12(12):8913-8923.