红曲菌属(Monascus spp.)是我国重要的药食两用微生物,能够产生多种酶系,包括酯化酶、糖化酶及酸性蛋白酶等,在发酵食品中具有非常重要的意义[1-2]。其中,酯化酶可催化多种有机酸与乙醇生成己酸乙酯、乙酸乙酯、乳酸乙酯、丁酸乙酯等酯类物质,使浓香型白酒的香气更加丰满协调[3-4]。
至今为止,关于红曲霉产酯化酶的研究主要包括:高产酯化酶红曲菌株的分离、纯化、鉴定及产酶条件优化[1,5-7];多酶系红曲菌株的研究[8];红曲霉发酵黄水研究[9];红曲霉酯化黄水制备酯化液[10];复合酯化酶制剂的研究[11]等。有研究表明,酵母、红曲霉共发酵与堆积发酵配套工艺相结合,能使白酒中总酯含量增加,尤其是己酸乙酯,提高白酒酯化液品质[9,12]。目前,在工业上,一般采用固态发酵红曲霉产酯化酶[5-7]。然而,固态发酵受传质传热以及发酵调控的限制[13],导致红曲发酵周期长,酶制备效率低。因此,通过液态发酵生产高活性酯化酶,具有较大的潜力。
本研究从实验室保藏的10株红曲菌株中筛选1株高产酯化酶的菌株,通过分子生物学技术对其进行鉴定,并对其最适培养基进行筛选,最后对该红曲霉所产的酯化酶酶学特性进行初步研究,为利用红曲菌对白酒增香提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
红曲菌株M1、M3、M7、M8、M9、M11、X1、X2、CG-6、C003:天津科技大学食品工程与生物技术学院发酵食品与微生物资源开发研究室保藏。
1.1.2 试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京康为世纪生物技术公司;蛋白胨(生化试剂)、2×Primer STAR Buffer、Taq聚合酶(5 U/μL):北京索莱宝生物有限公司;硝酸钠、磷酸二氢钾、硫酸镁、葡萄糖等(均为分析纯):天津市光复精细化工研究所。
1.1.3 培养基
麦芽汁培养基:参照文献[14]进行制备。
种子液培养基:大米粉30 g/L,NaNO3 3 g/L,KH2PO4 2.5 g/L,MgSO4·7H2O 1 g/L,pH自然。
初筛培养基:无水葡萄糖60 g/L,蛋白胨20 g/L,NaNO3 10 g/L,KH2PO4 10 g/L,MgSO4·7H2O 5 g/L,pH自然。
复筛培养基1:可溶性淀粉70 g/L,大豆蛋白胨20 g/L,NaNO3 2g/L,KH2PO4 1g/L,MgSO4·7H2O2g/L,pH 4.5;复筛培养基2:葡萄糖50g/L,蛋白胨20 g/L,NaNO3 2g/L,KH2PO4 1.5 g/L,MgSO4·7H2O 1 g/L,pH 5.0;复筛培养基3:大米粉50 g/L,NaNO3 3 g/L,KH2PO4 1.5 g/L,MgSO4·7H2O 1 g/L,pH自然;复筛培养基4:在复筛培养基3的基础上加入20 g/L大豆蛋白胨。
以上培养基的灭菌条件均为121℃灭菌20 min。
1.2 仪器与设备
SW-CJ-1FD型超净工作台:上海博讯事业有限公司医疗设备厂;LS-B50L型立式压力蒸汽灭菌锅:上海华线医用核子仪器有限公司;KCL2000型恒温恒湿培养箱:日本EYELA东京理化公司;AG22331型高速离心机:德国Ep pendorf公司;070-851型聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Biometra公司;ZWY-2112D型恒温培养振荡器:上海支撑分析仪器制造有限公司。
1.3 方法
1.3.1 高产酯化酶红曲菌株的筛选
将红曲菌株M1、M3、M7、M8、M9、M11、X1、X2、CG-6、C003的孢子悬浮液(5.0×105个/mL)以10%(V/V)的接种量接种到初筛培养基中,30℃、180 r/min条件下振荡培养4 d,以发酵上清液中的酯化酶活力为指标进行初筛。
以10%的接种量将初筛菌株的孢子悬浮液分别接种于复筛培养基1、2、3,30 ℃、180 r/min条件下培养5 d,定期检测上清液中酯化酶酶活变化,以达到最高酯化酶活力时间、酶活力为指标进行复筛。
1.3.2 红曲霉液态发酵产酯化酶培养基的选择
将菌株X1、X2接种于4种复筛培养基中,培养到最高酶活为止,以酯化酶活力为指标,选择红曲霉液态发酵产酯化酶的最佳培养基。
1.3.3 酯化酶活性的测定
采用1-萘酚比色法对酯化酶酶活进行测定[15]。将0.5mL上清液和3 mL pH=6.0的磷酸缓冲液混合后,添加0.1 mL 1-醋酸萘酯,空白组不添加1-醋酸萘酯,37℃水浴反应15min后加0.4 mL固蓝B盐,37℃保温10 min,在波长528 nm处测定吸光度值。
酯化酶酶活定义:在pH=6.0、37℃条件下,15 min水解1-醋酸萘酯产生1.0 nmol的1-萘酚所需酶量为1个酶活单位(U/mL)。
1.3.4 红曲霉菌种的分子生物学鉴定
将菌株X1的孢子悬浮液接种于复筛培养基2中,30℃、180 r/min条件下培养3d,8000r/min离心10min,取菌体,无菌水反复冲洗3次后,于-80℃保存备用。
采用DNA试剂盒法提取菌株X1的DNA,以其为模板,采用通用引物ITS-1(5"-TCCGTAGGTGAACCTGCGG-3")和ITS-4引物(5"-TCCTCCGCTTATTGATATGC-3")进行PCR扩增[16]。
PCR扩増体系:DNA模板2 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2.5 mmol/L)4 μL,2×Primer STAR Buffer 25 μL,引物各1 μL,Taq聚合酶(5 U/μL)0.5 μL,双蒸水(ddH2O)补充至50 μL。PCR扩增程序:96℃预变性1 min;96℃变性30 s,50℃退火30 s,72℃延伸90 s,共35个循环;72℃再延伸10 min。PCR扩增产物于1%的琼脂糖凝胶中进行电泳,凝胶成像仪中观察条带,PCR扩增产物送至苏州金唯智生物科技有限公司进行测序。
PCR扩增产物序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST搜索,选取同源性较高的菌株,采用软件clustal×1.83进行多序列比对,用MEGA 5.10软件中的邻接(neighbor-joining,NJ)法构建系统发育树[17]。
1.3.5 酯化酶酶学特性研究
最适反应温度及pH值:设定反应温度分别为25℃、35℃、37 ℃、40 ℃、45 ℃、55 ℃;pH值分别为2.0、3.0、4.0、5.0、6.0、7.0。测定酯化酶活力,研究酯化酶的最适反应温度及pH值。
温度及pH稳定性:将粗酶液在25℃、35℃、45℃、55℃、65 ℃条件下分别水浴0、10 min、20 min、30 min、40 min后,冷却;将pH 5.0、6.0、7.0、8.0的3 mL磷酸盐缓冲溶液分别与0.5 mL酶液混合均匀,在4℃条件下保存24 h。测定残余酶活力,最大酶活力记为100%,计算相对酶活力,研究该酯化酶的温度及pH稳定性。
2 结果与分析
2.1 高产酯化酶红曲菌株的筛选
采用初筛培养基对10株红曲霉进行初筛,酯化酶活力测定结果见图1。
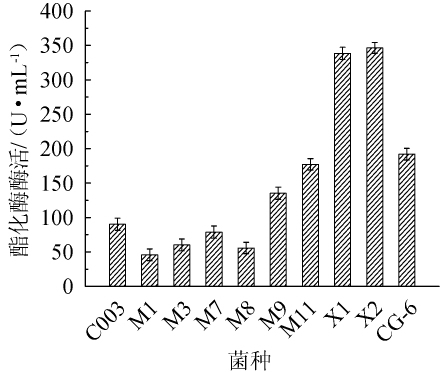
图1 不同红曲霉的酯化酶活力
Fig.1 Esterase activity of different Monascus
由图1可知,不同红曲霉液态发酵产酯化酶的能力不同,其中菌株X2的酯化酶活力最高,为346.28 U/mL,菌株X1次之(338.37 U/mL),菌株M1、M3、M7、M8、C003等产酯化酶能力较低。菌株X1和X2的酯化酶活力差异较小,因此,采用3种复筛培养基(1、2、3)对菌株X1和X2进行进一步筛选,结果见图2。
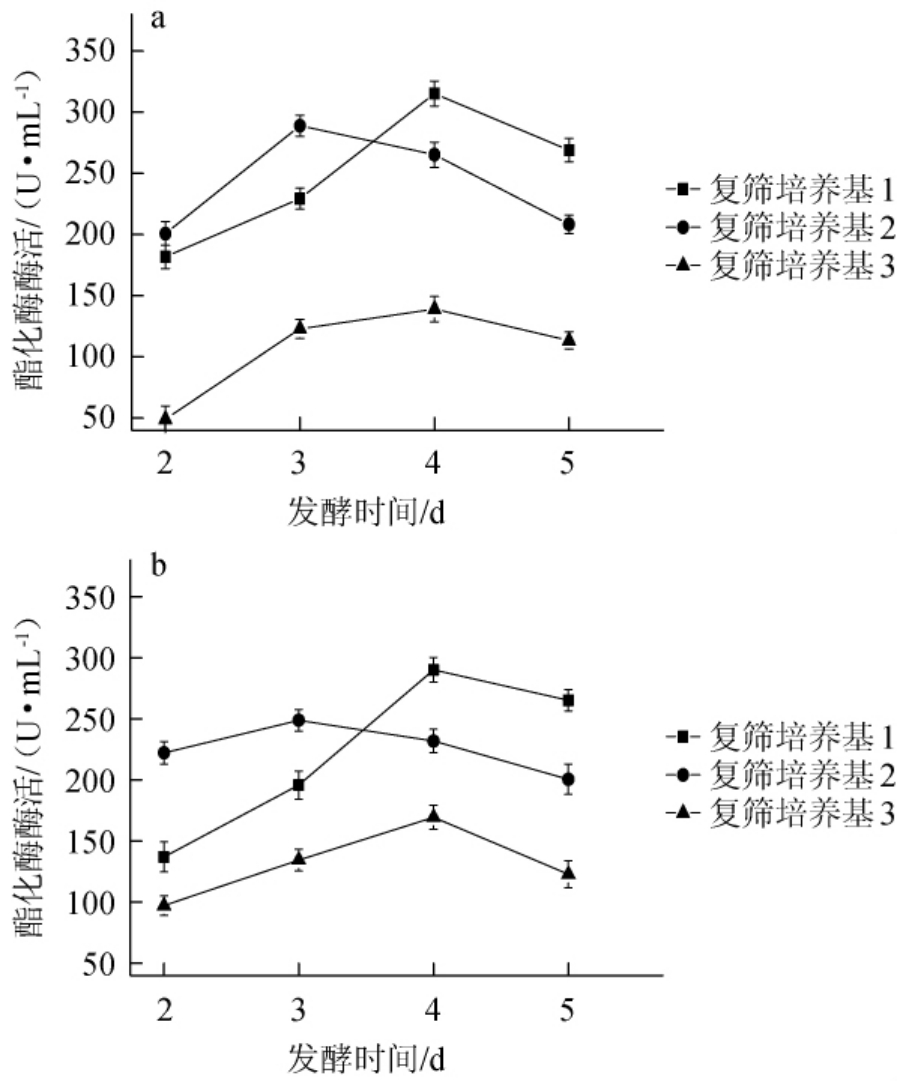
图2 菌株X1(a)和X2(b)在不同培养基中的酶活
Fig.2 Enzyme activity of strain X1(a)and X2(b)in different media
由图2可知,无论何种培养基,两株菌的发酵上清液中酯化酶酶活均呈现先上升后下降的趋势,菌株X1和X2在不同培养基中培养时,最高酶活出现时间均相同,可见两株菌的生长和酯化酶生产状况非常相近。从最高酶活出现的时间上看,复筛培养基2最早,这可能与培养基中碳源有关[18]。此外,复筛培养基3中没有加入迟效氮源,影响了酯化酶的产生[19]。为此,在复筛培养基3中加入20 g/L的大豆蛋白胨,成为复筛培养基4,进行后续实验。
2.2 红曲霉液态发酵产酯化酶培养基的选择
采用4种复筛培养基对菌株X1和X2进行发酵,重复3次,从中选择稳定性最佳的发酵培养基,结果如图3所示。
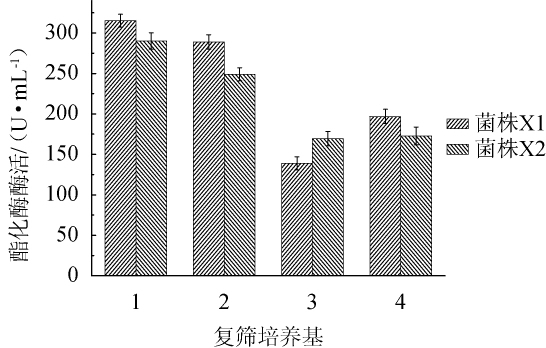
图3 菌株X1和X2在不同复筛培养基中的酯化酶活性
Fig.3 Esterase activity of strain X1 and X2 in different secondary screening media
由图3可知,菌株X1和X2在复筛培养基1的酯化酶活力高于其他3种培养基,且稳定性良好,由此可知,复筛培养基1更适合红曲霉菌株的生长及产酶;菌株X1的酯化酶活力均高于菌株X2,且在复筛培养基1条件下,酯化酶酶活最高,为315.19 U/mL,菌株X2为X1酶活的92.07%。因此,菌株X1在液态条件下发酵分泌酯化酶能力更强。同时,培养基4中,大豆蛋白胨的加入有效提高了发酵液的酶活力,但仍显著低于复筛培养基1和2。因此,选择菌株X1进行分子生物学鉴定。
2.3 分子生物学鉴定
菌株X1的系统发育树见图4。
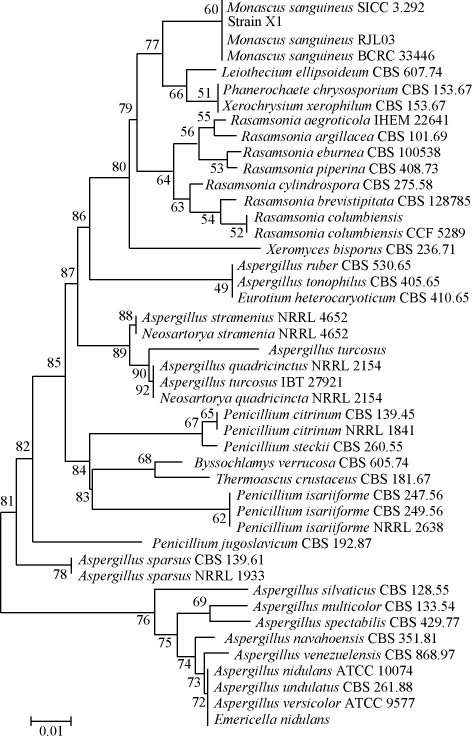
图4 基于ITS序列菌株X1的系统发育树
Fig.4 Phylogenetic tree of strain X1 based on ITS sequences
由图4可知,菌株X1与血红红曲霉(Monascussanguineus)聚于一支,相似度最高。因此,鉴定菌株X1为血红红曲霉(Monascus sanguineous)。
2.4 酯化酶酶学特性分析结果
2.4.1 酯化酶的最适反应温度及pH值
酯化酶的最适反应温度及pH值测定结果如图5所示。
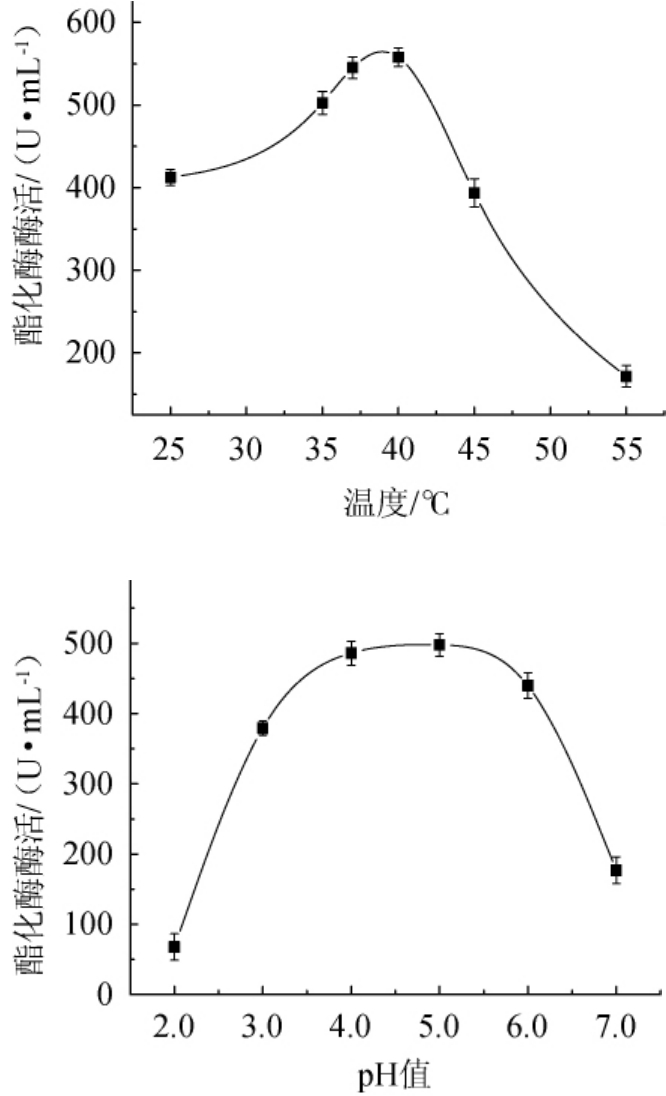
图5 酯化酶的最适温度及pH
Fig.5 Optimal temperature and pH of esterase
由图5可知,随着反应温度的升高,酯化酶活力呈先升高后下降的趋势。当反应温度为40℃时,酯化酶活力最高,为557.9 U/mL。分析原因可能是,酶作为反应催化剂,温度可影响其本身某些基团的解离、与底物的结合等[20]。在一定温度范围内,随着温度升高,分子运动速率加快,酶促反应速率加快,而温度过高,蛋白开始变性,酶活降低。因此,该酶的最适反应温度为40℃。
由图5可知,随着反应体系pH值的增大,酯化酶活力呈先升高后下降的趋势。当反应pH值为5.0时,酯化酶活力最高,为497.8U/mL。分析原因可能是,酶分子上有酸性和碱性的氨基酸侧链基团,可直接影响底物的结合和进一步催化反应,也可能影响酶的空间结构,从而影响酶的活性[21];此外,酶活性部位的解离以及底物结构的破坏都会导致酶-底物复合物不能进一步转化成产物。因此,该酶的最适反应pH值为5.0。
2.4.2 酯化酶的温度及pH稳定性
酯化酶的温度及pH稳定性结果见图6。
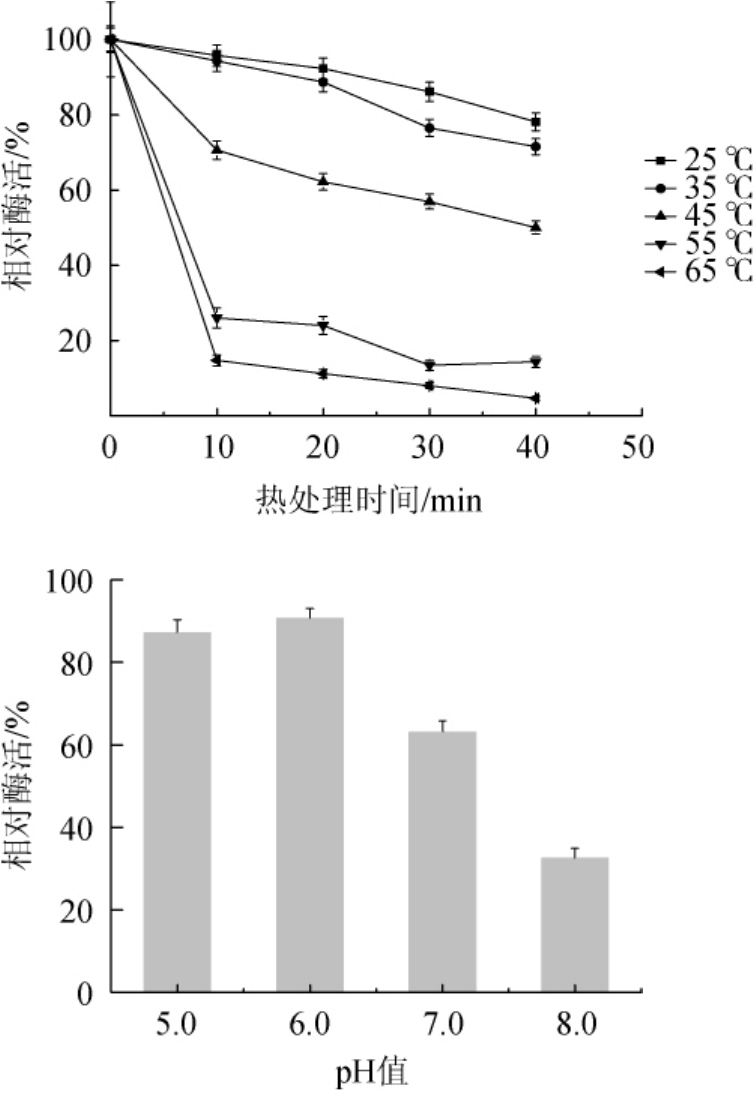
图6 酯化酶的温度和pH稳定性
Fig.6 Temperature and pH stability of esterase
由图6可知,当酯化酶在25℃和35℃条件下处理40 min后,相对酶活为78.08%、71.50%,酯化酶稳定性较好;45℃条件下处理40 min后,相对酶活为50.01%,酶稳定性较差;当处理温度为55℃和65℃时处理10 min后,相对酶活为26.05%和14.75%,40 min后酶活几乎下降为0,酶活不稳定。因此,该酯化酶在25~35℃条件下稳定性较好。
当pH值在5.0~6.0时,处理24 h后,酯化酶相对酶活>80%,酯化酶较稳定,尤其是在pH 6.0缓冲液中保存时,相对酶活为90.65%;当pH值>6.0时,酯化酶酶不稳定;pH为8.0时,相对酶活迅速降低为32.5%,表明该酶在碱性条件下易失活。
2.4.3 金属离子对酯化酶活力的影响
不同金属离子对酯化酶酶活的影响结果如图7所示。
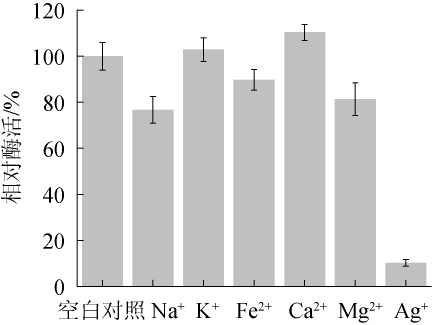
图7 不同金属离子对酯化酶活性的影响
Fig.7 Effect of different metal ions on esterase activity
由图7可知,Ca2+可以明显促进该红曲酯化酶的活性,相对酶活为110.28%,因此,可作为该酶的促进剂;K+对酯化酶活力的影响不显著;而Mg2+、Na+、Fe2+和Ag+对该酯化酶均具有不同程度的抑制作用,其中Ag+对该酯化酶的抑制作用最明显,相对酶活仅为10.22%,是该酶的酶活抑制剂。
3 结论
本研究通过筛选得到一株高产酯化酶的红曲霉菌株X1,经分子生物学鉴定为血红红曲霉(Monascus sanguineous),其最适产酶培养基为可溶性淀粉70g/L,大豆蛋白胨20g/L,NaNO3 2 g/L,KH2PO4 1 g/L,MgSO4·7H2O 2 g/L,初始pH值4.5;采用最优培养基,在30℃、180 r/min条件下发酵4 d后,酯化酶酶活力为315.19 U/mL。粗酶酶学性质研究结果表明,该酯化酶的最适反应温度为40℃,在25~35℃稳定性较好;最适pH值为5.0,在pH为5.0~6.0时,稳定性较高;Ca2+可提高该酯化酶活性,Mg2+、Fe2+、Na+、Ag+则有不同程度抑制作用,且Ag+抑制作用最明显,相对酶活仅为10.22%。本研究为红曲霉液态条件下分泌酯化酶进而制备酯化液提供参考,也为红曲酯化酶制剂在白酒生产中的应用提供了更多依据。
[1]CHEN W P,HE Y,ZHOU Y X,et al.Edible filamentous fungi from the species Monascus:Early traditional fermentations,modern molecular biology,and future genomics[J].Compr Rev Food Sci Food Safety,2015,14(5):555-567.
[2]胡娜,吴鑫颖,李付丽,等.紫色红曲霉FBKL3.0018产酯化酶的酶学性质研究[J].中国酿造,2017,36(5):123-127.
[3]谢恩举,徐世江.红曲酯化酶制剂在浓香型粮食酒生产中的应用[J].中国酿造.2000,19(1):27.
[4]罗小叶,胥思霞,邱树毅,等.高酯化大曲催化增香技术在浓香型白酒生产上的应用[J].中国酿造,2018,37(10):141-144.
[5]刘新宇.红曲霉的分离纯化及在清香型白酒中的应用[D].临汾:山西师范大学,2014.
[6]杜春迎.浓香型大曲中高产酯化酶菌株的筛选及产酶条件优化究[D].哈尔滨:黑龙江大学,2012.
[7]张磊,张华玲,刘绪,等.红曲霉产酯化酶条件的研究[J].酿酒科技,2013(9):68-70.
[8]赵吉兴,李耀,李凯.红曲霉固体发酵生产酿造增香发酵剂的研究与应用[J].中国酿造.2013,32(3):114-117.
[9]刘丹,杨帆,薛意斌,等.红曲霉Monascus sanguineus X1处理黄水的培养基优化及酯化液制备.食品科学技术学报,http://kns.cnki.net/kcms/detail/10.115/TS.20190130.1537.002.html.
[10]CHEN S,LIU K Y,ZHENG J,et al.Study on enzymatic esterification conditions of yellow water optimized by response surface methodology[J].Sci Technol Food Ind,2012,33(12):205-209.
[11]CHENG G.Liquor industry status and prospects for Monascus[J].Mod Food,2016,12(6):15-17.
[12]艾金忠,马美荣,聂建光,等.高酯化酶活性红曲霉及生香酵母在二锅头白酒生产中的应用[J].酿酒,2013,40(4):33-34.
[13]葛龙,赵艳,章亭洲.固态发酵技术的特点与应用[J].饲料与畜牧,2010(8):54-56.
[14]林琳,王昌禄,李贞景,等.mok E基因过表达对红曲霉Monacolin K产量、菌丝及孢子形态的影响[J].食品科学,2018,39(8):45-49.
[15]潘名志.红曲霉产酯化酶特性及其酶学性质的研究[D].贵阳:贵州大学,2009.
[16]MANTER D K,VIVANCO J M.Use of the ITS primers,ITS1F and ITS4,to characterize fungal abundance and diversity in mixed-template samples by qPCR and length heterogeneity analysis[J].J Microbiol Meth,2007,71(1):7-14.
[17]KUMAR S,TAMURA K,NEI M.MEGA:Molecular evolutionary genetics analysis software for microcomputers[J].Bioinformatics,1994,10(2):189-191.
[18]CSOTA J,VENDRUSCOLO F.Production of red pigments by Monascusruber CCT 3802 using lactose as a substrate[J].Biocatal Agr Biotech,2017,11:50-55.
[19]HILARES R T,DE-SOUZA R A,MARCELINO P F,et al.Sugarcane bagasse hydrolysate as a potential feedstock for red pigment production by Monascus ruber[J].Food Chem,2017,doi:https://doi.org/10.1016/j.food chem.2017.11.111.
[20]VAREJAO N,DE-ANDRADE R A,ALMEIDA R V,et al.Structural mechanism for the temperature-dependent activation of the hyperthermophilicPf2001 esterase[J].Structure,2018,26(2):doi:10.1016/j.str.2017.12.004.
[21]CHEN L,DANG G,DENG X,et al.Characterization of a novel exported esterase Rv3036c from Mycobacterium tuberculosis[J].Protein Expres Purif,2014,104:50-56.