苹果酸脱氢酶(malate dehydrogenase,MDH)EC 1.1.1.37普遍存在于动物、植物和微生物中,可以催化草酰乙酸(oxaloacetic acid,OAA)可逆地还原为苹果酸[1]。MDH参与柠檬酸循环、乙醛酸循环、蛋白质合成、糖异生等代谢活动[2]。在生物科学进化分析领域,MDH广泛应用于系统发育、遗传多样性、个体发育和种间杂种分析的研究过程[3]。在农业监测领域,MDH被用作植物抗病性和易感性的早期鉴定和诊断标记[4]。在食品工业领域,MDH被作为指示酶用以检测L-苹果酸[5]、醋酸[6]、柠檬酸[7]在食品中的含量。在医药卫生领域,MDH临床诊断试剂盒应用于急性肝损伤、肝癌、肺癌等疾病的早期诊断[8]。鉴于MDH具有以上重要的应用价值,其制备工艺一直备受国内外研究人员的关注。现阶段MDH的来源主要有两个方面:一方面是从动物肝脏、心肌组织中直接分离提取;另一方面是从微生物的发酵产物中提取。
目前,产MDH菌株多来源于陆生环境[9-11],海洋作为一个独特的生物环境,从其中筛选得到的MDH具有耐高盐、适合低温条件下应用等优势。本课题组从大连地区渤海海泥中分离得到一株高产MDH的墓画大洋芽孢杆菌(Oceanobacillus picturae)XJH-11,为了进一步考察该菌株的潜在应用价值,提高其产MDH的能力,本研究通过单因素试验和响应面设计试验优化菌株XJH-11产MDH的发酵条件,讨论了各因素对其产MDH能力的影响,从而为深入研究该菌株及后续的中试放大试验奠定基础。
1 材料与方法
1.1 材料与试剂
墓画大洋芽孢杆菌(Oceanobacillus picturae)XJH-11(Genbank NO.:MK050016):分离于大连渤海海泥,辽宁省海洋微生物工程技术研究中心保藏。
牛肉膏、蛋白胨、Trition X-100、二硫苏糖醇(dithiothreitol,DTT)、酵母膏、葡萄糖、硫酸镁、琼脂粉(均为生化试剂或分析纯):生物工程上海股份有限公司。
裂解溶液(0.1 mol/L,pH8 Tris-HCl、0.5 mol/L NaCl、1%Trition X-100、30 μmol/L DTT):本实验室配制。
种子培养基:牛肉膏3 g/L,蛋白胨10 g/L,海水配制,pH7.4,0.1 MPa灭菌20 min。
发酵培养基:葡萄糖5g/L,蛋白胨10g/L,硫酸镁0.08g/L,海水配制,pH8.0,0.1 MPa灭菌20 min。
1.2 仪器与设备
CRY-2112立式恒温摇床:上海茸研仪器有限公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司;YXQ-75SII立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;SCIENTZ-650E超声波细胞粉碎机:宁波新芝生物科技股份有限公司;CR21N高速冷冻离心机:株式会社日立制作所;Multiskan GO全波长酶标仪:美国赛默飞世尔科技公司。
1.3 方法
1.3.1 种子液、粗酶液制备
将斜面保藏菌株墓画大洋芽孢杆菌(Oceanobacillus picturae)XJH-11接种到装液量为125 mL/500 mL的种子培养基中,并在25℃、150r/min摇床中振荡培养36h,作为种子液。再将其以5%接种量接种到装液量为125 mL/500 mL的发酵培养基中,相同的条件培养36 h。
取发酵液于4℃、8 000 r/min离心10 min,弃去上清液,取湿菌体经0.1mol/LTris-HCl缓冲液(pH8.0)洗涤3次以上,直至菌体洗净为止。将洗净后的菌体重悬于裂解溶液中,冰浴条件下超声波破碎,能量30%,每次破碎8 s,间隙9 s,破碎40 min。将破碎的菌液4℃、12 000 r/min离心20 min,上清液为粗酶液。
1.3.2 菌株产苹果酸脱氢酶发酵条件优化单因素试验[13-15]
(1)发酵培养基优化
碳源种类优化:将可溶性淀粉、麸皮、秸秆粉、麦芽糖、葡萄糖、乳糖、微晶纤维素作为单一碳源加入发酵培养基中,添加量为5 g/L,考察碳源种类对MDH酶活的影响;碳源含量优化:确定最佳碳源种类后,调整发酵培养基碳源含量分别为2.5 g/L、5.0 g/L、7.5 g/L、10.0 g/L、12.5 g/L,考察碳源含量对MDH酶活的影响。
氮源种类优化:确定最优碳源的条件下,将蛋白胨、牛肉膏、磷酸二氢铵、氯化铵、酵母膏、牛肉膏+蛋白胨、尿素、磷酸氢二铵作为单一氮源加入发酵培养基中,添加量为10 g/L,考察氮源种类对MDH酶活的影响。氮源含量优化:确定最佳氮源种类后,调整发酵培养基氮源含量分别为5 g/L、10 g/L、15 g/L、20 g/L、25 g/L,考察氮源含量对MDH酶活的影响。
无机盐种类优化:在确定最优碳源、氮源的条件下,将CuSO4、KCl、MgSO4、NaCl、ZnCl2作为单一无机盐离子加入发酵培养基中,添加量为0.8 g/L,考察无机盐种类对MDH酶活的影响。无机盐含量优化:确定最佳无机盐种类后,调整发酵培养基无机盐含量分别为0.06 g/L、0.08 g/L、0.10 g/L、0.12 g/L、0.14 g/L,考察无机盐含量对MDH酶活的影响。
发酵培养基初始pH值优化:分别调整发酵培养基初始pH值为6.5、7、7.5、8、8.5、9,考察发酵培养基初始pH值对酶活的影响。
(2)培养条件优化
在确定最佳发酵培养基条件下,固定其他条件不变,分别调整发酵温度为10℃、15℃、20℃、25℃、30℃、35℃、40 ℃,转速为140 r/min、150 r/min、160 r/min、170 r/min、180 r/min、200 r/min,装液量为50 mL/500 mL、75 mL/500 mL、100 mL/500 mL、125 mL/500 mL、150 mL/500 mL、175 mL/500 mL、200 mL/500 mL,接种量分别为2%、3%、4%、5%、6%、7%、8%;培养36 h后测定MDH酶活。
1.3.3 Plackett-Burman试验设计
在单因素试验的基础上,选取8个影响因子作为研究对象,以MDH酶活(Y)为响应值,Plackett-Burman(PB)设计的试验次数N=12,PB试验设计的因素和水平如表1所示。
表1 Plackett-Burman试验因素及水平
Table 1 Factors and levels of Plackett-Burman experiments
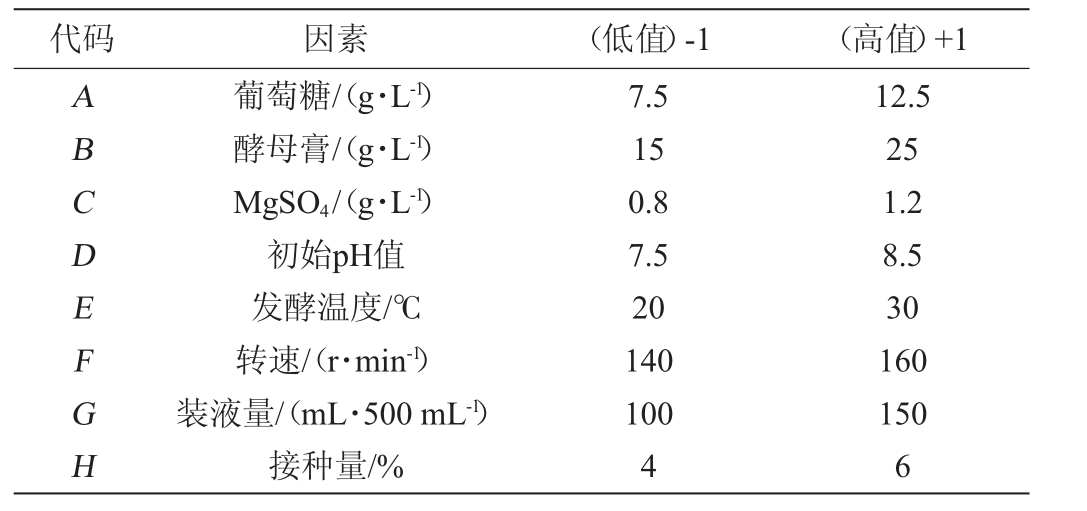
代码 因素 (低值)-1 (高值)+1 ABCDEFGH葡萄糖/(g·L-1)酵母膏/(g·L-1)MgSO4/(g·L-1)初始pH值发酵温度/℃转速/(r·min-1)装液量/(mL·500 mL-1)接种量/%7.5 15 0.8 7.5 20 140 100 4 12.5 25 1.2 8.5 30 160 150 6
1.3.4 最陡爬坡试验设计
根据Plackett-Burman测试结果中每个显著影响因素效应的大小,设定步长和变化方向,找出峰值,并快速逼近最佳值区域。
1.3.5 中心组合试验设计
根据最佳爬坡试验的结果,将具有最高酶活的一组用作中心组合试验的中心点,运用Design-Expert 8.0.6软件进行Box-Behnken试验设计,响应面分析法用于优化产酶条件参数的分析。运用Design-Expert8.0.6软件分析得到最优结果,最后对预测值进行验证。每个处理做3个平行。
1.3.6 测定方法
按照参考文献[12]的方法测定MDH酶活。
2 结果与分析
2.1 菌株产苹果酸脱氢酶发酵条件优化单因素试验
2.1.1 培养基碳源种类的优化
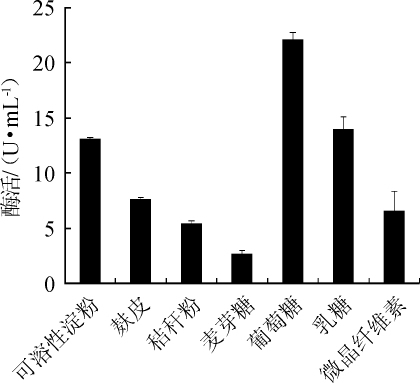
图1 不同碳源种类对苹果酸脱氢酶活力的影响
Fig.1 Effect of different carbon sources on malic dehydrogenase activity
由图1可知,当葡萄糖为单一碳源时,菌株XJH-11产生的MDH酶活最高,为22.07 U/mL。乳糖、可溶性淀粉和麸皮次之,微晶纤维素、秸秆粉、麦芽糖作为碳源时,酶活很低。因此,葡萄糖是菌株XJH-11产MDH的最适碳源。
2.1.2 葡萄糖添加量的优化
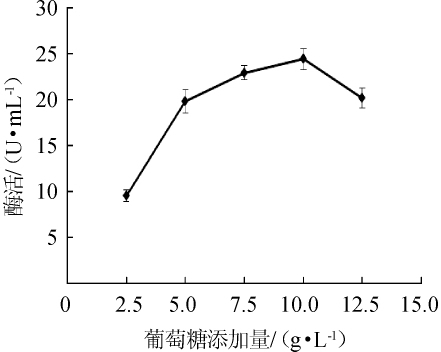
图2 葡萄糖添加量对苹果酸脱氢酶活力的影响
Fig.2 Effect of glucose addition on malic dehydrogenase activity
由图2可知,葡萄糖添加量从2.5g/L升至10g/L时,MDH酶活随葡萄糖添加量的增加而增加,当葡萄糖添加量达到10 g/L时,MDH的酶活最高,为24.46U/mL。当葡萄糖添加量>10g/L之后,酶活降低,说明葡萄糖浓度的增加抑制了菌株XJH-11对葡萄糖的利用。因此,最适葡萄糖添加量为10g/L。
2.1.3 培养基氮源种类的优化
由图3可知,当无机氮源用作唯一的氮源时,菌株XJH-11产MDH的酶活较低。当利用酵母膏、牛肉膏、蛋白胨以及牛肉膏+蛋白胨时,酶活很高。因此,菌株XJH-11产MDH优先利用有机氮源。其中酵母膏作为氮源时酶活最高,为24.52U/mL。因此,酵母膏是菌株XJH-11产MDH的最适氮源。
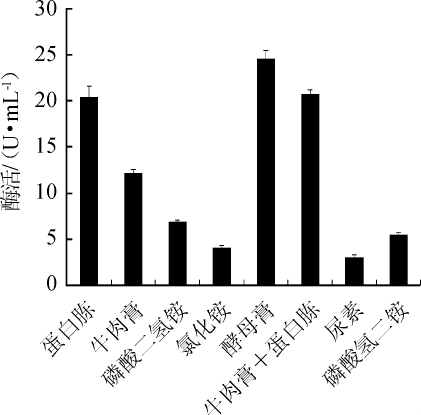
图3 不同氮源种类对苹果酸脱氢酶活力的影响
Fig.3 Effect of different nitrogen sources on malic dehydrogenase activity
2.1.4 酵母膏添加量的优化
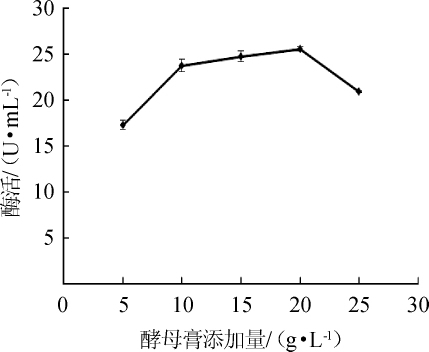
图4 酵母膏添加量对苹果酸脱氢酶活力的影响
Fig.4 Effect of yeast extract addition on malic dehydrogenase activity
由图4可知,酵母膏添加量为5~20 g/L时,酶活也随之增加。当酵母膏添加量达到25 g/L时,酶活下降。这表明过量浓度的酵母膏对菌体的生长有一定抑制作用,进而影响MDH的合成。当酵母膏添加量达到20 g/L时,酶活最高,为25.61 U/mL。因此,最适酵母膏添加量为20 g/L。
2.1.5 培养基无机盐种类的优化
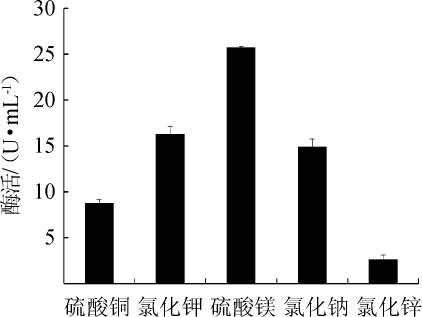
图5 不同无机盐种类对苹果酸脱氢酶活力的影响
Fig.5 Effect of different inorganic salts on malic dehydrogenase activity
由图5可知,以硫酸镁作为无机盐时,菌株XJH-11产MDH酶活最高,为25.64 U/mL。原因可能是镁离子参与稳定酶的构象,使其更易与底物接触[16]。而氯化钾和氯化钠次之;原因可能是其有利于维持菌体细胞膜内外的渗透压,能够使菌体XJH-11更好的生长[17]。因此,硫酸镁是菌株XJH-11产MDH的最适无机盐。
2.1.6 硫酸镁添加量的优化
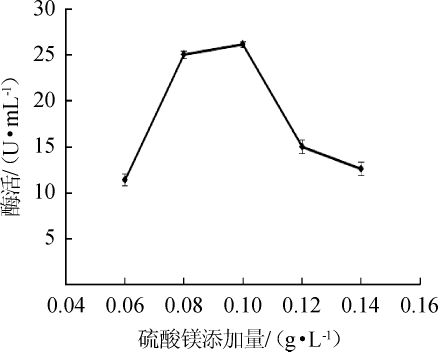
图6 硫酸镁添加量对苹果酸脱氢酶活力的影响
Fig.6 Effect of magnesium sulfate addition on malic dehydrogenase activity
由图6可知,当硫酸镁添加量为0.1 g/L时,MDH酶活最高,为26.13U/mL;硫酸镁添加量为0.06g/L和0.14 g/L时,酶活分别为11.39 U/mL和12.59 U/mL;这表明硫酸镁浓度过低或过高都会对菌体生长产生一定的抑制作用,从而影响酶的合成。因此,最适硫酸镁添加量为0.1 g/L。
2.1.7 培养基初始pH值优化
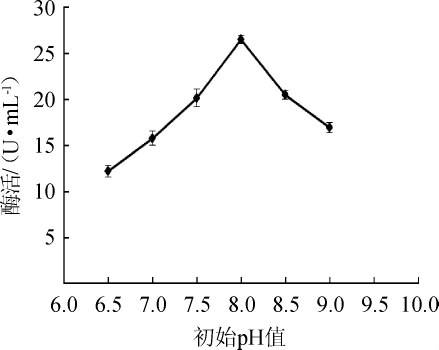
图7 初始pH值对苹果酸脱氢酶活力的影响
Fig.7 Effect of initial pH value on malic dehydrogenase activity
由图7可知,当发酵培养基初始pH值为6.5~8.0时,菌株XJH-11产MDH酶活也随之增高;当初始pH值为8.0时,酶活最高,为26.47U/mL;当初始pH为8.5~9.0时,酶活虽有所下降,但仍具有较高的酶活,说明菌株XJH-11在碱性条件下,适合其产MDH。因此,发酵培养基最适初始pH值为8.0。
2.1.8 发酵温度的优化
由图8可知,当发酵温度为10~25℃时,MDH酶活逐渐上升;发酵温度为25℃时,MDH酶活最高,为26.87 U/mL;发酵温度为30~40℃时,酶活随之降低。因此,最适发酵温度为25℃。
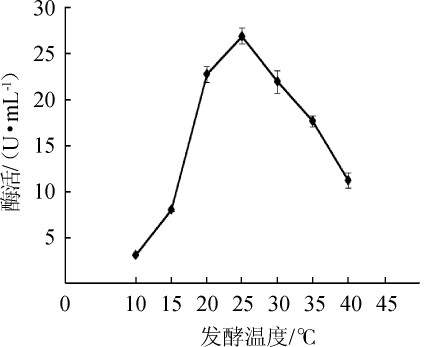
图8 发酵温度对苹果酸脱氢酶活力的影响
Fig.8 Effect of fermentation temperature on malic dehydrogenase activity
2.1.9 转速的优化
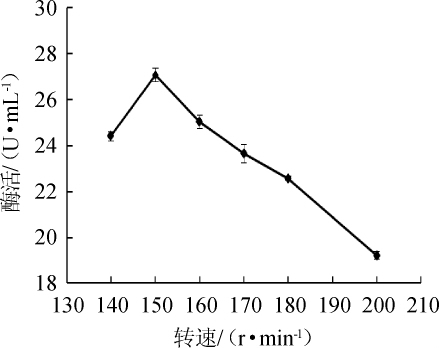
图9 转速对苹果酸脱氢酶活力的影响
Fig.9 Effect of shaking speed on malic dehydrogenase activity
由图9可知,MDH酶活随转速在140~150r/min范围内的增加而增高;当转速为150r/min时,酶活最高,为27.06 U/mL;转速>150 r/min之后,酶活随之降低,可能是过高的转速影响菌体的生长。因此,最适转速为150 r/min。
2.1.10 装液量的优化
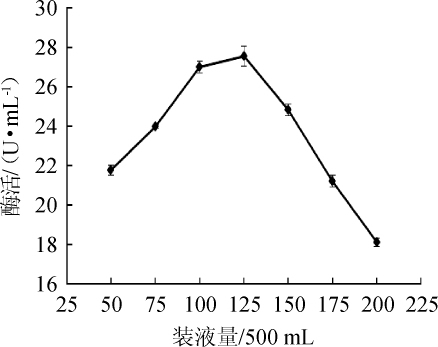
图10 装液量对苹果酸脱氢酶活力的影响
Fig.10 Effect of liquid loading volume on malic dehydrogenase activity
由图10可知,当装液量为(50~125)mL/500 mL时,菌株XJH-11产生的MDH酶活呈增加趋势;当装液量为125 mL/500 mL时,酶活最大,为27.54 U/mL;当装液量为(150~200)mL/500mL时,酶活随之下降。装液量主要影响菌株对溶氧量的需求[18]。当装液量为125 mL/500 mL时,实现了菌株XJH-11溶氧量的最佳值,促进了菌株的生长,并进一步提高了菌株产酶量。因此,最适装液量为125mL/500mL。
2.1.11 接种量的优化
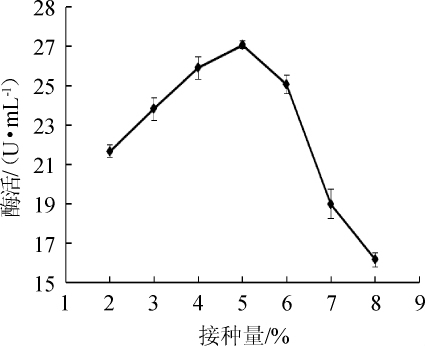
图11 接种量对苹果酸脱氢酶活力的影响
Fig.11 Effect of inoculum on malic dehydrogenase activity
由图11可知,当接种量为2%~5%时,菌株MDH随着接种量的增加而增加;当接种量为5%时,酶活达到最大值,为27.08U/mL;当接种量>5%之后,酶活反而下降。这是因为培养基中的营养物质是有限的,培养基中菌体数目过多也会影响菌株的生长,进而影响菌株产酶。因此,最适接种量为5%。
2.2 Plackett-Burman设计筛选显著因子[19-21]
基于单因素试验,Plackett-Burman(N=12)试验考察影响MDH发酵工艺中8个因素的显著性。试验的设计和结果如表2所示,主效应分析采用Design-Expert8.0.6软件进行,结果如表3所示。
表2 Plackett-Burman试验设计与结果
Table 2 Design and results of Plackett-Burman experiments
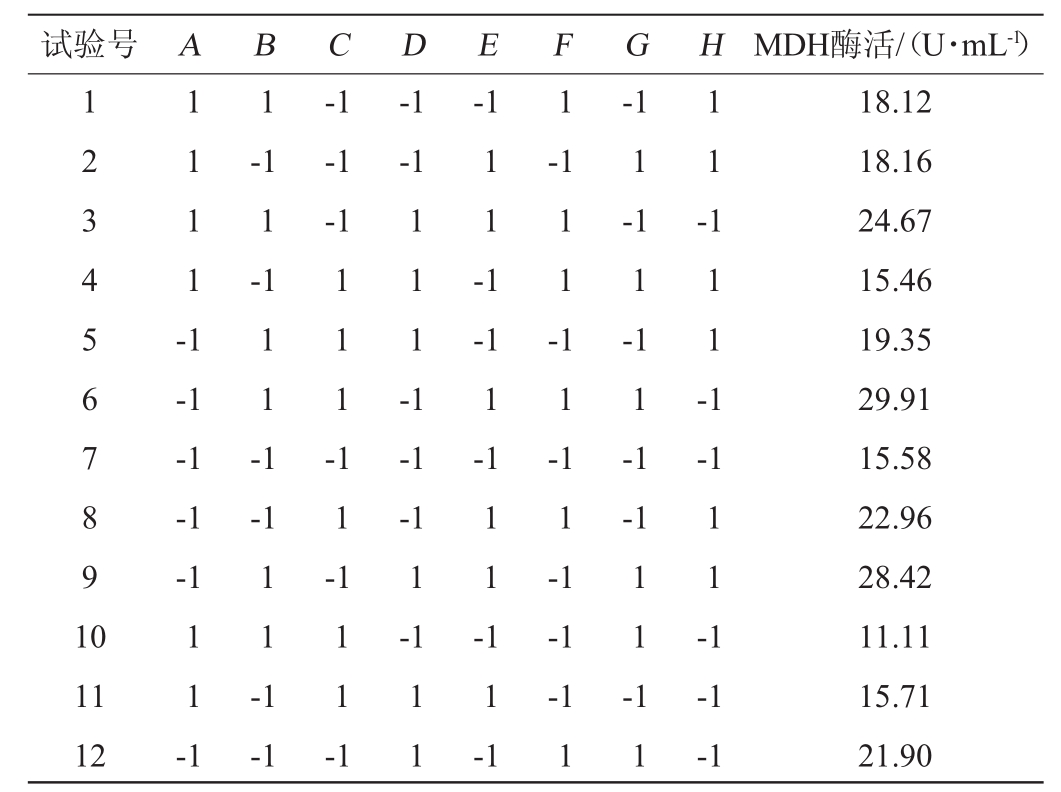
试验号A B C D E F G H MDH酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 1 1 1 1 -1 1-1 1-1 1-1-1-1-1-1-1 1 1 -1-1 1 1 -1 1 --1-1-1-1 1 1 -1 1 1 1 -1 1 1 -1-1 1-1 1 1 -1 1 1 -1-1-1 1 1 --1-1 1-1 1 1 -1 1 -1-1 1-1 1-1 1-1-1 1 1 -1 11 12 1 1 -1 1 1 -1 1 1 --1 1 1 1 -1 1 1 1 1 -1-1-1 1 1 1-1-1 18.12 18.16 24.67 15.46 19.35 29.91 15.58 22.96 28.42 11.11 15.71 21.90
表3 Plackett-Burman设计的各因素水平及主效应分析
Table 3 Factors,levels and main effects analysis of Plackett-Burman design
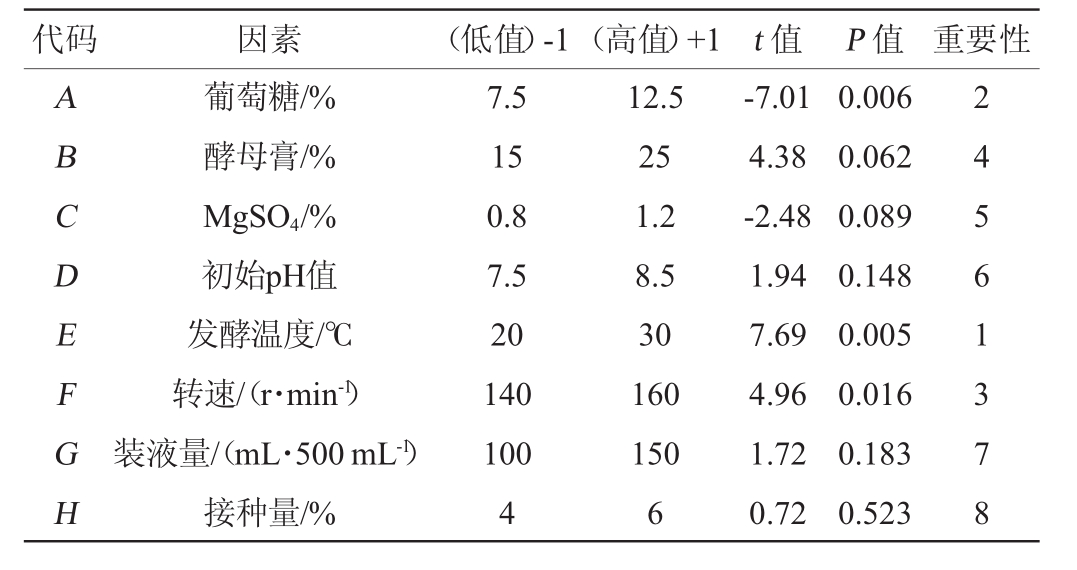
代码 因素 t值 P值 重要性(低值)-1(高值)+1 ABCDEFGH葡萄糖/%酵母膏/%MgSO4/%初始pH值发酵温度/℃转速/(r·min-1)装液量/(mL·500mL-1)接种量/%7.5 15 0.8 7.5 20 140 100 4 12.5 25 1.2 8.5 30 160 150 6-7.01 4.38-2.48 1.94 7.69 4.96 1.72 0.72 0.006 0.062 0.089 0.148 0.005 0.016 0.183 0.523 2 4 5 6 1 3 7 8
由表3可知,发酵温度、葡萄糖添加量、转速的P值分别为0.005、0.006、0.016,均<0.05,因此,发酵温度、葡萄糖添加量和转速这3个因素对试验结果的影响均达到显著水平,在所选因素中对试验结果影响较大。发酵温度与转速具有正效应,葡萄糖具有负效应。因此,选择发酵温度、葡萄糖添加量和转速设计响应面试验。
2.3 最陡爬坡试验
最陡爬坡试验是确定逼近中心点的显著影响因素的取值以及提高MDH的产量,发酵温度、葡萄糖添加量、转速这3个因素的变化方向和步长的试验设计及结果如表4所示。由表4可知,3个显著影响因素的中心点在第2组试验附近,因此确定第2组的水平作为响应面试验的中心点,即发酵温度25℃、葡萄糖添加量10 g/L、转速150 r/min。
表4 最陡爬坡试验设计及结果
Table 4 Design and results of the steepest ascent experiments

试验号 A发酵温度/℃B葡萄糖添加量/(g·L-1)C转速/(r·min-1)MDH酶活/(U·mL-1)123 20 25 30 12.5 10 7.5 140 150 160 30.02 34.58 31.49
2.4 响应面试验
利用上述Plackett-Burman试验结果,基于PB试验和最陡爬坡试验确定的3因素3水平,以MDH酶活(Y)作为响应值,采用Design-Expert 8.0.6软件进行设计,相关设计及结果见表5~表7。
表5 菌株XJH-11产苹果酸脱氢酶条件优化响应面试验因素与水平
Table 5 Factors and levels of response surface experiments for malic dehydrogenase production conditions optimization by strain XJH-11

因素-1 0 1 A发酵温度/℃B葡萄糖添加量/(g·L-1)C转速/(r·min-1)20 7.5 140 25 10 150 30 12.5 160
表6 菌株XJH-11产苹果酸脱氢酶条件优化Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken experiments for malic dehydrogenase production conditions optimization by strain XJH-11
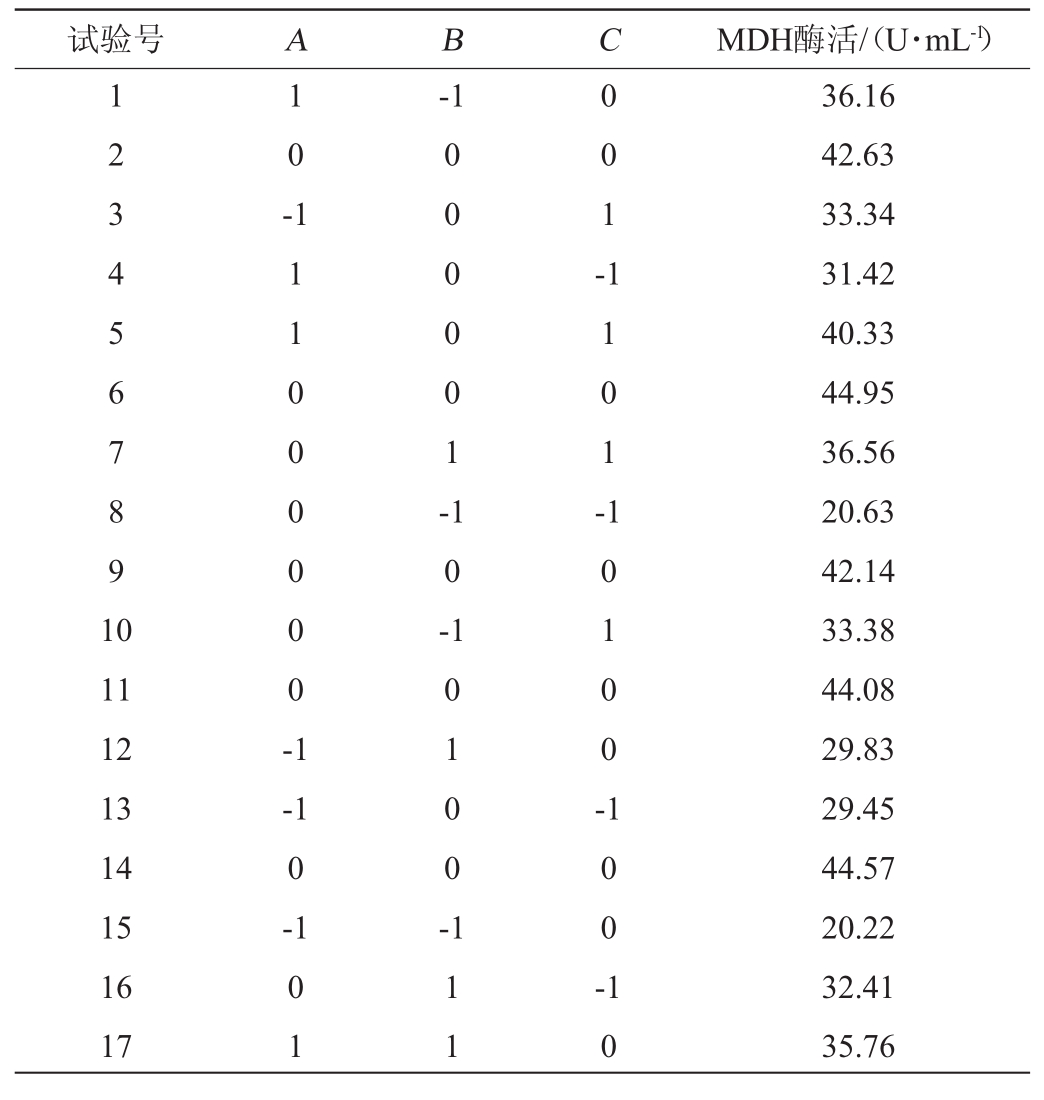
试验号A B C MDH酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 1 0 --1 0 0 0 0 0 1 -0 0 1 -1 1 1 0 0 0 0 0 0 -1 1 0 -1 1 0 1 -11 12 13 14 15 16 17-1 0-1 1 0 1 0 0 -1 0 1 0 0 -0 1 1 1 1 1 0 0 -1 0 36.16 42.63 33.34 31.42 40.33 44.95 36.56 20.63 42.14 33.38 44.08 29.83 29.45 44.57 20.22 32.41 35.76
表7 回归模型方差分析
Table 7 Variance analysis of the quadratic model
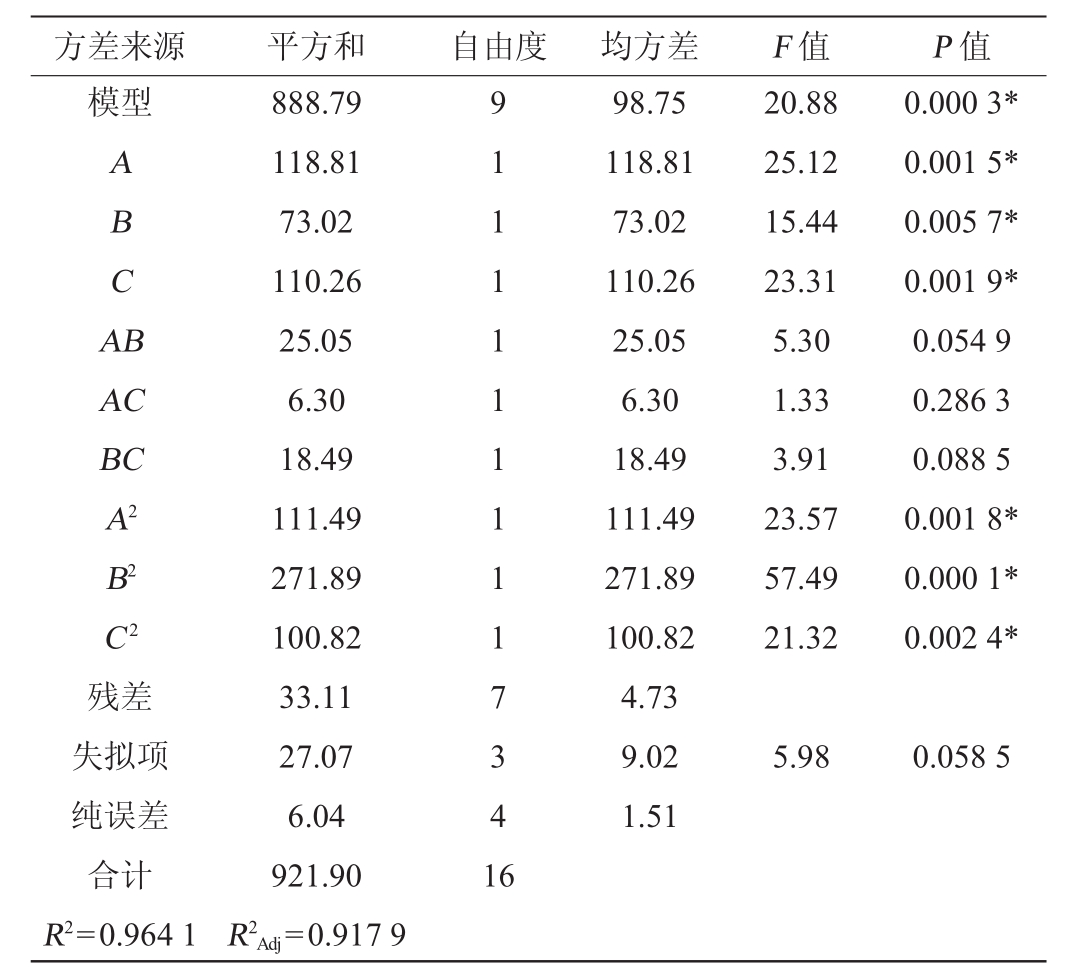
注:“*”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方差 F值 P值模型ABCA B AC BC A2 B2 C 2 20.88 25.12 15.44 23.31 5.30 1.33 3.91 23.57 57.49 21.32 0.000 3*0.001 5*0.005 7*0.001 9*0.054 9 0.286 3 0.088 5 0.001 8*0.000 1*0.002 4*残差失拟项纯误差合计R2=0.964 1 888.79 118.81 73.02 110.26 25.05 6.30 18.49 111.49 271.89 100.82 33.11 27.07 6.04 921.90 R2Adj=0.917 9 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 98.75 118.81 73.02 110.26 25.05 6.30 18.49 111.49 271.89 100.82 4.73 9.02 1.51 5.98 0.058 5
由表7可知,所选回归模型的P值<0.01,表明整体模型对试验结果具有极显著的影响,具有可信度;失拟项的P值为0.058 5>0.05,失拟项的检验不显著,模型选择适当。该模型的决定系数R2为0.9641,校正决定系数R2Adj为0.9179,表明模型可信度很高。MDH酶活性(Y)对发酵温度(A)、葡萄糖添加量(B)、转速(C)的多元二次方程为:Y=43.67+3.85A+3.02B+3.71C-2.50AB+1.25AC-2.15BC-5.15A2-8.04B2-4.89C 2。该回归方程可用于代替试验实际点进行初步分析和预测[22-24]。
利用Design-Expert8.0.6软件绘制响应面曲线图,结果见图12。由图12可知,经软件分析,响应值存在最大值,得出最适发酵条件为发酵温度27.04℃,葡萄糖添加量10.2 g/L,转速154.18r/min,软件分析预测最大酶活为45.34U/mL。为了便于试验操作,将发酵条件修改为发酵温度27℃,葡萄糖添加量10g/L,转速150r/min。在此条件下进行5次验证试验,平均酶活为43.67 U/mL,接近理论值,表明响应面法得到的最佳条件准确可靠。优化后的酶活比优化前的22.07 U/mL提高了197.87%。
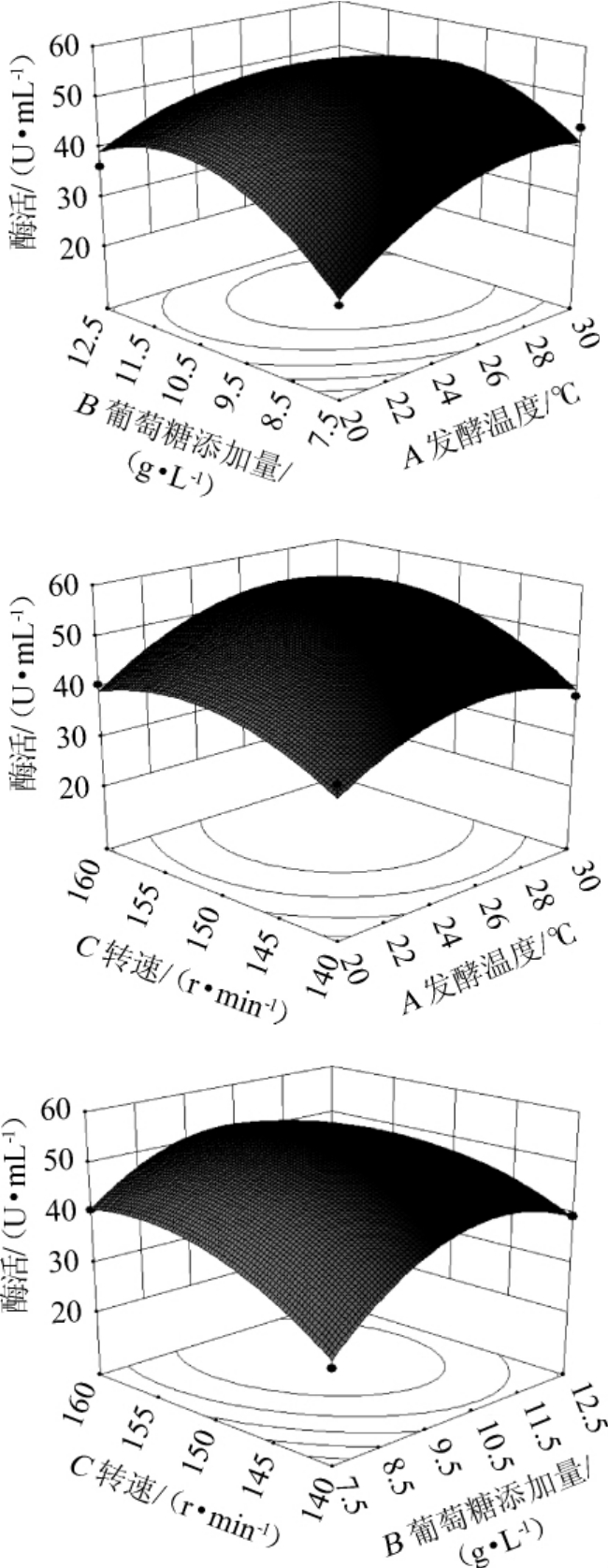
图12 发酵温度、葡萄糖添加量和转速交互作用对苹果酸脱氢酶活力影响的响应曲面与等高线
Fig.12 Response surface plots and contour line of effects of interaction between fermentation temperature,glucose addition and shaking speed on MDH activity
3 结论
本研究以单因素为基础,采用响应面试验对墓画大洋芽孢杆菌(Oceanobacillus picturae)XJH-11产MDH发酵条件进行研究,得到最佳发酵条件:发酵培养基为葡萄糖10 g/L、酵母膏20 g/L、硫酸镁0.1 g/L、初始pH值为8.0,最优发酵条件为发酵温度27℃、摇床转速150 r/min、接种量5%、装液量125 mL/500 mL。在此优化条件下,MDH酶活为43.67 U/mL,比优化前提高了197.87%。
[1]吴军林,吴清平,张菊梅,等.L-苹果酸生物合成研究进展[J].食品科学,2014,35(3):238-242.
[2]TAKAHASHIINIGUEZ T,ABURTO R,NVILCHIS G A,et al.Function,kinetic properties,crystallization,and regulation of microbial malate dehydrogenase[J].J Zhejiang Univ-Sci B,2016,17(4):247-261.
[3]AN Y,CAO Y,XU Y.Purification and characterization of the plastid-localized NAD-dependent malate dehydrogenase from Arabidopsis thaliana[J].Biotechnol Appl Biochem,2016,63(4):490-496.
[4]王庆杰.苹果细胞质苹果酸脱氢酶基因的抗逆功能鉴定及机制研究[D].泰安:山东农业大学,2016.
[5]CHEN K H,LEE S Y,SHOW P L,et al.Direct recovery of malate dehydrogenase from highly turbid yeast cell homogenate using dye-ligand affinity chromatography in stirred fluidized bed[J].J Chromatogr B,2018,1100-1101:65-75.
[6]曾英杰.荔枝酒发酵过程中酿酒酵母Ydcs101代谢醋酸的调控研究[D].海口:海南大学,2015.
[7]常平平,郝艳红,周遵武,等.食品中柠檬酸快速检测试剂盒的研制[J].中国酿造,2015,34(3):111-114.
[8]肖景惠,张庆芳,于爽,等.微生物中苹果酸脱氢酶研究现状及展望[J].中国酿造,2018,37(8):14-18.
[9]王俊,杨晓霞,魏云林,等.深黄被孢霉苹果酸脱氢酶基因的克隆和表达[J].中国微生态学杂志,2017,29(9):993-997.
[10]崔锦锦,季秀玲,林连兵,等.一个深黄被孢霉苹果酸脱氢酶基因的克隆与表达[J].生命科学研究,2017,21(3):208-212.
[11]刘俊.Thermus Thermophilus HB27苹果酸脱氢酶基因的克隆表达、酶抑制动力学及蛋白折叠研究[D].杭州:浙江理工大学,2010.
[12]龚韧,孙艳,王静,等.猪心肌苹果酸脱氢酶的制备及应用[J].食品与生物技术学报,2008,27(5):57-61.
[13]张翔,张彦昊,刘孝永,等.产壳聚糖酶菌株ncps116发酵条件优化及其酶学性质[J].化工进展,2018,37(6):2354-2363.
[14]周新尚,逄飞,窦少华,等.海洋生淀粉酶菌株发酵条件响应面优化[J].中国酿造,2017,36(7):80-84.
[15]吴优,周卫,李尧益,等.Arthrobacter ureafaciens CZ31丙氨酸脱氢酶可溶性表达及产酶条件优化[J].微生物学报,2017,57(12):1778-1787.
[16]肖冬来,张迪,林衍铨,等.金属离子对香菇纤维素酶、漆酶和木质素过氧化物酶活性的影响[J].中国食用菌,2018,37(3):56-58.
[17]王茜茜.基于iTRAQ技术对耐盐植物乳杆菌FS5-5的蛋白质组学分析[D].沈阳:沈阳农业大学,2016.
[18]宋爱荣,田雪梅.不同装瓶量对樟芝液体深层培养的影响[C].中国海峡两岸菌物学学术研讨会论文集.北京:中国菌物学会,2004:3-6.
[19]陈志杰,韩永斌,沈昌,等.Plackett-Burman设计在灵芝生长及产胞外多糖主要影响因子筛选中的应用[J].食品科学,2005,26(12):115-118.
[20]郭琪,杨晖.Plackett-Burman设计法筛选影响桃儿七内生真菌Penicillium sp.XJ产鬼臼类物质发酵培养的主要因子[J].内蒙古农业大学学报(自然科学版),2015,36(4):83-87.
[21]孟利强,赵晓宇,陈静宇,等.响应面法优化枯草芽孢杆菌B91发酵培养基[J].安徽农业科学,2015,43(25):26-29.
[22]林秀芳,尹文哲,张智,等.基于design-expert软件设计优化动物双歧杆菌培养条件工艺[J].食品研究与开发,2017,38(7):144-148.
[23]孙丽娜,范英兵,胡冬慧,等.响应面优化纤维素酶提取蓝莓多糖工艺研究[J].食品研究与开发,2017,38(23):57-60.
[24]刘水英,李新生,党娅,等.响应面法优化紫山药花青苷提取工艺及其抗氧化活性[J].食品科学,2014,35(22):84-91.