米酒是典型的、以糯米为原料发酵而成的酿造酒,乙醇和高级醇是米酒主要的醇类物质,其含量直接影响米酒的口感及风味。高级醇主要由正丙醇、异丁醇、异戊醇、己醇、β-苯乙醇组成,在发酵过程中经由糖代谢、氨基酸机构化途径形成[1]。研究表明[2-4],适量的高级醇可以丰富酒的口感及风味,但超过一定浓度时,酒体变得不协调,饮后容易出现头晕、后苦、上头等症状,长时间积累于体内而造成机体损伤[5],甚至死亡[6]。
目前,发酵酒中高级醇的测定方法有分光光度法、气相色谱(gas chromatography,GC)法及气相色谱-质谱联用(GC-MS)法。米酒酒精度较低,用国标GB/T 13662—2018《黄酒》中的酒精计法测定时,蒸馏过程操作繁琐、浪费材料,且误差大[7]。随着毛细管柱的发展,以其较高的柱效、优异的惰性等优点,被广泛应用[8]。GC对高级醇的测定多采用WAX和FFAP等色谱柱[9],其研究对象多为啤酒和白兰地[10-11]。国内外对于发酵酒中乙醇及高级醇的分析检测研究较多,曾诗雨等[12]用超纯水处理标样采集色谱数据建立校正表,固相微萃取-气相色谱(solid phase microextractiongaschromatography,SPME-GC)法测定米酒中的乙醇;林玲等[13]采用直接进样,HP-INNOWAX柱测定黄酒中高级醇含量;CHUNG H等[14]采用直接进样,CP WAX-57柱测定韩国米酒中甲醛、高级醇含量;卢珍华等[15]采用蒸馏结合GC的方测定糯米酒中高级醇。但目前气相色谱对乙醇及高级醇测定的研究仅限于成品酒,米酒酿造过程中的乙醇及高级醇检测鲜有研究。无论直接进样或蒸馏后超纯水定容再进样,都有大量水进入色谱柱而造成固定相流失,缩短色谱柱的寿命;对酿造过程中乙醇及高级醇含量测定方法的研究,有利于及时把控米酒酿造情况、改善因米酒高级醇含量高而等实际生产问题。对于米酒酿造业的发展具有深远意义。
本研究以米酒发酵酒为对象,甲醇作为溶剂数倍稀释处理,致力于建立米酒酿造过程中,对乙醇、丙醇、β-苯乙醇、正丙醇、异丁醇、异戊醇、己醇等多种醇同时测定的方法,为米酒酿造酒在生产中,对酒精度及高级醇含量的控制提供基础数据,对把控米酒酿造生产和产品的控制具有深远意义。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
米酒:实验室自制。
1.1.2 试剂
乙醇、正丙醇、异丁醇、异戊醇、己醇、β-苯乙醇(纯度均≥99.95%):美国Sigma-Aldrich公司;甲醇(色谱纯):台湾昌泰有限公司。
1.2 仪器与设备
Agilent 7890A型气相色谱仪(配有7693自动进样器、10μL自动进样针、HP-INNOWAX(30m×0.25mm×0.25μm)色谱柱):美国安捷伦公司;FA1004电子分析天平:上海良平仪器仪表有限公司。
1.3 方法
1.3.1 色谱条件
参照《色谱理论基础》[16],选用不同极性色谱柱:强极性柱HP-INNOWAX(30 m×0.25 mm×0.25 μm)[13]、弱极性柱HP-5(30 m×0.25 mm×0.25 μm)[17]、中强极性柱DB-FFAP(30 m×0.25 mm×0.25 μm)[18]作为乙醇及高级醇定量分析的目标色谱柱。由于溶剂甲醇与乙醇沸点较低且较接近,高级醇各组分之间的沸点跨度较宽,选择分流进样、程序升温的方式采集数据,以初始温度(35℃、40℃、45℃、50 ℃、55 ℃),分流比(20∶1、30∶1、40∶1、50∶1、60∶1)、空气流量(200 mL/min、250 mL/min、300 mL/min、350 mL/min、400 mL/min)、升温速率(第一阶段(8℃/min、12℃/min、16℃/min、20℃/min)、第二阶段(30℃/min、40℃/min、50℃/min、60℃/min))等,以分离度R,保留值(k')及分析时间(tm)为分离柱柱效的依据确定色谱条件。
1.3.2 色谱峰的定性
量取各组分高级醇标准品5 μL、乙醇1 mL分别装入10 mL容量瓶中,用甲醇定容;得到单一标准液;分别取单一标准液1 mL至10 mL容量瓶混合并用甲醇定容。先用混合溶液进样,分析色谱图出峰情况,确定色谱柱以及色谱条件;再单一标准品溶液进样,确定各组分保留时间。
1.3.3 乙醇及高级醇的定量
定量方法:外标法
取乙醇、正丙醇、异丁醇、异戊醇、己醇、β-苯乙醇,用甲醇定容,配制得到1#~8#梯度浓度6种醇的混合标准溶液。
按照优化的色谱条件,标准品梯度浓度由低到高的顺序:1#~8#标样依次进样,每个浓度进样3次,以各组分标样梯度浓度为横坐标,3次测定峰面积的平均值为纵坐标,建立校正表,得到各组分的定量线性关系;将混合标准溶液不断稀释浓度进样分析,记录信噪信号值,确定各组分的定量限及检出限。
1.3.4 验证试验
(1)重复性和稳定性:取米酒25 mL,用甲醇定容至50 mL,静置30 min,过0.22 μm有机膜,双通道同时进样,每1d测定一次,连续测定5 d,每次重复3次,每次测定结果为3次测定的峰面积均值,并计算各组分的相对标准偏差(relative standard deviation,RSD)。
(2)精密度:取10 mL实验室发酵米酒加入50 mL容量瓶,用甲醇定容,静置30 min,过0.22 μL有机膜,双通道同时进样,连续进样5次,外标法定量,并计算各组分的RSD。
(3)准确度:量取10 mL的米酒发酵液20份,5份一组(4组),1组用甲醇定容至50 mL,作为本底值,另外3组分别加0.5mL1.3.3中配制的混合标准溶液3#、5#、6#,用甲醇定容为50mL,静置30min,过膜,进样分析。计算各组分的回收率,回收率=(加标样品测定值-样品测定值)/加标值×100%[19]。
1.3.5 酒样的处理及分析
分别量取10mL、5mL、2mL、1mL米酒发酵液于10mL容量瓶中,用甲醇定容稀释(1、2、5、10)倍,静置30 min(沉淀多糖及蛋白质等大分子絮状物),取上清液过0.22 μm有机膜,进样分析。
2 结果与分析
2.1 优化色谱条件
对三根不同极性色谱柱进行柱效分析比较,结果见表1。
表1 色谱柱的分离柱效
Table 1 Separation column efficiency of chromatographic columns
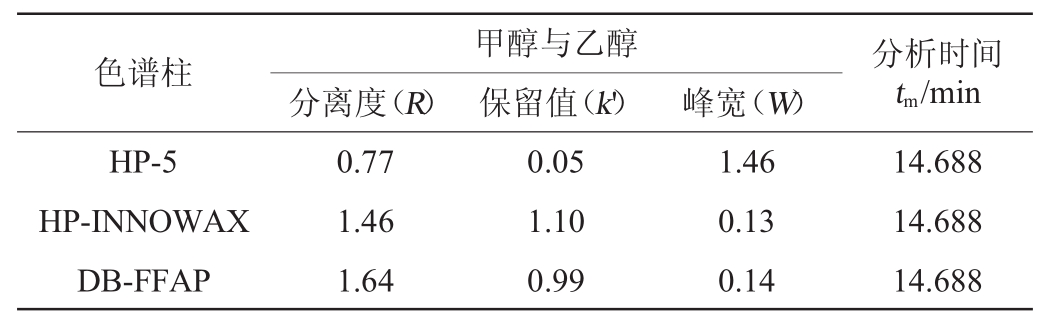
色谱柱 分析时间tm/min HP-5 HP-INNOWAX DB-FFAP分离度(R)甲醇与乙醇保留值(k')峰宽(W)0.77 1.46 1.64 0.05 1.10 0.99 1.46 0.13 0.14 14.688 14.688 14.688
HP-5色谱柱的气相色谱图如图1所示,甲醇与乙醇的分离度(R)<1,k'<0.2(在tm少的同时,0.2≤k'≤20时,色谱柱分离度效果越好)[20],两者的分离效果不佳,通过改变色谱条件,也不能改善甲醇与乙醇的分离效果。因此,HP-5色谱柱不适合测定以甲醇为溶剂的乙醇酒样。
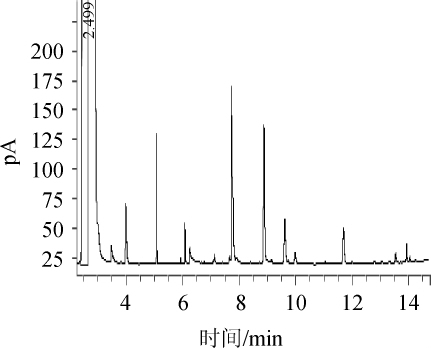
图1 HP-5色谱柱测定酒样的气相色谱图
Fig.1 Gas chromatogram of wine sample with HP-5 column
色谱柱DB-FFAP和HP-INNOWAX的标准品气相色谱图见图2。
由图2可知,第一个色谱峰为溶剂甲醇,乙醇及各高级醇与酒样谱图一一对应且彼此分离。由表1和图2分析优化得到本实验的最佳气相色谱条件如下:进样量1 μL;分流比为40∶1;进样口、检测器温度250 ℃;氢气流量30 mL/min;空气流量300mL/min;分流流量40mL/min;总流量44mL/min;进样器温度250℃;平均线速度25.812cm/s;柱流量1.0mL/min;程序升温:初始温度45℃,保持3min,16℃/min升温至120℃,保持3 min,以50℃/min升温至220℃,保持2 min。
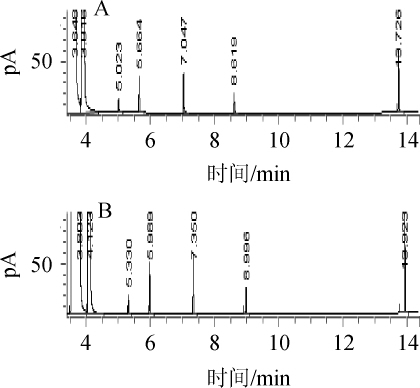
图2 DB-FFAP(A)和HP-INNOWAX(B)色谱柱条件下混合标准品的气相色谱图
Fig.2 Gas chromatogram of mixed standards with DB-FFAP(A)and HP-INNOWAX(B)columns
DB-FFAP和HP-INNOWAX色谱柱的色谱图峰形对称,各高级醇组分均能完全分离,甲醇与乙醇峰均有重叠,通过调节分流比、升温速率、进样量等实现色谱条件,使得甲醇峰与乙醇峰实现完全分离;本研究就色谱柱HP-INNOWAX及色谱柱DB-FFAP采用双通道进样方法做进一步验证实验。
2.2 组分的定量关系及检测限
双通道色谱柱同时进行数据采集,以信噪比为10(S/N≈10)为定量限浓度,接近信噪比为3(S/N≈3)为检测限浓度,以质量浓度(X)为横坐标,峰面积(Y)为纵坐标,建立线性方程。得到表2所示的线性范围、相关系数R2、定量限(limit of quantitation,LOQ)及检出限(limit of detection,LOD)等。
表2 DB-FFAP和HP-INNOWAX色谱柱分析各组分的线性关系、相关系数、检出限、定量限
Table 2 Linear relation,correlation coefficient,LOD and LOQ of each component analysis by DB-FFAP and HP-INNOWAX chromatographic columns
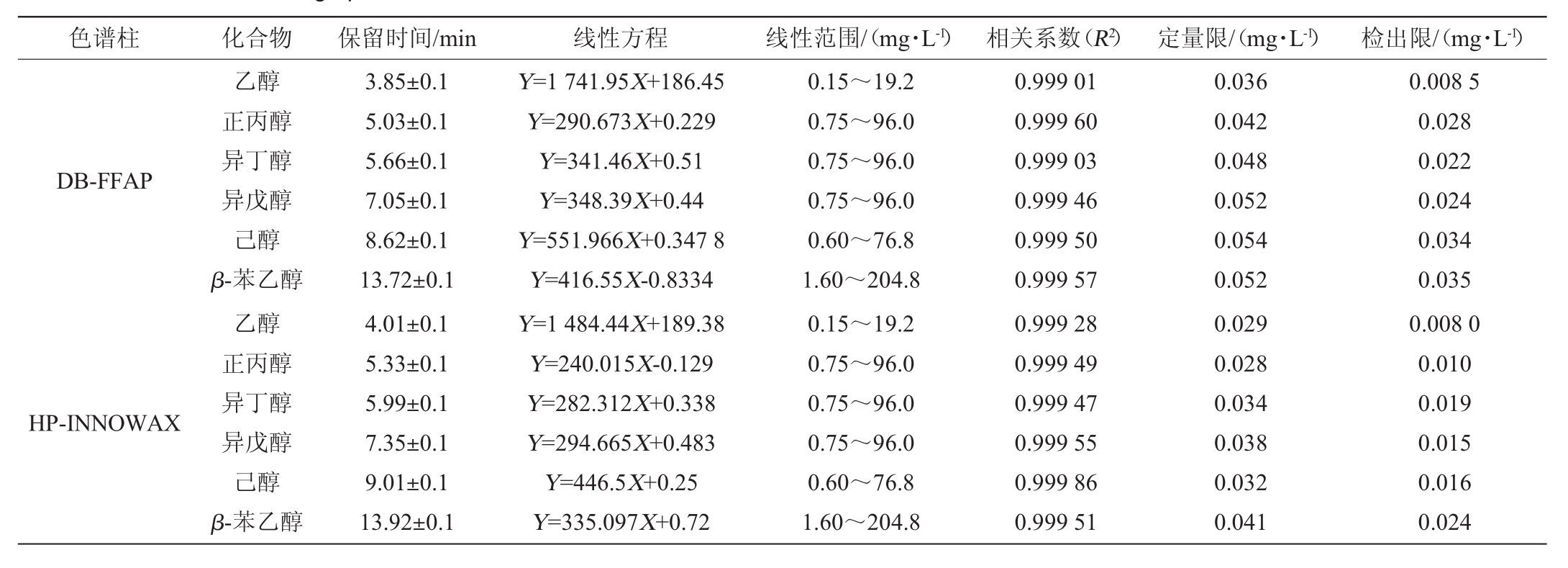
色谱柱化合物保留时间/min线性方程线性范围/(mg·L-1)相关系数(R2)定量限/(mg·L-1)检出限/(mg·L-1)DB-FFAP HP-INNOWAX乙醇正丙醇异丁醇异戊醇己醇β-苯乙醇乙醇正丙醇异丁醇异戊醇己醇β-苯乙醇3.85±0.1 5.03±0.1 5.66±0.1 7.05±0.1 8.62±0.1 13.72±0.1 4.01±0.1 5.33±0.1 5.99±0.1 7.35±0.1 9.01±0.1 13.92±0.1 Y=1 741.95X+186.45 Y=290.673X+0.229 Y=341.46X+0.51 Y=348.39X+0.44 Y=551.966X+0.347 8 Y=416.55X-0.8334 Y=1 484.44X+189.38 Y=240.015X-0.129 Y=282.312X+0.338 Y=294.665X+0.483 Y=446.5X+0.25 Y=335.097X+0.72 0.15~19.2 0.75~96.0 0.75~96.0 0.75~96.0 0.60~76.8 1.60~204.8 0.15~19.2 0.75~96.0 0.75~96.0 0.75~96.0 0.60~76.8 1.60~204.8 0.999 01 0.999 60 0.999 03 0.999 46 0.999 50 0.999 57 0.999 28 0.999 49 0.999 47 0.999 55 0.999 86 0.999 51 0.036 0.042 0.048 0.052 0.054 0.052 0.029 0.028 0.034 0.038 0.032 0.041 0.008 5 0.028 0.022 0.024 0.034 0.035 0.008 0 0.010 0.019 0.015 0.016 0.024
由表2可知,乙醇含量为0.3%vol~19.2%vol,5种高级醇的含量为1.2~204.8 mg/L,DB-FFAP和HP-INNOWAX色谱柱的峰面积与含量的线性关系均良好,各组分的相关系数R2在0.999 01~0.999 86,R2均>0.999,定量限范围分别为0.42~0.056 mg/L和0.028~0.041 mg/L,检出限范围分别为0.022~0.039 mg/L和0.010~0.024 mg/L,两根色谱柱测定乙醇性能相似,测定高级醇时,HP-INNOWAX色谱柱较DB-FFAP色谱柱的检出限低。说明在一定浓度范围内,两根色谱柱在本研究的色谱条件下,6种醇分析检测的线性关系良好。
2.3 方法的重复性试验

图3 DB-FFAP(A)和HP-INNOWAX(B)色谱柱分析各组分的重现性试验结果
Fig.3 Results of reproducibility tests of each component analysis by DB-FFAP(A)and HP-INNOWAX(B)chromatographic columns
采用双通道DB-FFAP和HP-INNOWAX色谱柱对5倍甲醇处理的发酵米酒同时进行5次数据采集,6种醇的峰面积如图3所示。
由图3可知,DB-FFAP和HP-INNOWAX色谱柱各组分的峰面积表现平稳,没有太大差异,且色谱柱DB-FFAP与HP-INNOWAX各组分峰面积的RSD分别在0.1%~1.9%和0.1%~1.5%范围内波动,说明发酵酒样在稀释5倍时,DB-FFAP和HP-INNOWAX色谱柱的重复性均良好。
2.4 方法的精密度试验
采用双通道DB-FFAP和HP-INNOWAX色谱柱对5倍甲醇处理的发酵米酒,同时进样分析测定5次,测定结果见表3。
表3 DB-FFAP和HP-INNOWAX色谱柱分析各组分的精密度试验结果
Table 3 Results of precision tests of each component analysis by DB-FFAP and HP-INNOWAX chromatographic columns

色谱柱 化合物平均值/(mg·L-1)标准差 RSD/%1 2含量/(mg·L-1)3 4 5 DB-FFAP HP-INNOWAX乙醇(%vol)丙醇异丁醇异戊醇己醇β-苯乙醇乙醇(%vol)丙醇异丁醇异戊醇己醇β-苯乙醇12.25 41.70 91.75 82.70 69.05 121.10 12.55 50.60 83.60 76.75 60.25 111.20 11.95 39.10 84.25 81.30 65.70 142.15 12.15 48.90 88.20 78.35 57.35 104.95 12.15 39.70 94.70 74.30 66.30 132.55 12.70 48.20 88.10 74.70 56.25 106.15 11.55 42.85 91.05 76.25 74.80 167.75 12.40 46.90 90.45 81.05 55.95 109.25 13.35 44.30 82.25 76.95 66.85 158.40 12.25 47.35 86.40 80.60 57.65 108.35 12.25 41.70 91.75 82.70 69.05 121.10 12.41 48.39 87.35 78.29 57.49 107.98 1.12 2.16 5.29 3.55 3.72 18.91 0.22 1.46 2.54 2.66 1.70 2.48 8.97 5.21 5.96 4.53 5.43 13.09 1.79 3.01 2.91 3.39 2.96 2.30
由于测定结果的相对标准偏差(relative standard devi ation,RSD)数值越低,方法的精密度越高[21]。由表3可知,在测定稀释5倍的米酒发酵液时,色谱柱HP-INNOWAX各组分的RSD在1.79%~3.39%范围内(<5%),但DB-FFAP色谱柱除异戊醇的RSD=4.53%外,其他成分的RSD均>5%,且测定β-苯乙醇的RSD高达13.09%。结果表明,色谱柱HP-INNOWAX测定稀释5倍的米酒发酵液精密度良好。
2.5 方法的加标回收率试验
向样品中加标测定加标回收率验证方法的准确度。测定加入高、中、低3个水平的回收率及平均回收率,结果如表4所示。
由表4可知,6种醇类的平均回收率在90.89%~96.53%范围内,RSD为0.11%~3.02%(<5%)。结果表明,此方法检测米酒发酵液中乙醇及高级醇含量的误差小,在一定范围内,满足样品测定的要求,表明该方法的测定结果准确度较高。
表4 HP-INNOWAX色谱柱分析各组分的加标回收率试验结果
Table 4 Results of standard recovery rate tests of each component analysis by HP-INNOWAX chromatographic column

化合物 本底值/(mg·L-1)加标量/(mg·L-1)测定值/(mg·L-1)回收率/%平均回收率/%RSD/%乙醇(%vol)12.5796.321.23正丙醇47.9 0.6 2.4 4.8 3 12 24 13.15 14.85 17.24 50.66 58.93 70.01 96.67 95.00 97.29 92.00 91.92 92.13 92.020.11
续表
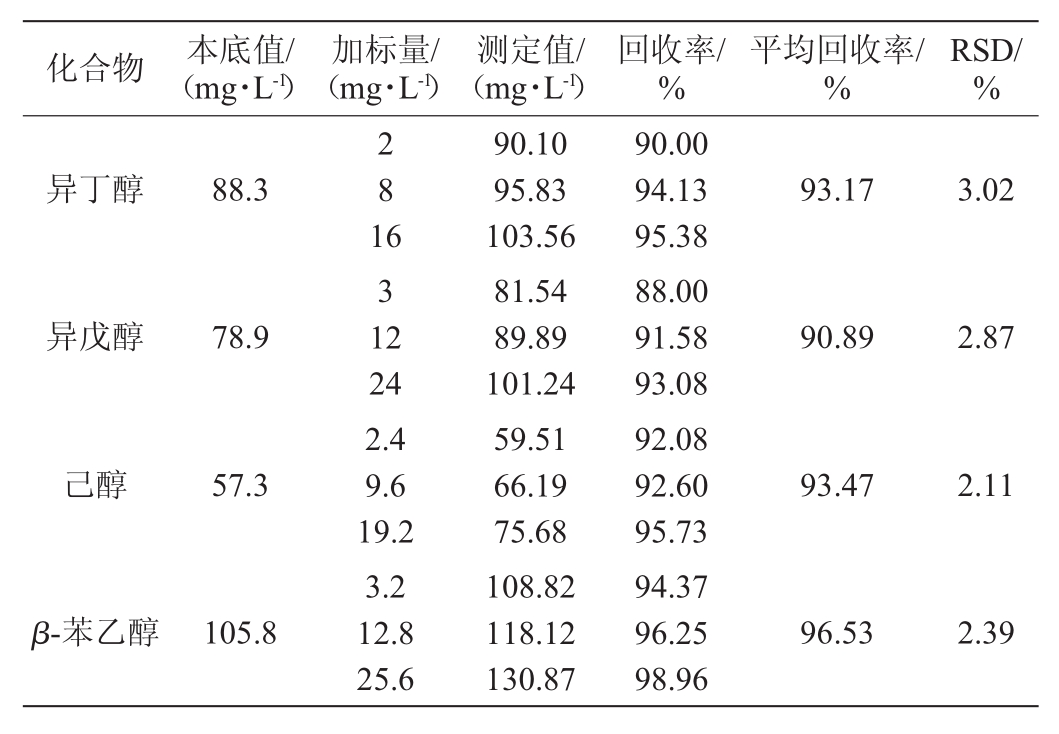
化合物 本底值/(mg·L-1)加标量/(mg·L-1)测定值/(mg·L-1)回收率/%平均回收率/%RSD/%异丁醇88.3 2 8 1 93.173.02异戊醇78.9 6 3 1 2 90.892.87己醇57.393.472.11 β-苯乙醇105.8 24 2.4 9.6 19.2 3.2 12.8 25.6 90.10 95.83 103.56 81.54 89.89 101.24 59.51 66.19 75.68 108.82 118.12 130.87 90.00 94.13 95.38 88.00 91.58 93.08 92.08 92.60 95.73 94.37 96.25 98.96 96.532.39
2.6 米酒样品中6种醇的测定
在发酵前期,发酵体系含大量水系和有机大分子,用甲醇作溶剂分别1倍、2倍、5倍、10倍稀释酒样,解决因直接进样而导致的进样针推阻和柱流失问题色谱柱HP-INNOWAX外标定量测定米酒发酵液不同倍数稀释下各组分的含量,结果见表5。
表5 不同稀释倍数米酒乙醇及高级醇含量测定结果及相对标准差
Table 5 Determination results and relative standard deviation of ethanol and higher alcohol contents in rice wine with different dilution ratio
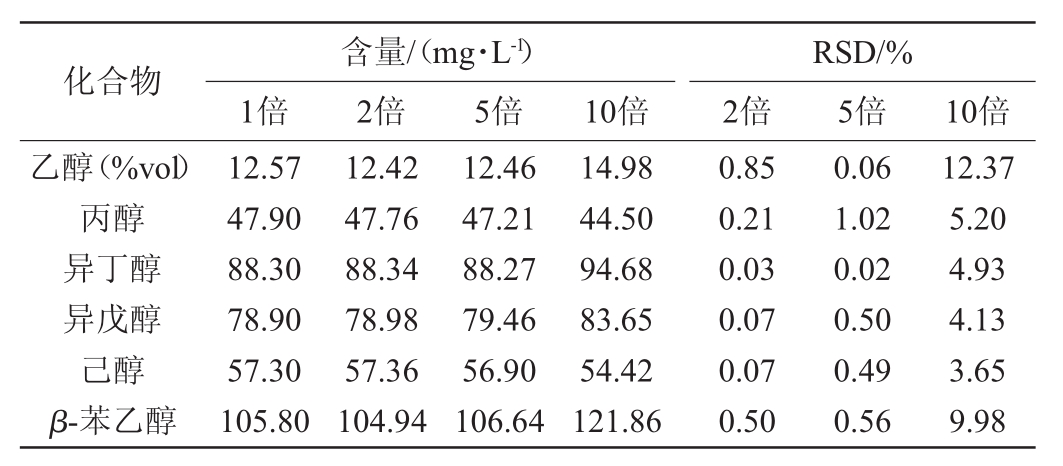
化合物乙醇(%vol)丙醇异丁醇异戊醇己醇β-苯乙醇含量/(mg·L-1)1倍 2倍 5倍 2倍10倍RSD/%5倍 10倍12.57 47.90 88.30 78.90 57.30 105.80 12.42 47.76 88.34 78.98 57.36 104.94 12.46 47.21 88.27 79.46 56.90 106.64 14.98 44.50 94.68 83.65 54.42 121.86 0.85 0.21 0.03 0.07 0.07 0.50 0.06 1.02 0.02 0.50 0.49 0.56 12.37 5.20 4.93 4.13 3.65 9.98
由表5可知,与原液酒样对比,稀释2倍~5倍时RSD值均<5%,分析结果与原液测定值差异不大,但当稀释10倍浓度时,除异丁醇、异戊醇、己醇RSD<5%外,其他醇测定值偏差较大。因此,本方法确定以甲醇稀释5倍米酒发酵液为样品前处理,直接进样分析测定米酒中乙醇及高级醇的含量。
3 结论
本研究以米酒为研究对象,建立米酒酿造过程中乙醇及高级醇含量的测定方法,通过优化色谱条件,选择出分离效果较好的色谱柱DB-FFAP和HP-INNOWAX;5倍甲醇稀释处理,双通道色谱柱同时进样分析比较,两根色谱柱的精密度实验验证:色谱柱DB-FFAP的RSD高达16%,色谱柱HP-INNOWAX各种醇的RSD均小于5%,表明DB-FFAP色谱柱不适合本方法对米酒发酵过程对乙醇及高级醇的测定;用HP-INNOWAX色谱柱做高、中、低3种不同加标浓度的回收率试验,平均回收率为90.89%~96.53%,RSD<5%。与前人研究方法比较,本研究方法样品分析时间短,用时14.88 min,由此表明,HP-INNOWAX色谱柱的稳定性、重现性和准确度均良好,并且省时;综合考虑进样针及色谱柱等耗材的维护及损耗,不同倍数甲醇处理酒样的色谱分析,确定5倍甲醇稀释发酵米酒酒样。该方法省时,高效、稳定、准确,且实用性强,可应用于米酒酿造工业生产上对乙醇及高级醇的实时监测。
[1]黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018.37(1):7-11.
[2]张兴亚,林玲,蒋予箭.黄酒中高级醇含量控制的研究进展[J].中国酿造,2011,30(10):13-17.
[3]黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018,37(1):7-11.
[4]戈瑚瑚,倪莉.黄酒饮后产生上头上火的原因探究[J].食品与发酵工业,2010,36(8):136-139.
[5]CHUNG H,MI K Y,KIM M,et al.Volatile hazardous compounds in alcoholic beverages[J].J Appl Biol Chem,2012,55(3):141-148.
[6]SZCS S,SARVARY A,MCKEE M.Could the high level of cirrhosis in central and eastern Europe be due partly to the quality of alcohol consumed?An exploratory investigation[J].Addiction,2005,100(4):536-543.
[7]曾朝珍,张永茂,康三江,等.发酵酒中高级醇的研究进展[J].中国酿造,2015,34(5):11-15.
[8]杜利敏,陈宁宁,袁野.毛细管柱气相色谱法测定白酒中乙醇的浓度[J].医药论坛杂志,2015,36(3):64-65.
[9]CHI C,BAI F,XIAOYAN L I,et al.Determination of methanol and higher alcohols content in jujube brandy in different aging containers by capillary GC[J].Liquor-Making Sci Technol,2015,24(4):105-108.
[10]YANG X L,LUO Z M,HU S P,et al.Reducing total higher alcohol content in high gravity fermentation of beer[J].Food Sci,2011,32(9):188-192.
[11]白凤岐,迟超逸,王迪,等.毛细管气相色谱法测定红枣白兰地中甲醇、乙酸乙酯、高级醇含量[J].食品工业科技,2014,35(24):57-60.
[12]曾诗雨,赵丽丽,王可兴,等.固相微萃取-气相色谱法测定全麦酒酿中乙醇含量[J].食品安全质量检测学报,2017,8(4):1397-1403.
[13]林玲,王丽,张兴亚,等.气相色谱法测定黄酒中的高级醇[J].中国酿造,2011,30(5):170-172.
[14]CHUNG H,MI K Y,HAN J,et al.Evaluation of volatile organic compounds in alcoholic beverages consumed in Korea[J].J Kor Soc Appl Biol Chem,2015,58(3):423-432.
[15]卢珍华,杨秋明,彭莺.毛细管气相色谱法测定糯米酒中的甲醇、乙酸乙酯和杂醇油[J].食品研究与开发,2006,27(6):123-125.
[16]卢佩章,戴朝政.色谱理论基础[M].北京:科学出版社,1989:165-206.
[17]黄振波.气相色谱法测定酒中氨基甲酸乙酯[J].现代食品,2016,3(6):74-76.
[18]殷德荣.毛细管气相色谱法测定绍兴黄酒中挥发性物质[J].中国卫生检验杂志,2006,16(8):930-931.
[19]王芹,冯景春,冯开.气相色谱法及其应用[J].广东化工,2014,41(12):202-202.
[20]孟玉,郑伟.气相色谱分析方法的选择和优化[J].口腔护理用品工业,2010,20(3):44-46.
[21]TENG Y,QUN P,ZHAI X,et al.Study on colorimetric method and content determination of total phenol in homemade plum wine[J].Med Plant,2017,8(1):22-26.