海参是高蛋白、低脂肪、低胆固醇的滋补品[1],不仅富含蛋白质、人体必需氨基酸以及各种微量元素、维生素等,而且含有许多生物活性物质(如海参多糖、海藻皂苷、胶原蛋白、海参肽以及脑苷酯等),具有很高的营养价值[2-3]。但随着我国海参养殖规模的不断扩大,海参疾病的不断爆发,成为制约海参养殖的瓶颈问题[4]。在海参的消化道和体壁之间具有空腔,其中充满液体和悬浮的类似于人体血细胞的体细胞,海参的细胞免疫均由体细胞完成,体液免疫应答基于体腔细胞分泌的各种免疫因子进入体腔[5]。
我国沿海具有丰富的海藻资源,其中海带含有丰富的褐藻胶、甘露醇、蛋白质、碘、钠、钾、钙、镁和多种维生素等营养成分[6],因其具有易获得、成本低、营养价值高等优点成为海参养殖产业中理想的天然饲料,但海带因其所含多糖组分达50%,在饲喂海参过程中往往会使养殖水体发粘,使养殖水易滋生细菌,从而诱发海参病变[6]。目前国内外常用的海带多糖降解的方法分为化学降解法,物理降解法和生物降解法[7-8]。其中生物降解法即酶解是用专一性糖苷酶或非专一性酶通过特异性开裂多糖中的某一糖苷键,对多糖进行酶解。较之化学法及物理法具有条件温和,降解产物分子量易于控制、效率高、污染小等优点[9],是国内外学者的研究热点。
本研究利用实验室菌株假单胞菌(Pseudoalteromonas)H0-5的粗酶液对海带进行酶解,将海带中多糖降解为3~5种聚合度不同的寡糖。使用具有抑菌活性并能调节海参免疫作用的海带寡糖和酶解海带泥饲喂海参,这样不仅保留了海带原有的营养价值,更消除了因未被海参消化的海带多糖造成的水体黏稠继而滋生病原微生物等的负面影响,既能抑制水体微生物的生长,也能调节海参免疫功能,从而提高海参的抗病能力,达到海参绿色健康养殖预防海参病害发生的目的[10-13]。因此,海带酶解产物在海参健康养殖中具有很大的开发价值及意义。
本研究混合不同比例海带酶解产物饲喂海参,通过定期监控海参体质量变化及测定海参体壁相关免疫因子(超氧化物歧化酶(superoxide dismutase,SOD)、酸性磷酸酶(acidphosphatase,ACP)、碱性磷酸酶(alkaline phosphatase,AKP)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)及丙二醛(malondialdehyde,MDA)含量),探究酶解海带产物对海参体质量及免疫相关酶活性的影响。为研制具有免疫调节功能的绿色海参饵料奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
假单胞菌(Pseudomonassp.)H0-5:本实验室保藏。海参:大连北大水产有限公司。
1.1.2 化学试剂
铁氰化钾(分析纯)、苯酚(分析纯):天津市科密欧化学试剂有限公司;无水乙酸钠(分析纯):天津市风船化学试剂科技有限公司;硼酸(分析纯):天津博迪化学股份有限公司;4-氨基安替吡啶(分析纯):天津市光复精细化工研究所;2-硫代巴比妥酸(分析纯):上海科丰化学试剂有限公司;磷酸苯二钠(分析纯):国药集团化学试剂有限公司;四水合钼酸铵(分析纯):西陇化工股份有限公司;二喹啉甲酸(bicinchoninic acid,BCA)法蛋白分析试剂盒、超氧化物歧化酶(SOD)活力测定试剂盒:北京索莱宝科技有限公司。
1.2 仪器与设备
756MC型紫外可见分光光度计:上海元析仪器有限公司;iMark酶标仪:美国伯乐公司;MIKKO 220R台式高速离心机:德国Hettich公司;MLS-3750高压蒸汽灭菌器:日本SANYO电气公司。
1.3 实验方法
1.3.1 实验饲料的制备
利用本实验室自有菌株H0-5产酶对海带进行降解,根据前期研究成果表明,在装样量为40%、接种量为1%,培养温度为20℃、摇床转速为150 r/min的条件下培养22 h酶活最高,收集粗酶液,加入处理好的海带(1 cm2方块,自来水泡发),20℃、150 r/min水浴摇床反应,24 h时培养瓶中肉眼已经看不见海带碎块即为降解完全,经过滤得到上清,后经喷雾干燥制取海带寡糖粉末;所得沉淀经冷冻干燥制成海带泥粉末。
1.3.2 海参养殖
将购买的健康海参(成参)以每组20只,且以平均体质量为(2.60±0.70)g为标准分为10组,饲养于水池中,采用海参生长适宜条件[14]:温度(15~17℃)、盐度(29‰~31‰)、pH(7.7~7.9)、养殖水(海水)、进排水(晚上换水一次)、饵料投喂(早上喂基础饲料一次)。通过观察海参每日进食与排便情况确定海参状态是否稳定,待稳定后展开实验。
实验分为海带泥组、海带寡糖组和对照组。对照组饲喂100%基础海参饲料,海带寡糖组饲喂含不同含量(0.5%、2.5%、5.0%、10.0%)海带寡糖的基础饲料,海带泥组饲喂含不同含量(25%、50%、75%、100%)海带泥的基础饲料。实验过程中每10 d记录海参质量,5个循环后解剖海参,测定海参体壁组织液中免疫相关因子(SOD、CAT、POD、ACP、AKP、MDA)。海参生长率计算公式如下:
1.3.3 海参体壁组织液的制备[15]
新鲜的海参去内脏,用去离子水洗净体壁,取相同部位体壁1 g,剪碎后于冰水浴中研磨,加入9 mL预冷无菌生理盐水,收集体壁组织研磨液,4℃、4 000 r/min离心10 min,取上清,分装置于-80℃冰箱中备用。
1.3.4 分析检测
(1)海参体壁组织中蛋白浓度的测定
采用BCA法蛋白分析试剂盒对海参提取样品中蛋白总量进行测定。
(2)海参体壁中相关免疫因子活力测定
超氧化物歧化酶(SOD)采用SOD试剂盒测定[16-18];酸性磷酸酶(ACP)采用磷酸苯二钠法[19-21];碱性磷酸酶(AKP)采用磷酸苯二钠法[19-21];过氧化氢酶(CAT)采用钼酸铵法[22-27];过氧化物酶(POD)采用愈创木酚法[28-30];丙二醛(MDA)含量测定采用硫代巴比妥酸(thiobarbituric acid,TBA)法[31]。
1.3.5 数据统计
试验数据用SPSS16.0软件进行单因素方差分析(analysis of variance,ANOVA),并以“平均值±标准差”表示,显著性水平设为P<0.05,极显著性水平设为P<0.01。
2 结果与分析
2.1 海带寡糖及海带泥对海参质量增长的影响
以基础饲料喂养(100%)为对照组,不同含量海带寡糖和海带泥添加组为实验组,实验总时长为50 d,每隔10 d测定海参体质量,比较10组海参体质量总生长率,结果见图1。由图1可知,对照组海参总生长率为(7.3±0.64)%,海带寡糖组海参生长率均高于对照组,且海参体质量生长率随饲料中海带寡糖含量呈浓度依赖性,10%时最高,为(76.60±2.49)%。海带泥含量为25%时,海参质量总生长率最高,为(40.30±2.45)%,但海参体质量生长率随着饲料中海带泥含量增加而减少,海带泥占比100%时海参质量生长率低于对照组。结果表明,酶解海带寡糖对海参生长具有极显著的促进作用(P<0.01),在合理添加范围内(≤10%),海参体质量长率随海带寡糖添加量的增加而增加。海带泥的促增长作用明显弱于海带寡糖,且基础饲料成分比例过低(≤20%)时,海参的生长率反而下降。

图1 海带寡糖及海带泥添加量对海参生长率的影响
Fig.1 Effect ofLaminaria japonicaoligosaccharide and mud additions on growth rate of sea cucumber
2.2 海带寡糖及酶解海带泥对海参体壁组织超氧化物歧化酶活力影响
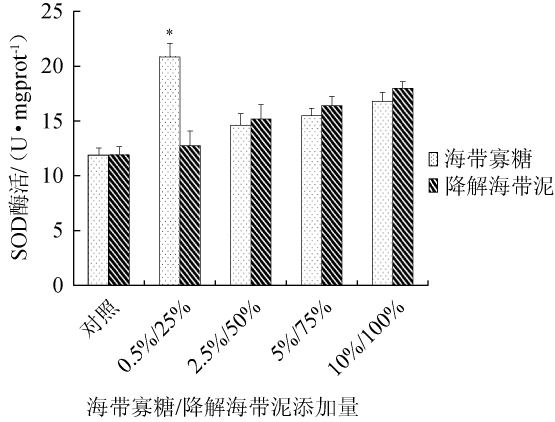
图2 海带寡糖及海带泥添加量对海参体壁组织超氧化物歧化酶活性的影响
Fig.2 Effect ofLaminaria japonicaoligosaccharide and mud additions on superoxide dismutase activities in sea cucumber perisome tissue
SOD广泛存在于动物、植物、微生物和培养细胞中,催化超氧化物阴离子发生歧化作用,生成H2O2和O2。SOD不仅是超氧化物阴离子清除酶,而且是H2O2主要生成酶,在生物抗氧化系统中具有重要作用。以基础饲料(100%)喂养为对照组,不同含量海带寡糖和海带泥添加组为实验组,50 d后收集海参体壁液,用SOD试剂盒检测,结果见图2。由图2可知,海带寡糖添加量为0.5%时,海参体壁组织中SOD活力最高,为20.847 U/mg(P<0.05),其他组SOD活力增长并不显著(P>0.05);降解海带泥组中各组海参体壁组织中SOD活力虽随海带泥添加量呈梯度增加,但作用均不显著(P>0.05)。结果表明,酶解海带产物均能提高海参体壁组织中SOD活力,其中0.5%海带寡糖组能够显著提高海参体壁组织中SOD活力(P<0.05)。
2.3 海带寡糖及酶解海带泥对海参体壁组织中过氧化氢酶活力的影响
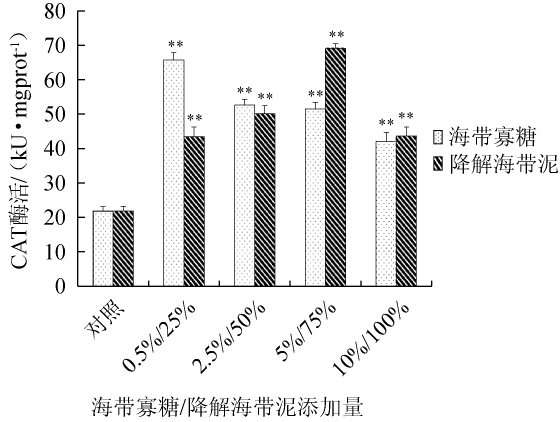
图3 海带寡糖及海带泥添加量对海参体壁组织过氧化氢酶活性的影响
Fig.3 Effect ofLaminaria japonicaoligosaccharide and mud additions on catalase activities in sea cucumber perisome tissue
CAT是过氧化物酶体的标志酶,能够催化过氧化氢分解成氧和水,使细胞免受过氧化氢的损伤。以基础饲料(100%)喂养为对照组,不同含量海带寡糖和海带泥添加组为实验组,50 d后收集海参体壁液,用钼酸铵法检测CAT活性,结果见图3。由图3可知,酶解海带寡糖与酶解海带泥作用于海参后,海参体壁组织内CAT活力均有显著升高,且相较于对照组均有极显著性差异(P<0.01),其中海带寡糖与海带泥添加量分别为0.5%和75%时,CAT活力最高,分别为65.74 kU/mg和69.17 kU/mg。结果表明,酶解海带寡糖和酶解海带泥均能够保护海参免受氧化损伤的作用。
2.4 海带寡糖及酶解海带泥对海参体壁组织内过氧化物酶活力影响

图4 海带寡糖及海带泥添加量对海参体壁组织过氧化物酶活性的影响
Fig.4 Effect ofLaminaria japonicaoligosaccharide and mud additions on peroxidase activities in sea cucumber perisome tissue
POD是体内过氧化物酶体的另一种代表酶,与CAT一起清除体内多余的过氧化氢。以基础饲料喂养(100%)为对照组,不同含量海带寡糖和海带泥添加组为实验组,50 d后收集海参体壁液,用愈创木酚法检测POD活性,结果见图4。由图4可知,酶解海带寡糖添加量为5%时海参体壁组织中POD有最大活力,为8.135 U/mg,与对照组相比具有显著性差异(P<0.05),但酶解海带泥对海参体壁组织中POD活力均无显著影响(P>0.05)。
2.5 海带寡糖及酶解海带泥对海参体壁组织碱性磷酸酶和酸性磷酸酶活力的影响
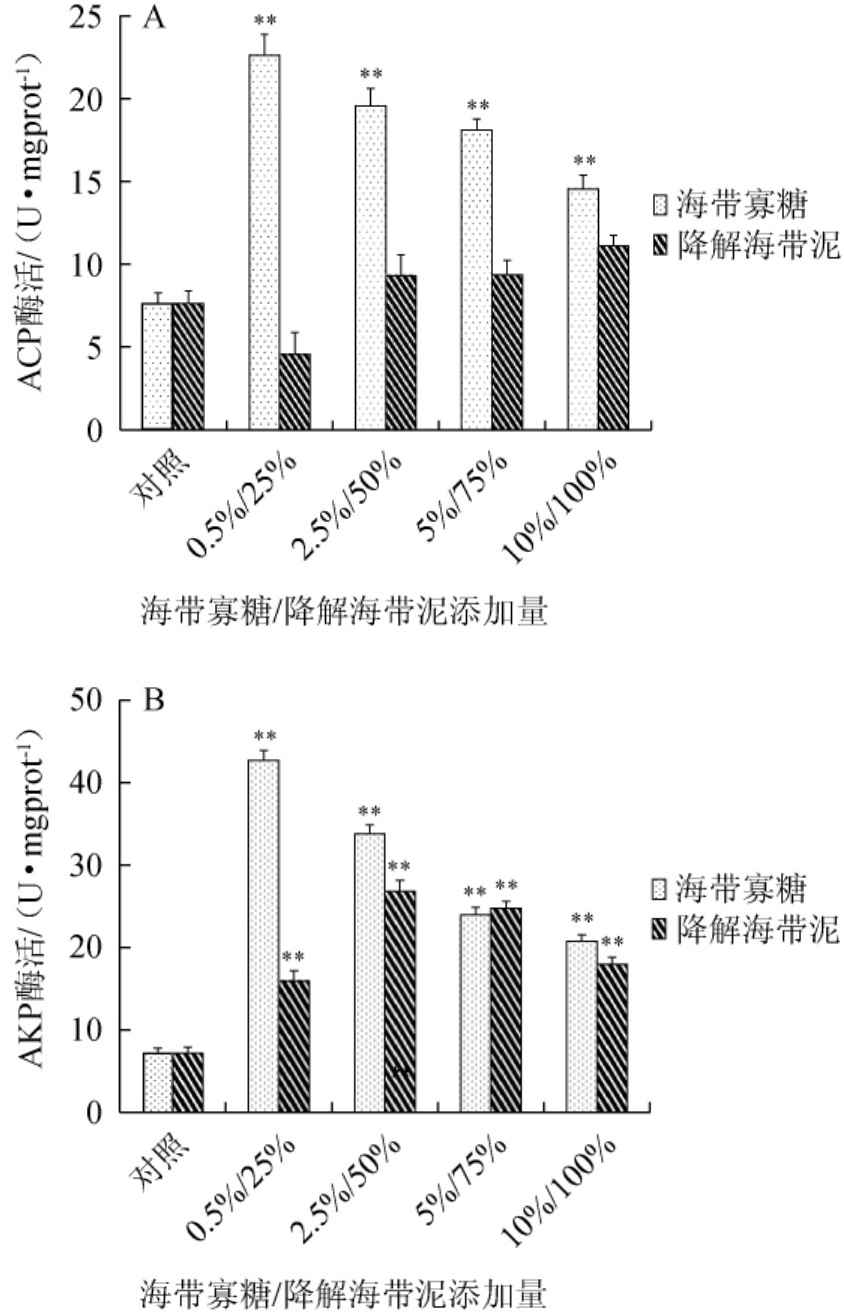
图5 海带寡糖及海带泥添加量对海参体壁组织酸性磷酸酶(A)及碱性磷酸酶(B)活性的影响
Fig.5 Effect ofLaminaria japonicaoligosaccharide and mud additions on acid phosphatase(A)and alkaline phosphatase(B)activities in sea cucumber perisome tissue
碱性磷酸酶(AKP)在机体内可催化各种醇和酚的磷酸酯进行水解,在细胞膜上较为活跃。酸性磷酸酶(ACP)与核酸和蛋白质代谢活动相关,也可参与脂类的代谢,对于机体免疫有重要的生物学意义。以基础饲料(100%)喂养为对照组,不同含量海带寡糖和海带泥添加组为实验组,50 d后收集海参体壁液,用磷酸苯二钠法检测AKP及ACP活性,结果见图5。由图5可知,与对照组相比海带寡糖对海参体内ACP和AKP的产生都有显著的促进作用(P<0.01),但是酶活与添加量呈负剂量依赖性。0.5%的海带寡糖对海参体内ACP和AKP产生的促进作用最强,分别为22.62U/mg(对照组7.62 U/mg)和42.65 U/mg(对照组7.17 U/mg)。而海带泥对海参体内ACP活力的影响不显著(P>0.05),对AKP的活力有显著的提高作用(P<0.01)(50%添加量最佳),但是其提高作用低于海带寡糖。
2.6 海带寡糖及酶解海带泥对海参体内丙二醛含量影响
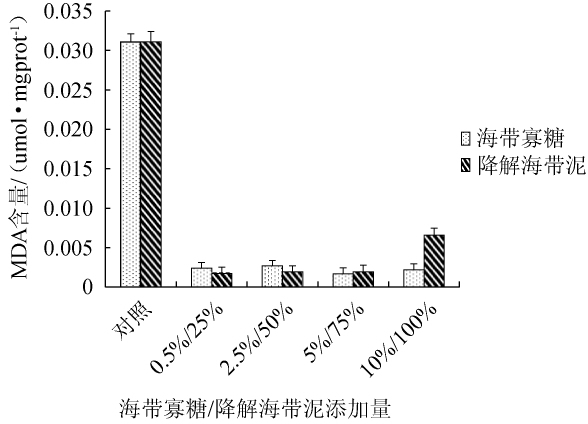
图6 海带寡糖及海带泥添加量对海参体壁组织丙二醛含量的影响
Fig.6 Effect ofLaminaria japonicaoligosaccharide and mud additions on malondialdehyde contents in sea cucumber perisome tissue
MDA为脂质过氧化物,可以反应机体内脂质过氧化反应的程度。以基础饲料(100%)喂养为对照组,不同含量海带寡糖和海带泥添加组为实验组,50 d后收集海参体壁液,用TBA法检测MDA含量,结果见图6。由图6可知,对照组海参体壁组织中MDA含量均极显著高于实验组(P<0.01),其中以寡糖添加量和酶解海带泥添加量分别为10%和25%时最少,具有极显著性差异(P<0.01)。结果表明,海带寡糖及海带泥均能显著性抑制机体内过氧化反应,从而保护机体免受氧化损伤。
3 结论
本实验通过研究不同添加剂量的酶解海带寡糖和酶解海带泥对海参体质量及海参体壁液中免疫相关因子活力的影响,结果表明,酶解海带寡糖及酶解海带泥对海参体质量增长均有一定的促进作用,其中海带寡糖的促进作用高于海带泥,其促进作用与添加剂量呈正相关。海带寡糖对海参体壁中免疫相关因子活力有一定的提高作用,其中0.5%添加量的海带寡糖的作用最显著。结果表明,酶解海带寡糖作为海参廉价高效的免疫增强剂和饲料添加剂具有一定的应用前景。
[1]王婧媛,王联珠,孙晓杰,等.海参加工工艺、营养成分及活性物质研究进展[J].食品安全质量检测学报,2018,6(9):11.
[2]赵玲,马红伟,曹荣,等.10种海参营养成分分析[J].食品安全质量检测学报,2016,7(7):2867-2872.
[3]ROGGATZ C C,GONZALEZ-WANGUEMERT M,PEREIRCA H,et al.A first glance into the nutritional properties of the sea cucumberParastichopus regalisfrom the Mediterranean Sea(SE Spain)[J].Nat Prod Res,2018,32(1):116-120.
[4]刘哲.海参养殖中微生态制剂的应用探讨[J].现代农村科技,2018(8):45.
[5]XUE Z,LI H,WANG X L,et al.A review of the immune molecules in the sea cucumber[J].Fish Sheiifish Immun,2015,44(1):1-11.
[6]钟鸣,胡超群.海参养殖饲料学研究进展[J].饲料工业,2016,37(18):58-64.
[7]姚骏,张弘,郭森,等.海带的生物活性及系列产品开发研究进展[J].食品研究与开发,2018,39(8):198-202.
[8]王琪琳.海带硫酸多糖降解研究进展[J].聊城大学学报:自然科学版,2007,20(1):49-52.
[9]谢瑾,林宗毅,王智荣,等.海带多糖酶法降解及其产物生物活性的研究[J].食品研究与开发,2016,37(20):23-27.
[10]史德杰,孙远远,何冬晓,等.海参养殖技术探讨[J].河北渔业,2017(2):35-36.
[11]缪栋.海参养殖池微生物多样性及其动态研究[D].扬州:扬州大学,2017.
[12]陈效儒.对虾与海参高效免疫激活物质的筛选与评价[D].青岛:中国海洋大学,2009.
[13]李桂英.对虾肠道益生菌对凡纳滨对虾非特异免疫力和抗病力影响的研究[D].青岛:中国海洋大学,2011.
[14]赵聚萍.三种刺参混养模式的研究[D].烟台:烟台大学,2018.
[15]季晓彤,王玲,薛鹏,等.海参组织蛋白酶K的部分酶学性质及其对海参自溶的影响[J].中国农业大学学报,2017,22(9):75-80.
[16]范鑫.AtNEK6在棉花旱盐胁迫响应中的表达分析研究[D].北京:中国农业科学院,2018.
[17]王小虎.水稻类病变早衰基因LMES3和LMES4的克隆与功能研究[D].扬州:扬州大学,2018.
[18]王仁君,王建国,丁宁,等.多氯联苯(Aroclor 1242)胁迫下鲤鱼肝脏组织氧化应激[J].海洋与湖沼,2018,49(6):1286-1293.
[19]王鹏,江晓路,江艳华,等.褐藻低聚糖对提高大菱鲆免疫机能的作用[J].海洋科学,2006,30(8):6-9.
[20]赵吉伟,李小龙.野生及养殖茴鱼体内ACP、AKP和CAT活力的比较研究[J].水产学志,2011(24):12-15.
[21]唐婉琴,张江惠,袁伦强.水体锰暴露对草鱼碱性磷酸酶、酸性磷酸酶及代谢的影响[J].重庆师范大学学报:自然科学版,2018,35(3):69-74.
[22]田荟琳.猪血中过氧化氢酶的提取纯化及性质研究[D].天津:天津商业大学,2007.
[23]周强,曹春艳.血清过氧化氢酶的比色测定[J].哈尔滨医科大学学报,2001,35(6):473-474.
[24]李丹彤,谢广成,李洪福,等.裙带菜和萱藻凝集素对刺参组织主要免疫酶活性的影响[J].水产学报,2011,35(4):524-528.
[25]陈雁,王玉敏.Nrf2在肺纤维化治疗中作用的研究进展[J].中国老年学杂志,2018,38(3):1254-1256.
[26]谭雪丽,鲁梅,李美麒,等.重金属胁迫下2株芽孢杆菌的形成及生物学特征[J].贵州农业科学,2018,46(2):74-77.
[27]陈仲,蒋经纬,高杉,等.不同病原菌刺激后仿刺参幼参体腔细胞中免疫相关酶的应答变化[J].水产科学,2018,37(3):295-300.
[28]CHEN J,GAO G Z,FANG X M,et al.Effects of drought stress on activity of POD and CAT in wheat during generation period[J].J Anhui Agr Sci,2013,14(11):1529-1531.
[29]李强,姚霞,孙楷,等.不同光质对茅苍术生长、抗氧化酶活性及挥发油含量的影响[J].中国实验方剂杂志,2018,24(5):27-32.
[30]曹新芳,黄卉卉,任秋楠,等.泥鳅消化道过氧化物酶、三磷酸腺苷酶、琥珀酸脱氢酶、酸性磷酸酶、碱性磷酸酶及非特异性酯酶的分布与组织定位[J].中国组织化学与细胞化学杂志,2018,27(5):453-458.
[31]FERNÁNDEZ J,PEREZ-ALVAREZ J A,FERNANDEZ-LOPEZ J A.Thiobarbituric acid test for monitoring lipid oxidation in meat[J].Food Chem,1997,59(3):345-353.