L-亮氨酸是人体八种必需氨基酸之一[1],对肌肉组织的生长发育具有重要意义[2-3]。L-亮氨酸是机体重要的能量供体[4],当人体处于运动、饥饿以及创伤等特殊生理状态时,适当地补充L-亮氨酸能够有效缓解各种不适症状[5-6]。此外,在临床上L-亮氨酸还被应用于术后营养支持,以及肝脏、肾脏疾病的治疗等[7-8]。L-亮氨酸无法在人和动物体内合成,因此,必须从食物中摄取或者通过服用含有L-亮氨酸的功能性食品或药品获得[9]。
自然界中的L-亮氨酸主要由植物和微生物合成,而微生物发酵法是目前L-亮氨酸最主要的生产方式。由于L-亮氨酸的合成途径长、反馈调控机制严格,L-亮氨酸生产菌株的产量和转化率仍然较低[10]。目前,大肠杆菌(Escherichia coli)和谷氨酸棒杆菌(Corynebacterium glutamicum)是工业发酵生产L-亮氨酸的主要菌株,其中谷氨酸棒杆菌作为一种常见的工业微生物,常被改造用作各种氨基酸、有机酸以及生物燃料等产品的生产菌株[11]。VOGT M等[12]引入突变的乙酰乳酸合酶编码基因ilvBN和异丙基苹果酸合酶编码基因leuA解除代谢产物对关键酶的反馈抑制;张跃等[13]通过敲除转录调控阻遏蛋白LtbR提高亮氨酸操纵子的转录水平;HUANG Q等[14]通过敲除丙氨酸转氨酶编码基因alaT、乳酸脱氢酶编码基因ldh和苏氨酸脱水酶编码基因ilvA等阻断了代谢副产物(L-丙氨酸、乳酸和L-异亮氨酸)的合成,L-亮氨酸的产量和转化率得到明显提升;刘辉等[15]通过代谢计量分析,对L-亮氨酸发酵所使用的碳源进行比较,提出葡萄糖有利于菌体生长并提供充足的碳架,而使用蔗糖则更有利于提高糖酸转化率。
在谷氨酸棒杆菌细胞中,L-亮氨酸的合成需要以丙酮酸和乙酰辅酶A作为前体物[16],构建柠檬酸合酶缺失的菌株能够有效减少丙酮酸和乙酰辅酶A的消耗,有助于提高L-亮氨酸的产量和糖酸转化率,但是也会对细胞生长造成严重影响。通过在培养基中添加柠檬酸,能够在一定程度上回补柠檬酸缺陷,但是由于谷氨酸棒杆菌的柠檬酸摄取效率较低,不能有效地将培养基中的柠檬酸转运进细胞内。因此,本研究利用同源重组方法[17]使L-亮氨酸生产菌株C.glutamicumALDP的柠檬酸合酶失活,并引入柠檬酸转运蛋白突变基因CP_103,获得一株能高效摄取柠檬酸的菌株;在此基础上,比较不同的柠檬酸添加方式对菌体生长、L-亮氨酸产量和糖酸转化率的影响。旨在通过对谷氨酸棒杆菌中L-亮氨酸生产的中心碳代谢进行修饰以及发酵条件的优化,提高L-亮氨酸的产量和转化率。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒及引物
本研究所使用的菌株和质粒见表1,引物见表2。
表1 本研究所使用的菌株和质粒
Table 1 Strains and plasmids used in this study

注:Leu为L-亮氨酸(L-leucine);LeuHx为亮氨酸羟肟酸盐(L-leucine hydroxamate);NV为正缬氨酸(norvaline);SG为磺胺胍(sulfaguanidine);2-TA为2-噻唑丙氨酸(2-thiazolylalanine);Cm为氯霉素(chloramphenicol);Km为卡那霉素(kanamycin)。
菌株和质粒特征和基因型/用途 来源菌株C.glutamicumCP C.glutamicumAN02 C.glutamicumALDP C.glutamicumALDPΔgltA C.glutamicumALDPΔgltACP_103质粒pK18mobsacB pK18mobsacB-ΔgltA pK18mobsacB-CP_103 pXT01+leuBCD pEC-XK99E+leuACP经诱变筛选获得,Ile-,2-TAr,SGr,LeuHxr,NVr C.glutamicumATCC13032,ΔCgl2610::Ptuf+ilvBNXV,ΔCgl1890::Ptuf+ilvBNXV C.glutamicumAN02,pXT01+leuBCD,pEC-XK99E+leuACP C.glutamicumALDP,ΔgltA C.glutamicumALDP,ΔgltA,ΔCgl2103::Ptuf+CP_103实验室保藏实验室保藏实验室保藏本研究本研究Kmr,sacB Kmr,sacB,用于敲除gltA基因Kmr,sacB,用于将Ptuf启动子和CP_103基因整合到Cgl2103基因序列内部Cmr,Ptuf,用于过表达人工构建的leuBCD操纵子Kmr,Ptrc,用于过表达来源于CP的leuA基因实验室保藏本研究本研究实验室保藏实验室保藏
表2 本研究所使用的引物
Table 2 Primers used in this study

引物编号 引物名称引物序列(5'-3')1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 gltA-UF gltA-UR gltA-DF gltA-DR Cgl2103-UF Cgl2103-UR Ptuf-F Ptuf-R CP_103-F CP_103-R Cgl2103-DF Cgl2103-DR JD-gltA-F JD-gltA-R JD-Cgl2103-F JD-Cgl2103-R CTATGACATGATTACGAATTCTGAATGCTGGCCTTGAGGG TGCGGGATGGTCAAAAGTGATCAGTCCAGTCTC CTTTTGACCATCCCGCAAGTTGGTTCCTC ACGACGGCCAGTGCCAAGCTTAGACAGTGGGTGGCCGGA CTATGACATGATTACGAATTCGTGCCACCACGTGGCAAA ATTTTCGCAAGTACATCGAAATGCGGTGATCT ATGTACTTGCGAAAATCCTGTTTGATGGTG CTGCTCATAAGCTTTCCTCCTGGACTTC GGAAAGCTTATGAGCAGCTCAACACTT CAACGAAGTTATGCGCTGAGTGGCACGAC GCGCATAACTTCGTTGATAATGGCCCCAC ACGACGGCCAGTGCCAAGCTTGGGGACTTCGAAAGCATCG GAATTGCATGGGGAAAGCTACTC AATCGATGATGAACACCAGGGTA CAACAGGCTGCACTATGGGAAG GCGGCATTTGTGACACCTG
1.1.2 培养基
LB培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L。
基础培养基:(NH4)2SO45 g/L,KH2PO46 g/L,K2HPO4 4g/L,MgSO4·7H2O1g/L,维生素H(vitaminH,VH)10mg/L,琼脂粉25 g/L;根据碳源需求,加入葡萄糖或柠檬酸30 g/L。
种子培养基:葡萄糖30g/L,酵母粉5g/L,玉米浆30mL/L,KH2PO42 g/L,MgSO4·7H2O 1 g/L,灭菌后加入卡那霉素(10 μg/mL)和氯霉素(10 μg/mL)。
发酵培养基:葡萄糖80 g/L,酵母粉2 g/L,玉米浆30 mL/L,KH2PO42 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,维生素B110 mg/L,灭菌后加入卡那霉素(10 μg/mL)和氯霉素(10 μg/mL)。
上述培养基的灭菌方式均为115℃、15 min。
1.1.3 试剂
PrimeSTARRHS脱氧核糖核酸(deoxyribonucleic acid,DNA) 聚合酶、QuickCutTMHind III和QuickCutTMEcoR I:宝日医生物技术(北京)有限公司;ClonExpress II One Step Cloning Kit:南京诺唯赞生物科技有限公司;L-亮氨酸标准品(纯度99%):Sigma-Aldrich西格玛奥德里奇(上海)贸易有限公司;硫酸卡那霉素(纯度>94%)、氯霉素(纯度98%)和蔗糖(生化试剂):阿拉丁试剂(上海)有限公司;玉米浆:河南巨龙生物工程股份有限公司;柠檬酸(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
Mastercycler nexus聚 合酶链式反应(polymerase chain reaction,PCR)仪、NBS Bio-Flu 110 3L和7.5 L发酵罐:德国Eppendorf NBS公司;V-1200型可见分光光度计:上海美谱达仪器有限公司;SBA生物传感仪:山东省科学院生物研究所;S-433D全自动氨基酸分析仪:北京捷盛依科科技发展有限公司;mini Spain DYCP-32B型琼脂糖水平电泳仪:北京六一生物科技有限公司;Prominence模块化高效液相色谱(high performance liquid chromatography,HPLC)仪:岛津企业管理(中国)有限公司。
1.3 方法
1.3.1 重组菌株的构建
柠檬酸合酶编码基因gltA的敲除:以C.glutamicum AN02的基因组DNA为模板,利用引物P1/P2和P3/P4分别扩增gltA基因的上、下游序列,再利用引物P1/P4通过重叠延伸PCR将两段PCR扩增产物连接;重叠延伸PCR产物与pK18mobsacB质粒经核酸内切酶HindIII和EcoRI酶切;利用同源重组酶将重叠延伸PCR产物与线性化的pK18mobsacB质粒连接,获得重组质粒pK18mobsacB-ΔgltA(图1);将该质粒转化至感受态细胞C.glutamicumAN02中,利用含有卡那霉素(10 μg/mL)的LB培养基和含有蔗糖(10 g/L)的LB培养基筛选获得gltA基因缺失的菌株C.glutamicum AN02ΔgltA,使用引物P13和P14进行鉴定。

图1 质粒pK18mobsacB-ΔgltA的构建流程
Fig.1 Construction process of pK18mobsacB-ΔgltAplasmid
柠檬酸转运蛋白突变基因CP_103的整合:首先以C.glutamicumAN02的基因组DNA为模板,利用引物P5/P6和P11/P12分别扩增假蛋白编码基因Cgl2103的上、下游序列,利用引物P7/P8扩增Ptuf启动子序列,再以C.glutamicumCP的基因组DNA为模板,利用引物P9/P10扩增CP_103基因序列,最后利用引物P5/P12通过重叠延伸PCR将四段PCR扩增产物连接;重叠延伸PCR产物与pK18mobsacB质粒经核酸内切酶Hind III和EcoR I消化;利用同源重组酶将重叠延伸PCR产物与线性化的pK18mobsacB质粒连接,获得重组质粒pK18mobsacB-CP_103(图2);将该质粒转化至感受态细胞C.glutamicumAN02ΔgltA中,利用含有卡那霉素(10μg/mL)的LB培养基和含有蔗糖(10g/L)的LB培养基筛选获得整合了Ptuf启动子和CP_103基因的菌株C.glutamicum AN02ΔgltACP_103,使用引物P15和P16对Ptuf启动子和CP_103基因进行鉴定。

图2 质粒pK18mobsacB-CP_103的构建流程
Fig.2 Construction process of pK18mobsacB-CP_103plasmid
将pXT01+leuBCD(用于过表达异丙基苹果酸脱氢酶编码基因leuB和异丙基苹果酸脱水酶编码基因leuCD)和pEC-XK99E+leuACP(用于过表达异丙基苹果酸合酶突变基因leuACP)均分别转化至C.glutamicumAN02ΔgltA和C.glutamicumAN02ΔgltACP_103中获得重组菌株C.glutamicumALDPΔgltA和C.glutamicumALDPΔgltACP_103。
1.3.2 重组菌株的培养
基础培养基平板培养:在无菌条件下,用接种环从甘油管中沾取少量菌液,分别以三区划线的方式接种于以葡萄糖或柠檬酸为唯一碳源的基础培养基平板,倒置于32℃培养箱中,培养48 h。
摇瓶培养:在无菌条件下,用接种环取一环活化菌体接种于装有30mL种子培养基的500mL圆底三角瓶中,32℃、200 r/min条件下培养至OD600nm值为10~12。取3 mL种子培养液接种于装有30 mL发酵培养基的500 mL挡板三角瓶中,32℃、200 r/min条件下培养32 h。培养过程中,根据指示剂苯酚红的颜色变化,用25%氨水调整发酵液的pH在6.4~7.2范围内;当葡萄糖质量浓度<10g/L时,补加1~2mL60%的葡萄糖溶液。
发酵罐培养:在无菌条件下,取活化的菌体接种于装有1.6L种子培养基的3L发酵罐中于32℃条件下培养,采用25%氨水维持发酵液pH在7.0~7.2范围内,通过调整搅拌和通风维持溶氧在25%~30%,培养至OD600nm为14~16时,将300 mL种子培养液接种于装有3.7 L发酵培养基的7.5 L发酵罐中于32℃条件下培养32 h,用25%氨水维持发酵液的pH在7.0~7.2范围内,通过调整搅拌和通风维持溶氧在25%~30%,通过流加80%葡萄糖溶液维持发酵液中葡萄糖质量浓度≥10 g/L,通过流加60%柠檬酸溶液维持发酵液中柠檬酸质量浓度在1~5 g/L、5~10 g/L、10~15 g/L和15~20 g/L的范围内。
1.3.3 检测方法
OD600nm值和葡萄糖含量的测定方法参考文献[18]。
L-亮氨酸含量的测定[21]:发酵液于12 000 r/min条件下离心3 min,上清液经适当倍数稀释后加入900 μL 2%磺基水杨酸溶液中,静置15 min,在12 000 r/min条件下离心15 min,取800 μL上清液经孔径为0.15 μm的滤膜过滤后,利用S-433D全自动氨基酸分析仪测定L-亮氨酸含量。
柠檬酸含量的测定[20]:发酵液于12 000 r/min条件下离心3 min,上清液经适当倍数稀释后,用孔径为0.15 μm的滤膜过滤,利用HPLC测定柠檬酸含量。HPLC条件:色谱柱为Aminex HPX-87H(300 mm×7.8 mm),流动相为5 mmol/L硫酸,流速0.5 mL/min,柱温30℃,检测波长为215 nm。
根据L-亮氨酸和柠檬酸的含量计算糖酸转化率,计算公式如下:
2 结果与分析
2.1 重组质粒和工程菌株的构建
2.1.1 重组质粒pK18mobsacB-ΔgltA的构建
gltA基因的上、下游PCR扩增产物及重叠延伸PCR扩增产物经琼脂糖凝胶电泳检测,结果如图3所示。
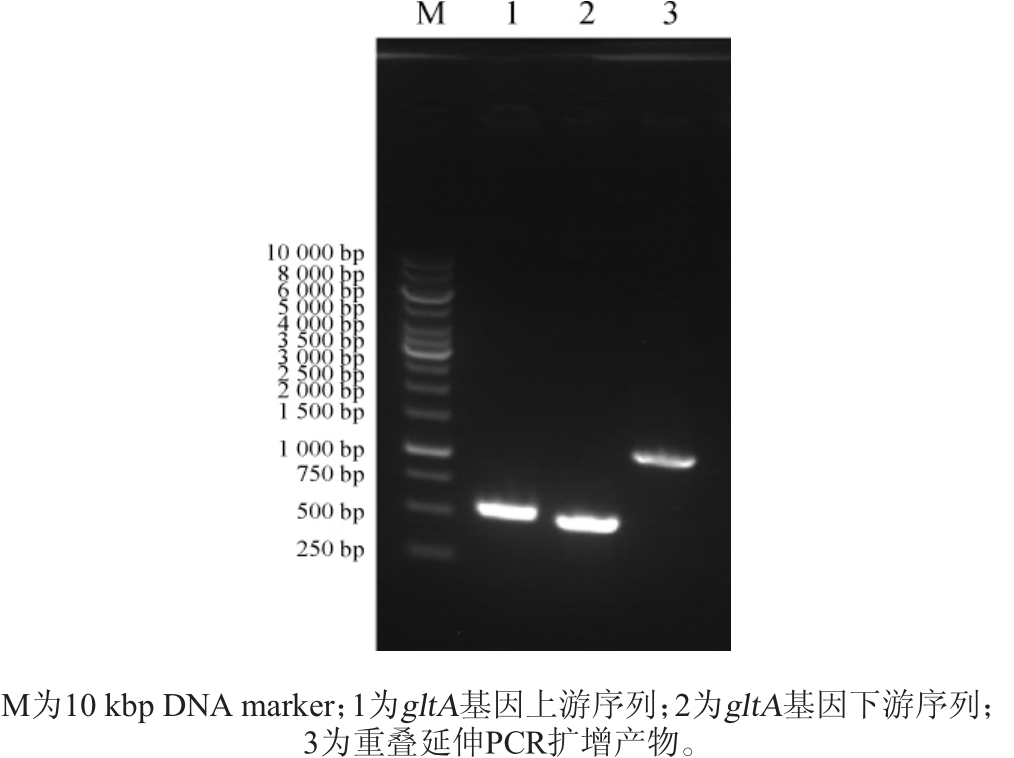
图3 构建重组质粒pK18mobsacB-ΔgltA相关序列的PCR扩增结果
Fig.3 PCR amplification results of sequences relating to the construction of recombinant plasmid pK18mobsacB-ΔgltA
由图3可知,gltA基因的上、下游序列扩增产物长度分别为503bp和493bp,重叠延伸PCR扩增产物长度为996bp,PCR扩增结果与理论预期相符。利用同源重组的方法将重叠延伸PCR扩增产物与pK18mobsacB质粒连接,获得质粒pK18mobsacB-ΔgltA。
2.1.2 重组质粒pK18mobsacB-CP_103的构建
Cgl2103基因的上、下游序列和Ptuf启动子的序列、CP_103基因序列的PCR扩增产物及重叠延伸PCR扩增产物经琼脂糖凝胶电泳检测,结果如图4所示。

图4 构建重组质粒pK18mobsacB-CP_103相关序列的PCR扩增结果
Fig.4 PCR amplification results of sequences relating to the construction of recombinant plasmid pK18mobsacB-CP_103
由图4可知,Cgl2103基因的上、下游序列PCR扩增产物碱基长度分别为512 bp和494 bp,Ptuf启动子序列长度为390bp,CP_103基因序列长度为1581bp,重叠延伸PCR扩增产物长度为2977bp,PCR扩增结果与理论预期相符。利用同源重组的方法将重叠延伸PCR扩增产物与pK18mobsacB质粒连接,获得质粒pK18mobsacB-CP_103。
2.1.3 工程菌株的构建
将重组质粒pK18mobsacB-ΔgltA转化至感受态细胞C.glutamicumAN02中,使用引物P13和P14鉴定gltA基因缺失菌株C.glutamicumAN02ΔgltA;将重组质粒pK18mobsacBCP_103转化至感受态细胞C.glutamicumAN02ΔgltA中,使用引物P15和P16鉴定整合了Ptuf启动子和CP_103基因的菌株C.glutamicumAN02ΔgltACP_103。利用琼脂糖凝胶电泳检测PCR扩增产物,结果如图5所示。

图5 重组菌株谷氨酸棒状杆菌AN02ΔgltA和谷氨酸棒状杆菌AN02ΔgltACP_103的PCR鉴定结果
Fig.5 Identification results of recombinant strainsC.glutamicum AN02ΔgltAandC.glutamicumAN02ΔgltACP_103by PCR
由5(A)可知,利用鉴定引物P13和P14对gltA基因进行PCR扩增,以C.glutamicumAN02和C.glutamicumAN02 ΔgltA的基因组为模板的扩增产物序列长度分别为2 232 bp和1 109 bp,表明C.glutamicumAN02ΔgltA菌株的gltA基因已经成功被敲除;由图5(B)所示,利用鉴定引物P15和P16对Cgl2103基因进行PCR扩增,以C.glutamicumAN02和C.glutamicumAN02ΔgltACP_103的基因组为模板的扩增产物序列长度分别为1 744 bp和3 007 bp,表明Ptuf启动子和CP_103基因已经成功地整合到C.glutamicumAN02 ΔgltACP_103菌株的Cgl2103基因内部。最后将pXT01+leuBCD和pEC-XK99E+leuACP均分别转化至C.glutamicum AN02ΔgltA和C.glutamicumAN02ΔgltACP_103中获得C.glutamicumALDPΔgltA和C.glutamicumALDPΔgltACP_103。
2.2 柠檬酸转运蛋白突变基因对柠檬酸摄取的影响
为验证C.glutamicumALDPΔgltACP_103的柠檬酸摄取能力,以C.glutamicumCP、C.glutamicumALDP和C.glutamicumALDPΔgltA为对照,分别在以葡萄糖和柠檬酸作为唯一碳源的基础培养基平板上于32℃条件下培养48h,生长状况如表3所示。
表3 菌株在不同碳源培养基上的生长情况
Table 3 Growth situation of strains on the media with different carbon sources

注:“-”表示不能生长,未观察到菌落;“+”表示生长缓慢,能形成较小菌落;“++”表示生长稍慢,能形成明显菌落;“+++”表示生长较快,能形成较大菌落。
菌株C.glutamicumCP C.glutamicumALDP C.glutamicumALDPΔgltA C.glutamicumALDPΔgltACP_103碳源种类葡萄糖 柠檬酸+++++++++++ - - +
由表3可知,所有菌株均能在以葡萄糖为唯一碳源的培养基上生长,且具有较快的生长速率。而当以柠檬酸为唯一碳源时,基因组上未整合CP_103基因的C.glutamicum ALDP和C.glutamicumALDPΔgltA均不能生长,或因生长速度过慢未能在48 h内形成可见菌落;而C.glutamicum CP和基因组整合了CP_103基因的C.glutamicumALDP ΔgltACP_103均能以缓慢速度生长。由此可见,谷氨酸棒杆菌自身的柠檬酸摄取能力较弱,而引入柠檬酸转运蛋白突变基因CP_103能够显著提升菌株的柠檬酸摄取能力。
2.3 柠檬酸转运蛋白突变基因对L-亮氨酸合成的影响
为考察柠檬酸合酶缺失以及整合CP_103基因对菌株合成L-亮氨酸的影响,将菌株C.glutamicumALDP、C.glutamicumALDPΔgltA和C.glutamicumALDPΔgltACP_103分别在不添加柠檬酸和添加30 g/L柠檬酸的条件下进行摇瓶发酵,每组设置3个平行,发酵32 h,发酵过程中的菌体浓度、柠檬酸含量、L-亮氨酸产量和糖酸转化率分别如图6和图7所示。
由图6可知,在培养基中不添加柠檬酸的条件下,出发菌株C.glutamicumALDP最终的OD600 nm值和L-亮氨酸产量最高,分别为58.6±4.4和(18.3±1.2)g/L,糖酸转化率为15.6%;而C.glutamicumALDPΔgltA和C.glutamicumALDP ΔgltACP_103的最终OD600nm值分别为14.1±2.2和13.9±2.4,L-亮氨酸产量分别为(4.7±1.1)g/L和(4.6±1.4)g/L,糖酸转化率分别为16.2%和16.3%。由此可见,在不添加柠檬酸的条件下,较菌株C.glutamicumALDP,敲除gltA基因的菌株的菌体浓度和L-亮氨酸产量都显著下降(P<0.001),而C.glutamicumALDPΔgltA和C.glutamicumALDPΔgltA CP_103两株菌的生长和L-亮氨酸产量无明显差异(P>0.05)。结果表明,尽管敲除gltA基因有利于降低丙酮酸和乙酰辅酶A的消耗、提高目的产物的转化率[12],但是会对细胞生长及产物合成造成严重影响。
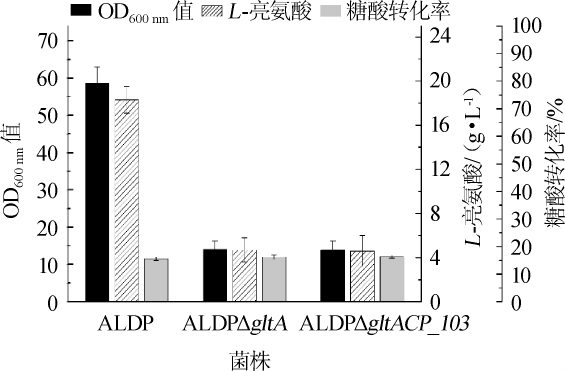
图6 不添加柠檬酸条件下菌株的发酵结果
Fig.6 Fermentation results of strains without citric acid addition
由图7可知,当培养基中添加浓度为30 g/L的柠檬酸时,C.glutamicumALDP和C.glutamicumALDPΔgltA的最终OD600 nm值分别为64.3±5.5和18.9±2.5,较不添加柠檬酸提高9.7%和34.0%;L-亮氨酸产量分别为(19.5±1.4)g/L和(6.8±1.1)g/L,较不添加柠檬酸提高6.6%和44.7%;糖酸转化率分别为17.5%和18.6%,较不添加柠檬酸提高12.2%和14.8%。结果表明,在培养基中添加一定含量的柠檬酸有助于促进菌体的生长和提高L-亮氨酸的产量和糖酸转化率,且对于柠檬酸合酶缺失的菌株C.glutamicumALDPΔgltA的提升效果更明显,这是因为添加的柠檬酸在一定程度上回补了柠檬酸合酶缺失造成的柠檬酸缺陷。然而添加柠檬酸对于出发菌株C.glutamicumALDP的生长和产L-亮氨酸的影响并不显著(P>0.05),其主要原因为,一方面C.glutamicumALDP细胞自身能够正常合成柠檬酸,另一方面,C.glutamicumALDP的柠檬酸摄取能力有限,不能高效地将柠檬酸转运到胞内。基因组整合了CP_103基因的C.glutamicumALDPΔgltACP_103的最终OD600 nm值为25.7±2.8,L-亮氨酸产量为(10.4±1.6)g/L,糖酸转化率为19.3%,较不添加柠檬酸时分别提高84.9%,126.9%和18.4%,较C.glutamicumALDPΔgltA分别提高36.0%、52.9%、3.76%。由此可见,整合CP_103基因不仅有助于回补柠檬酸缺陷,还能够进一步优化菌株碳代谢,从而提升L-亮氨酸的产量和糖酸转化率。
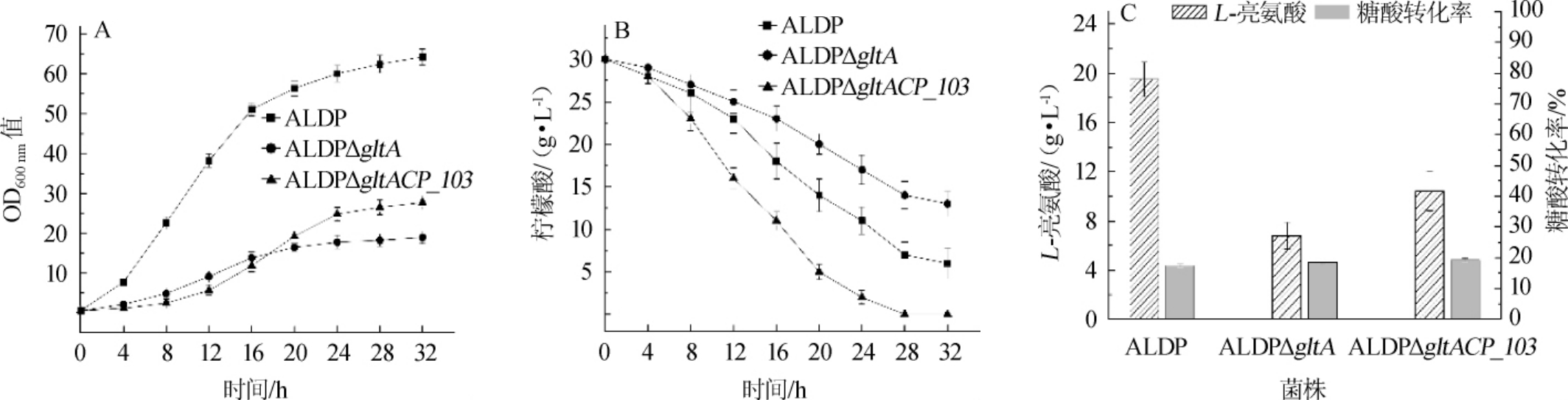
图7 添加30 g/L柠檬酸对菌体生长(A)、柠檬酸摄取(B)及L-亮氨酸产量和糖酸转化率(C)的影响
Fig.7 Effects of citric acid addition 30 g/L on the cell growth(A),citric acid uptake(B),L-leucine production and the conversion rate of glucose to acid(C)of strain
在发酵结束时,C.glutamicumALDP和C.glutamicum ALDPΔgltA的发酵液中仍然残留一定量的柠檬酸,而C.glutamicumALDPΔgltACP_103的发酵液中的柠檬酸在28 h时全部耗尽,但是C.glutamicumALDPΔgltACP103在发酵前期生长速率缓慢,其原因可能是C.glutamicum ALDPΔgltACP_103对柠檬酸的摄取过快,导致胞内柠檬酸浓度过高,从而对葡萄糖的摄取和利用产生了一定的抑制作用。由此可见,尽管柠檬酸对于提高L-亮氨酸的产量和糖酸转化率具有明显作用,但是前期添加过高浓度柠檬酸不利于菌体生长,因此仍需要对柠檬酸的添加方式进行优化。
2.4 柠檬酸添加方式对L-亮氨酸合成的影响
在7.5 L发酵罐中,在初始发酵液中添加5 g/L柠檬酸,在发酵过程中通过流加的方式,维持柠檬酸质量浓度分别在1~5g/L、5~10g/L、10~15g/L和15~20 g/L的范围内,发酵32 h,菌体生长、L-亮氨酸产量和糖酸转化率如图8所示。
由图8A可知,在初始发酵液中添加5 g/L柠檬酸未对菌体生长造成明显的抑制作用,在发酵过程中维持柠檬酸含量为5~10g/L范围内时,最有利于菌体生长,最终OD600nm值为42.1。当柠檬酸含量<5 g/L时,不能充分回补菌株的柠檬酸缺陷,而柠檬酸含量>10 g/L则会对菌体生长产生抑制作用。由图8B可知,在流加柠檬酸的条件下,L-亮氨酸的产量比在发酵开始时一次性添加30 g/L柠檬酸的条件下得到明显提升。当柠檬酸含量<15 g/L时,L-亮氨酸的产量随着柠檬酸浓度的提高而增加,当柠檬酸含量在10~15g/L范围时,L-亮氨酸产量最高,为(22.5±1.5)g/L,比一次性添加柠檬酸的产量提高116.3%;而柠檬酸含量>15g/L时,由于菌体生长受到严重抑制,L-亮氨酸的产量未明显增加。当柠檬酸含量维持在10~15 g/L和15~20 g/L时,L-亮氨酸的糖酸转化率分别为23.1%和22.4%,较其他柠檬酸添加方式有明显提高。综上所述,初始发酵液中添加5 g/L柠檬酸,发酵过程中维持柠檬酸含量在10~15 g/L为C.glutamicumALDPΔgltACP_103的最佳发酵条件,较出发菌株C.glutamicumALDP的L-亮氨酸产量和糖酸转化率分别提高了23.0%和48.1%。
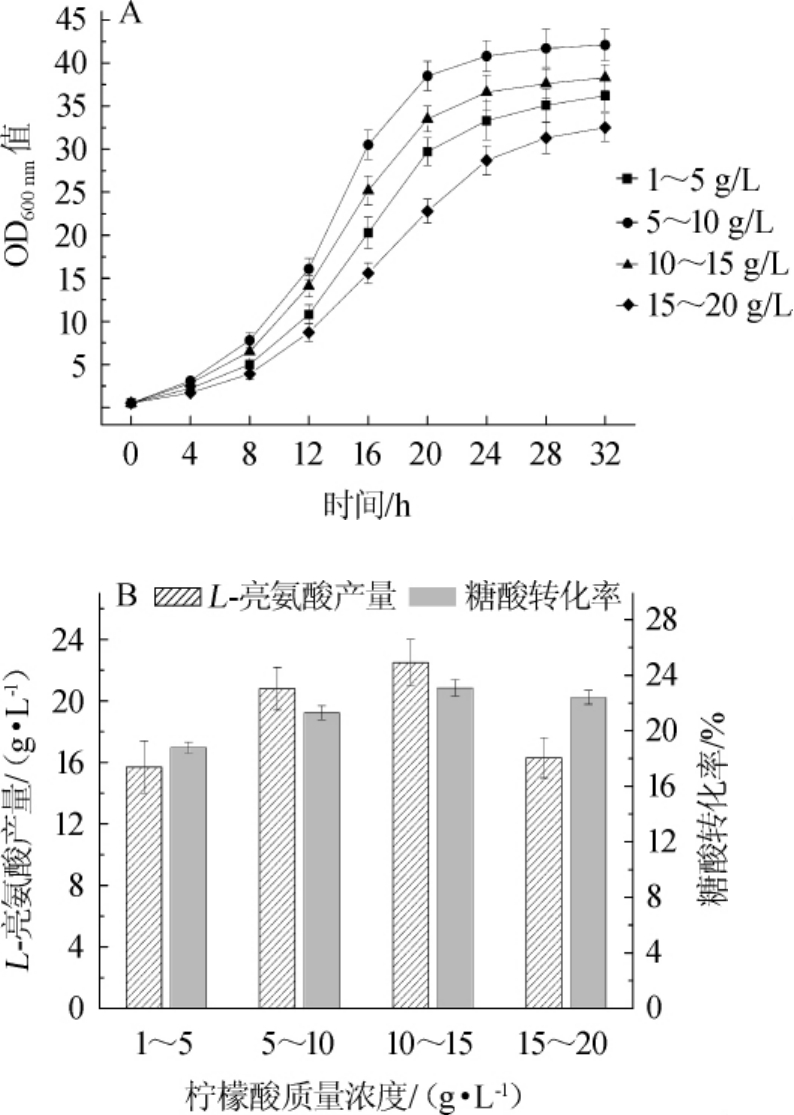
图8 不同柠檬酸添加方式对菌体生长(A)及L-亮氨酸产量和糖酸转化率(B)的影响
Fig.8 Effects of different citric acid addition methods on the cell growth(A)and L-leucine production and the conversion rate of glucose to acid(B)of strain
3 结论
本研究通过引入柠檬酸转运蛋白突变基因CP_103,显著提高了柠檬酸合酶基因gltA缺失谷氨酸棒状杆菌的柠檬酸摄取能力,在添加30 g/L柠檬酸的条件下,较C.glutamicumALDPΔgltA,C.glutamicumALDPΔgltACP103的OD600nm值、L-亮氨酸产量和糖酸转化率,分别提高36.0%、52.9%、3.76%。在此基础上,通过对柠檬酸的添加方式进行优化,结果表明,当初始发酵液中的柠檬酸添加量为5 g/L,发酵过程中通过流加的方式维持柠檬酸含量在10~15 g/L范围内时,较出发菌株C.glutamicumALDP,C.glutamicum ALDPΔgltACP_103的L-亮氨酸产量最高,为(22.5±1.5)g/L、糖酸转化率为23.1%,分别提高23.0%和48.1%,但菌体OD600nm值略微下降。
[1]GUO Y,HAN M,YAN W,et al.Generation of branched-chain amino acids resistantCorynebacterium glutamicum,acetohydroxy acid synthase by site-directed mutagenesis[J].Biotechnol Bioproc Eng,2014,19(3):456-467.
[2]张庆,漆正堂,丁树哲.亮氨酸及其代谢产物促进蛋白质合成的分子机制及其补充效果[J].生命的化学,2009,29(1):103-107.
[3]廖国周,柴仕名.支链氨基酸营养研究进展[J].饲料博览,2005(4):7-10.
[4]SURYAWAN A,HAWES J W,HARRIS R A,et al.A molecular model of human branched-chain amino acid metabolism[J].Am J Clin Nutr,1998,68(1):72-81.
[5]HARRIS R A,POPOV K M,ZHAO Y,et al.Regulation of branchedchain amino acid catabolism[J].J Nutr,1994,124(8 Suppl):1499S-1502S.
[6]王彬,李奇.亮氨酸的代谢及营养生理作用研究进展[J].饲料研究,2012(1):14-16.
[7]张晟,管向东,吴泽宇,等.富含支链氨基酸的肠外营养液在外科危重病人中的应用[J].中国实用外科杂志,2005,25(5):299-300.
[8]刘海燕,陈军贤,徐平珍,等.富含支链氨基酸的复方氨基酸液在肝硬化患者肠外营养中的作用[J].实用医学杂志,2010,26(3):454-456.
[9]孟仕平,丁玉,黄姗姗.L-亮氨酸的生理功能和分离纯化技术[J].食品工业科技,2011,32(4):397-400.
[10]MCCOURT J A,DUGGLEBY R G.Acetohydroxyacid synthase and its role in the biosynthetic pathway for branched-chain amino acids[J].Amino Acids,2006,31(2):173-210.
[11]BECKER J,WITTMANN C.Bio-based production of chemicals,materials and fuels-Corynebacterium glutamicumas versatile cell factory[J].Curr Opin Biotech,2012,23(4):631-640.
[12]VOGT M,HAAS S,KLAFFL S,et al.Pushing product formation to its limit:metabolic engineering ofCorynebacterium glutamicumfor L-leucine overproduction[J].Metab Eng,2014,22:40-52.
[13]张跃,张伟国.L-亮氨酸生物合成关键酶基因的克隆和表达[J].食品工业科技,2013,34(11):170-173.
[14]HUANG Q,LIANG L,WU W,et al.Metabolic engineering ofCorynebacterium glutamicumto enhance L-leucine production[J].Afr J Biotechnol,2017,16(18):1048-1060.
[15]刘辉,徐庆阳,谢希贤,等.不同碳源生物转化合成L-亮氨酸的代谢计量分析[J].生物技术通讯,2008,19(2):251-254.
[16]GUO Y,HAN M,XU J,et al.Analysis of acetohydroxyacid synthase variants from branched-chain amino acids-producing strains and their effects on the synthesis of branched-chain amino acids inCorynebacterium glutamicum[J].Protein Express Purif,2015,109:106-112.
[17]SCHÄFER A,TAUCH A,JÄGER W,et al.Small mobilizable multipurposecloningvectorsderived from theEscherichia coliplasmidspK18 and pK19:selection of defined deletions in the chromosome ofCorynebacterium glutamicum[J].Gene,1994,145:69-73.
[18]蔡萌萌,刘子强,户红通,等.α-酮戊二酸对L-羟脯氨酸产量的影响[J].中国酿造,2018,37(7):47-50.
[19]NORDLIE R C,LYGRE D G.The inhibition by citrate of inorganic pyrophosphate-glucose phosphotransferase and glucose 6-phosphatase[J].J Biol Chem,1966,241(13):3136-3141.
[20]袁文杰,孔亮,孜力汗,等.高效液相色谱法测定克鲁维酵母菊芋发酵液中的乙醇,糖和有机酸类代谢成分[J].分析化学,2009,37(6):850-854.