益生菌是一种通过调节肠道菌群平衡而对寄主机体施加有利影响的活的微生物[1-3]。近年来已相继提出了食用含益生菌产品的多种益处,包括抗菌、抗诱变、抗癌和降高血压以及降低血清胆固醇的含量、减轻乳糖不耐症等,同时还可以减少过敏现象的发生[4-8]。而要想达到这些健康效应,益生菌活菌数量是一个重要指标[9-11]。羊奶作为一种比较独特且又营养丰富的乳品资源,含有200多种营养物质和生物活性物质,被称为“奶中之王”[12-14]。随着乳制品市场的不断创新,多奶源、多种类将是未来乳业的发展趋势,人们对羊奶制品需求也由最初的营养健康上升为保健功能,这无疑对羊奶发酵剂的质量及种类提出了新的要求。针对羊奶凝乳性差、益生菌存活率低、有特殊气味等问题,AHMED M等[15]从羊奶中分离出19种乳酸菌,通过对其进行蛋白质水解、感官和安全性检测,筛选出菌株LbMS16、LbMS21和LbMF25作为羊奶制品的发酵剂;李串娜[16]通过对保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜热链球菌(Streptococcus thermophilus)的培养基进行优化,筛选出适宜的冻干保护剂,对酸羊奶直投式发酵剂进行了研究;葛萍等[17-18]通过对适于羊奶发酵的益生菌进行筛选后,与基础发酵剂YO-MIX883复配制成活菌数高、黏度大的羊奶饮料发酵剂。目前羊奶发酵剂在酸羊奶加工方面的研究较多,但鲜见关于益生菌在脱脂羊奶发酵基质中生长特性的研究。因此,本研究以脱脂羊奶为发酵基质,筛选出适宜羊奶发酵的菌种,通过单因素及正交试验优化发酵条件,将羊奶的营养功能和益生菌的保健功能有机结合,以期开发出一款产酸能力强和活菌数高的复配益生菌发酵剂,对益生菌羊奶饮料的开发具有较好的理论及实践意义。
1 材料与方法
1.1 材料与试剂
干酪乳杆菌(Lactobacilluscasei)LC-01:丹麦科汉森有限公司;嗜酸乳杆菌(Lactobacillus acidophilus)LAFTT-L10:帝斯曼(DSM)中国有限公司;副干酪乳杆菌(Lactobacillus paracasei)LPc-G110、植物乳杆菌(Lactobacillus plantarum)Lp-G18:润盈生物工程(上海)有限公司;长双歧杆菌(Bifidobacterium longum)CICC6187:中国工业微生物菌种保藏管理中心;羊奶:烟台某养殖场。
MRS固体培养基:蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,柠檬酸氢二铵2.0 g,葡萄糖20.0 g,吐温-80 1.0 mL,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,琼脂18.0 g,水1 000 mL,pH 6.2~6.6,121 ℃条件下灭菌20 min。
1.2 仪器与设备
CRJ-0.03/60型均质机:廊坊成瑞机械设备有限公司;FA1004型电子天平:上海舜宇恒平科技仪器有限公司;EM-30型磁力搅拌水浴锅:常州人和仪器厂;DNP-9082型电热恒温恒湿培养箱:上海精宏实验设备有限公司;LDZM-50KBS型立式压力蒸汽灭菌锅:上海申安医疗器械厂;9N100型碟式牛奶分离机:青海农牧机械制造有限公司。
1.3 方法
1.3.1 羊奶发酵剂的加工工艺流程
羊奶脱脂→均质(65℃、20 MPa)→热处理(115℃、15 min)→冷却(37℃左右)→接种→单菌培养→筛选→复配培养→发酵剂
1.3.2 羊奶发酵剂加工操作要点
(1)脱脂羊奶的制备
利用碟式牛奶分离机将羊奶进行脱脂处理,控制含脂率≤0.5%,因为羊奶中含有的游离脂肪酸会抑制益生菌的增殖,影响发酵剂菌种的培养及筛选。
(2)接种:称取益生菌各1 g,分别投放于99 mL的灭菌脱脂羊奶中,摇匀,制成菌含量为1%的接种菌液,发酵接种量以接种的脱脂乳体积计算[19]。
(3)单菌培养:将干酪乳杆菌、副干酪乳杆菌、植物乳杆菌、嗜酸乳杆菌放置于37℃恒温培养箱中培养72 h,长双歧杆菌置于厌氧培养罐中再放入37℃恒温培养箱中培养72h。
(4)筛选:选择产酸能力强、活菌数高的菌种进行复配发酵筛选试验。
(5)复配培养:根据菌株间的共生调节机制,将干酪乳杆菌与长双歧杆菌、副干酪乳杆菌与长双歧杆菌、嗜酸乳杆菌与长双歧杆菌分别以2∶1复配,在37℃的恒温条件下厌氧培养72 h,得发酵剂。
1.3.3 益生菌的筛选及复配试验
(1)益生菌种类对脱脂羊奶发酵性能的影响
以灭菌脱脂羊奶为发酵基质,干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌、副干酪乳杆菌、长双歧杆菌为试验对象,在预试验的基础上,以接种量为4%,发酵温度为37℃,发酵时间为72 h的条件下,每隔6 h测定一次不同益生菌发酵液的酸度、pH值和活菌数[20],对12组数据进行分析,筛选出产酸能力强、活菌数高的菌种进行复配发酵试验研究。
(2)不同复配益生菌对脱脂羊奶发酵性能的影响
在单菌种发酵试验菌种的基础上,以及根据益生菌的共生调节机制,将干酪乳杆菌与长双歧杆菌、副干酪乳杆菌与长双歧杆菌、嗜酸乳杆菌与长双歧杆菌分别以2∶1复配,接种量为4%,在37℃的恒温条件下厌氧培养72h。试验过程中每隔6 h测定一次不同复配菌种在生长稳定期(益生菌活菌数基本保持不变时)的最大活菌数,筛选出最佳益生菌组合。
(3)复配益生菌比例对脱脂羊奶发酵性能的影响
将干酪乳杆菌与长双歧杆菌以4∶1、3∶1、2∶1、1∶1、1∶2(V/V)混合,按4%的接种量接入灭菌后的脱脂羊奶中,在37℃条件下培养至菌种生长稳定期,测定其发酵酸度和活菌数,确定最佳复配比例。
1.3.4 复配益生菌发酵条件优化单因素试验
(1)接种量对复配益生菌发酵剂发酵性能的影响
复配益生菌按照2%、3%、4%、5%、6%的接种量接入灭菌后的脱脂羊奶中,在37℃条件下发酵至益生菌生长稳定期,测定其发酵酸度和活菌数,确定复配益生菌的最佳接种量。
(2)发酵温度对复配益生菌发酵剂发酵性能的影响
复配益生菌按照4%的接种量接入灭菌后的脱脂羊奶中,分别在35℃、36℃、37℃、38℃、39℃条件下发酵至益生菌生长稳定期,测定其发酵酸度和活菌数,确定复配益生菌的最佳发酵温度。
(3)发酵时间对复配益生菌发酵剂发酵性能的影响
复配益生菌按照4%的接种量接入灭菌后的脱脂羊奶中,在37℃条件下发酵至菌种生长衰亡期(益生菌活菌数逐渐降低时),每隔6 h测定一次发酵酸度和活菌数,确定复配益生菌的最佳发酵时间。
1.3.5 复配益生菌发酵条件优化正交试验
在单因素试验的基础上,选取接种量(A)、发酵时间(B)、发酵温度(C)进行3因素3水平的正交试验,以益生菌活菌数为评价指标,通过正交试验优化得出最佳发酵条件。正交试验因素与水平见表1。
表1 复配益生菌发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization of compound probiotics

水平 A接种量/% B发酵时间/h C发酵温度/℃1 2 3 3 4 5 48 54 60 35 37 39
1.3.6 分析检测
酸度的测定参照GB5009.239—2016《食品酸度的测定》中酚酞指示剂法;pH值的测定用pH计测量3次,取其平均值;益生菌活菌数的测定参照GB 4789.35—2016《食品微生物学检验乳酸菌检验》中MRS平板计数法。
1.3.7 数据处理
数据采用Origin 8.0.5统计分析软件进行处理,采用SPSS20.0进行显著性检验。
2 结果与分析
2.1 益生菌种类对脱脂羊奶发酵性能的影响

图1 单菌发酵滴定酸度和pH值(A)与活菌数(B)随时间变化曲线
Fig.1 Change curves of titration acidity,pH(A)and viable bacteria count(B)during single bacterium fermentation process
在脱脂羊奶发酵过程中,不同益生菌产酸能力及生长曲线均有一定的差别,这不仅与益生菌本身的发酵特性有关,也与其发酵介质有关[21]。由图1可知,干酪乳杆菌在生长稳定期最高活菌数达到6.19×108CFU/mL,显著高于其他几组菌(P<0.05),虽然在发酵后期活菌总数下降,但是发酵基质中的乳糖还没有消耗完,益生菌仍可以利用其作为能量来源物质生成乳酸[22]。因此,活菌基数越大,活菌下降速度越慢,产生的乳酸也就越多,滴定酸度也越高。5种菌种产酸能力最大的是干酪乳杆菌,发酵终点时滴定酸度达到(194.26±0.89)°T,而副干酪乳杆菌为(185.53±1.03)°T,嗜酸乳杆菌为(172.59±0.79)°T,植物乳杆菌为(148.18±0.51)°T,长双歧杆菌为(161.54±0.94)°T。而嗜酸乳杆菌在发酵初期,产酸速度较快,明显高于其他4种菌。并且滴定酸度要滞后于pH值,主要由于pH值的大小不仅取决于酸的数量和性质,而且还受到发酵基质中缓冲物质的影响[23]。此外,5种益生菌在发酵48h之后产酸量逐渐趋向平稳。结果表明,干酪乳杆菌在发酵初期产酸速度相对较慢,但是其产酸周期最长,产酸能力最强,生长稳定期的活菌数最高。
2.2 复配益生菌对脱脂羊奶发酵性能的影响
复配益生菌对脱脂羊奶中活菌数的影响结果见图2。由图2可知,各复配菌种在稳定期的最大活菌数差异较大。并且复配菌种的最大活菌数要明显高于其单菌种发酵的最大活菌数,所以当复配菌种存在共生机制时可以提高发酵基质中的活菌数,进而提高发酵效率[17]。其中干酪乳杆菌和长双歧杆菌在3种复配益生菌组合中的增菌效果最好,在生长稳定期的最大活菌数为8.89×108CFU/mL。虽然嗜酸乳杆菌和长双歧杆菌(2∶1)混合发酵时,较其他2组菌最先达到生长稳定期,但其复配组合的增菌效果(8.26×108CFU/mL)以及到达稳定期的时间明显低于干酪乳杆菌和长双歧杆菌(2∶1)。因为较高的活菌数和适宜的发酵时间有利于后期加工过程中获得足够的发酵酸度、风味物质以及提高产品的稳定性。副干酪乳杆菌和长双歧杆菌(2∶1)与干酪乳杆菌和长双歧杆菌(2∶1)复配组合具有相似的生长趋势,但增菌效果显著低于其他2组(P<0.05)。此外,干酪乳杆菌和长双歧杆菌(2∶1)复配组合的最大活菌数与葛萍[17]研究的副干酪乳杆菌(LP01)和YO-MIX883组合相比高近40%,可能与发酵基质的成分或菌种特性有关。因此,选择干酪乳杆菌和长双歧杆菌混合菌发酵脱脂羊奶较为合适。
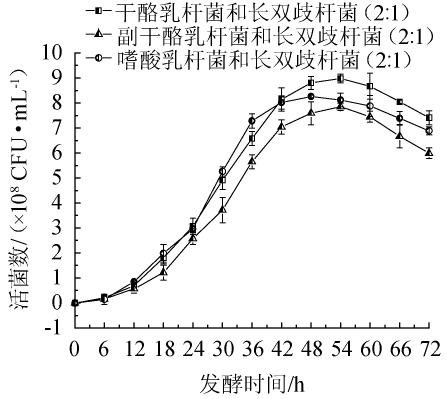
图2 复配益生菌活菌数随时间变化曲线
Fig.2 Change curve of viable compound probiotics count with time
2.3 益生菌复配比例对脱脂羊奶发酵性能的影响
益生菌复配比例对脱脂羊奶发酵性能的影响结果见图3。由图3可知,随着干酪乳杆菌与长双歧杆菌接种比例的减小,发酵基质中的活菌数呈现先升高后降低的趋势,表明了干酪乳杆菌与长双歧杆菌存在良好的共生关系,适当接种长双歧杆菌有利于增加发酵基质中的活菌数,提高发酵效率以及缩短发酵凝乳时间。滴定酸度随着接种比例的变化呈现逐渐降低的趋势,由于干酪乳杆菌的产酸能力优于长双歧杆菌,因此,随着干酪乳杆菌接种比例的减小,滴定酸度随之降低。综合考虑益生菌的活菌数和产酸能力,因此选择干酪乳杆菌和长双歧杆菌的最佳复配比为3∶1。

图3 干酪乳杆菌和长双歧杆菌接种比例对益生菌活菌数和滴定酸度的影响
Fig.3 Effect ofLactobacillus caseiandBifidobacterium longum inoculation ratio on viable probiotics count and titration acidity
2.4 复配益生菌发酵剂发酵条件优化单因素试验
2.4.1 接种量对复配益生菌发酵剂发酵性能的影响
接种量对复配益生菌发酵剂发酵性能的影响结果见表2。在发酵过程中发酵剂接种量会直接影响发酵基质中益生菌的存活率。当发酵剂接种量较少时,发酵速度缓慢。而当发酵剂接种量过大时,菌种产酸速度加快,并随着发酵的进行,菌种由稳定期进入衰亡期,菌体易出现自溶现象,再加上酸度对菌体的抑制作用随着酸度的增大越发明显[24-25],致使益生菌活菌数呈现下降的趋势。菌种的发酵性能除了受外部生长环境的影响,还与自身生理特性有关,从而抑制益生菌的生长繁殖,使发酵基质中活菌数降低。由表2可知,随着益生菌接种量增加,滴定酸度逐渐增大,并且pH值随之降低。其中当接种量为4%时,脱脂羊奶基质中益生菌在稳定期的最大活菌数最高,并且显著高于接种量为2%、3%、5%和6%(P<0.05),考虑生产成本的节约及较高的活菌数发酵条件,选择复配益生菌发酵剂的接种量4%为最佳。
表2 接种量对发酵剂发酵性能的影响
Table 2 Effect of inoculum on fermentation performance of starter
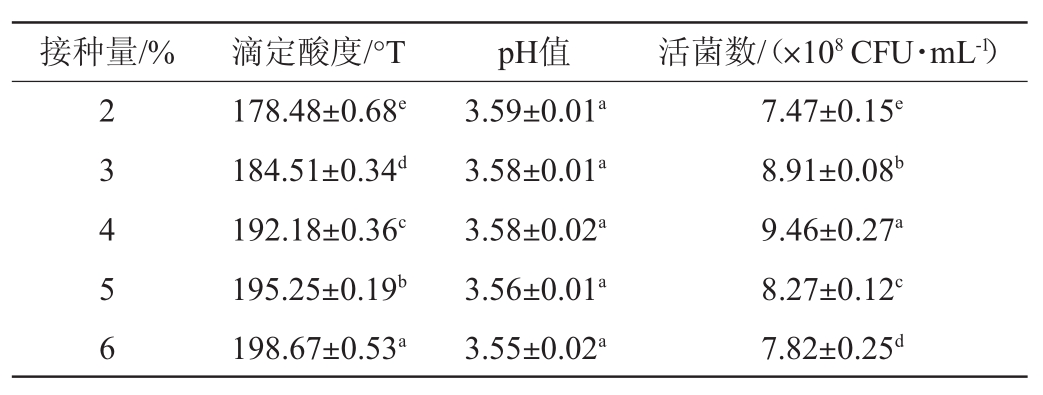
注:同一列不同上标字母表示差异显著(P<0.05)。结果表示为平均值±标准偏差,平行次数n=3。下同。
接种量/%滴定酸度/°TpH值活菌数/(×108CFU·mL-1)2 3 4 5 6 178.48±0.68e 184.51±0.34d 192.18±0.36c 195.25±0.19b 198.67±0.53a 3.59±0.01a 3.58±0.01a 3.58±0.02a 3.56±0.01a 3.55±0.02a 7.47±0.15e 8.91±0.08b 9.46±0.27a 8.27±0.12c 7.82±0.25d
2.4.2 发酵时间对复配益生菌发酵剂发酵性能的影响
发酵时间对复配益生菌发酵剂发酵性能的影响结果见图4。由图4可知,随着发酵时间的延长,发酵基质中的滴定酸度和益生菌活菌数都有逐渐增大趋势,而发酵后期,酸度趋于平稳状态,益生菌活菌数由于受到发酵基质环境的影响呈现下降的趋势。在发酵时间为48~54 h时,发酵基质中益生菌活菌数达到最大,显著高于其他发酵时间。在发酵初期,菌种处于适应期,生长速度缓慢,随后菌体进入对数期,生长繁殖较快,发酵基质中活菌数増加,随着发酵时间的延长,益生菌分解乳糖产生乳酸,使发酵基质的滴定酸度升高,从而抑制了菌种自身的生长,造成活菌数的下降。因此,选择54 h为最佳发酵时间。
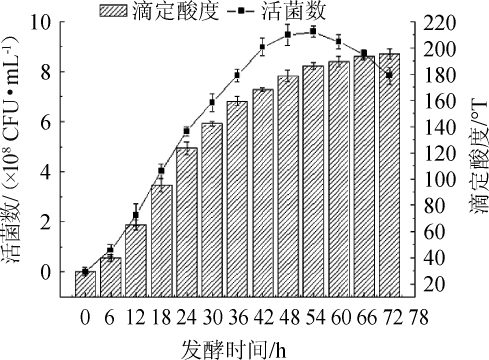
图4 发酵时间对发酵剂滴定酸度及活菌数的影响
Fig.4 Effect of fermentation time on the titration acidity and viable probiotics count of starter
2.4.3 发酵温度对复配益生菌发酵剂发酵性能的影响
发酵温度对复配益生菌发酵剂发酵性能的影响结果见表3。由表3可知,随着发酵温度的升高,发酵基质中酸度和活菌数变化显著(P<0.05),而pH变化不显著(P>0.05)。当复配发酵剂在37℃发酵时,发酵基质中益生菌活菌数明显高于其他几组。由于发酵温度与菌种代谢活动密切相关,在最适温度下代谢旺盛,菌体生长较快。并且不同的菌种有其适宜生长温度,在此温度下发酵基质中益生菌活菌数较高,同时也具有较强的耐酸性,能够抵抗发酵过程中乳酸的影响。因此,从益生菌发酵方面来看,复配益生菌发酵剂在37℃条件下发酵有利于益生菌的生长繁殖。
表3 发酵温度对发酵剂发酵性能的影响
Table 3 Effect of fermentation temperature on fermentation performance of starter
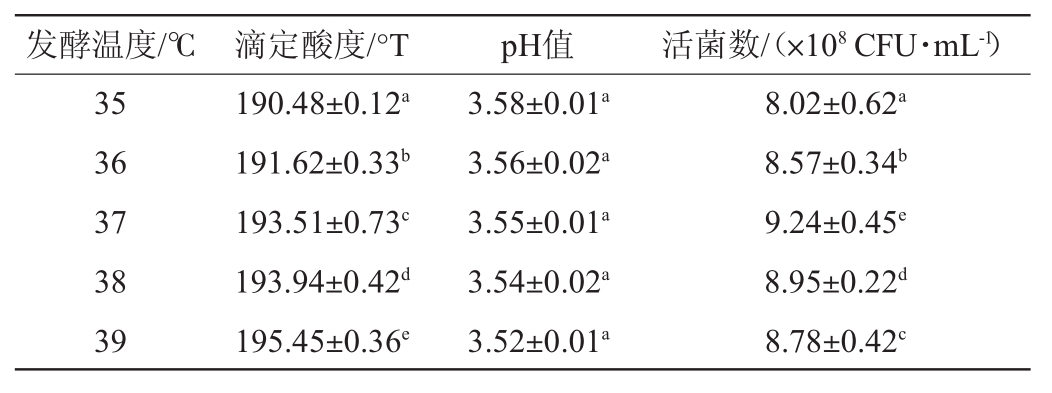
发酵温度/℃滴定酸度/°TpH值活菌数/(×108CFU·mL-1)35 36 37 38 39 190.48±0.12a 191.62±0.33b 193.51±0.73c 193.94±0.42d 195.45±0.36e 3.58±0.01a 3.56±0.02a 3.55±0.01a 3.54±0.02a 3.52±0.01a 8.02±0.62a 8.57±0.34b 9.24±0.45e 8.95±0.22d 8.78±0.42c
2.5 复配益生菌发酵条件优化正交试验
在单因素试验的基础上,以益生菌活菌数为考察指标,选择接种量、发酵时间、发酵温度为影响因素进行3因素3水平的正交试验,其结果与分析见表4。
表4 复配益生菌发酵条件优化正交试验结果与分析
Table 4 Results and analysis of orthogonal experiments for fermentation condition optimization of compound probiotics
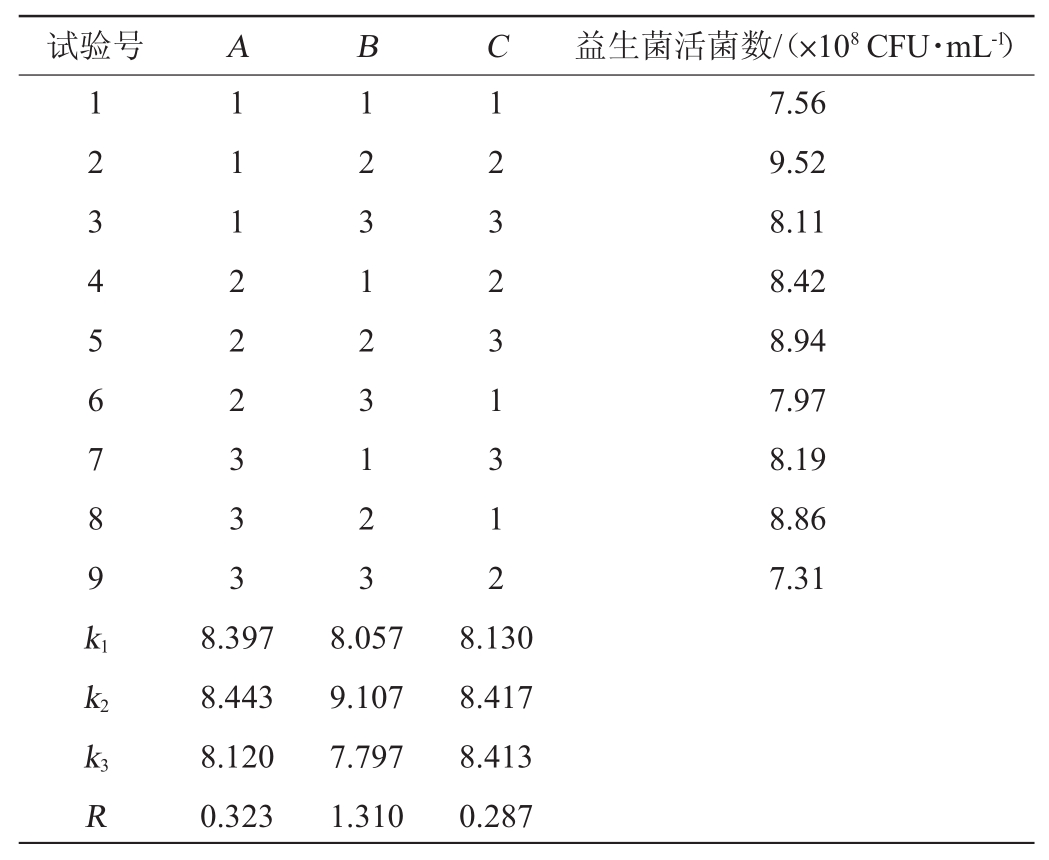
试验号ABC益生菌活菌数/(×108CFU·mL-1)1 2 3 4 5 6 7 8 9 k1 k2 k3 R 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 7.56 9.52 8.11 8.42 8.94 7.97 8.19 8.86 7.31 8.397 8.443 8.120 0.323 8.057 9.107 7.797 1.310 8.130 8.417 8.413 0.287
由表4可知,极差R越大,表示该因素对指标的影响越大,因此,各因素对复配益生菌活菌数的影响大小为发酵时间>接种量>发酵温度,最优发酵条件组合为A2B2C2,即接种量4%,发酵时间为54 h,发酵温度为37℃。在此优化条件下进行3次平行验证试验,益生菌的最大活菌数为9.59×108CFU/mL,滴定酸度为198.56 °T。
3 结论
在脱脂羊奶为发酵基质的基础上,通过探究干酪乳杆菌、嗜酸乳杆菌、长双歧杆菌等单菌的最大活菌数和产酸能力,并根据菌种间的共生调节机制,筛选出适于脱脂羊奶发酵的复配益生菌组合。在单因素试验的基础上,通过正交试验进一步对复配益生菌发酵剂的最佳发酵条件进行优化,即复配益生菌组合为干酪乳杆菌和长双歧杆菌,复配比为3∶1,接种量为4%,发酵时间54 h,发酵温度37℃。在此优化发酵条件下,最大活菌数可达9.59×108CFU/mL,酸度为198.56°T,与其他适用于羊奶发酵剂的发酵性能相比,干酪乳杆菌和长双歧杆菌复配组合可以赋予羊奶基质足够的发酵酸度、风味物质和活菌数,为益生菌羊奶饮料的开发奠定了良好的实践意义。
[1]袁秀丽,吕嘉枥,韩迪,等.益生菌制品的研究进展[J].中国乳品工业,2010,38(4):46-48.
[2]杜鹏,霍贵成.国内外益生菌制品发展现状[J].食品科学,2004,25(5):194-198.
[3]农清栋,屈泽强,许凤妙,等.益生菌的作用机制及临床应用研究进展[J].轻工科技,2017,33(5):28-30.
[4]BULTMAN S J.The microbiome and its potential as a cancer preventive intervention[J].Seminar Oncol,2016,43(1):97-106.
[5]刘齐,孙美玲,王鲁峰,等.益生菌的功能活性及其分子机理探究的研究进展[J].中国酿造,2014,33(1):14-19.
[6]SHAH N P.Some beneficial effects of probiotic bacteria[J].Biosci Microf l ora,2000,19(2):99-106.
[7]陆英.益生菌发酵剂的研究[D].无锡:江南大学,2006.
[8]杨琳琳.益生菌发酵玫瑰花饮料的研究[D].济南:山东师范大学,2018.
[9]HELLER J K.Probiotic bacteria in fermented foods:product characteristics and starter organisms[J].Am J Clin Nutr,2001,73(2):374S-379S.
[10]易文芝,刘成国.基于产酸能力和高活菌数的益生菌复合菌种发酵技术研究[J].中国乳品工业,2013,41(9):18-20.
[11]SHAH N P.Probiotic bacteria:selective enumeration and survival in dairy foods[J].J Dairy Sci,2000,83(4):894-907.
[12]祝静.羊酸奶发酵工艺及其质构特性和风味成分研究[D].杨凌:西北农林科技大学,2011.
[13]高佳媛,邵玉宇,王毕妮,等.羊奶及其制品的研究进展[J].中国乳品工业,2017,45(1):34-38.
[14]刘畅,许晓丹,史永翠,等.羊奶的营养保健功能与研究现状[J].乳业科学与技术,2013,36(1):25-28.
[15]AHMED M,LEILA B M.Lactobacilliisolated from algerian goat's milk as adjunct culture in dairyproducts[J].Brazil Arch Biol Technol,2014,57(3):410-420.
[16]李串娜.酸羊奶发酵菌株培养及冻干保护剂的研究[D].西安:陕西科技大学,2013.
[17]葛萍.益生菌羊乳饮料的制备[D].西安:陕西师范大学,2015.
[18]陈慧.益生菌发酵对羊酸奶食用品质和脂肪酸的影响[D].杨凌:西北农林科技大学,2013.
[19]刘成国,易文芝,周辉.高活菌数复合益生菌发酵乳工艺优化[J].农业工程学报,2013,29(13):286-296.
[20]王银,葛萍,白莉圆,等.益生菌发酵羊乳工艺的研究[J].中国乳品工业,2017,45(1):54-56,64.
[21]周琦.不同基质和接种量对益生菌L.caseiZhang及B.animalisV9发酵特性的影响[D].呼和浩特:内蒙古农业大学,2010.
[22]易文芝.基于高活菌数的益生菌酸乳发酵技术研究[D].长沙:湖南农业大学,2014.
[23]张水华.食品分析[M].北京:中国轻工业出版社,2004:83.
[24]杨起恒.乳酸菌发酵机理及酸奶工艺优化研究[D].北京:中国农业大学,2004.
[25]李宏梁,刘辉.发酵酸奶生产工艺优化[J].现代食品科技,2008,24(4):360-364.