枸杞(Lycium sinensisMill)为茄科落叶灌木,在全球共有97个品种,其中有31种已经被广泛应用于食品和药品领域[1]。中国枸杞主要分布在西北地区,如宁夏和柴达木盆地,其中柴达木枸杞已占该地区农牧业总产值的50.4%[2-3]。枸杞含有丰富的营养物质和生物活性成分(如枸杞多糖、甜菜碱、氨基酸、胡萝卜素、尼克酸和微量元素等),具有免疫调节、抗衰老、抗肿瘤、抗疲劳、补肝益肾、降血脂和降血糖等功效,是一种良好的“药食同源”食品[4-6]。
枸杞作为药食两用性植物深受人们青睐,但其商品形式比较单一,商业价值有待被挖掘。新鲜枸杞水分和糖含量高,不易储存、保质期短,目前主要进行干制品加工[7]。以枸杞鲜果为原料开发产品,具有减少资源浪费、有效保留营养成分和生物活性物质等优点。新鲜枸杞汁液丰富、颜色深厚、果香浓郁,且具有较高的营养和保健功能,是酿造保健型果酒的良好原料[8]。加工酿造枸杞酒不仅可最大限度保留原料中的营养成分,而且通过生物发酵还可产生大量生物活性物质和保健功能因子,是提高枸杞附加值的重要途径[9-10]。目前枸杞果酒已在市场上出现,但其发酵技术主要参照葡萄酒的酿造工艺,其品质还有待提高[11]。酵母对发酵过程及果酒品质至关重要,目前枸杞酒的酿造主要采用葡萄酒酿造商业化酵母,不能完全体现出枸杞独特的风味[12]。因此,筛选枸杞专用酿酒酵母是提高枸杞酒整体品质的重要途径。
本研究以青海海西州都兰县(柴达木盆地)新鲜枸杞为原料,通过自然发酵分离出枸杞内生酵母,并对其发酵特性进行研究,以期筛选出具有良好发酵性能的枸杞专用酿酒酵母,改善枸杞酒风味,提高枸杞酒品质,为枸杞酒的工业化生产提供一定的理论依据和技术支持,促进枸杞产业的多元化发展。
1 材料与方法
1.1 材料与试剂
新鲜枸杞:青海海西州都兰县青海昆仑河枸杞有限公司。
果胶酶(4万U/g)、偏重亚硫酸钾(分析纯):上海杰兔工贸有限公司;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YPD)培养基:广东环凯微生物科技有限公司;酵母浸膏、蛋白胨(均为生化试剂):国药集团化学试剂有限公司;酚酞、蒽酮(均为分析纯):上海浦口化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
PSH-300生化培养箱:中科生命科技股份有限公司;SJ-CJ-2FQ洁净工作台:苏州安泰空气技术有限公司;SPX-200电热干燥培养箱:南京实验仪器厂;THZ-C-1台式冷冻恒温振荡机:太仓市实验设备厂;XSP-4C显微镜:上海绘统光学仪器厂;SevenEasy plus pH仪:梅特勒-托利多仪器上海股份有限公司;723型可见分光光度计:上海精密科学仪器股份有限公司。
1.3 试验方法
1.3.1 枸杞酒自然发酵工艺流程及操作要点
操作要点:选择无腐烂、无杂质的新鲜枸杞,打浆后,立即加入0.01%偏重亚硫酸钾(相当于0.005%的二氧化硫),搅拌均匀。然后加入0.3%果胶酶,35℃酶解2~3 h,再按质量比加入10%的蔗糖,搅拌均匀,25℃条件下恒温发酵。当糖含量降低约13%时,取样分离酵母,当残糖量<4 g/L时发酵结束,立即分离,常温自然澄清2周后,用硅藻土下胶,-2℃条件下处理一周,采用孔径为0.45 μm的滤膜过滤、灌装。
1.3.2 酵母菌的分离
当枸杞发酵液中糖含量降低约13%时,取样,然后按照汤卫华等[13-14]的方法分离酵母:取发酵液100 μL,采用10倍梯度稀释法稀释至10-4~10-9,分别吸取0.5 mL稀释液转入YPD固体平板培养基,涂布均匀,于28℃培养48 h,挑选光滑的单菌落10个,在YPD固体平板上划线并于28℃培养48 h,再次挑选单菌落在试管斜面上划线,于28℃培养,4℃保存备用。
1.3.3 酵母菌的筛选
通过分离酵母菌形态的观察、产气性能、产酒精力及发酵力的测定,筛选优良酵母。
形态观察:挑取斜面上的单菌落划线于YPD平板,28℃条件下培养48 h,观察并记录菌落的质地、颜色和表面特征。挑选表面光滑、球形、不透明、奶油状的单菌落进行镜检,观察并记录细胞形态、繁殖方式等。
产气性能测定:采用杜氏管发酵法[15]测定初步筛选出的酵母菌的产气能力,记录产气时间和产气量,重复测定3次。
产酒精力测定:参照牛广财等[16]的方法。按照接种量1×107CFU/mL将酵母菌接种于YPD培养基,28℃、100 r/min条件下发酵8 d,测定发酵液的酒精度并由感官评定小组对发酵液的酒香和发酵香气进行感官评定,重复测定3次。
发酵力测定:采用CO2失重法[16]测定初筛酵母菌的发酵能力。按接种量1×107CFU/mL将酵母菌接种于YPD培养基,28℃、100 r/min条件下培养8 d,每隔12 h测定1次质量,重复测定3次。以发酵时间(x)为横坐标,CO2质量损失(y)为纵坐标,绘制发酵力曲线。
1.3.4 酵母菌耐受性的测定
参照王荣荣等[17]的方法对筛选酵母菌的耐受性进行测定。调整YPD培养基的葡萄糖含量(200 g/L、250 g/L、300 g/L、350 g/L、400 g/L),乙醇含量(10%vol、12%vol、14%vol、16%vol、18%vol、20%vol)和SO2含量(150 mg/L、200 mg/L、250 mg/L、300 mg/L、350 mg/L、400 mg/L),按5%(0.6×106CFU/mL)的接种量接种筛选酵母菌株,于28℃、100r/min条件下发酵48h,分别以葡萄糖质量浓度为20g/L、不添加乙醇、不添加SO2为对照,采用血球计数板测定发酵液中的菌体数,每组3个平行。
1.3.5 理化指标测定及感官评定
按照方法1.3.1工艺流程,向枸杞汁中添加8%蔗糖,接种优良酵母,28℃条件下恒温发酵,每天搅拌一次并测定残糖量,当发酵液残糖量<4 g/L时,记录发酵时间并取样。参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定发酵液的总酸、总糖、总SO2含量、游离SO2含量、pH值和酒精度。参照周书来等[18]的方法对产品进行感官评定,感官评定由8位经验丰富、具有专业知识的人员组成感官评定小组。
1.3.6 数据分析
利用SPSS18.0和Design Expert V8.0数据处理软件进行数据处理及统计分析。
2 结果与分析
2.1 枸杞酒自然发酵酵母菌的分离
当枸杞发酵液中糖含量降低约13%时,取样分离酵母,从稀释度为10-8平板上挑选10个光滑的单菌落进行平板划线,分离得到10株菌株,编号为G1~G10,其中菌株G1、G3和G8的平板划线结果如图1所示。

图1 分离菌株平板划线结果
Fig.1 Plate streaking results of isolated strains
由图1可知,菌株G1、G3和G8菌落形态较大,圆形、有突起,颜色为乳白色,且表面光滑,符合酵母菌的菌落特征。
2.2 枸杞酒自然发酵酵母的筛选
2.2.1 形态观察
分离菌株G1~G10的细胞形态和菌落形态见图2和表1。

图2 分离酵母菌的细胞形态
Fig.2 Cell morphology of isolated yeasts
表1 分离菌株的菌落形态和细胞形态
Table 1 Colony and cell morphology of isolated strains
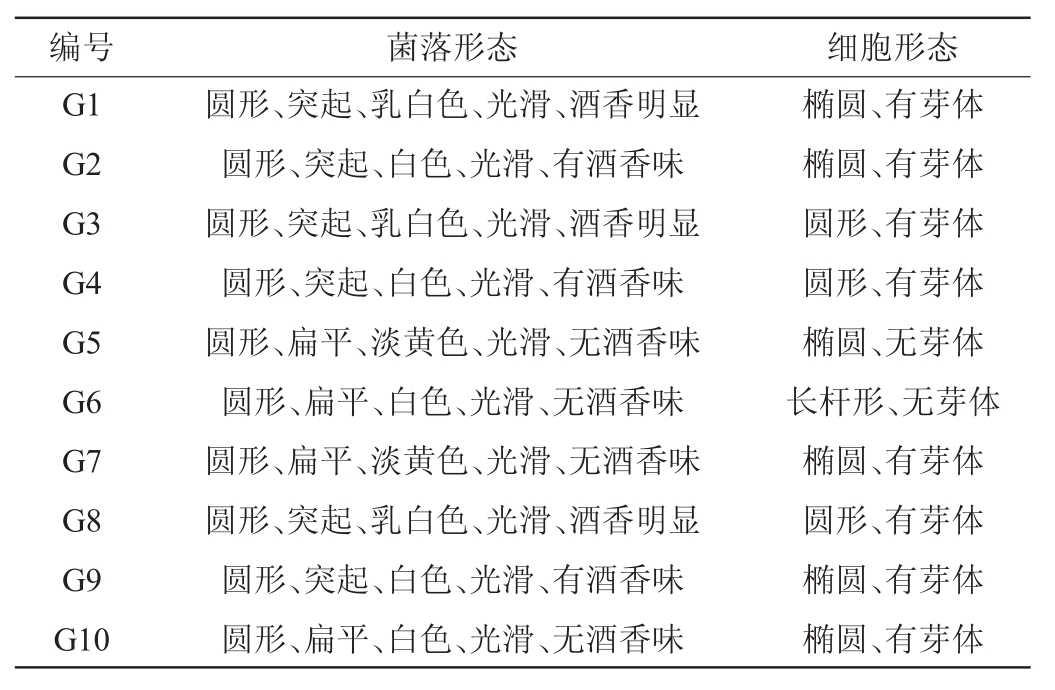
编号 菌落形态 细胞形态G1 G2 G3 G4 G5 G6 G7 G8 G9 G10圆形、突起、乳白色、光滑、酒香明显圆形、突起、白色、光滑、有酒香味圆形、突起、乳白色、光滑、酒香明显圆形、突起、白色、光滑、有酒香味圆形、扁平、淡黄色、光滑、无酒香味圆形、扁平、白色、光滑、无酒香味圆形、扁平、淡黄色、光滑、无酒香味圆形、突起、乳白色、光滑、酒香明显圆形、突起、白色、光滑、有酒香味圆形、扁平、白色、光滑、无酒香味椭圆、有芽体椭圆、有芽体圆形、有芽体圆形、有芽体椭圆、无芽体长杆形、无芽体椭圆、有芽体圆形、有芽体椭圆、有芽体椭圆、有芽体
由图2和表1可知,菌株G1、G2、G3、G4、G8和G9的菌落形态及细胞形态基本一致,菌落为圆形、突起、白色或乳白色、光滑、有酒香味,细胞为圆形或椭圆、出芽生殖,符合酵母菌特征。菌株G5的菌落形态为圆形、扁平、淡黄色且无酒香味,细胞为椭圆形、无芽体;菌株G6的菌落形态为圆形、扁平、白色且无酒香味,细胞为长杆形、无芽体;菌株G7和G10的菌落形态为圆形、扁平、淡黄色或白色且无酒香味,细胞为椭圆、有芽体。根据菌落和细胞形态特征初步筛选出菌株G1、G2、G3、G4、G8和G9为酵母菌[13-14]。
2.2.2 产气性能测定
对获得的6株酵母菌G1、G2、G3、G4、G8和G9进行产气性能测定,结果见表2。
表2 6株酵母菌的产气性能测定结果
Table 2 Determination results of gas-producing performance for 6 yeasts
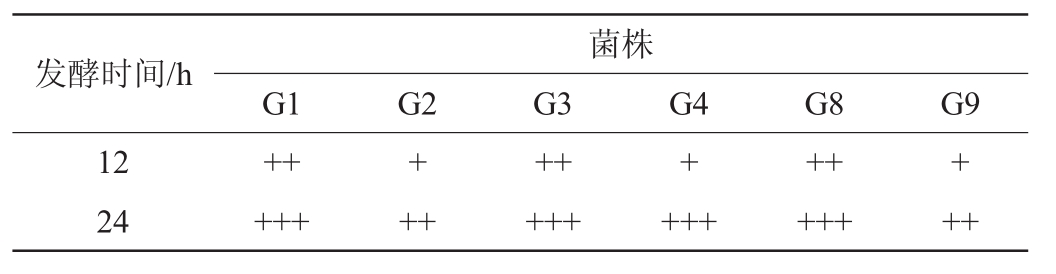
注:“+”表示产气量为杜氏管体积1/3;“++”表示产气量为杜氏管体积2/3;“+++”表示产气量为杜氏管满体积。
发酵时间/h 12 24菌株G1 G2 G3 G4 G8 G9+++++++++++++++++++++++++
由表2可知,28℃条件下发酵12 h时,菌株G2、G4和G9的产气量为杜氏管体积的1/3,菌株G1、G3和G8产气量为杜氏管体积的2/3;发酵24 h时,菌株G2和G9的产气量为杜氏管体积的2/3,其余4株酵母菌的产气量为杜氏管满体积,结果表明,酵母菌G1、G3、G4和G8具有较强的产气能力。
2.2.3 产酒精力测定
对6株酵母菌的产酒精力进行测定,并在培养后进行香气感官评定,结果见表3。
表3 6株酵母菌的产酒精力和香气评定结果
Table 3 Results of liquor-producing capacity and aroma evaluation for 6 yeasts
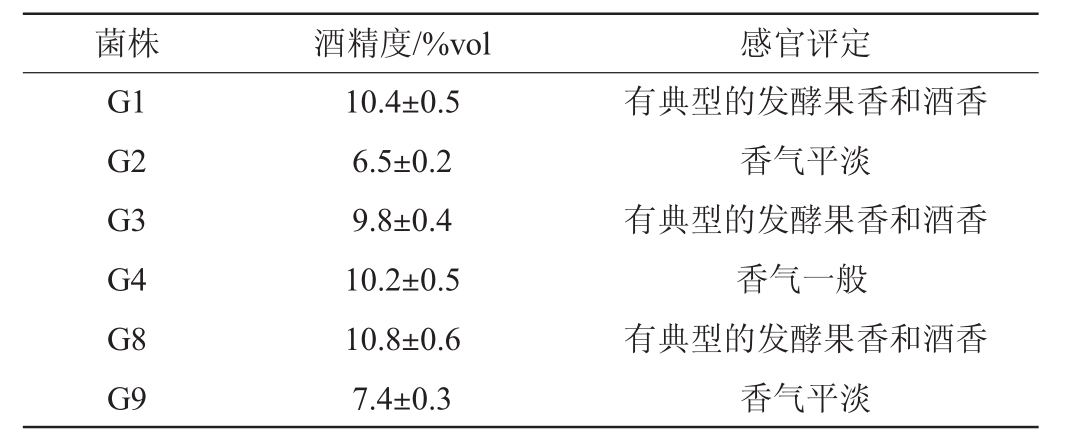
菌株 酒精度/%vol 感官评定G1 G2 G3 G4 G8 G9 10.4±0.5 6.5±0.2 9.8±0.4 10.2±0.5 10.8±0.6 7.4±0.3有典型的发酵果香和酒香香气平淡有典型的发酵果香和酒香香气一般有典型的发酵果香和酒香香气平淡
由表3可知,菌株G1、G4和G8具有强的产酒精能力,发酵液的酒精度分别为10.4%vol、10.2%vol、10.8%vol,其次为菌株G3(9.8%vol),菌株G2和G9的产酒精力较差,发酵液的酒精度分别为6.5%vol、7.4%vol。菌株G1、G3和G8发酵后均具有典型的发酵果香和酒香,菌株G4香气一般。结果说明,菌株G1和G8不仅具有较强的产酒精能力,且发酵后还产生较好的酒香和果香。
2.2.4 发酵力测定
对产气能力和产酒精能力较强的菌株G1、G3、G4和G8进行发酵力测定,结果见图3。
由图3可知,在发酵过程中,菌株G1和G8的CO2产生量明显高于菌株G3和G4;菌株G1在发酵前3 d产生的CO2较高,为发酵旺盛期,发酵第48小时时,CO2产生量最大,CO2质量损失为3.1 g),然后随着发酵时间的延长,CO2产生量逐渐下降;菌株G8在发酵前4 d,CO2产生量较大,为发酵旺盛期,发酵第36小时时,CO2产生量最大,CO2质量损失为3.3 g,然后随着发酵时间的延长,CO2产生量逐渐下降。结果说明,菌株G1和G8具有较强的发酵能力,且明显高于菌株G3和G4。
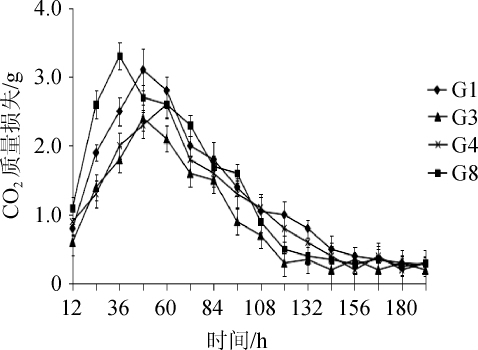
图3 酵母菌G1、G3、G4和G8的发酵力曲线
Fig.3 Fermentation capacity curves of yeast G1,G3,G4 and G8
通过形态观察、产气性能、产酒精力和发酵力的测定,筛选出菌株G1和G8为发酵性能良好的酵母菌,并对这两株酵母菌的耐受性进行研究。
2.3 酵母菌耐受性的测定
2.3.1 SO2耐受性测定
酵母菌G1和G8的SO2耐受性测定结果如图4所示。
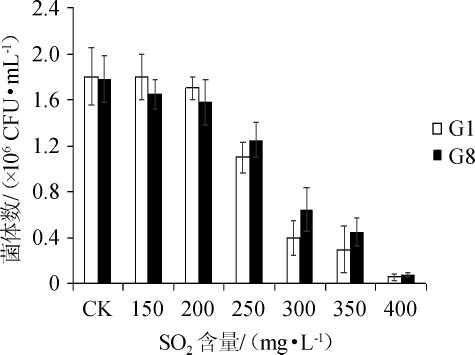
图4 不同SO2含量对筛选酵母生长的影响
Fig.4 Effect of different SO2content on growth of isolated yeasts
由图4可知,随着SO2含量的增加,菌株G1和G8的菌体数逐渐降低;当SO2含量≤200mg/L时,SO2含量对两株酵母菌的生长几乎无影响(P>0.05);当SO2含量为250 mg/L时,SO2含量对两株菌的生长有显著影响(P<0.05);当SO2含量为300 mg/L时,SO2含量对两株菌的生长有极显著影响(P<0.01);当SO2含量在250~350 mg/L范围内时,菌株G8对SO2的耐受性较菌株G1好。结果表明,菌株G1和G8最高可耐受250mg/L的SO2。通常情况下,果酒酿造中SO2含量<200 mg/L[19],因此,在SO2耐受性方面,菌株G1和G8完全可以满足酿酒的需要。
2.3.2 乙醇耐受性测定
酵母菌G1和G8的乙醇耐受性测定结果如图5所示。
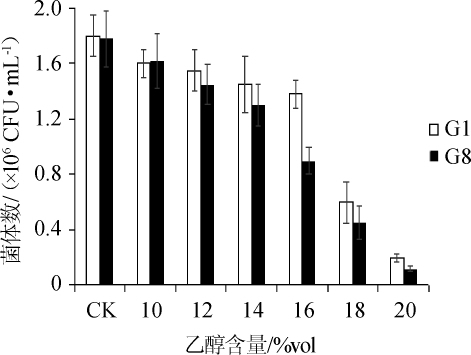
图5 不同乙醇含量对筛选酵母生长的影响
Fig.5 Effect of different content of ethanol on growth of isolated yeasts
由图5可知,随着乙醇含量的增加,菌株G1和G8的菌体数逐渐降低,当乙醇含量为10%vol~14%vol时,对两株菌的生长影响较小(P>0.05);菌株G8在乙醇含量为16%vol时,菌体数明显下降,而菌株G1在乙醇含量为18%vol时明显下降;在不同乙醇含量下菌株G1对乙醇的耐受性较菌株G8好,在高乙醇含量下尤其明显。结果表明,菌株G1的乙醇耐受性优于菌株G8,菌株G1最高可耐受16%vol乙醇,菌株G8最高可耐受14%vol乙醇。通常情况下,果酒的酒精度≤12%vol[19],因此,在乙醇耐受性方面,菌株G1和G8完全可以满足酿酒的需要。
2.3.3 糖耐受性测定
酵母菌G1和G8的糖耐受性测定结果如图6所示。

图6 不同糖含量对筛选酵母生长的影响
Fig.6 Effect of different sugar content on growth of isolated yeasts
由图6可知,随着糖含量的增加,菌株G1和G8的菌体数逐渐降低,当糖含量≤250 g/L时,对两株菌的生长影响较小(P>0.05%);当糖含量为300 g/L时,对菌株G1的生长有明显抑制作用(P<0.05),而菌株G8在糖含量为350 g/L时,菌体数明显下降(P<0.05);在不同糖含量下菌株G8对糖的耐受性优于菌株G1,在高糖含量下尤其明显。结果表明,菌株G8的糖耐受性优于菌株G1,菌株G1最高可耐受250g/L的糖,菌株G8最高可耐受300g/L的糖。通常情况下,发酵液中糖含量≤250 g/L[20],因此,在糖耐受性方面,菌株G1和G8完全可以满足酿酒的需要。
耐受性测定结果表明,酵母菌G1和G8有较好的SO2、乙醇和糖耐受性,完全可以满足枸杞酒发酵酿造的要求。
2.4 筛选酵母发酵枸杞酒的测定
分别接种菌株G1和G8于枸杞果汁中进行发酵,发酵结束后检测枸杞酒的总糖、总酸含量、酒精度、游离SO2含量及总SO2含量,并进行感官评价,结果如表4所示。
由表4可知,与菌株G1发酵的枸杞酒相比,菌株G8发酵枸杞酒的发酵时间(7 d)短,总酸含量(10.3 g/L)少,酒精度(12.1%vol)高;两株酵母菌发酵的枸杞酒的总糖含量、SO2含量和pH值差别不大(P>0.05%)。菌株G8发酵的枸杞酒色、香、澄清度和口感均较好,而菌株G1发酵的枸杞酒无枸杞典型风味,且稍有苦味和杂味。结果表明,菌株G8的发酵性能优于菌株G1的发酵特性。
表4 筛选酵母发酵枸杞酒的测定结果
Table 4 Determination results of wolfberry wine fermented by isolated yeasts
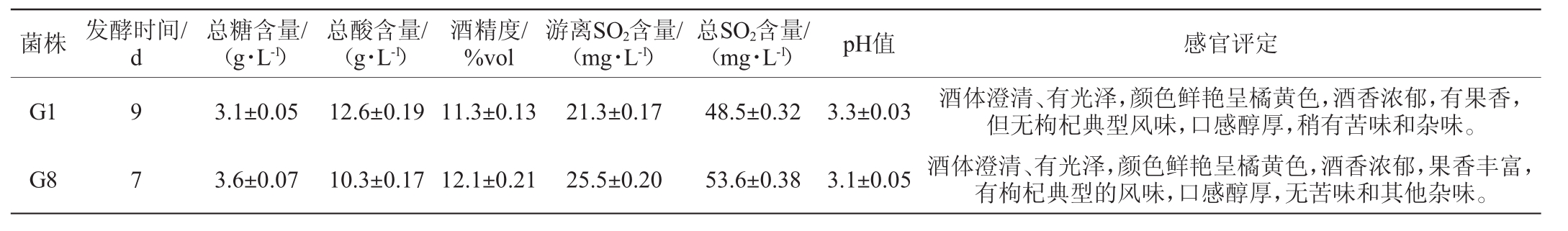
菌株 发酵时间/d总糖含量/(g·L-1)总酸含量/(g·L-1)酒精度/%vol游离SO2含量/(mg·L-1)总SO2含量/(mg·L-1)pH值 感官评定G1 G8 9 7 3.1±0.05 3.6±0.07 12.6±0.1911.3±0.13 10.3±0.1712.1±0.21 21.3±0.17 25.5±0.20 48.5±0.32 53.6±0.38 3.3±0.03 3.1±0.05酒体澄清、有光泽,颜色鲜艳呈橘黄色,酒香浓郁,有果香,但无枸杞典型风味,口感醇厚,稍有苦味和杂味。酒体澄清、有光泽,颜色鲜艳呈橘黄色,酒香浓郁,果香丰富,有枸杞典型的风味,口感醇厚,无苦味和其他杂味。
3 结论
本试验从新鲜枸杞自然发酵液中筛选枸杞内生酿酒酵母菌,并对其发酵特性进行研究。通过菌落形态和细胞形态观察,从分离的10株菌中筛选出6株酵母菌,编号为G1、G2、G3、G4、G8和G9;通过产气性能、产酒精力和发酵力测定,筛选出菌株G1和G8为性能良好的酵母菌。耐受性测定结果表明,菌株G1和G8有较好的SO2耐受性、乙醇耐受性和糖耐受性,均可耐受250 mg/L SO2,分别可耐受乙醇含量16%vol、14%vol,耐受糖含量250 g/L、300 g/L,完全可以满足枸杞酒发酵酿造的要求;发酵指标测定结果显示,菌株G8发酵时间短(7 d)、发酵酒精度高(12.1%vol)、总酸含量低(10.3 g/L),发酵的枸杞酒香气浓郁、具有枸杞典型风味,发酵性能优于G1。G8为筛选出的发酵性能优良的枸杞内生酿酒酵母。本研究对优化枸杞酒发酵工艺、改善枸杞酒风味,提高枸杞酒品质具有重要意义。
[1]梁晓婕,王亚军,安巍.黄果枸杞种质资源的研究进展[J].浙江农业科学,2017,58(8):1376-1378,1382.
[2]李月梅.柴达木盆地枸杞种植区土壤养分空间变异特征[J].西南农业学报,2018,31(8):1643-1648.
[3]ZHAO J H,LI H X,ZHANG C Z,et al.Physiological response of four wolfberry(LyciumLinn.)speciesunder drought stress[J].J Int Agr,2018,17(3):603-612.
[4]钱丹,纪瑞锋,郭威.中国枸杞属种间亲缘关系和栽培枸杞起源研究进展[J].中国中药杂质,2017,42(17):3282-3285.
[5]WANG X,SUN Z J,EL-SWAY S,et al.Effect of ridges and furrows plant of wolfberryon alkalized solonchak[J].Ekoloji,2018,27(106):975-983.
[6]XIE L,ZHENG Z A,MUJUNNDAR A S,et al.Pulsed vacuum drying(PVD)of wolfberry:Drying kinetics and quality attributes[J].Dry Technol,2018,36(12):1501-1514.
[7]周艳华,李涛,覃世民,等.枸杞活性成分提取分离方法研究进展[J].食品研究与开发,2014,35(24):163-166.
[8]OUYANG X Y,YUAN G,REN J,et al.Aromatic compounds and organoleptic features of fermented wolfberry wine:Effects of maceration time[J].Int J Food Prop,2017,20(10):2234-2248.
[9]刘亚,刘建花,张惠玲,等.枸杞酒发酵主要代谢产物对类胡萝卜素降解的影响[J].食品科学,2017,38(14):36-41.
[10]刘亚,付丽霞,王晓昌,等.枸杞酒酿造过程中预处理条件对枸杞汁色泽及酚酸的影响[J].食品科技,2016,41(3):73-77.
[11]KUANG Y,QIU F,KONG W J,et al.Natural occurrence of ochratoxin A in wolfberry fruit wine marketed in China[J].Food Addit Contam B,2012,5(1):70-74.
[12]REN J,WANG S Y,NING Y,et al.The impact of over-maturation on the sensoryand nutritional qualityof Gouqi(Chinese wolfberry)wine[J].J I Brewing,2018,124(1):57-67.
[13]汤卫华,殷海松,吕春晖,等.枸杞酒发酵菌种的筛选及其香气分析[J].中国酿造,2014,33(10):63-66.
[14]郝瑶,王陶,李文,等.富硒猕猴桃果酒酵母的筛选及鉴定[J].食品科学,2014,35(21):175-179.
[15]张莉,张兰,张玉,等.酿酒酵母菌株的筛选与发酵特性分析[J].河南农业科学,2018,47(6):144-148.
[16]董亚晨,戴忆宁,蔡瑾,等.无花果内源酵母的筛选、鉴定及发酵性能测试[J].中国食品学报,2014,14(8):240-246.
[17]牛广财,朱丹,王军,等.沙棘果酒优良酵母菌的筛选及分子生物学鉴定[J].中国食品学报,2009,9(6):60-65.
[18]周书来,唐勇,王琪,等.乐山3种不同葡萄品种酿制葡萄酒品质对比分析[J].中国酿造,2018,37(1):82-85.
[19]王荣荣,刘坤峰,朱静,等.野生猕猴桃酿酒酵母的筛选及其发酵特性研究[J].食品工业科技,2018,39(16):115-119.
[20]李华,王华,袁春龙,等.葡萄酒工艺学[M].北京:科学出版社,2007:123-148.