二十二碳六烯酸(docosahexaenoic acid,DHA)是一种重要的ω-3系列多不饱和脂肪酸,具有促进婴幼儿大脑和视力的发育,预防和治疗心血管疾病,防治癌症,治疗精神失调,防治肥胖,防治关节炎等重要生理功能[1-3]。DHA的普遍来源是鱼油,但是鱼油具有不良的鱼腥味,且鱼油中常含有二十碳五烯酸(eicosapentaenoic acid,EPA),高含量的EPA不适用于婴幼儿奶粉[4]。而微生物来源的DHA因为具有含量高、质量好、过程可控、质量稳定等优点成为研究热点。
裂殖壶藻(Schizochytriumsp.)因为具有胞内DHA含量高、生长快、易于培养等优点,已成为工业化生产DHA的理想菌株之一[5]。裂殖壶藻胞内的不饱和脂肪酸除DHA外还伴随着一定量的二十二碳五烯酸(docosapentaenoic acid,DPA),但DPA不像EPA,对膳食中的DHA功效无阻扰作用[6]。近年来,裂殖壶菌已成为DHA产业化的研究热点,但是目前国内外对裂殖壶藻的研究主要集中在诱变高产菌株以及发酵条件对DHA产量的影响上,而对探讨DHA合成过程中所涉及到的脂肪酸流量分配问题探讨的研究还较少。本研究利用一株Schizochytriumsp.A3-9,采用均匀设计试验探究初始葡萄糖含量、碳氮比、装液量及柠檬酸、苹果酸和生物素等外源添加物对其发酵过程中脂肪酸代谢合成规律的影响,为工业化生产中提高裂殖壶菌胞内DHA含量提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
裂殖壶藻(Schizochytriumsp.)A3-9:由成都通威水产科技公司提供原始菌株,经常压室温等离子体(atmospheric androomtemperatureplasma,ARTP)诱变后由实验室保藏。
1.1.2 化学试剂
蛋白胨、酵母浸粉、酵母膏:北京奥博星生物技术有限责任公司;玉米浆干粉:上海金穗生物科技有限公司;海盐:山东省莱州市康兴源盐化有限公司;葡萄糖、琼脂粉、47%三氟化硼乙醚、甲醇、三氯甲烷、正己烷、氯化钠、氢氧化钾、无水硫酸钠:成都市科隆化学品有限公司;试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
活化培养基:葡萄糖5g/L,酵母浸粉1g/L,蛋白胨1g/L,海盐15 g/L,琼脂粉17 g/L,pH自然,121℃灭菌20 min。
种子培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨5 g/L,海盐15 g/L,pH自然,121℃灭菌20 min。
初始摇瓶发酵培养基:葡萄糖50g/L,玉米浆干粉15g/L,酵母膏 10 g/L,蛋白胨 5 g/L,海盐 15 g/L,pH 6.0,121℃灭菌20 min。
1.2 仪器与设备
GCMS-QP2010 SE气质联用仪:日本岛津公司;LRHS-250B恒温恒湿培养箱:上海跃进医疗器械有限公司;HZQX100恒温振荡培养箱:太仓市实验设备厂;TGL16M台式高速冷冻离心机:长沙湘智离心机仪器有限公司;FA2004B电子天平:上海天美天平仪器有限公司。
1.3 方法
1.3.1 培养方法
菌株活化:将保存于实验室-80℃冰箱的菌种划线接于固体培养基中,28℃培养48 h。
种子培养:用接种环挑取平板上的单菌落转接于装液量为50mL/250mL液体培养基中,28℃、180r/min培养24h。
摇瓶发酵培养:以10%(V/V)接种量取种子液接种于装液量为100 mL/500 mL发酵培养基中,28℃、180 r/min培养48 h。
摇瓶发酵培养试验分3批次进行,共计40组实验数据,分别在28℃、180 r/min条件下培养48 h,考察因素包括:初始葡萄糖含量(40g/L、50g/L、60g/L、70g/L、80g/L、90g/L)、装液量(60 mL/500 mL、80 mL/500 mL、100 mL/500 mL、120mL/500mL、140mL/500mL、160mL/500mL、180mL/500mL、200 mL/500 mL、220 mL/500 mL)、碳氮比(8、11、14、17、20、23、26、29、32),并添加了柠檬酸(0、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L、1.2 g/L、1.4 g/L、1.6 g/L)、苹果酸(0、0.2 g/L、0.4g/L、0.6 g/L、0.8 g/L、1.0 g/L、1.2 g/L、1.4 g/L、1.6 g/L)和生物素(0、0.1 mg/L、0.2 mg/L、0.3 mg/L、0.4 mg/L、0.5 mg/L、0.6mg/L、0.7mg/L、0.8mg/L)3种外源添加物,同时以初始培养条件(初始葡萄糖含量为50g/L,装液量为100mL/500mL,碳氮比为12.5,不添加外源添加物,28℃、180r/min培养48h)作为对照组。
上述所有试验组碳氮比的调节是通过改变原始发酵培养基中玉米浆干粉的添加量(0~28.84 g/L),而酵母膏和蛋白胨添加量则与初始葡萄糖含量保持一定比值;3种外源添加物均是在裂殖壶藻发酵24 h后通过无菌过滤添加。
1.3.2 分析检测
(1)生物量测定
发酵液生物量测定方法参考文献[2]。
(2)脂肪酸含量的测定
油脂的提取及甲酯化方法参考文献[7]。油脂经三氟化硼催化法甲酯化后利用气相色谱-质谱(gas chromatography and mass spectrometry,GC-MS)法检测。
气相色谱条件:RTX-5silMS色谱柱(30 m×0.25 mm×0.25 μm),进样口温度260 ℃,载气为高纯度氦气(He),压力105.8 kPa,总流量37.1 mL/min,柱流量1.1 mL/min,线速度40.0 cm/s,吹扫流量3.0 mL/min,分流比30∶1,柱温采取程序升温,初始温度为160℃,保持2 min,以10℃/min升至190℃,保持2 min,以30℃/min升至220℃,保持15 min,总程序时间33 min,进样量1 μL。
质谱条件:电子电离(electronic ionization,EI)源,离子源温度230℃,接口温度250℃,溶剂延迟时间3 min,质量扫描范围35~450 m/z,全扫描方式。
脂肪酸定性定量方法:参考文献[7]。
1.3.3 数据分析方法
采用SAS软件,以初始葡萄糖含量、碳氮比、装液量及3种外源添加物的添加量为自变量,以生物量、总脂肪酸含量、不饱和脂肪酸与饱和脂肪酸的流量分配比及DHA与DPA的流量分配比为因变量,采用逐步回归分析建立回归方程。为使不同考察因素之间具有可比性,将各因素的取值进行归一化处理(即分别将各因素的最低取值设为0,最高取值设为1,中间取值按比例映射到0~1之间)。
2 结果与分析
2.1 裂殖壶藻生物量影响因子的回归分析
40组试验数据的生物量范围为5.13~38.20 g/L,对照组生物量为18.63 g/L。以初始葡萄糖含量(X葡萄糖)、碳氮比(X碳氮比)、装液量(X装液量)及3种外源添加物(X柠檬酸、X苹果酸、X生物素)的添加量为自变量,以裂殖壶藻生物量(Y1)为因变量,采用逐步回归分析,得到回归方程:
根据回归方程,仅提示生物量与初始葡萄糖含量及碳氮比有关,未得到生物量与装液量及3种外源添加物添加量之间的相关性,这可能是由于在试验组取值范围内,装液量及3种外源添加物添加量改变对生物量影响较小,被初始葡萄糖含量及碳氮比改变带来的影响掩盖。由回归系数看,生物量与初始葡萄糖含量一次项回归系数为正,与碳氮比一次项回归系数为负,说明当X葡萄糖取1(即初始葡萄糖含量为90 g/L),X碳氮比取0(即碳氮比为8)时,最有利于生物量积累,这是因为细胞生长需要充足的碳源和氮源,因此,初始碳源和氮源含量越多,积累的生物量就越多[12]。
根据回归方程计算,预测生物量可达最大值为36.94g/L,此时初始葡萄糖含量90 g/L,碳氮比8,对装液量及3种外源添加物添加量无要求。对该生物量优化条件进行3次发酵验证试验,验证试验中装液量与3种外源添加物添加量与对照组保持一致,最终得到生物量平均值为38.12 g/L,比对照组提高了104.59%,证明了增加初始葡萄糖含量,降低碳氮比有利于生物量积累。
2.2 裂殖壶藻总脂肪酸含量影响因子的回归分析
对照组总脂肪酸含量为33.62 g/100 g藻粉,40组试验数据中总脂肪酸含量范围为9.98~50.70 g/100 g藻粉。以初始葡萄糖含量(X葡萄糖)、碳氮比(X碳氮比)、装液量(X装液量)及3种外源添加物(X柠檬酸、X苹果酸、X生物素)的添加量为自变量,以藻粉中的总脂肪酸含量(Y2)为因变量,采用逐步回归分析,得到回归方程:
根据回归方程可知,总脂肪酸含量与碳氮比、装液量及柠檬酸添加量有关,未得到总脂肪酸含量与初始葡萄糖含量、苹果酸和生物素添加量之间的相关性,这可能是由于在试验组取值范围内,初始葡萄糖含量及苹果酸和生物素添加量的改变对总脂肪酸含量的影响较小,被掩盖。回归方程中,与装液量有关的项仅有一项,且回归系数为正,说明在试验范围内(装液量60~220 mL/500 mL),总脂肪酸含量随着装液量的增加而增加,即溶氧越低越有利于裂殖壶藻胞内总脂肪酸的积累;回归方程中与柠檬酸有关的项也仅有一项,且回归系数为正,说明在试验范围内(柠檬酸添加量0~1.6 g/L),总脂肪酸含量随着柠檬酸添加量的增加而增加,这可能是因为柠檬酸裂解酶催化柠檬酸裂解反应是脂肪酸合成所需乙酰辅酶A(acetyl coenzyme A,Co A)的来源[8];回归方程中,碳氮比的二次项回归系数为负,一次项回归系数为正,说明在试验范围内(碳氮比8~32),总脂肪酸含量随碳氮比的增大呈先增加后减少的趋势,这是因为当培养基中氮源耗尽时,产油微生物会接到此信号并作出反应,不断增加胞内腺嘌呤核糖核苷酸(adeno sine monophosphate,AMP)脱氨酶的活性,从而导致细胞内AMP的浓度不断降低,异柠檬酸脱氢酶活性减弱甚至完全停止,进而导致产油微生物线粒体内柠檬酸大量积累,为维持胞内环境的平衡,苹果酸/柠檬酸转移酶将过量的柠檬酸释放到线粒体外,然后在柠檬酸裂解酶的作用下将其裂解生成乙酰辅酶A和草酰乙酸,生成的乙酰辅酶A进入脂肪酸合酶(fatty acid synthase,FAS)途径或者聚酮合酶(polyketide synthase,PKS)途径进一步合成各种微生物油脂[10],提高碳氮比可以使裂殖壶藻提前进入油脂积累,利于脂肪酸的合成,但是氮源是细胞生长必须的营养物质,碳氮比过高会打破裂殖壶藻的代谢平衡,反而不利于油脂积累;回归方程中,碳氮比与柠檬酸和装液量的交互项回归系数均为正,说明装液量与碳氮比及柠檬酸添加量与碳氮比对总脂肪酸的积累有协同促进作用,具体原因还有待深入研究。
根据回归方程计算,当X碳氮比取0.625,X装液量取1,X柠檬酸取1时,预测总脂肪酸含量可达最大值52.14 g/100 g藻粉,此时碳氮比取23,装液量取220 mL/500 mL,柠檬酸添加量取1.6 g/L,对初始葡萄糖含量及苹果酸、生物素添加量无要求。对该总脂肪酸含量优化条件进行3次发酵验证试验,验证试验中初始葡萄糖含量及苹果酸、生物素添加量与对照组保持一致,最终得到总脂肪酸含量平均值为47.16 g/100 g藻粉,虽然未达到预测值,但是相比对照组提高了40.25%,提升效果显著,证明了适当增加碳氮比,增加装液量(即降低溶氧)、添加柠檬酸有利于总脂肪酸积累。
2.3 裂殖壶藻脂肪酸代谢影响因子的分析
通过GC-MS对藻粉中脂肪酸进行检测,总离子流色谱图见图1,各脂肪酸鉴定结果见表1。由图1可知,除内标物十三烷酸外,共检测出7种脂肪酸,包括十四烷酸、十五烷酸、十六烷酸、十七烷酸、十八烷酸五种饱和脂肪酸以及二十二碳五烯酸(DPA)、二十二碳六烯酸(DHA)两种不饱和脂肪酸。
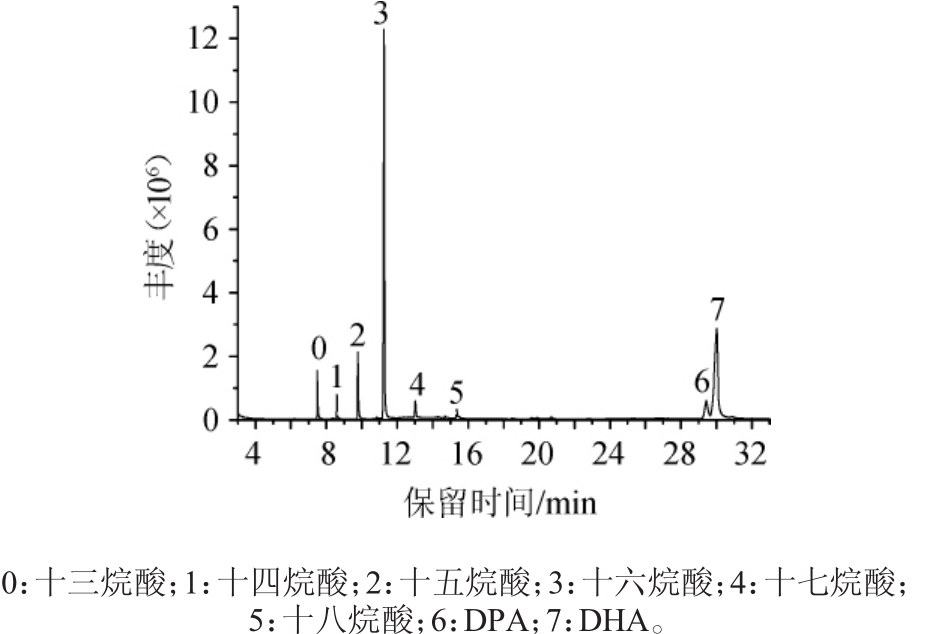
图1 裂殖壶藻A3-9中脂肪酸GC-MS分析总离子流色谱图
Fig.1 Total ion chromatogram of fatty acid inSchizochytriumsp.A3-9 analysis by GC-MS
表1 裂殖壶藻A3-9中脂肪酸组成GC-MS分析结果
Table 1 Results of fatty acid composition inSchizochytriumsp.A3-9 by GC-MS
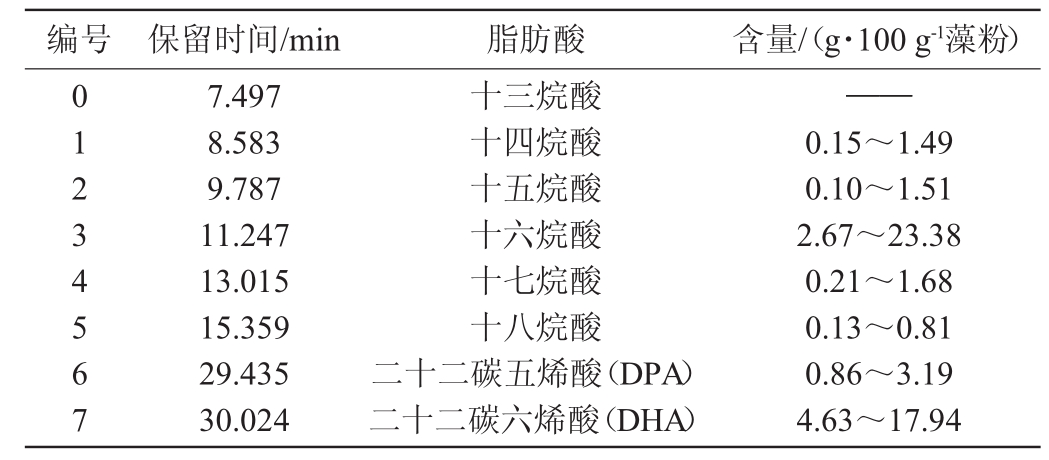
注:“——”表示未检出。
编号保留时间/min脂肪酸含量/(g·100 g-1藻粉)0 1 2 3 4 5 6 7 7.497 8.583 9.787 11.247 13.015 15.359 29.435 30.024十三烷酸十四烷酸十五烷酸十六烷酸十七烷酸十八烷酸二十二碳五烯酸(DPA)二十二碳六烯酸(DHA)——0.15~1.49 0.10~1.51 2.67~23.38 0.21~1.68 0.13~0.81 0.86~3.19 4.63~17.94
如表1所示,裂殖壶藻A3-9中十六烷酸和DHA含量最丰富,在40组发酵试验中,十六烷酸含量范围为2.67~23.38 g/100 g藻粉,DHA含量范围为4.63~17.94 g/100 g藻粉,除此之外,DPA的含量也较为丰富,含量范围为0.86~3.19 g/100 g藻粉,而十四烷酸、十五烷酸、十七烷酸和十八烷酸含量均较低。
研究表明,裂殖壶藻在发酵过程中有两条脂肪酸合成途径:传统的FAS合成途径和PKS合成途径(见图2)[10]。十四烷酸、十五烷酸、十六烷酸、十七烷酸、十八烷酸五种饱和脂肪酸由FAS途径合成[4],而DPA和DHA两种不饱和脂肪酸由PKS途径合成[6,11]。PKS途径中DPA和DHA并不是前体与产物之间的关系,但是由于DPA在PKS途径中的代谢过程尚不明确,故将DPA与DHA代谢途径发生改变的节点用未知代谢物表示。
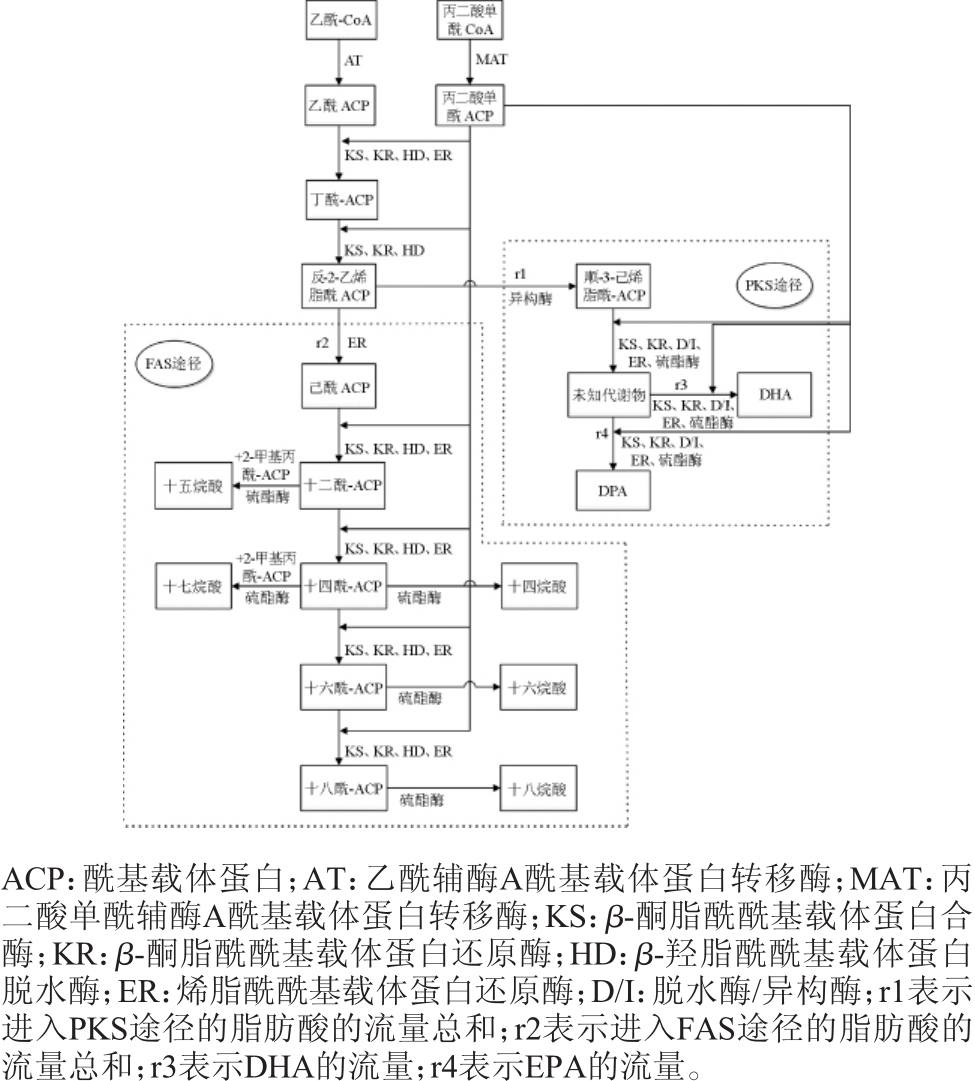
图2 裂殖壶藻A3-9胞内脂肪酸代谢流量图
Fig.2 Metabolic flow chart of fatty acid in the cell of Schizochytriumsp.A3-9
如图2所示,脂肪酸的前体物质乙酰辅酶A在合成DHA的过程中发生过两次分流,一次是在反-2-己烯脂酰ACP节点处,一部分前体物质进入PKS途径合成不饱和脂肪酸,一部分进入FAS途径合成饱和脂肪酸;另一次是在PKS途径中的某一中间产物,一部分最终合成ω-3系列不饱和脂肪酸DHA,而另一部分最终合成ω-6系列不饱和脂肪酸DPA。因此,在前体物质总量一定的情况下,促进其更多的进入PKS途径(即提高r1/r2的比值),并在PKS途径中更多合成DHA(即提高r3/r4的比值),是提高裂殖壶藻胞内DHA含量的新思路。
2.3.1 不饱和脂肪酸与饱和脂肪酸流量分配影响因子的回归分析
根据40组试验数据计算,反-2-己烯脂酰分支节点处不饱和脂肪酸与饱和脂肪酸的流量分配比r1/r2变化范围为0.46~1.11,对照组为0.948 2。以初始葡萄糖含量(X葡萄糖)、碳氮比(X碳氮比)、装液量(X装液量)及3种外源添加物(X柠檬酸、X苹果酸、X生物素)的添加量为自变量,以r1/r2(Y3)为因变量,采用逐步回归分析,得到回归方程:
根据回归方程,提示r1/r2与初始葡萄糖含量、碳氮比、装液量及柠檬酸和苹果酸添加量均有关,未得到与生物素添加量之间的相关性,这可能是由于生物素是乙酰辅酶A羧化酶的载体,而乙酰辅酶A羧化酶是乙酰辅酶A转化为丙二酸单酰辅酶A的限速酶,不参与后续脂肪酸合成,因此不会影响PKS途径与FAS途径之间的流量分配,也不会影响后续DHA与DPA之间的流量分配。回归方程中,与葡萄糖和柠檬酸有关的项各有一项,且回归系数均为正,说明增加初始葡萄糖浓度和柠檬酸添加量会促进反-2-己烯脂酰ACP进入PKS途径合成不饱和脂肪酸;回归方程中与装液量有关的项也仅有一项,且回归系数为负,说明降低装液量,即增加溶氧可以促进反-2-己烯脂酰ACP进入PKS途径合成不饱和脂肪酸;回归方程中与碳氮比有关的项有两项,且回归系数均为负,说明降低碳氮比可以促进反-2-己烯脂酰ACP进入PKS途径合成不饱和脂肪酸。回归方程中苹果酸与柠檬酸交互项为正,与碳氮比交互项为负,说明当碳氮比较低,柠檬酸添加量较高时,增加苹果酸添加量可以促进反-2-己烯脂酰ACP流入PKS途径。
根据回归方程计算,当X碳氮比和X装液量取0,X葡萄糖、X柠檬酸和X苹果酸取1时,预测r1/r2可达最大值1.50,此时初始葡萄糖含量90 g/L,碳氮比8,装液量60 mL/500 mL,柠檬酸和苹果酸添加量1.6 g/L。对该条件进行3次发酵验证试验,验证试验中生物素添加量与对照组保持一致,最终得到r1/r2平均值为1.15,虽然未达到预测值,但是相比对照组提高了21.28%,有一定提升效果。
2.3.2 DPA与DHA流量分配影响因子的回归分析
根据40组试验数据计算,DHA与DPA流量分配比r3/r4变化范围为4.13~7.11,对照组为6.62。以初始葡萄糖含量(X葡萄糖)、碳氮比(X碳氮比)、装液量(X装液量)及3种外源添加物(X柠檬酸、X苹果酸、X生物素)的添加量为自变量,以r3/r4(Y4)为因变量,采用逐步回归分析,得到回归方程:
根据回归方程可知,r3/r4与碳氮比、装液量及苹果酸添加量均有关,未得到与初始葡萄糖含量及柠檬酸与生物素添加量之间的相关性,其可能原因同上。回归方程中,与装液量有关的项仅有一项,且回归系数为正,说明随着装液量的增加,不饱和脂肪酸中DHA所占比重会增加;回归方程中与苹果酸有关的项有两项,且均为负,说明随着苹果酸添加量的增加,DHA在不饱和脂肪酸中的比重会下降;回归方程中碳氮比的二次项及其与苹果酸的交互项回归系数为负,而碳氮比与装液量的交互项回归系数为正,总体来看,随着碳氮比的增加,不饱和脂肪酸中DHA所占比重会降低。
根据回归方程计算,当X碳氮比取0.28,X装液量取1,X苹果酸取0时,r3/r4预测可达最大值6.75,此时碳氮比14.75,装液量220 mL/500 mL,苹果酸添加量0 g/L。对该条件进行3次发酵验证试验,验证试验中初始葡萄糖含量及柠檬酸和生物素添加量与对照组保持一致,最终得到r3/r4平均值为6.82,相比对照组提高了3.02%,有一定提升效果,证明了降低溶氧并适当提高碳氮比可以提高DHA在不饱和脂肪酸中所占比重。
3 结论
在裂殖壶藻摇瓶发酵培养过程中,其生物量主要受培养基初始葡萄糖含量和碳氮比的影响,初始葡萄糖含量90 g/L,碳氮比8时最有利于生物量积累,此时生物量可达38.12 g/L,较对照组提高了104.59%。裂殖壶藻细胞中总脂肪酸含量随着柠檬酸添加量和装液量的增加而增加,而随着碳氮比的增加,总脂肪酸含量呈先增加后降低趋势,装液量220 mL/500 mL,碳氮比23,柠檬酸添加量1.6 g/L时总脂肪酸的积累可达47.16 g/100 g藻粉,相比对照组提高了40.25%。当初始葡萄糖含量90 g/L,碳氮比8,装液量60 mL/500 mL,柠檬酸和苹果酸添加量1.6 mg/L时,PKS途径对底物的竞争优势最强,推测可能在这些条件下异构酶活性更强;而当碳氮比取14.75,装液量取220 mL/500 mL时可以提高DHA在PKS途径产物中的比重。
[1]李卫娟,王计伟,王宇霄,等.响应面法优化裂殖壶菌发酵培养基的研究[J].中国饲料,2014(23):22-25.
[2]蒋晓艳,李雁群,吉宏武,等.裂殖壶菌Schizochytriumsp.20888产DHA培养条件优化[J].微生物学通报,2016,43(6):1199-1209.
[3]王灿,张伟,张明亮,等.裂殖壶菌产DHA发酵培养基的优化[J].食品工业科技,2015,36(4):171-174,179.
[4]COLIN R.Fattyacid biosynthesis in microorganisms being used for single cell oil production[J].Biochimie,2004,86(11):807-815.
[5]吕小义,付杰,尹佳,等.高产DHA裂壶藻突变株的选育[J].中国酿造,2015,34(4):106-109.
[6]常桂芳.氧对裂壶藻利用甘油产DHA影响机制及其高密度发酵控制策略的研究[D].无锡:江南大学,2013.
[7]张凤枰,罗彬月,杜雪莉,等.气相色谱内标法测定水产饲料中的脂肪酸[J].中国粮油学报,2015,30(1):136-139,146.
[8]王澍,张静雯,吕小义,等.寇氏隐甲藻突变株发酵条件的响应面优化[J].中国酿造,2014,33(9):71-74.
[9]王申强,罗玮,姜易彤,等.外源添加剂促进裂殖壶菌合成DHA[J].生物加工过程,2013,11(5):21-25.
[10]王申强.裂殖壶菌产DHA的发酵工艺研究及高产菌株选育[D].无锡:江南大学,2013.
[11]谢达平.食品生物化学[M].第二版.北京:中国农业出版社,2014:176-177.
[12]ZHANG T,LOU F,TAO G J,et al.Composition and structure of single cell oil produced bySchizochytrium limacinumSR31[J].J Am Oil Chem Soc,2016,93(10):1337-1346.
[13]SUN X M,GENG L J,REN L J,et al.Influence of oxygen on the biosynthesis of polyunsaturated fatty acids in microalgae[J].Bioresource Technol,2018,250:868-876.
[14]王澍,吕小义,张静雯,等.不同碳氮源浓度和培养温度对裂殖壶菌产 DHA 的影响[J].中国油脂,2015,40(10):74-77.
[15]赖雅琦.控制溶氧分阶段培养提高裂殖壶菌DHA产率的研究[D].杭州:浙江大学,2013.
[16]张涛.裂殖壶菌发酵过程中脂肪酸迁移规律的研究[D].无锡:江南大学,2017.
[17]SILVINA M R.Improvement of a two-stage fermentation process for docosahexaenoic acid production byAurantiochytrium limacinumSR21 applying statistical experimental designs and data analysis[J].Bioresource Technol,2010,101(7):2367-2374.
[18]GUO D S,JI X J,REN L J,et al.Development of a multi-stage continuous fermentation strategy for docosahexaenoic acid production bySchizochytriumsp.[J].Bioresource Technol,2018,269:32-39.
[19]XIE Y X,WANG G Y.Mechanisms of fatty acid synthesis in marine fungus-like protists[J].Appl Microbiol Biotechn,2015,99(20):8363-8375.
[20]HOESTENBERGHE S V,FRANSMAN C A,LUYTEN T,et al.Schizochytriumas a replacement for fish oil in a fishmeal free diet for jade perch,Scortum barcoo(McCulloch﹠Waite)[J].Aquac Res,2016,47(6):1747-1760.
[21]ZHAO B,LI Y F,LI C L,et al.Enhancement ofSchizochytriumDHA synthesis by plasma mutagenesis aided with malonic acid and zeocin screening[J].Appl Microbiol Biotechn,2018,102(5):2351-2361.
[22]GUO D S,JI X J,REN L J,et al.Improving docosahexaenoic acid production bySchizochytriumsp.using a newly designed high-oxygensupply bioreactor[J].Aiche J,2017,63(10):4278-4286.
[23]REN L J,SUN L,ZHUANG X Y,et al.Regulation of docosahexaenoic acid production bySchizochytriumsp.:Effect of nitrogen addition[J].Bioproc Biosyst Eng,2014,37(5):865-872.