海洋占地球表面积约71%,由于特殊的生存环境,海洋微生物能产生陆栖微生物所不能产生的结构新颖、作用特殊的生物活性物质,有较大的潜力应用于医疗、食品、环境保护等各个领域[1-2],因此开发具有全新性质的酶已成为国际酶制剂研究的热点[3]。葡萄糖氧化酶(glucose oxidase,GOD)EC l.1.3.4在氧气存在的条件下能够催化葡萄糖产生葡萄糖酸和H2O2,具有去除葡萄糖、脱氧、杀菌等作用[4-5]。1999年我国农业部将GOD定为12种允许使用的饲料酶制剂添加剂之一,是十分重要的工业酶之一[6-7]。随着畜牧业的发展,我国对GOD的需求量逐年上升,但我国GOD主要依赖进口。GOD具有去除饲料中霉菌毒素、延长饲料保质期、提高饲料养分消化率和替代抗生素等作用,可调节畜禽肠道pH、保护肠道上皮细胞完整、减少应激损伤、促进生长、降低死亡率等性能[8-11],已成为研究学者和养殖企业关注的焦点。
黄晓月等[12]通过单因素试验及响应面法对产GOD的海洋细菌进行发酵条件优化,结果表明,该菌的最优发酵条件为发酵温度31℃、接种量8%、转速200 r/min、发酵时间60 h,酶活为优化前的1.5倍。郭云瑕等[13]通过单因素试验对经过紫外诱变后的黑曲霉进行发酵条件优化,结果表明,发酵温度30℃、接种量5%、转速160 r/min、发酵时间72 h为产GOD的最优发酵条件,酶活为优化前的9.56倍。HAQIU等[14]对紫外诱变后的黑曲霉进行优化,优化后的酶活约为之前的2倍。范新蕾等[15]通过响应面法对产GOD的黑曲霉菌株进行发酵条件优化,优化后的酶活为优化前的1.93倍。
GOD在动物、植物和微生物体内均有广泛地分布[16]。国内外GOD的来源主要为陆地来源的多为霉菌及其工程菌的生产菌株[17],其培养温度大多为30~40℃[18],分离纯化困难,生产成本高且无法直接应用于食品领域。酵母菌具有安全性高、易培养、易于纯化,生产成本低等特点[19],但酵母菌源的GOD的研究近乎空白。因此从海洋中筛选出产低温GOD的酵母菌,对扩充资源库具有重要意义。本研究以大连黄海海域海泥为样本进行海洋低温酵母菌的筛选,并对其发酵条件(碳源及浓度,有机氮源、无机氮源及浓度,初始pH及发酵温度等进行单因素及正交试验研究,为实现低温GOD的产业化生产提供前期基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品和试剂
海泥:大连黄海海域(123.396°E,36.7014°N,深度6~20 m);蛋白Marker:美国Thermo Fisher Scientific公司;邻联茴香胺:美国Sigma公司;辣根过氧化物酶(60 U/mL):生工生物工程(上海)股份有限公司;真菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:大连TaKaRa公司。其他试剂均为国产分析纯。
1.1.2 培养基
富集(种子)培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,海水配制,pH自然;121℃灭菌20 min。
初筛培养基:葡萄糖80g/L,蛋白胨3g/L,NaNO34g/L,KH2PO42 g/L,MgSO4·7H2O 0.7 g/L,KCl 0.5 g/L,CaCO3 3.5 g/L,可溶性淀粉10 g/L,KI 1.7 g/L,脱氧胆酸钠0.2 g/L,琼脂 20 g/L,海水配制,pH 5.6;121℃灭菌20 min。
发酵培养基:葡萄糖60 g/L,蛋白胨3 g/L,NaNO34 g/L,KH2PO42 g/L,MgSO4·7H2O 0.7 g/L,KCl 0.5 g/L,CaCO3 10 g/L,海水配制,pH 5.6;121℃灭菌20 min。
菌种保藏培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10g/L,琼脂20g/L,海水配制,pH自然;121℃灭菌20min。
1.2 仪器与设备
YXQ-LS-100SII立式压力蒸汽灭菌器:上海博迅实业有限公司;HD-1360超净工作台:北京悦泰行科技发展有限公司;THZ-312台式恒温振荡培养箱:上海精胜科学仪器设备有限公司;BZ-01显微镜:德国徕卡公司;Multiskan FC酶标仪:美国THERMO FISHER公司;pHB-4p酸度计:上海升隆电子科技有限公司。
1.3 方法
1.3.1 产低温GOD酵母菌的分离筛选
取1 g海泥样品在无菌操作条件下加入装有100 mL富集培养基的250 mL锥形瓶中,25℃、160 r/min恒温摇床培养24 h。
用无菌海水将富集培养液从10-1依次稀释至10-6,分别吸取10-4、10-5、10-6三个梯度稀释液200 μL均匀涂布于初筛培养基平板上,25℃恒温培养3~5 d。挑取菌落周围出现蓝紫圈的酵母菌株,接种到新的初筛培养基平板中划线纯化培养。
将纯化好的具有蓝紫圈的酵母菌株接种于装有100mL发酵培养基的250 mL锥形瓶中,于25℃、160 r/min恒温摇床培养48 h。发酵结束后,取1 mL发酵液,4℃、4 000 r/min离心10 min,收集上清即为粗酶液,测定GOD酶活力。
1.3.2 GOD酶活测定方法
葡萄糖氧化酶酶活的定义:在下述条件下,每1分钟将1 μmol的β-D-葡萄糖氧化成葡萄糖酸并生成过氧化氢所需的酶量为1个单位(U/mL)。
反应底物为100 μL 5%葡萄糖溶液、200 μL 0.07 g/L邻联茴香胺溶液、10 μL 0.1 g/L辣根过氧化物酶溶液的混合溶液[20-23]。将底物与10 μL GOD标准样品或粗酶液分别于25℃温育10min,然后将底物与酶液迅速混匀,用酶标仪测其在波长500 nm条件下测其吸光度值的变化值,每隔1 min测定一次,连续测定5 min。计算每分钟吸光度值增加值的平均值ΔA。GOD酶活计算公式如下:
式中:EAGOD为葡萄糖氧化酶酶活,U/mL;ΔA:吸光度值的变化值;V1为反应液体积,mL;V2为样品体积,mL;7.5为消光系数。
1.3.3 菌种保藏
斜面保藏:将筛选到的具有产GOD能力的酵母菌株分别接种到斜面保藏培养基上,25℃恒温培养3~5 d后,置于4℃冰箱保存备用。
甘油保藏:将筛选到的具有产GOD能力的酵母菌株分别接种到种子培养基上,25℃、160 r/min培养24 h后,取培养液与灭菌过的甘油混合,甘油终浓度为25%,置于-80℃冰箱保存备用。
1.3.4 菌株鉴定
(1)形态学鉴定
将筛选得到的产GOD酵母菌接种于固体培养基在25℃培养3~7 d,观察菌落的形状、大小、颜色等形态学特征,并在光学显微镜(10×100)及电子显微镜下观察菌体形态。
(2)分子生物学鉴定
采用真菌DNA提取试剂盒提取菌株基因组DNA,然后采用通用引物进行聚合酶链反应(polymerasechainreaction,PCR)扩增及测序。将得到的菌株DNA序列在美国国家生物技术信息中心(national center of biotechnologyinformation,NCBI)上进行BLAST比对,并下载相似性最大的序列和该属内代表种,利用MEGA5软件构建系统发育树[24-25]。
1.3.5 发酵条件优化
培养基中营养源的种类及浓度对产酶均有不同程度的影响,选择合适的营养源及其浓度可提高菌株产GOD的酶活。以GOD的酶活为考察指标,采用单因素试验及正交试验优化担子菌WYQ 23的最优产酶条件。
单因素试验:分别对碳源种类(葡萄糖、蔗糖、可溶性淀粉、乳糖、麦芽糖)及添加量(2%、4%、6%、8%、10%)进行优化;对有机氮源种类(蛋白胨、牛肉膏、酵母粉、尿素、玉米膏)及添加量(0.2%、0.3%、0.4%、0.5%、0.6%)进行优化;对无机氮源种类(NaNO3、KNO3、NH4Cl、(NH4)2SO4、NH4NO3)及添加量(0.2%、0.3%、0.4%、0.5%、0.6%)进行优化;对无机盐(KH2PO4、MgSO4、KCl、CaCO3)添加量分别进行优化。对发酵培养基初始pH(5.0、5.5、6.0、6.5、7.0、7.5)和发酵温度(15℃、20℃、25℃、30℃、35℃)进行优化,所有实验均做3个平行。
正交试验:在培养基成分单因素优化的基础上,以菌体产葡萄糖氧化酶的酶活为评价指标,选择葡萄糖(A)、蛋白胨(B)、NaNO3(C)添加量及发酵温度(D)为影响因素,采用L9(34)正交设计进行试验优化,确定最佳产酶条件,正交试验因素与水平见表1。
表1 产酶条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for enzyme production condition optimization
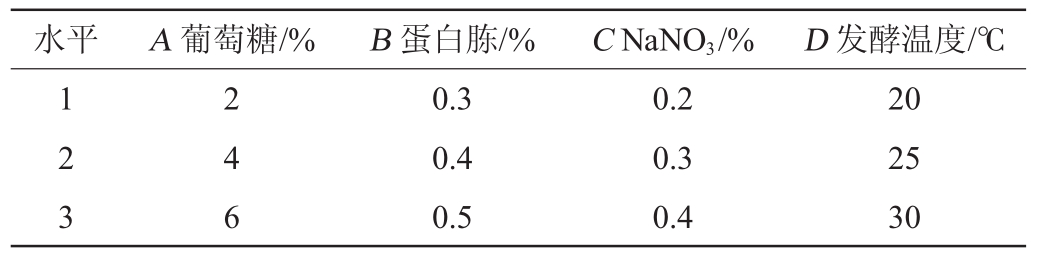
水平 A葡萄糖/% B蛋白胨/% CNaNO3/% D发酵温度/℃1 2 3 2 4 6 0.3 0.4 0.5 0.2 0.3 0.4 20 25 30
2 结果与分析
2.1 产低温GOD酵母菌筛选
从海泥样品中共分离到26株酵母菌,根据菌落形态及是否有蓝紫圈最终获得5株不同酵母菌。将这5株酵母菌接种于发酵培养基中测定其酶活力,结果见表2。由表2可知,通过比较其酶活力,从中筛选出一株酶活最高的菌株WYQ23,该菌株酶活为0.66U/mL,其他菌株酶活为0.17~0.53U/mL。
表2 产低温葡萄糖氧化酶菌株的筛选结果
Table 2 Screening results of low temperature glucose oxidase producing strains

菌株编号 WYQ 3 WYQ 11WYQ 16WYQ 23WYQ 24酶活/(U·mL-1)0.170.530.410.660.22
2.2 菌株鉴定
2.2.1 形态学鉴定
菌株WYQ 23在固体种子培养基上于25℃培养生长,3~7 d后得到直径约为4~10 mm的褐色的菌落。由图1A可知,菌落呈圆形,扁平,较不透明,表面较光滑,正面与反面以及边缘与中央部位的颜色较一致。由图1B可知,菌株显微镜下呈卵圆形,与酵母菌镜下形态一致。
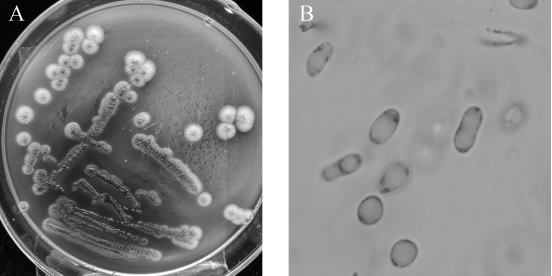
图1 菌株WYQ 23的菌落形态(A)及细胞形态(B)
Fig.1 Colony morphology(A)and cell morphology(B)of strain WYQ 23
2.2.2 分子生物学鉴定
将菌株WYQ 23的ITS区序列在NCBI中进行BLAST分析,利用MEGA5软件构建系统发育树,结果见图2。由图2可知,经比对,该菌株与Basidioascussp.相似度最高,达99%。因此,该菌株被鉴定为担子菌(Basidioascussp.)。该菌株ITS区序列已申请GenBank号,为SUB4615397 Seq1 MK038973。

图2 菌株WYQ 23基于ITS基因序列系统发育树
Fig.2 Phylogenetic tree of strain WYQ 23 based on ITS gene sequences
2.3 发酵条件优化
2.3.1 碳源对菌株WYQ 23产酶的影响
分别以6%的葡萄糖、蔗糖、可溶性淀粉、乳糖、麦芽糖作为碳源,培养菌株WYQ 23,培养基中其他成分及含量均与发酵培养基一致。发酵培养后测其酶活,结果如图3A所示。由图3A可知,当葡萄糖为碳源时酶活最高,为0.66U/mL,蔗糖次之,为0.61 U/mL,当麦芽糖和乳糖为碳源时的酶活较低,当可溶性淀粉为碳源时酶活极低。因此菌株WYQ 23最适碳源为葡萄糖。在该基础上,进一步研究了不同葡萄糖添加量对菌株WYQ23产酶的影响,结果如图3B所示。由图3B可知,当葡萄糖添加量>4%时,GOD酶活随着浓度升高而降低,当葡萄糖添加量<4%时,GOD酶活也降低,因此,葡萄糖的最适添加量为4%。

图3 不同碳源(A)及葡萄糖添加量(B)对菌株WYQ 23产酶的影响
Fig.3 Effects of different carbon sources(A)and glucose addition(B)on enzyme production of strain WYQ 23
2.3.2 有机氮源对菌株WYQ 23产酶的影响
分别以0.3%的蛋白胨、牛肉膏、酵母粉、尿素、玉米膏作为有机氮源,培养菌株WYQ 23,结果如图4A所示。由图4A可知,当有机氮源为蛋白胨时,GOD酶活最高为0.82U/mL,牛肉膏次之,为0.53 U/mL。当有机氮源为酵母粉、玉米膏或尿素时,其酶活较低。不同蛋白胨添加量对菌株WYQ 23产酶的影响,结果如图4B所示。由图4B可知,在蛋白胨添加量<0.4%时,GOD酶活随着浓度增加而增大;在蛋白胨添加量>0.4%时,GOD酶活随着浓度增加而降低。因此,蛋白胨最优添加量为0.4%。

图4 不同有机氮源(A)及蛋白胨添加量(B)对菌株WYQ 23产酶的影响
Fig.4 Effects of different organic nitrogen sources(A)and peptone addition(B)on enzyme production of strain WYQ 23
2.3.3 无机氮源对菌株WYQ 23产酶的影响

图5 不同无机氮源(A)及NaNO3添加量(B)对菌株WYQ 23产酶的影响
Fig.5 Effects of different inorganic nitrogen(A)and NaNO3addition(B)on enzyme production of strain WYQ 23
分别以0.4%的无机氮源NaNO3、KNO3、NH4Cl、(NH4)2SO4、NH4NO3作为培养菌株WYQ 23,结果如图5A所示。由图5A可知,在无机氮源为NaNO3时GOD的酶活最高为0.94U/mL,KNO3次之,为0.77 U/mL。当无机氮源NH4Cl、(NH4)2SO4或NH4NO3,其酶活较低。不同NaNO3添加量对菌株WYQ 23产酶的影响,结果如图5B所示。由如图5B可知,在NaNO3浓度<0.3%时,GOD酶活降低;在NaNO3浓度>0.3%时,GOD酶活随着浓度增加而降低。因此,NaNO3最优添加量为0.3%。
2.3.4 无机盐对菌株WYQ 23产酶的影响
分别对KH2PO4、MgSO4、KCl、CaCO3的添加量进行优化,结果如图6所示。由图6可知,其最适添加量分别为MgSO4 0.07%、KCl 0.03%、KH2PO40.3%、CaCO30.6%。
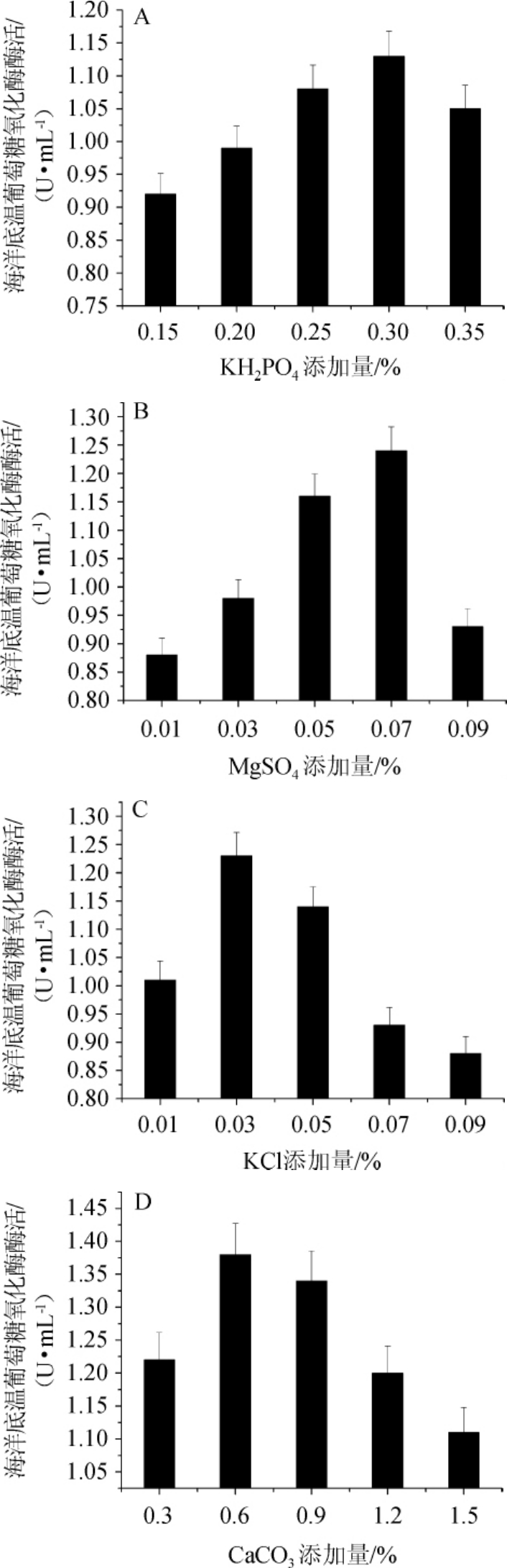
图6 KH2PO4(A)、KCl(B)、MgSO4(C)及CaCO3(D)添加量对菌株WYQ 23产酶的影响
Fig.6 Effects of KH2PO4(A),KCl(B),MgSO4(C)and CaCO3(D)addition on enzyme production of strain WYQ 23
2.3.5 发酵培养基初始pH对菌株WYQ 23产酶的影响
不同发酵培养基初始pH优化结果如图7所示。由图7可知,在初始pH<6.0时,随着初始pH的升高GOD酶活逐渐增加;在初始pH>6.0时,随着初始pH的升高GOD酶活逐渐下降;发酵培养基初始pH值为6.0时酶活力达到最高,为1.54 U/mL。因此,菌株WYQ 23的发酵培养基最适初始pH值为6.0。
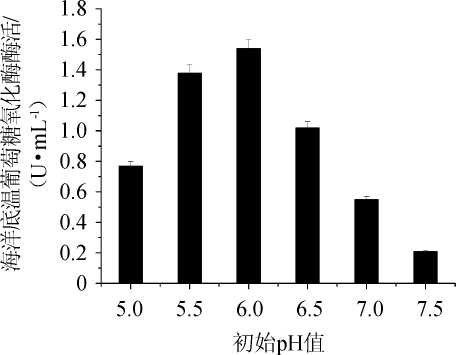
图7 培养基初始pH对菌株WYQ 23生长及产酶的影响
Fig.7 Effect of initial pH on growth and enzyme production of strain WYQ 23
2.3.6 发酵温度对WYQ 23产酶的影响
不同发酵温度优化结果如图8所示。由图8可知,在发酵温度低于25℃时,酶活随着发酵温度升高而升高;在发酵温度高于25℃时,酶活随着发酵温度升高反而降低。因此,最优发酵温度为25℃。

图8 发酵温度对菌株WYQ 23产酶的影响
Fig.8 Effect of fermentation temperature on enzyme production of strain WYQ 23
2.3.7 正交试验结果
根据单因素试验优化结果,因为葡萄糖、蛋白胨、NaNO3及发酵温度对酶活影响较大,因此选择葡萄糖、蛋白胨、NaNO3添加量及发酵温度进行L9(34)正交设计,试验结果见表3。由表3可知,根据极差值可知各因素对菌株WYQ 23产酶的影响次序为发酵温度>NaNO3添加量>葡萄糖添加量>蛋白胨添加量,最优产酶条件组合为A2B1C2D2,即葡萄糖添加量4%,蛋白胨添加量0.3%,NaNO3添加量0.3%,发酵温度25℃。在此优化条件下,葡萄糖氧化酶酶活达到1.67 U/mL。
表3 产酶条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for enzyme production condition optimization
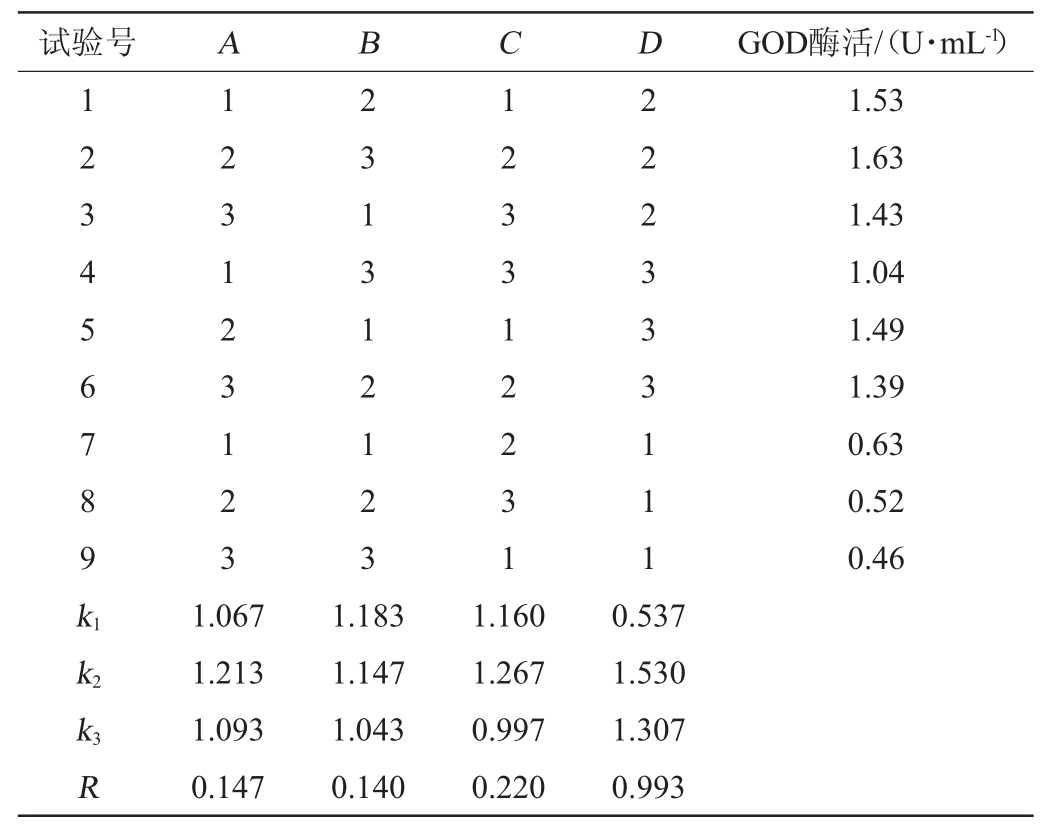
试验号ABCDGOD酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 k1 k2 k3 R 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 1 2 3 3 1 2 2 3 1 2 2 2 3 3 3 1 1 1 1.53 1.63 1.43 1.04 1.49 1.39 0.63 0.52 0.46 1.067 1.213 1.093 0.147 1.183 1.147 1.043 0.140 1.160 1.267 0.997 0.220 0.537 1.530 1.307 0.993
3 结论
本研究从大连黄海海域海泥样品中筛选得到一株产低温GOD的海洋酵母菌WYQ 23,对该菌株的ITS区进行同源性比对并构建系统发育树,确定该菌株为担子菌Basidioascussp.。该菌株产低温GOD最优产酶条件:葡萄糖4%、蛋白胨0.3%、NaNO30.3%、CaCO30.6%、MgSO40.07%、KCl 0.03%、KH2PO40.3%,初始pH 6.0,发酵温度25℃。在此优化条件下,该菌株产低温GOD酶活力达到1.67 U/mL,是优化前的2.53倍。
[1]张长生,李文利.海洋微生物学:新机遇,新挑战[J].微生物学通报,2018,45(9):1841-1842.
[2]叶日英,徐德峰,孙力军,等.海洋源高产葡萄糖氧化酶细菌的筛选和主要酶学性质[J].浙江农业学报,2018,30(4):672-678.
[3]李蓉,张庆芳,迟乃玉.微生物葡萄糖氧化酶的研究进展[J].中国酿造,2018,37(3):1-5.
[4]SINGH O V.Mutagenesis and analysis of moldAspergillus nigerfor extracellular glucose oxidase production using sugarcane molasses[J].Appl Biochem Biotech,2006,135(1):43-57.
[5]BELYAD F,KARKHANEI A A,RAHEB J.Expression,characterization and one step purification of heterologous glucose oxidase gene fromAspergillus nigerATCC 9029 inPichia pastoris[J].EuPA Open Proteom,2018,19:1-5.
[6]邵彩梅,刘燕,王玉璘,等.葡萄糖氧化酶对丹系母猪围产期便秘、粪便菌群及初乳品质的影响[J].饲料工业,2018,39(21):39-43.
[7]惠明,董贞,田青,等.碳纤维共固定葡萄糖氧化酶-过氧化氢酶的研究[J].中国食品学报,2018,18(3):134-140.
[8]龚金秋,刘志强,田雯,等.葡萄糖氧化酶的研究进展及其在猪生产中的应用[J].中兽医医药杂志,2018,37(5):34-38.
[9]王冰.葡萄糖氧化酶在猪饲料中的研究进展[J].饲料博览,2018(1):21-24.
[10]胡亚奇.葡萄糖氧化酶在鸡生产上的应用[J].中兽医学杂志,2018(1):76.
[11]张同燕.葡萄糖氧化酶在养殖业中的应用研究进展[J].当代畜牧,2018(3):16-17.
[12]黄晓月,莫日坚,徐德峰,等.海洋源Bacillus cereusCAMT2377产葡萄糖氧化酶过程分析及优化[J].中国生物制品学杂志,2018,31(11):1268-1273.
[13]郭云瑕,孙钰婷,辛颖,等.葡萄糖氧化酶产生菌的紫外诱变及发酵条件优化[J].食品科技,2016,41(5):2-6.
[14]HAQ U,NAWAZ I,MUKHTAR A,et al.Optimization of inoculum volume,fermentation medium and aeration rate for the production of glucose oxidase by UV mutant strain ofAspergillus nigeran-14[J].Pakistan J Bot,2015,47(SI):329-332.
[15]范新蕾,肖成建,顾秋亚,等.响应面法优化黑曲霉产葡萄糖氧化酶发酵条件[J].食品与生物技术学报,2014,33(10):1096-1100.
[16]郭贺楠,杨勇智,董冰,等.葡萄糖氧化酶研究进展[J].中国畜牧杂志,2018,54(4):10-14.
[17]高庆华,董聪,王玥,等.共表达分子伴侣PDI和Ero1对葡萄糖氧化酶在毕赤酵母中表达的影响[J].生物技术通报,2018,34(7):174-179.
[18]顾磊.Aspergillus niger葡萄糖氧化酶的异源分泌表达、分子改造和发酵生产[D].无锡:江南大学,2014.
[19]闻一凡,顾磊,张娟,等.定点突变提高毕赤酵母产葡萄糖氧化酶的氧化稳定性[J].食品与生物技术学报,2016,35(12):1260-1267.
[20]KHATTAB A A,BAZARAA W A.Screening,mutagenesis and protoplast fusion ofAspergillus nigerfor the enhancement of extracellular glucose oxidase production[J].J Ind Microb Biot,2005,32(7):289-294.
[21]范新蕾,肖成建,顾秋亚,等.ARTP诱变选育葡萄糖氧化酶高产菌株及发酵条件优化[J].工业微生物,2015,45(1):15-19.
[22]王周圆,别小妹,吕凤霞,等.产黄青霉A4产胞外葡萄糖氧化酶发酵工艺优化[J].食品工业科技,2015,36(16):217-221.
[23]朱洪菊.葡萄糖氧化酶产生菌的诱变育种及条件优化[D].济南:山东师范大学,2012.
[24]石淑钰,张庆芳,迟乃玉,等.一株海洋低温葡萄糖氧化酶菌株的筛选、鉴定及部分酶学性质[J].微生物学通报,2014,41(5):832-838.
[25]王晓辉,王贵鹏,张庆芳,等.一株抗灰霉病解淀粉芽孢杆菌的筛选鉴定及抑菌蛋白的分离[J].吉林农业科学,2015,40(1):64-67.