我国作为农业大国,畜牧业产品产量居世界前列,但是对于粮食和饲料在我国一直处于薄弱地位。同时,由于各种农作物及副产品的处理不当对资源与环境也造成了巨大压力[1-3]。我国从20世纪90年代开始研究微生物发酵饲料,大量研究表明[4-6],微生物发酵饲料可提高原料的营养价值、动物的消化利用率等特点,对建立一个正常,平衡的动物体内微生物生态系统起着重要的作用。当前,生物饲料的开发已逐渐成为我国饲料加工的热点[7]。
玉米蛋白粉作为一种重要的蛋白饲料资源含有丰富的蛋白质,被广泛应用于各类蛋白饲料生产中[8-10],基于微生物发酵饲料的生产特点,利用微生物发酵玉米蛋白粉,不仅解决了玉米蛋白粉的浪费和吸收率问题,由于发酵产物中含有丰富的氨基酸等各类营养物质,还可有效提高动物的生长率[11]。
在发酵饲料行业中,产朊假丝酵母(Candida utilis)主要作为益生菌及饲用发酵菌剂使用,常被用于生产多种具有功能性的生物物质。研究表明[12],饲料中添加产朊假丝酵母,提高了仔鹅生长性能,优化了其盲肠菌群。采用产朊假丝酵母混菌发酵玉米蛋白粉,可以提高其营养价值。并且近年来随着诱变育种技术的发展,相对于单一的诱变方式,复合诱变能够更好的提高目标微生物的各项功能性产物代谢量,如李学思等[13]从宋河大曲中酵法筛选出1株高产蛋白酶菌株MSPN-11,经紫外诱变技术得1株高产蛋白酶菌株MSPR 8,酶活提高了26.38%。朱明军等[14]对产中性蛋白酶的枯草芽孢杆菌以紫外线、硫酸二乙酯为诱变剂,对其进行两轮复合诱变,诱变菌的发酵液酶活较出发菌提高了59.68%。本研究采用紫外-光复活诱变方式对目标菌株进行处理,对目标菌株进行筛选[15],进而得到高产蛋白酶的菌株,并将其应用于发酵玉米蛋白粉饲料生产,可有效提高饲料利用率,降低成本,具有良好的绿色与经济前景。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
产朊假丝酵母(Candida utilis):齐齐哈尔大学生物工程实验室保藏。
1.1.2 化学试剂
无水乙醇、胰蛋白胨、琼脂粉、碳酸钠、酪蛋白、酪氨酸、葡萄糖、磷酸氢二钠、磷酸二氢钠、三氯乙酸等(均为分析纯或生化试剂):天津市凯通化学试剂有限公司;脱脂牛奶:市售。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[16]:2%胰蛋白胨,2%葡萄糖,100 mL水,115℃,灭菌30 min。YPD固体培养基加入2%琼脂;
脱脂牛奶培养基:A 5 g脱脂牛奶与50 mL蒸馏水混合;B 2 g琼脂50 mL蒸馏水。A、B分别115℃灭菌20 min,冷却至60℃混匀后倒入平板。
1.2 仪器与设备
PYX-DHS隔水式电热恒温培养箱;上海跃进医疗器械厂;PHS-25数显pH计;上海精密科学仪器有限公司;TV1901紫外可见分光光度计;北京谱析通用仪器有限公司;DSX-280不锈钢压力蒸汽灭菌器;上海申安医疗器械厂;ZHJH-C2109C超净工作台;上海智城分析仪器有限公司。
1.3 方法
1.3.1 菌种生长曲线测定
采用比浊法测定出发菌株的生长曲线[17]。
1.3.2 菌悬液的制备
接种一环产朊假丝酵母至YPD液体培养基中,于28℃、200 r/min培养20 h,得到菌悬液。
1.3.3 紫外诱变
使用紫外灯对菌悬液进行不同时间(0~150s)的照射,每隔5s进行一次取样,稀释之后进行YPD平板涂布。将YPD平板倒扣培养进行菌落计数,绘制致死率曲线。致死率计算公式如下:
1.3.4 紫外-光复活诱变
对菌悬液采用最佳紫外诱变时间(120 s)进行照射,然后放置白炽灯下进行不同时间(0~30 s)的光复活照射,每隔5 s进行一次取样,稀释后进行YPD平板涂布,将YPD平板倒扣避光培养进行菌落计数,计算光复活率及正突变率,其计算公式如下:

1.3.4 突变株的筛选
将经紫外-光复活诱变处理后的菌悬液稀释后涂布于脱脂牛奶平板上32℃,培养48 h。根据透明圈直径与菌落直径的比值,筛选出产蛋白酶活力较强的菌株。菌落的透明圈直径与菌落直径比值大小可以表示菌株产蛋白酶能力的强弱,该比值越大,则代表菌株产蛋白酶能力越强。
1.3.5 酶活力测定
将筛选菌株接入YPD液体培养基,于32℃、180 r/min条件下摇床培养48 h,取培养液采用Folin-酚法测定中性蛋白酶活力。
1.3.6 遗传稳定性试验
根据菌株产蛋白酶活力筛选出一株较出发菌株提高最大的突变株进行连续传代试验,将筛选所得菌株接入YPD固体培养基进行连续传代5次培养后,取各代菌种接入液体培养基于32℃、180 r/min条件下摇床培养48 h,取培养液采用Folin-酚法测定其中性蛋白酶活力。
2 结果与分析
2.1 出发菌株的生长曲线
对微生物进行紫外诱变处理前,一般要求出发菌株应处于对数生长期,当菌株处于对数生长期时对紫外线照射更加敏感,易发生突变,而且处于对数生长期的菌种自身代谢能力强,相对稳定,生长速度快繁殖旺盛[18]。以产朊假丝酵母(Candida utilis)作为出发菌株,接种至YPD液体培养于32℃、180r/min条件下摇床培养,在波长600nm处测定不同生长时间的OD600nm值,绘制菌株生长曲线见图1。
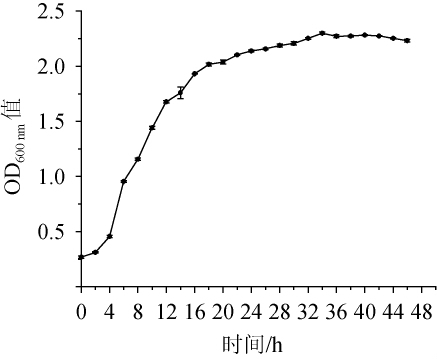
图1 产朊假丝酵母生长曲线
Fig.1 Growth curve ofCandida utilis
由图1可知,0~4 h期间菌体浓度几乎无变化,此时菌种处于生长延迟期。从第6小时开始菌体浓度剧增,此时菌种进入对数生长期,20h后菌种生长速度减缓,进入稳定期,30 h后,随着菌种的生长缓慢,菌悬液浓度几乎保持不变,进入衰亡期。结果表明,出发菌种的对数生长期为6~20 h,应选择对数中前期的菌种进行紫外诱变处理。因此,选择经过12 h培养的菌液进行紫外诱变处理。
2.2 紫外诱变处理
进行紫外诱变育种时,为了得出最佳诱变剂量,需先对出发菌种的紫外线致死率进行计算,产朊假丝酵母致死率曲线见图2。
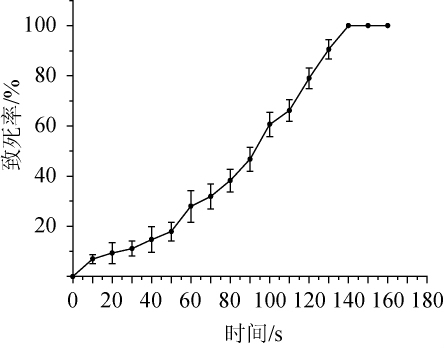
图2 产朊假丝酵母致死率曲线
Fig.2 Lethality rate curve ofCandida utilis
由图2可知,随着紫外线照射时间的增加,菌株的死亡率也随之增加。产朊假丝酵母在紫外照射剂量为120 s时的致死率达到80%,由于致死率为80%时,紫外诱变处理的效果最佳,菌种正突变率最高。因此,采用120 s为产朊假丝酵母的最佳紫外诱变剂量。
2.3 紫外-光复活诱变[19]
在紫外照射120 s后放入白炽灯下进行不同时间(0~30 s)的光复活照射,通过平板涂布法计算光复活率,并测量计算透明圈直径与菌落直径比值,与单一诱变突变株进行比较,通过计数透明圈直径比大于原始菌株直径比的菌落数,与菌落总数的比值计算正突变率,产朊假丝酵母光复活率及正突变率曲线见图3。

图3 产朊假丝酵母光复活率及正突变率曲线
Fig.3 Photoreactivation rate and positive mutation rate curve of Candida utilis
由图3可知,随着光复活时间在0~30 s范围内增加,菌株光复活率也随之由10.01%增加至32.42%。随着光复活时间在0~30s内的增加,正突变率呈现先增加后减少的趋势,并且在白炽灯照射剂量达到20 s时,菌株正突变率最大达到14.99%,随后便随着白炽灯照射时间的增加而减小。因此,确定在紫外照射120 s后,白炽灯照射20 s为最佳光复活剂量。
2.4 高产蛋白酶突变菌株筛选
2.4.1 紫外诱变突变株筛选
将出发菌株进行单一紫外诱变处理(紫外照射120 s)后,将其倒扣避光培养于32℃恒温培养箱中48 h,根据透明圈直径与菌落直径的比值,筛选出产蛋白酶活力较强的菌株,并测定其酶活力,结果见表1。
表1 紫外诱变突变株的初筛
Table 1 Primary screening of UV mutated strain

菌株 菌落直径/mm透明圈直径/mm透明圈直径/菌落直径中性蛋白酶活力/(U·mL-1)出发菌株YC-3 YC-27 YC-56 YC-57 YC-73 1.44±0.020 0.72±0.012 0.78±0.012 1.18±0.020 1.20±0.057 0.90±0.000 10.46±0.014 9.44±0.057 7.34±0.012 12.56±0.000 13.10±0.020 8.96±0.012 7.62±0.031 13.11±0.094 9.41±0.036 10.64±0.025 10.94±0.076 9.96±0.022 21.93±0.082 35.55±0.074 28.31±0.132 30.63±0.055 29.54±0.202 28.85±0.080
由表1可知,出发菌株透明圈与菌落直径比值为7.62,由于脱脂牛奶培养基上菌落的透明圈直径与菌落直径比值大小可以反映菌株产蛋白酶能力的强弱,该比值越大,则代表菌株产蛋白酶能力越强。所以通过120 s的紫外线照射,筛选出较出发菌株比值提高最大的5株突变株,其中以YC-3最大达到13.11,将筛选所得5株菌株于32℃摇床培养48 h后测定其酶活力,得出发菌株酶活力为21.93 U/mL,突变株中以YC-3酶活力最大达到35.55 U/mL,是出发菌株酶活力的1.62倍,但提升效果较差,为更好的提高菌株产蛋白酶能力,对经紫外诱变后的菌株再次进行光复活试验。
2.4.2 紫外-光复活诱变突变株筛选
出发菌株的菌悬液经过紫外照射120 s后,再经白炽灯照射20 s,得到紫外-光复活诱变菌株,涂布于脱脂牛奶培养基于32℃恒温培养箱培养48 h。计算透明圈直径与菌落直径比值,并测定其酶活力,结果见表2。
表2 紫外-光复活诱变的突变株筛选
Table 2 Screening of mutant strain by UV photoreactivation mutagenesis

菌株 菌落直径/mm透明圈直径/mm透明圈直径/菌落直径中性蛋白酶活力/(U·mL-1)YC-3 FC-20.14 FC-20.24 FC-20.25 FC-20.26 FC-20.28 0.72±0.012 0.70±0.020 0.72±0.010 0.67±0.012 0.71±0.012 0.64±0.020 9.44±0.057 12.00±0.020 10.92±0.012 11.01±0.012 11.60±0.020 10.41±0.012 13.11±0.094 17.14±0.054 15.17±0.067 16.18±0.022 16.57±0.038 16.25±0.055 35.55±0.074 64.18±0.213 57.30±0.087 60.41±0.102 61.73±0.057 61.08±0.062
由表2可知,YC-3的透明圈与菌落直径比值为13.11,从测得的突变株中筛选透明圈与菌落直径比值>13.11的突变株。经筛选共得出5株比值较YC-3提高最大的突变株,其中以突变株FC-20.14的比值最大为17.14。将筛选出的5株突变株分别接入YPD液体培养基中于32℃摇床培养48 h后离心取上清液测定其中性蛋白酶活力[20],其中以突变株FC-20.14酶活力最高为64.18 U/mL。是单一紫外诱变的突变株YC-3的酶活力35.55 U/g的1.81倍,是出发菌株酶活力21.93 U/mL的2.93倍。
2.6 遗传稳定性试验
将突变株FC-20.14接至YPD斜面培养基上培养传代。连续培养5代后,将每代均接种于YPD液体培养基中,测定其中性蛋白酶活力[21-24],结果见表3。
表3 突变株FC-20.14遗传稳定性
Table 3 Genetic stability of mutant strain FC-20.14

项目 第1代酶活力/(U·mL-1)第2代 第3代 第4代 第5代64.15±0.068 64.18±0.045 64.02±0.091 63.99±0.082 63.97±0.104
由表3可知,对突变株FC-20.14进行连续传代5次,酶活力稍有降低。从第1代至第5代,酶活力变化了0.21 U/mL,变化率为0.32%,变化幅度不显著,证明连续传代会对突变株FC-20.14的蛋白酶活力造成一定影响,但减少程度较小,由此可得出,该突变株遗传性状稳定,遗传性能良好,可用作发酵玉米蛋白粉饲料。
3 结论
本研究通过紫外-光复活诱变育种筛选出一株遗传性状稳定的较出发菌株蛋白酶活力有明显提高的产朊假丝酵母突变菌株FC-20.14用作微生物发酵玉米蛋白粉饲料,经测定出发菌株经单一紫外诱变过后,筛选出一株紫外突变株YC-3,蛋白酶活力为35.55 U/mL,较出发菌株的蛋白酶活力提高了0.62倍。经紫外-光复活诱变处理后,筛选出一株紫外-光复合突变株FC-20.14,该突变株透明圈直径与菌落直径比值为17.14,蛋白酶活力为64.18U/mL,较出发菌株提高1.93倍。通过遗传稳定性试验发现连续传代5次后该突变株蛋白酶活力变化率为0.32%,变化幅度不显著,证明其拥有稳定的遗传性能,可用于发酵玉米蛋白粉饲料,为发酵玉米蛋白粉饲料的研究奠定了基础。
[1]宋鹏,陈五岭.微生物发酵蛋白饲料饲喂肉猪效果的研究[J].江苏农业科学,2006(5):105-107.
[2]CHEN R M,ZHANG C Y,YAO B,et al.Corn seeds as bioreactors for the production of phytase in the feed industry[J].J Biotechnol,2013,165(2):120-126.
[3]WANZENBÖCK E,SCHREINER M,ZITZ U,et al.A combination of wheat bran and vegetable oils as feedstuff in laying hens'diet:impact on egg quality parameters[J].Agr Sci,2018,9(6):676-691.
[4]罗玲,韩奇鹏,曲湘勇.微生物发酵饲料在动物生产上的应用研究进展[J].饲料与畜牧,2016(2):45-50.
[5]MARQUES R V,DA PAZ M F,DUVAL E H,et al.Staphylococcus xylosusfermentation of pork fatty waste:raw material for biodiesel production[J].Brazil J Microbiol,2017,47(3):675-679.
[6]GUO H W,CHANG J,YIN Q Q,et al.Effect of the combined physical and chemical treatments with microbial fermentation on corn straw degradation[J].Bioresource Technol,2013,148(5):361-365.
[7]邢文会,付瑞敏,王丁,等.微生物发酵甘薯渣产蛋白饲料的工艺优化及对育肥猪生产性能的影响[J].江苏农业科学,2016,44(4):279-284.
[8]林谦,戴求仲,蒋桂韬,等.玉米及其加工副产品的营养价值评定[J].中国饲料,2013(4):18-21.
[9]JIN D X,LIU X L,ZHENG X Q,et al.Preparation of antioxidative corn protein hydrolysates,purification and evaluation of three novel corn antioxidant peptides[J].Food Chem,2016,204(1):427-436.
[10]FREDIN S M,FERRARETTO L F,AKINS M S,et al.Shaver.Effects of corn-based diet starch content and corn particle size on lactation performance,digestibility,and bacterial protein flow in dairy cows[J].J Dairy Sci,2015,98(1):541-553.
[11]江成英,王松,李琰,等.固态发酵玉米黄粉饲料复合菌种的筛选[J].中国酿造,2018,37(2):71-74.
[12]聂琴,戴晋军,胡骏鹏,等.酵母源生物饲料的菌种与功能[J].中国饲料,2018(11):89-93.
[13]李学思,侯小歌,李绍亮,等.中高温大曲中高产蛋白酶菌株的选育[J].酿酒,2017,44(2):47-51.
[14]朱明军,区健发,陈鸿图.中性蛋白酶高产菌株的诱变选育[J].现代食品科技,2013,29(11):2686-2691.
[15]王金主,袁建国,杨丹,等.产脂肪酶菌株的筛选及紫外-光复活诱变[J].食品与药品,2011,13(5):192-195.
[16]赵炎葱,李景华,刘敏.毕赤酵母工程菌在不同培养基中生长的研究[J].河南大学学报(医学版),2013,32(4):273-275.
[17]朱艳蕾.细菌生长曲线测定实验方法的研究[J].微生物学杂志,2016,36(5):108-112.
[18]王蒙蒙,张莉,李慧,等.粪肠球菌生长曲线的测定及其对小鼠脑组织的影响[J].中国畜牧兽医,2018,45(4):1041-1049.
[19]张崇淼,刘强强,国承荣.紫外线消毒后耐药性大肠埃希氏菌的光复活特性[J].环境工程学报,2017,11(4):2145-2149.
[20]刘晓艳,张晓燕,杨国力,等.枯草芽孢杆菌L1发酵产中性蛋白酶活性的研究[J].食品与发酵科技,2018,54(3):55-59.
[21]兰海英,石乔,李娜,等.表达纤溶酶抑制剂Textilinin-1的毕赤酵母工程菌遗传稳定性分析[J].中国生物制品学杂志,2018,31(11):1201-1206.
[22]ZHANG Y,HE M L,ZOU S M,et al.Breeding of high biomass and lipid producingDesmodesmussp.by ethylmethane sulfonate-induced mutation[J].Bioresource Technol,2016,207:268-275.
[23]KENZHEBAYEVA S S,ALYBAYEVA R,ATABAYEVA S,et al.Improvement of spring wheat protein quality and quantity by mutation breeding[J].Curr Opin Biotechnol,2013,24:85.
[24]温智慧,李敬知,冯瑞琪,等.EMS诱变高异丁醇耐受性酿酒酵母的筛选[J].中国酿造,2018,37(10):66-71.