山西老陈醋素有“天下第一醋”的盛誉[1],以其“酸醇厚、味清香、回味绵、质浓稠、色紫檀和久贮不变质”的特色深受广大消费者喜爱[2]。大曲中因含蛋白酶、糖化酶、纤维素酶等几十种酶类与霉菌、酵母菌等微生物而素有“曲是醋中骨”之称,其在山西老陈醋的酿造中起到重要的作用。大曲中的霉菌在生长代谢过程中会产生丰富的酶系,尤其是糖化酶,是食醋酿造过程中的重要糖化剂。除了糖化酶,霉菌也会产生一定的蛋白酶,分解原料中的蛋白质生成各种氨基酸和多肽,此类物质的含量是成品食醋质量优劣的一个标准[3]。纤维素酶则可使食醋酿造原料中的纤维素转化为可发酵性的糖,从而增加了原料中可利用的碳源,还可以破坏原料中的细胞壁结构促进淀粉的溶出,这有利于糖化酶更好地进行糖化[4]。
近年来,一些学者对大曲及酿造中的优良霉菌进行了一些筛选、鉴定、产酶条件优化及糖化酶基因等研究工作。张琳等[5]用Martin培养基对大曲中的霉菌进行分离,分别以透明圈和酶活大小进行初筛和复筛获得高产糖化酶菌株,其中菌株M6糖化酶活力最高,酶活可达3912.08 U/mL。刘茗铭等[6]从曲中筛选高产糖化酶菌株,通过单因素试验和正交试验,确定固态发酵产酶最佳条件为:糠壳添加量4%、接种量1.25%、初始pH值为5.5、料水比5∶3(g∶mL),在30℃条件下培养72 h,其糖化酶活性高达1 791.3 U/g。唐国敏等[7]报道,经多次诱变获得的黑曲霉T21,其糖化酶基因编码区序列与BOEL E等[8]报道的黑曲霉糖化酶基因编码区序列一致,黑曲霉突变菌株T21中稳定态糖化酶信使核糖核酸(messenger ribonucleic acid,mRNA)含量非常高,这可能是菌株T21糖化酶高产的重要原因之一。
本研究主要从山西老陈醋大曲中分离筛选高产糖化酶的菌株,对其产蛋白酶和纤维素酶的能力进行分析,并对其糖化酶基因进行聚合酶链反应(polymerase chain reaction,PCR)扩增、序列比对和氨基酸序列预测,初步探讨菌株高产酶活的基因机制,为其进一步基因工程育种研究奠定基础;在此基础上还对产酶摇瓶发酵培养基和发酵条件进行了优化,为山西老陈醋酿造专用酶制剂的开发进行研究基础积累。高产糖化酶霉菌的筛选、鉴定及产酶条件优化为定向选育、定向调控提供理论依据,对山西老陈醋酿造专用酶制剂的开发及山西老陈醋的提质增效具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 霉菌菌株
75株霉菌:分离自山西老陈醋大曲,保存于山西农业大学食品学院生物工程实验室。
1.1.2 化学试剂
葡萄糖、蛋白胨、琼脂(均为生化试剂):天津市天力化学试剂有限公司;Maker D、mix:上海生工生物工程股份有限公司;PCR引物:北京六合华大基因科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[6]、产糖化酶筛选培养基[5]、麸皮培养基[9]。
液体发酵产酶基础培养基:麸皮3%,(NH4)2SO40.4%,KH2PO40.2%,MgSO4 0.03%,CaCl20.03%,pH 5.5。1×105Pa灭菌20 min。
1.2 仪器与设备
UV-9100紫外可见分光光度计:北京瑞利分析仪器公司;Eppendorf离心机:艾本德(中国)有限公司;T100 PCR仪、Universial HoodⅡ型凝胶成像系统:美国Bio-Rad公司;DYY-6C型琼脂糖凝胶电泳仪:北京六一仪器厂;ZQPL-200立式全温振荡培养箱:天津市莱玻特瑞仪器设备有限公司;DHP-500电热恒温培养箱:北京市光明医疗仪器厂。
1.3 方法
1.3.1 高产糖化酶霉菌的筛选
将75株霉菌菌株分别接种到产糖化酶筛选培养基上,于30℃静置培养48 h,向产糖化酶筛选培养基的培养皿中加入4 mL卢戈氏碘液进行染色,分别测量透明圈的大小;用生理盐水冲洗PDA培养基上的霉菌孢子,制备孢子浓度为106个/mL的孢子悬液,将各霉菌孢子悬液均按2%(V/V)接种量接种于麸皮培养基中,30℃发酵3 d,取样,采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)比色法[10]测定糖化酶的活力。糖化酶酶活定义:1 g酶粉于40℃、pH 4.6条件下,每小时水解可溶性淀粉产生1 mg葡萄糖的酶量为一个酶活力单位(U/g)。
1.3.2 高产糖化酶霉菌的筛选
将筛选出的产糖化酶较高的霉菌菌株按照1.3.1方法制备样品,分别采用福林比色法[10]、DNS比色法[11]测定蛋白酶、纤维素酶的活力。
蛋白酶的酶活定义:1 g固体酶粉在40℃(酸性pH=3.0、中性pH=7.5、碱性pH=10.5)条件下,每分钟水解酪素产生1 μg酪氨酸为一个酶活力单位(U/g)。
纤维素酶的酶活定义:1g固体酶粉在40℃和pH值4.2条件下,每分钟水解纤维素生成1μg的量为一个酶活单位(U/g)。
1.3.3 高产糖化酶霉菌的鉴定
对筛选出的高产糖化酶霉菌菌株进行观察并记录菌落的颜色及形态[12],以及在显微镜下观察菌丝体特征及孢子形态,对菌株进行菌种的初步鉴定[13]。
采用改良的十六烷基三甲基溴化铵(hexadecyltrimethyl ammonium bromide,CTAB)法[14]提取基因组。并以此为模板进行PCR扩增。PCR反应体系和条件见参考文献[15],PCR反应以ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')为ITS基因序列的上下游引物,用以对ITS序列进行扩增鉴定菌株。扩增产物送至北京六合华大基因科技股份有限公司进行测序,测序结果与美国国立生物技术信息中心(national center for biotechnologyinformation,NCBI)数据库中序列进行比对。
1.3.4 高产糖化酶霉菌的糖化酶基因扩增
以1.3.3中所提基因组为模板,按上述方法进行PCR扩增及比对,以P3(5'-CAATGTCGTTCCGAT-3')和P4(5'-GTCCAGAAGGACTGC-3')为糖化酶基因序列的上下游引物,用以对糖化酶基因进行扩增。采用NCBI、DNAstar等数据库和软件,分析糖化酶基因的同源性,推导蛋白的氨基酸序列,并对编码蛋白的分子质量、等电点等性质进行预测。
1.3.5 高产糖化酶霉菌的摇瓶培养
按1.3.1方法将调整好孢子悬液浓度的霉菌分别按6%接种量接种于装液量为100 mL/250 mL液体发酵产酶基础培养基中,30℃、150 r/min发酵6 d。将产酶发酵液于4℃、4000r/min的条件下离心20min,取上清液,测定糖化酶活力。
1.3.6 产酶发酵培养基及发酵条件的优化
(1)产酶发酵培养基的优化
在液体发酵基础培养基的基础上,分别改变其中的碳氮源浓度及起始pH值,考查碳源添加量(麸皮1%、2%、3%、4%、5%)、氮源添加量(硫酸铵0.5%、1.0%、1.5%、2.0%、2.5%)和起始pH值(4.0、5.0、6.0、7.0、8.0)对发酵液中的糖化酶活力的影响。通过单因素试验,选取每个因素中最优的3个水平,采用L9(33)正交试验设计研究碳源浓度、氮源浓度、起始pH值3个因素对菌株产酶的影响。
(2)产酶发酵条件的优化
采用优化后的培养基,分别改变其中的装液量、接种量及转速,考查装液量(50 mL/250 mL、75 mL/250 mL、100 mL/250 mL、125 mL/250 mL)、接种量(4%、6%、8%、10%)和转速(125 r/min、145 r/min、165 r/min、185 r/min)对发酵液中的糖化酶活力影响。通过单因素试验,选取每个因素中最优的3个水平,采用L9(33)正交试验设计研究装液量、接种量及转速3个因素对菌株产酶的影响。
2 结果与分析
2.1 高产糖化酶霉菌的筛选及鉴定
糖化酶又称葡萄糖淀粉酶,是一种可将淀粉、糊精、糖原水解为葡萄糖,且有助于酵母分解葡萄糖生成乙醇的酶制剂。在大曲研究中,由于关系到淀粉的利用,糖化酶活是关注大曲质量的一项重要指标[16]。
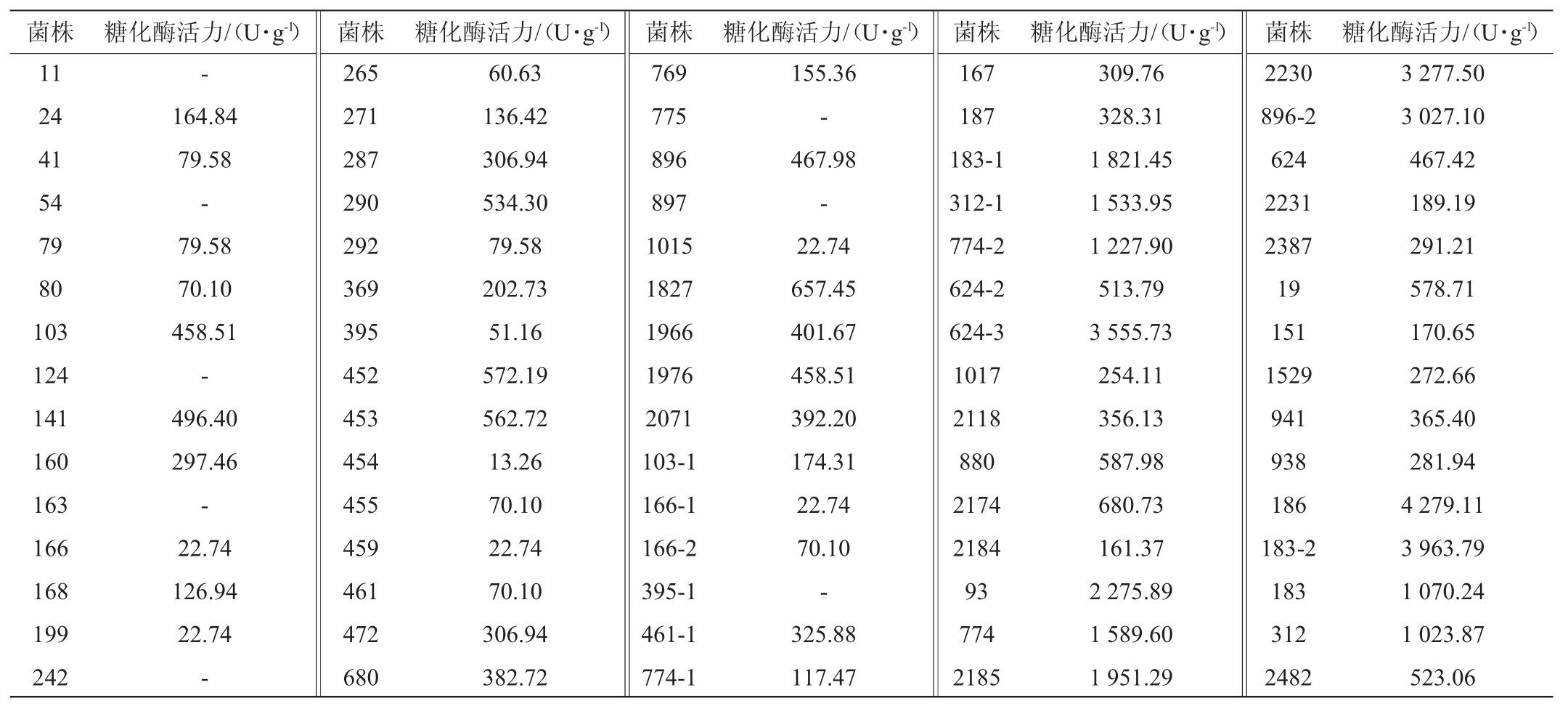
将分离出的75株霉菌分别接种到产糖化酶筛选培养基上,观察其透明圈的大小。同时将各霉菌制成孢子悬液,分别接种于麸皮培养基中,经过发酵产酶培养后,菌株的糖化酶活力如表1所示。由表1可知,所测霉菌的酶活力差别较大,糖化酶活力最高的霉菌为菌株186,酶活可达4279.11U/g,其次菌株183-2、624-3、2230、896-2、93为糖化酶活力较高的菌株,糖化酶分别为3 963.79 U/g、3 555.73 U/g、3 277.50 U/g、3 027.10 U/g、2 275.89 U/g。
表1 霉菌菌株糖化酶活力测定结果
Table 1 Determination results of saccharifying enzyme activity of mold strains
注:“-”表示未检出。
菌株糖化酶活力/(U·g-1)菌株糖化酶活力/(U·g-1)菌株糖化酶活力/(U·g-1)菌株糖化酶活力/(U·g-1)菌株糖化酶活力/(U·g-1)11 24 41 54 79 80 103 124 141 160 163 166 168 199 242-164.84 79.58-79.58 70.10 458.51-496.40 297.46-22.74 126.94 22.74-265 271 287 290 292 369 395 452 453 454 455 459 461 472 680 60.63 136.42 306.94 534.30 79.58 202.73 51.16 572.19 562.72 13.26 70.10 22.74 70.10 306.94 382.72 769 775 896 897 1015 1827 1966 1976 2071 103-1 166-1 166-2 395-1 461-1 774-1 155.36-467.98-22.74 657.45 401.67 458.51 392.20 174.31 22.74 70.10-325.88 117.47 167 187 183-1 312-1 774-2 624-2 624-3 1017 2118 880 2174 2184 93 774 2185 309.76 328.31 1 821.45 1 533.95 1 227.90 513.79 3 555.73 254.11 356.13 587.98 680.73 161.37 2 275.89 1 589.60 1 951.29 2230 896-2 624 2231 2387 19 151 1529 941 938 186 183-2 183 312 2482 3 277.50 3 027.10 467.42 189.19 291.21 578.71 170.65 272.66 365.40 281.94 4 279.11 3 963.79 1 070.24 1 023.87 523.06
大曲中除了糖化酶,其中的蛋白酶和纤维素酶对于食醋酿造也起到重要的作用,酸性蛋白酶可溶解发酵原料颗粒,促进糖化发酵,降解底物可提供微生物增殖所需的营养小肽、氨基酸等,降解的氨基酸可促进氨基酸的代谢,改善风味成分,提高乙醇浓度[17];纤维素酶可降解原料中的纤维素,促进淀粉和蛋白的降解,提高发酵率[18]。因此,在筛选高产糖化酶菌株的同时考虑蛋白酶和纤维素酶显得尤为重要。
将上述筛选的产糖化酶最高的6株霉菌进行蛋白酶和纤维素酶活力的测定,酶活力测定结果如表2所示。由表2可知,菌株186的三种酶活均较高,其蛋白酶和纤维素酶活力分别可达到368.80 U/g和4 476.60 U/g,除了菌株896-2的蛋白酶活力(377.09 U/g)略高于菌株186,其余菌株的蛋白酶活力显著低于菌株186(P<0.05),而菌株896-2的纤维素酶(2 806.34 U/g)却显著低于菌株186(P<0.05),因此,菌株186不仅高产糖化酶,且高产蛋白酶和纤维素酶,是高产3种酶的优良菌株。
表2 霉菌菌株糖化酶、蛋白酶及纤维素酶酶活力测定结果
Table 2 Determination results of saccharifying enzyme,protease and cellulase activity of mold strains

菌株 糖化酶活力/(U·g-1)蛋白酶活力/(U·g-1)纤维素酶活力/(U·g-1)186 183-2 624-3 2230 896-2 93 4 279.11 3 963.79 3 555.73 3 277.50 3 027.10 2 275.89 368.80 2.65 4.31 40.76 377.09 2.65 4 476.60 4 401.37 3 792.66 2 532.76 2 806.34 3 807.06
经筛选后得到高产酶的菌株186,对其进行形态观察,结果见图1。由图1可知,菌株186在PDA培养基上生长的相对较快,但生长蔓延较为局限。生长初期菌丝为白色,后逐渐变为鲜黄色直至变为厚绒状的驼色,较干燥,菌落外有同心的白色圆圈,菌落背面为淡黄褐色。在PDA液态培养基中振荡培养时,培养1 d后形成白色菌丝体小球,于显微镜下观察菌丝体,可观察到菌丝分枝繁茂且具有横隔,菌丝无色透明。显微镜下观察孢子,可观察到分生孢子梗无色,顶部形成球形的孢子囊,孢子囊上对生小梗,上长有的分生孢子呈球形、褐色轮廓。

图1 菌株186的菌落形态、菌丝体形态、孢子囊及孢子梗形态
Fig.1 Colonial morphology,mycelial morphology,sporangia and sporophore morphology of strain 186
提取菌株186基因组并对ITS序列进行PCR扩增,测序序列与NCBI数据库中序列进行比对,下载相近菌株的基因序列,构建系统进化树,其ITS序列系统进化树见图2。由图2可知,菌株186在系统进化树上与黑曲霉(Aspergillus niger)同属于一个分支,与黑曲霉Aspergillus nigerstrain B4/1/VF(登录号KX901281.1)等的相似度极高,可达100%,结合形态观察,由此推断,菌186属于黑曲霉(Aspergillus niger)。

图2 菌株186 ITS序列系统进化树
Fig.2 Phylogenetic tree of strain 186 based on ITS sequences
本试验筛选出的黑曲霉186糖化酶活力显著高于王旭亮等[19]从不同大曲中分离的黑曲霉在大麦豌豆纯种曲培养基中于25℃条件下培养7d的糖化酶活力(495.10~708.5U/g)(P<0.05);蛋白酶活则与黄永光[20]从白酒酿造过程中分离的黑曲霉lsq21菌株在麸曲培养基中的蛋白酶活力(373.49 U/g)相近;黑曲霉186纤维素酶活力明显高于李兰晓[21]研究的黑曲霉的纤维素酶活力(759.9±51.7)U/g。综合分析,黑曲霉186在产酶方面表现优良。
2.2 高产糖化酶霉菌的糖化酶基因序列分析
将黑曲霉186的糖化酶基因进行PCR扩增,其糖化酶基因PCR扩增产物电泳检测结果如图3所示,其扩增条带单一,亮度较高。将产物测序所得序列申请登录号,为MK641588,该基因的DNA序列开放阅读框长度为1449bp,该基因鸟嘌吟(Guanine)+胞嘧啶(Cytosime)含量为57.76%,NCBI搜索比对后发现,该基因与黑曲霉TCCC41661糖化酶基因(登录号:KM488271.1)序列同源性达到100%。用DNAstar软件推导氨基酸序列,详细序列见图4。由图4可知,该基因编码的酶蛋白由482个氨基酸组成。软件预测出该酶的分子质量约为51.75 kDa,等电点为3.99。
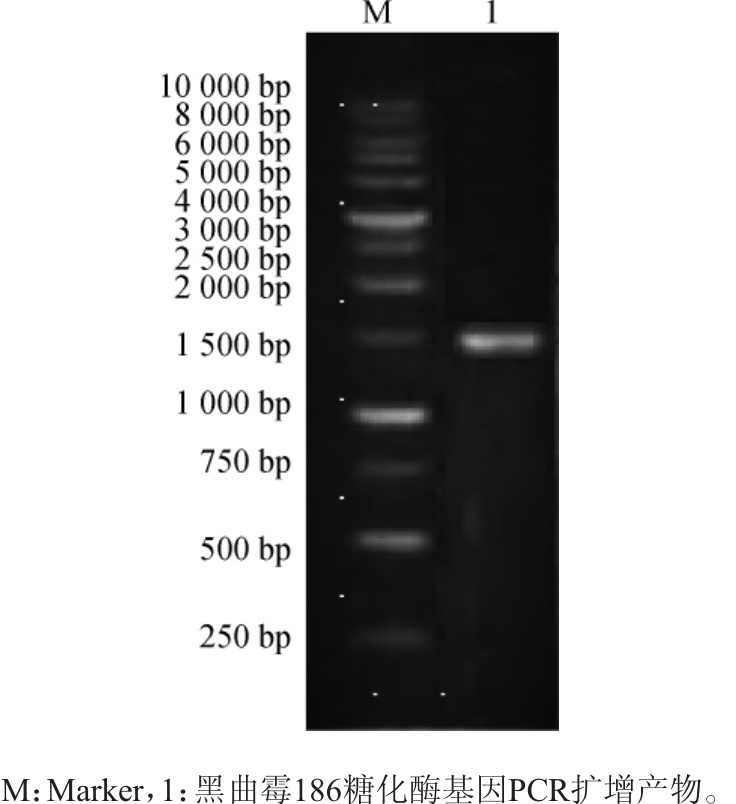
图3 黑曲霉186糖化酶基因PCR扩增产物电泳图
Fig.3 Electrophoresis of PCR amplification product of saccharifying enzyme gene ofAspergillus niger186

图4 黑曲霉186糖化酶基因推导出的氨基酸序列
Fig.4 Amino acids sequences derived from saccharifying enzyme gene ofAspergillus niger186
2.3 高产糖化酶霉菌的产酶条件优化
2.3.1 产糖化酶发酵培养基的优化
碳源、氮源添加量及起始pH值对糖化酶活力的影响结果见图5。由图5可知,随着碳源中麸皮含量、氮源中硫酸铵含量以及初始pH值的增加,发酵液中糖化酶活力均呈现先上升后下降的趋势,在碳源中麸皮含量为4%、氮源中硫酸铵含量为1.0%和起始pH值为7.0时,菌株186的糖化酶活力最高。
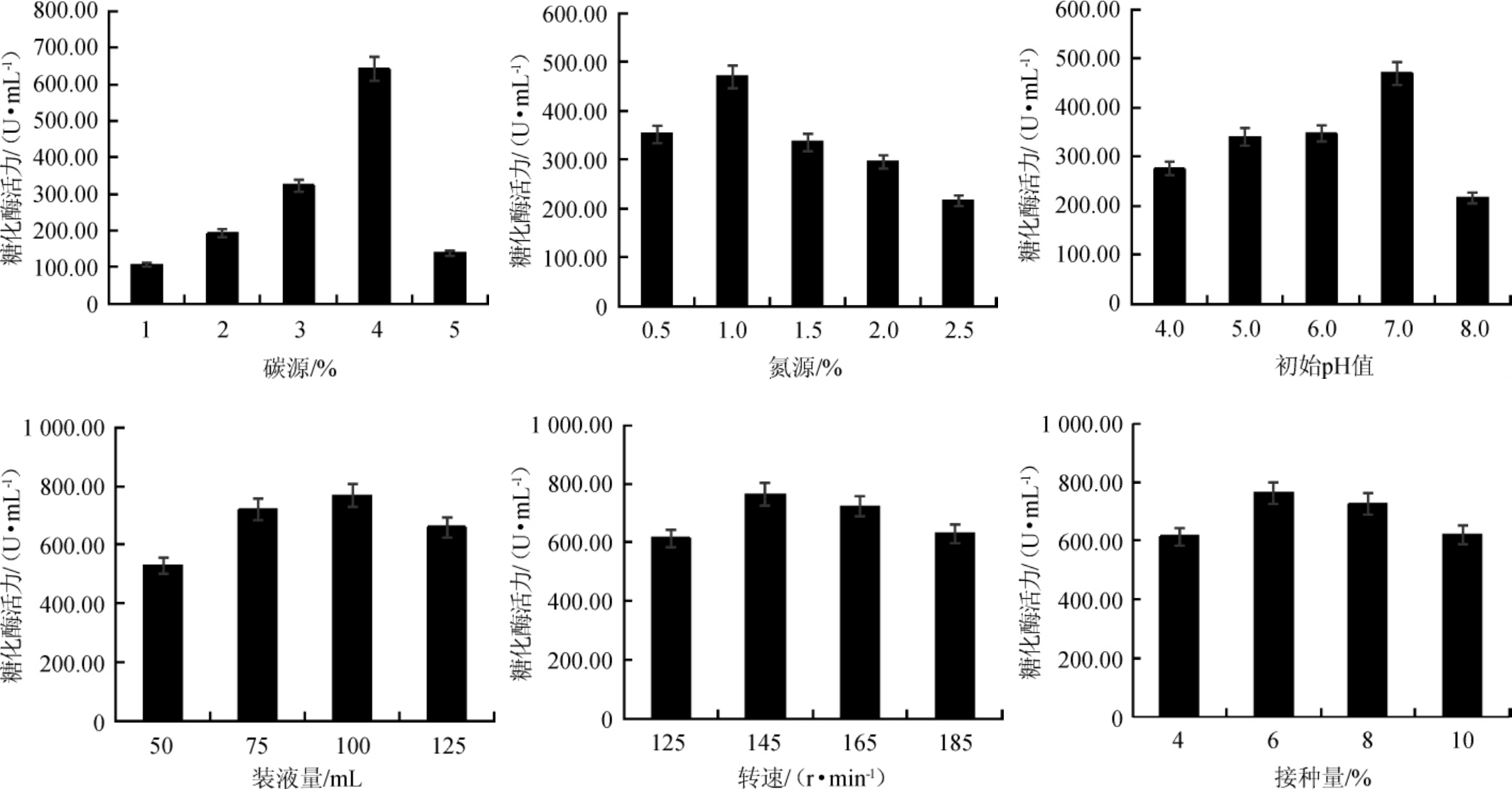
图5 培养基及发酵条件对黑曲霉186糖化酶活力的影响
Fig.5 Effect of medium and fermentation conditions on the saccharifying enzyme activity ofAspergillus niger186
通过单因素试验,选取每个因素中最优的3个水平,即碳源浓度(麸皮含量分别为3%、4%、5%)、氮源浓度(硫酸铵含量分别为0.5%、1.0%、1.5%)和起始pH值(6.0、7.0、8.0),采用L9(33)正交试验研究碳源浓度、氮源浓度、起始pH值3个因素对菌株产酶的影响,正交试验结果见表3。由表3可知,产糖化酶的最优培养基条件组合为A2B1C2,即麸皮4%,硫酸铵0.5%,初始pH值为7.0。在此优化培养基条件下,糖化酶活力为898.45 U/mL。
表3 培养基优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for medium optimization
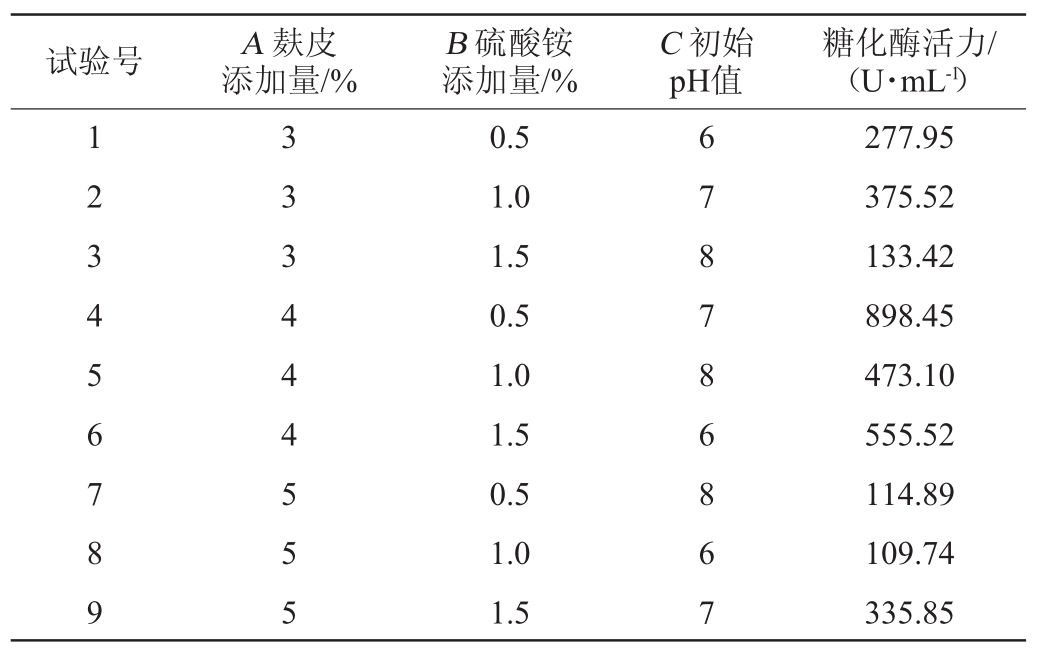
试验号 A麸皮添加量/%B硫酸铵添加量/%C初始pH值糖化酶活力/(U·mL-1)1 2 3 4 5 6 7 8 9 3 3 3 4 4 4 5 5 5 0.5 1.0 1.5 0.5 1.0 1.5 0.5 1.0 1.5 6 7 8 7 8 6 8 6 7 277.95 375.52 133.42 898.45 473.10 555.52 114.89 109.74 335.85
续表
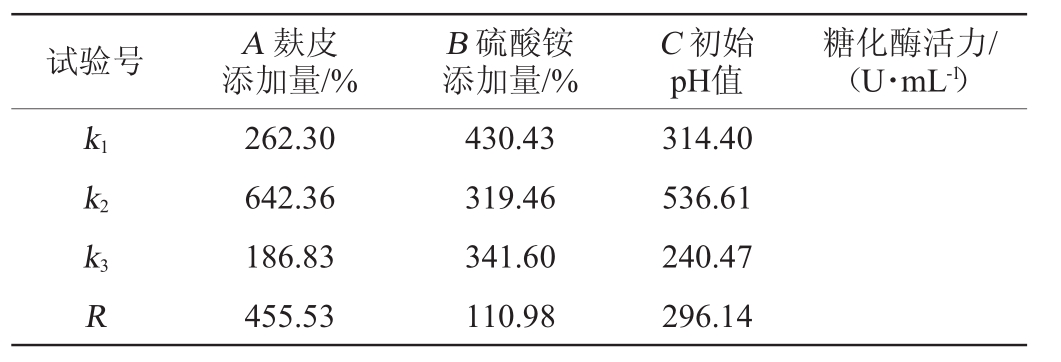
试验号 A麸皮添加量/%B硫酸铵添加量/%C初始pH值糖化酶活力/(U·mL-1)k1 k2 k3 R 262.30 642.36 186.83 455.53 430.43 319.46 341.60 110.98 314.40 536.61 240.47 296.14
2.3.2 产糖化酶发酵条件的优化
装液量、接种量及转速对发酵液中的糖化酶活力影响结果见图5。由图5可知,随着装液量、接种量及转速的增加,发酵液中糖化酶活力均呈现先上升后下降的趋势,在装液量为100 mL/250 mL、转速为145 r/min、接种量为6%的条件下,菌株186的糖化酶活力最高。
通过单因素试验,选取每个因素中最优的3个水平,即装液量(75 mL/250 mL、100 mL/250 mL、125 mL/250 mL)、转速(125 r/min、145 r/min、165 r/min)和接种量(4%、6%、8%),采用L9(33)正交试验研究装液量、接种量及转速3个因素对菌株产酶的影响,正交试验结果见表4。由表4可知,最佳发酵条件组合为A2B2C3,即装液量100 mL/250 mL,转速145 r/min,接种量8%。在此最佳发酵条件下,糖化酶活力为890.56 U/mL。
表4 发酵条件优化正交试验结果与分析
Table 4 Results and analysis of orthogonal experiments for fermentation conditions optimization

试验号 A装液量/(mL·250 mL-1)B转速/(r·min-1)C接种量/%糖化酶活力/(U·mL-1)1 2 3 4 5 6 7 8 9 k1 k2 k3 R 75 75 75 100 100 100 125 125 125 312.40 652.46 350.56 340.07 125 145 165 125 145 165 125 145 165 333.98 502.64 478.80 144.82 4 6 8 6 8 4 8 4 6 198.25 258.37 480.57 437.86 890.56 628.97 365.83 358.98 326.86 395.40 341.03 578.99 237.96
采用上述优化的发酵培养基及工艺,于30℃摇床培养7 d后黑曲霉186的糖化酶活力可达892.98 U/mL,是优化前的1.77倍。
3 结论
本研究以分离自山西老陈醋大曲中的霉菌为研究对象,筛选出1株高产糖化酶的菌株,并且测定结果显示,其产蛋白酶和纤维素酶的能力也较强,为一株集多种酶活于一身的高产优良菌株,对其糖化酶基因进行PCR扩增、序列比对,该糖化酶基因组DNA序列编码区长1 449 bp,与黑曲霉TCCC41661糖化酶基因(登录号:KM488271.1)编码区序列一致,共编码482个氨基酸,预测出该酶的分子质量约为51.75 kDa,等电点为3.99。通过单因素试验和正交试验,优化液态培养基及发酵条件,得出最优的培养基及发酵条件为:麸皮4%,硫酸铵0.5%,初始pH值为7.0,接种量8%,装液量100 mL/250 mL,转速145 r/min,在此优化条件下培养7 d后,黑曲霉186糖化酶活力可达892.98 U/mL,是优化前的1.77倍。
[1]NIE Z,ZHENG Y,DU H,et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiol,2015,47:62-68.
[2]LI S,LI P,LIU X,et al.Bacterial dynamics and metabolite changes in solid-state acetic acid fermentation of Shanxi aged vinegar[J].Appl Microbiol Biot,2016,100(10):4395-4411.
[3]LI P,FENG F,LUO L,et al.Microbiota dynamics associated with environmental conditions and potential roles of cellulolytic communities in traditional Chinese cereal starter solid-state fermentation[J].Appl Environ Microbiol,2015,81(15):5144-5156.
[4]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2012,117(1):82-90.
[5]张琳,张也,王如福,等.大曲中高产糖化酶菌株的筛选及环境耐受性分析[J].山西农业大学学报(自然科学版),2016,36(10):740-744.
[6]刘茗铭,周阳子,袁乐梅,等.酒曲中高产糖化酶霉菌的筛选及其固态发酵产酶条件优化[J].食品与发酵工业,2018,44(10):118-123.
[7]唐国敏,徐雁漪,龚辉,等.黑曲霉糖化酶高产株糖化酶cDNA的合成、克隆和序列分析[J].生物工程学报,1993,9(2):117-121.
[8]BOEL E,HJORT I,SVENSSON B,et al.Glucoamylases G1 and G2 from Aspergillus nigerare synthesized from two different but closely related mRNAs[J].Embo J,1984,3(5):1097-1102.
[9]LI P,LIN W,LIU X,et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous ofBacillus,Pediococcus,WickerhamomycesandSaccharomycopsis[J].Food Microbiol,2017,61:83-92.
[10]LI P,LIANG H,LIN W T,et al.Microbiota dynamics associated with environmental conditions and potential roles of cellulolytic communities in traditional chinese cereal starter solid-state fermentation[J].Applied﹠Environmental Microbiology,2015,81(15):5144-56.
[11]LI P,AFLAKPUI F W K,YU H,et al.Characterization of activity and microbial diversity of typical types of Daqu for traditional Chinese vinegar[J].Ann Microbiol,2015,65(4):2019-2027.
[12]谢玉球,时晓,周二干,等.洋河大曲中糖化酶高产霉菌的筛选鉴定及固态发酵条件优化[J].酿酒科技,2016(4):39-42.
[13]郭红珍.山西老陈醋大曲红曲霉分离鉴定[J].中国食品添加剂,2006(3):99-103.
[14]ZHENG X W,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter(Fen-Daqu),revealed by culturedependent and culture-independent methods[J].Food Microbiol,2012,31(2):293-300.
[15]谭婷婷,王家林,桑戈,等.北方黄酒麦曲中真菌的筛选·鉴定及系统发育分析[J].安徽农业科学,2015,43(17):15-16,71.
[16]班世栋,王晓丹,陈孟强,等.酱香型大曲中具产酶功能霉菌的分离筛选[J].酿酒,2014,41(4):31-36.
[17]黄永光,徐岩.真菌Aspergillus hennebergii酸性蛋白酶小麦固态发酵性能研究[J].食品工业科技,2014,35(21):135-139.
[18]班世栋.酱香大曲中霉菌类群和酶系研究[D].贵阳:贵州大学,2015.
[19]王旭亮,王异静,王德良,等.白酒发酵高糖化性能霉菌的筛选及鉴定[J].酿酒科技,2012(9):22-28.
[20]黄永光.酱香型白酒酿造中Aspergillus hennebergii及其分泌酸性蛋白酶的研究[D].无锡:江南大学,2014.
[21]李兰晓.黑曲霉(Aspergillus nigersp.)固态发酵啤酒糟生产纤维素酶及其酶学性质与发酵产物的研究[D].泰安:山东农业大学,2008.