乳酸菌是可以将多种碳水化合物发酵转化为乳酸等的一类细菌的总称,其生长代谢对发酵食品的品质和风味有很大的贡献[1-2]。国内学者广泛开展了对优良乳酸菌株的筛选工作,从酸奶[3]、开菲尔粒[4]、泡菜[5]和山西老陈醋酒醪和醋醅[6]等传统发酵食品中筛选关于产酸[6]、产乙偶姻[7]、分解亚硝酸盐[8]、降胆固醇[9]、抗氧化[10]等益生特性的优良乳酸菌菌株。
近年来,国内外学者关于乳酸菌分型开展了一些研究工作[11],采用的方法主要有限制性片段长度多态性(restriction fragment length polymorphisms,RFLP)分析技术、脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)、扩增片段长度多态性(amplifiedfragmentlengthpolymorphism,AFLP)分析、基因组短重复序列聚合酶联式反应(repetitive-element polymerasechainreaction,rep-PCR)分析技术及随机扩增多态性脱氧核糖核酸(random amplified polymorphic deoxyribonucleic acid,RAPD)技术。RANDAZZOCL等[12]采用RFLP技术与传统生理生化鉴定相结合的方法分析了橄榄菜自然发酵过程中乳酸菌的多样性,探明了乳酸菌类群及其变化规律。PSONI L等[13]采用PFGE技术分析了分离自希腊山羊乳奶酪中的40株乳酸乳球菌的多样性,结果显示40株菌具有丰富的多态性。DIMITROV Z P等[14]采用AFLP、PFGE等分子分型技术对分离自健康人体的乳酸菌进行了鉴定和多态性分析。ADIGUZEL G C等[15]利用Rep-PCR技术分析了76株分离自土耳其发酵香肠的乳酸菌,并将它们鉴定到了种和菌株的水平。
RAPD技术是建立在PCR基础之上的一种可对基因组进行多态性分析的分子分型技术。作为PCR技术的延伸,RAPD技术有其自身的特点:退火温度较低;模板DNA用量少;简捷快速,安全性好;所用时间短,且能较好的对同种类的菌株进行分型,因为方法简单快速等优势,近年来很多学者采用此方法对乳酸菌菌株进行分型研究[16-17]。关于乳酸菌菌株分型的研究大都是型别与耐药性的关系,关于型别与益生特性之间的关系鲜有研究。本研究主要对分离自藏灵菇、山西老陈醋酒醪和醋醅传统发酵食品的乳酸菌进行16S rDNA鉴定、RAPD菌株基因分型及及产酸、产乙偶姻、降胆固醇、分解亚硝酸盐及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力进行研究,探讨型别与特性之间的关系,筛选优良菌株,以期为菌剂开发和传统发酵食品品质及风味改善提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
藏灵菇(Zanglinggu,Z):市售;山西老陈醋酒醪(Shanxi aged vinegar jiulao,SAV-JL)、山西老陈醋醋醅(Shanxi aged vinegar cupei,SAV-CP):山西老陈醋醋厂。
1.1.2 试剂
细菌基因组提取试剂盒、MIX和Maker D:生物工程(上海)有限责任公司;细菌通用引物、基因分型随机引物M13由华大基因(北京)股份有限公司合成;胆固醇、亚硝酸盐、DPPH、肌酸、盐酸萘乙二胺、邻苯二甲醛(均为分析纯):北京奥博星生物技术有限责任公司。
1.1.3 培养基
MRS培养基[4]、V-P培养基[7]、降胆固醇筛选培养[9]:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
T100PCR仪、Universial HoodⅡ凝胶成像系统:美国Bio-Rad公司;DYY-6C型琼脂糖凝胶电泳仪:北京六一仪器厂;722型可见分光光度计:上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 传统发酵食品中乳酸菌菌株的分离及鉴定
采用MRS培养基对市售藏灵菇样品(Z)和山西老陈醋酒醪(SAV-JL)、山西老陈醋醋醅(SAV-CP)中的乳酸菌进行分离,并进行菌落形态和细胞形态观察,用细菌基因组提取试剂盒提取菌株基因组,进行16S rDNA测序及菌种鉴定,并构建系统进化树。采用的引物[4]为:正向引物27F:5'-AGAGTITGATCCTGGCTCAG-3';反向引物1492R:5'-ACGGYTACCTI'GTI'ACGACTY-3'。
1.3.2 传统发酵食品中乳酸菌菌株基因分型[18]
以分离菌株的基因组DNA为模板,采用随机引物M13进行RAPD分型;反应体系如下:30 μL反应体系包括引物3 μL,模板3.5 μL,2×Mix 15 μL,ddH2O 10.5 μL;PCR反应扩增程序为:94℃预变性4 min;94℃变性30 s,58℃退火1 min,72℃延伸2 min,30个循环;72℃再延伸10 min,4℃,永远。反应结束后扩增产物经1.0%琼脂糖凝胶电泳分离后在凝胶成像系统上观察分析。
1.3.3 传统发酵食品中优良乳酸菌菌株的筛选
采用MRS液体培养基,按照2%接种量接种上述分离得到的乳酸菌,于37℃静置培养24 h后,将发酵液8 000 r/min离心10 min,取上清,用酸碱中和法[6]测定其总酸含量;用肌酸比色法[7]测定其乙偶姻含量;用邻苯二甲醛比色法[5]测定培养前后发酵上清胆固醇含量;用盐酸萘乙二胺光度法[8]测定培养液中亚硝酸钠含量;参考WANG L C等[10]实验方法测定发酵上清液DPPH自由基清除力。
2 结果与分析
2.1 传统发酵食品中乳酸菌菌株的鉴定
从藏灵菇、山西老陈醋酒醪和醋醅中共分离得到40株乳酸菌,藏灵菇来源24株,山西老陈醋酒醪来源5株,醋醅来源11株,经过形态学观察,典型乳酸菌的菌落形态和细胞形态描述见表1,典型乳酸菌的菌落形态和细胞形态见图1,16S rDNA测序后构建进化树见图2。
表1 传统发酵食品中乳酸菌菌株细胞及菌落形态特征
Table 1 Colony and cell morphology of lactic acid bacteria in traditional fermented food

菌种编号 细胞形态 菌落形态Z1,Z4,Z5,Z6,Z8,Z9,Z12,Z15,Z18,Z20,Z27,Z35,Z42,Z53,Z56,Z58,Z60,SAV-JL7,SAV-JL57,SAV-CP967 Z10,Z14,SAV-JL576,SAV-CP578,SAV-CP584,SAV-CP728,SAV-CP736,SAV-CP737 SAV-JL3,SAV-JL216,SAV-JL245,SAV-CP1888,SAV-CP2422,SAV-CP2426 Z29,Z36,Z62,Z71,Z81,SAV-CP2420小短杆菌落直径1 mm,圆形,微凸起,表面光滑,有光泽,边缘规则,乳白色,不透明小短杆菌落直径1 mm,圆形,隆起,表面光滑,有光泽,边缘规则,乳白色,不透明球状球状菌落直径0.5 mm,圆形,隆起,表面光滑,有光泽,边缘规则,乳白色,不透明菌落直径0.5 mm,圆形,微凸起,表面光滑,有光泽,边缘规则,半透明

图1 传统发酵食品中典型乳酸菌菌株细胞及菌落形态
Fig.1 Colony and cell morphology of typical lactic acid bacteria in traditional fermented food
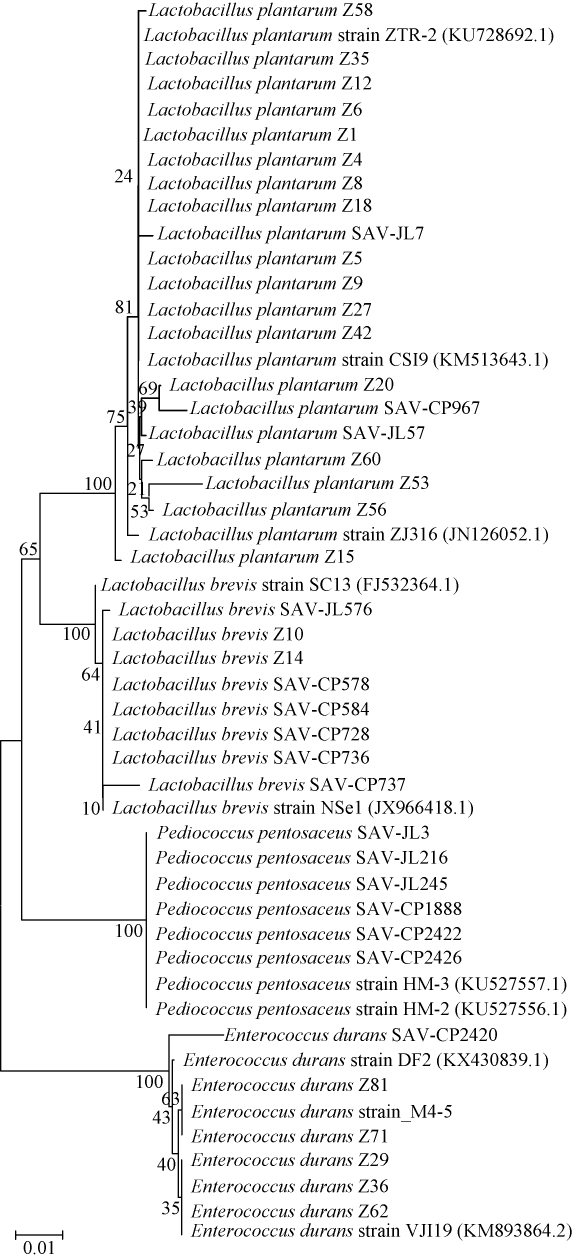
图2 传统发酵食品中典型乳酸菌的16S rDNA系统发育树
Fig.2 Phylogenetic tree of typical lactic acid bacteria in traditional fermented food based on 16S rDNA sequences
由图2可知,菌株Z1、Z4、Z5、Z6、Z8、Z9、Z12、Z15、Z18、Z20、Z27、Z35、Z42、Z53、Z56、Z58、Z60、SAV-JL7、SAV-JL57、SAV-CP967与植物乳杆菌同属于一个分支,通过BLAST比对,这些菌株序列与已知的多株植物乳杆菌16S rDNA的同源性最高可达99%,故鉴定为植物乳杆菌(Lactobacillus plantarum),其中藏灵菇来源17株,酒醪来源2株,醋醅来源1株;同样,鉴定菌株Z10、Z14、SAV-JL576、SAV-CP578、SAV-CP584、SAV-CP728、SAV-CP736、SAV-CP737为短乳杆菌(Lactobacillus brevis),其中2株分离自藏灵菇,1株分离自酒醪,5株分离自醋醅;鉴定菌株SAV-JL3、SAV-JL216、SAV-JL245、SAV-CP1888、SAV-CP2422、SAV-CP2426为戊糖片球菌(Pediococcus pentosaceus),均来自山西老陈醋的酒醪(3株)和醋醅(3株);鉴定菌株Z29、Z36、Z62、Z71、Z81、SAV-CP2420为耐久肠球菌(Enterococcus durans),5株分离自藏零菇,1株分离自醋醅。
2.2 传统发酵食品中乳酸菌菌株基因分型
采用随机引物M13对40株乳酸菌进行PCR扩增,结果见图3。
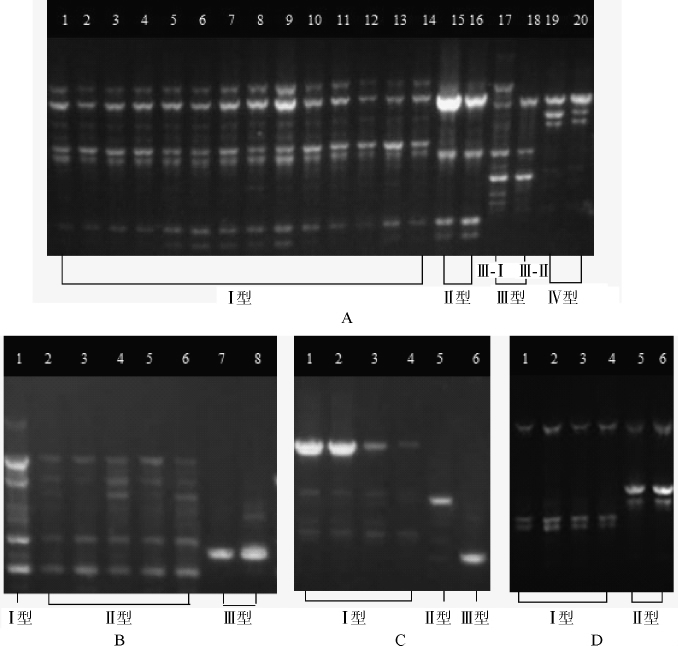
图3 传统发酵食品中乳酸菌的RAPD分型电泳图
Fig.3 RAPD genotyping electrophoresis of lactic acid bacteria in traditional fermented food
由图3A可知,20株植物乳杆菌被分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4个型别,Ⅲ型又分为Ⅲ-Ⅰ、Ⅲ-Ⅱ2个亚型,其中菌株Z1、Z4、Z5、Z6、Z8、Z9、Z12、Z15、Z18、Z20、Z27、Z35、Z42、Z53为Ⅰ型,菌株Z56、Z58为Ⅱ型,菌株Z60为Ⅲ-Ⅰ型,菌株SAV-JL7为Ⅲ-Ⅱ型,菌株SAV-JL57、SAV-CP967为Ⅳ型。由图3B可知,8株短乳杆菌呈现Ⅰ、Ⅱ、Ⅲ3个型,菌株Z10为Ⅰ型,菌株Z14、SAV-JL576、SAV-CP578、SAV-CP584、SAV-CP728为Ⅱ型,其余菌株SAV-CP736、SAV-CP737为Ⅲ型。由图3C可知,株戊糖片球菌呈现3个型别,菌株SAV-JL3、SAV-JL216、SAV-JL245、SAV-CP1888归属于Ⅰ型,菌株SAV-CP2422归属于Ⅱ型,菌株SAV-CP2426归属于Ⅲ型。由图3D可知,6株耐久肠球菌被分为Ⅰ、Ⅱ 2个型;菌株Z29、Z36、Z62、Z71为同一个克隆型,其余菌株Z81、SAV-CP2420为一个克隆型。
综上所述,来源于藏灵菇的24株乳酸菌,其优势克隆型为植物乳杆菌,来源于山西老陈醋酒醪的6株乳酸菌主要为戊糖片球菌,而来源于醋醅的10株乳酸菌主要为短乳杆菌,表明分离的乳酸菌具有菌株基因多样性,为菌株的益生特性等筛选提供了遗传基础。
2.3 传统发酵食品中乳酸菌菌株产酸特性
由图4可知,40株乳酸菌发酵液总酸含量在2.18~24.30g/L,其中植物乳杆菌SAV-JL7产酸含量最高(24.30g/L),其含量高于焦玉双[6]从山西老陈醋大曲中分离得到的戊糖片球菌L20(16.4 g/L),不同来源的乳杆菌菌株产酸的能力显著不同。另外,植物乳杆菌中呈现Ⅲ型菌株的总酸含量(19.45~21.98 g/L)显著高于Ⅱ型(10.23~13.32 g/L);同样,耐久肠球菌中Ⅱ型菌株总酸(8.26~9.04 g/L)含量普遍高于Ⅰ型(2.40~5.99 g/L),表明同种同型别乳酸菌产酸的能力具有相似性,同种不同型别乳酸菌产酸的能力具有差异性。
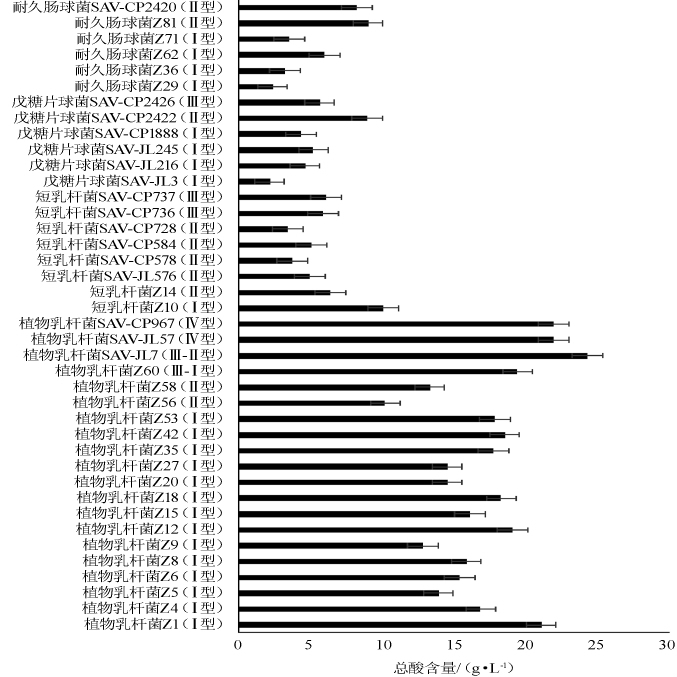
图4 传统发酵食品中乳酸菌的产酸量
Fig.4 Total acids production of lactic acid bacteria in traditional fermented food
2.4 传统发酵食品中乳酸菌菌株产乙偶姻特性
由图5可知,40株乳酸菌发酵液乙偶姻含量在0.14~0.54mg/mL,其中植物乳杆菌SAV-JL7(0.54mg/mL)、植物乳杆菌SAV-JL57(0.53mg/mL)和耐久肠球菌Z81(0.45mg/mL)乙偶姻含量最高。另外,植物乳杆菌Ⅲ型菌株乙偶姻含量(0.46~0.54 mg/mL)明显高于Ⅱ型(0.14~0.18 mg/mL),耐久肠球菌Ⅱ型菌株乙偶姻含量(0.43~0.45 mg/mL)高于Ⅰ型(0.16~0.24mg/mL),表明乳酸菌产乙偶姻的能力在同种同型别菌株中存在一致性,同种不同型别菌株存在差别。

图5 传统发酵食品中乳酸菌的乙偶姻产量
Fig.5 Acetoin production of lactic acid bacteria in traditional fermented food
2.5 传统发酵食品中乳酸菌菌株降胆固醇特性[19]
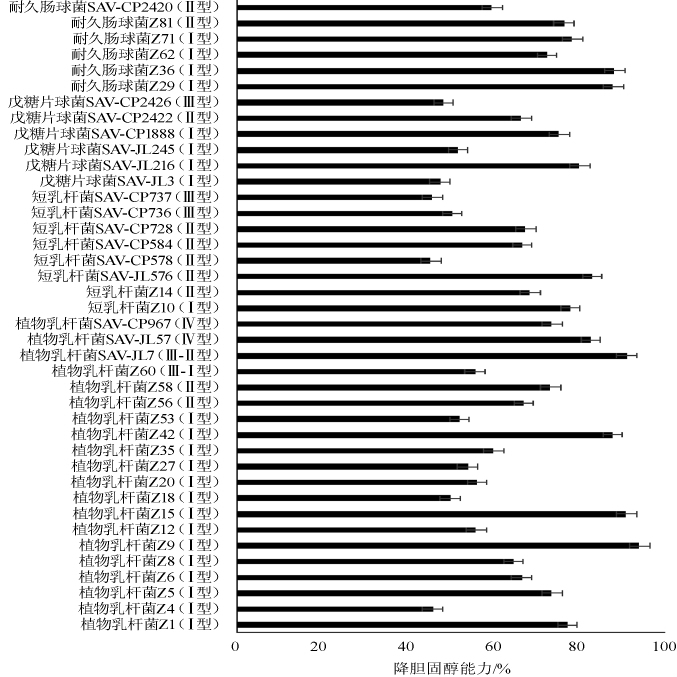
图6 传统发酵食品中乳酸菌的降胆固醇能力
Fig.6 Cholesterol reduction ability of lactic acid bacteria in traditional fermented food
由图6可知,40株乳酸菌中降胆固醇能力较强的为植物乳杆菌Z9(94.09%)、植物乳杆菌SAV-JL7(91.15%),明显高于黄颖等[20]从藏灵菇发酵乳中降胆固醇效果明显的嗜酸乳杆菌(50.36%)和周海柱[21]从传统泡菜里分离得到的植物乳杆菌PL5(51.67%)。另外,植物乳杆菌呈现的Ⅰ、Ⅱ、Ⅲ、Ⅳ4个型别菌株降胆固醇能力在45.77%~94.09%,短乳杆菌呈现的Ⅰ、Ⅱ、Ⅲ3个型别菌株降胆固醇能力在45.36%~83.10%,戊糖片球菌呈现的Ⅰ、Ⅱ、Ⅲ3个型别菌株降胆固醇能力在47.50%~80.15%,耐久肠球菌呈现的Ⅰ、Ⅱ2个型别菌株降胆固醇能力在59.67%~88.34%,表明菌株降胆固醇能力同型别无明显关系。
2.6 传统发酵食品中乳酸菌菌株分解亚硝酸盐特性[22]
由图7可知,40株乳酸菌培养24h后,分解亚硝酸盐能力集中在35.78%~74.12%,其中植物乳杆菌SAV-JL7(74.15%)和耐久肠球菌Z71(73.99%)分解亚硝酸盐能力最强,略低于荣凤君[23]从传统发酵食品中分离得到的植物乳杆菌L12(90%)和程方方等[24]从新疆传统酸马乳中筛选得到的肠膜明串珠菌(88.91%),不同来源的乳酸菌菌株分解亚硝酸盐的能力显著不同,这与菌株的生境直接相关。另外,植物乳杆菌菌株分解亚硝酸盐能力在35.78%~74.12%,短乳杆菌菌株分解亚硝酸盐能力在43.23﹠~70.13%,戊糖片球菌菌株分解亚硝酸盐能力在38.69%~68.42%,耐久肠球菌菌株分解亚硝酸盐能力在43.89%~73.99%,菌株分解亚硝酸盐与其型别无明显关联。
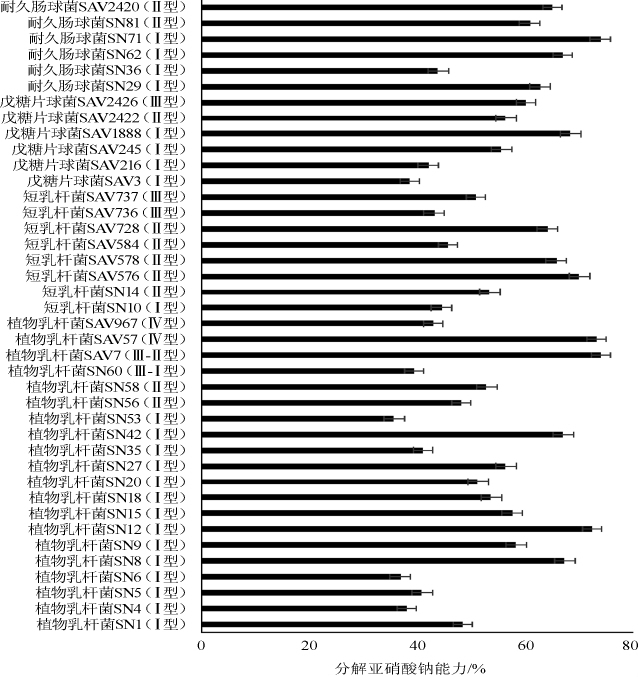
图7 传统发酵食品中乳酸菌的分解亚硝酸盐能力
Fig.7 Nitrite degradation rate of lactic acid bacteria in traditional fermented food
2.7 传统发酵食品中乳酸菌菌株DPPH自由基清除能力特性
由图8可知,40株乳酸菌DPPH自由基清除能力40.95%~92.29%,其中植物乳杆菌SAV-JL7(92.29%)、植物乳杆菌Z42DPPH自由基清除能力最强(92.08%),结果高于翰墨等[25]从传统酸奶中分离得到一株鼠李糖乳杆菌(54.26%)。另外,植物乳杆菌中呈现Ⅲ型菌株DPPH自由基清除能力(61.82%~92.29%)显著高于Ⅱ型(45.98%~57.33%);相似地,耐久肠球菌中Ⅱ型菌株DPPH自由基清除能力(69.22%~72.16%)含量普遍高于Ⅰ型(56.78%~69.54%),表明同种同型别乳酸菌DPPH自由基清除能力具有相似性,同种不同型别乳酸菌DPPH自由基清除能力具有差异性。
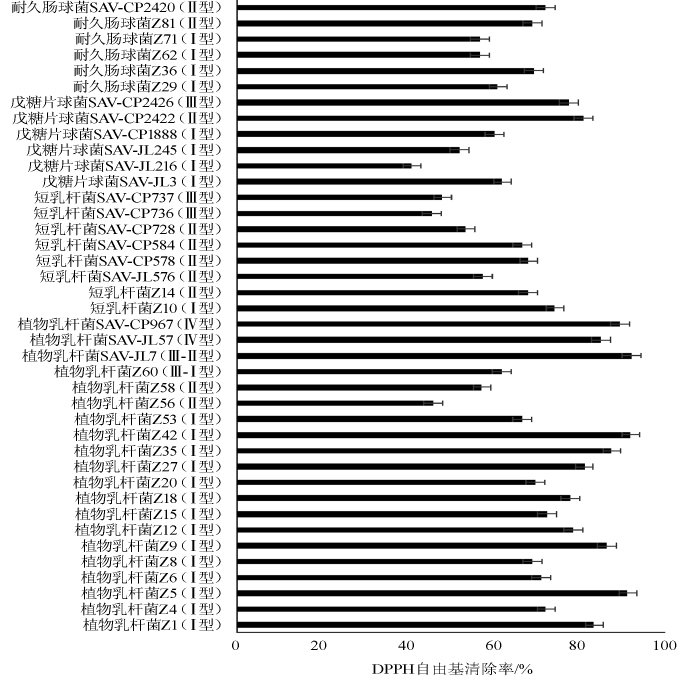
图8 传统发酵食品中乳酸菌的DPPH自由基清除能力
Fig.8 DPPH radical scavenging capacity of lactic acid bacteria in traditional fermented food
3 结论
从传统发酵食品中分离得到的40株乳酸菌,其中20株为植物乳杆菌(Lactobacillus plantarum),8株为短乳杆菌(Lactobacillus brevis),6株为戊糖片球菌(Pediococcus pentosaceus),6株为耐久肠球菌(Enterococcus durans),RAPD菌株基因分型结果发现传统发酵食品分离得到的乳酸菌种内具有基因多样性,同种同型别的乳酸菌产酸、产乙偶姻、降胆固醇、分解亚硝酸盐及DPPH自由基清除能力特性具有相似性;同种不同型别的乳酸菌的特性具有差异性,结合5种特性,最终筛选出1株性能均较好的植物乳杆菌SAV-JL7,属于植物乳杆菌Ⅲ-Ⅱ型,优良菌株可为生产菌剂的开发和发酵产品的提质增效提供参考。
[1]LIU S N,HAN Y,ZHOU Z J.Lactic acid bacteria in traditional fermented Chinese food[J].Food Res Int,2011,44(3):643-651.
[2]POGAI T,MANCINI A,SANTARELLI M,et al.Diversity and dynamic of lactic acid bacteria strains during aging of a long ripened hard cheese produced from raw milk and undefined natural starter[J].Food Microbiol,2013,36(2):207-215.
[3]ZARE E M,LASHANI E,DAVOODABADI A.Antimicrobial properties of lactic acid bacteria isolated from traditional yogurt and milk against Shigellastrains[J].Gms Hygiene Infect Control,2018,13(1):1-5.
[4]TAKUYA Y,TATSUJI S,TAKENORI N,et al.Lactic acid bacteria from kefir increase cytotoxicity of natural killer cells to tumor cells[J].Foods,2018,7(4):48-56.
[5]LIU A,LI X,PU B,et al.Use of psychrotolerant lactic acid bacteria isolated from Chinese traditional Paocai for the quality improvement of Paocai products[J].J Agr Food Chem,2017,65(12):2580-2587.
[6]焦玉双.山西老陈醋大曲中优良乳酸菌的分离筛选及其发酵应用研究[D].晋中:山西农业大学,2016.
[7]LU Z M,LIU N,WANG L J,et al.Elucidating and regulating the acetoin producing role of microbial functional group in multispecies acetic acid fermentation[J].Appl Environ Microbiol,2016,82(19):5860-5868.
[8]KUNG L,SMITH M L,ERICA B D S,et al.An evaluation of the effectiveness of a chemical additive based on sodium benzoate,potassium sorbate,and sodium nitrite on the fermentation and aerobic stability of corn silage[J].J Dairy Sci,2018,101(7):5949-5960.
[9]黄燕燕,郭均,黎恒希,等.降胆固醇乳酸菌的体外筛选及其降胆固醇机理探讨[J].食品科学,2018,39(6):88-94.
[10]WANGLC,PANTM,TSAITY.Lacticacidbacteria-fermentedproduct of green tea andHouttuynia cordataleaves exerts anti-adipogenic and anti-obesity effects[J].J Food Drug Anal,2018,26(3):973.
[11]WULLCHLEGER S,LACROIX C,BONFOH B,et al.Analysis oflactic acid bacteriacommunities and their seasonal;variations in a spontaneouslyfermented dairyproduct(Malian fene)by applying a cultivation/genotype-based binary model[J].Int Dairy J,2013,29(1):28-35.
[12]RANDAZZO C L,RESTUCCIA C,ROMANO A D,et al.Lactobacillus casei,dominant species in naturally fermented Sicilian green olives[J].Int J Food Microbiol,2004,90(1):9-14.
[13]PSONI L,KOTZAMANIDIS C,YIANGOU M,et al.Genotypic and phenotypic diversity ofLactococcus lactisisolates from Batzos,a Greek PDO raw goat milk cheese[J].Int J Food Microbiol,2007,114(2):211-220.
[14]DIMITROV Z P,MINKOVA S,MICHAYLOVA M.Comparative evaluation of three molecular typing methods in their applicability to differentiateLactobacillusstrains with human origin[J].World J Microbiol Biot,2008,24(8):1305-1312.
[15]ADIGUZEL G C,ATASEVER M.Phenotypic and genotypic characterization oflactic acid bacteria isolated from Turkish dryfermented sausage[J].Roman Biotechnol Lett,2009,14(1):4130-4138.
[16]周宁.中国不同地区市售酸奶中乳酸菌的药物敏感性分析[D].杨凌:西北农林科技大学,2012.
[17]李艳莉.酸奶及发酵剂中分离乳酸菌药物敏感性研究[D].广州:华南理工大学,2015.
[18]吴林寰.整合型元基因组序列分析平台构建及其在酿醋微生物群落功能研究中的应用[D].无锡:江南大学,2016.
[19]WANG S C,CHANG C K,CHAN S C,et al.Effects of lactic acid bacteria isolated from fermented mustard on lowering cholesterol[J].Asian Pac J Trop Biomed,2014,4(7):523-528.
[20]黄颖,隋玉杰,钟莉莉,等.藏灵菇发酵乳中降胆固醇乳酸菌的分离及鉴定[J].吉林大学学报,2010,36(6):1181-1185.
[21]周海柱,高云航,郭玮,等.高效降胆固醇植物乳杆菌的筛选及其益生潜能初探[J].中国农业大学学报,2018,23(2):36-42.
[22]FEI Y T,LIU D M,LUO L H,et al.Molecular characterization ofLactobacillus plantarumDMDL 9010,a strain with efficient nitrite degradation capacity[J].Plos One,2014,9(11):113792.
[23]荣凤君.四种自制发酵食品中益生乳杆菌的筛选及功能特性研究[D].长春:吉林农业大学,2017.
[24]程方方,武运,武亚婷,等.酸马乳源降解亚硝酸盐乳酸菌的分离及鉴定[J].中国酿造,2018,37(9):72-77.
[25]韩墨,王燕,杨志鹏,等.内蒙古传统酸奶乳酸菌的筛选及体外益生效果评价[J].食品研究与开发,2018(1):152-156.