作为一种呼吸跃变型水果,猕猴桃采摘后存在保藏困难、易腐败变质和营养成分易流失等问题[1],因此,对猕猴桃进行深加工显得尤为重要。近年来,以猕猴桃为原料开发了果酒[2]、果醋[3]和果脯[4]等系列产品,不仅充分利用了猕猴桃的营养价值,而且提高了猕猴桃的利用率,助推了猕猴桃全产业链的发展。目前制备猕猴桃果酒的工艺常包括清汁发酵、去皮发酵和带皮发酵3种形式[5]。猕猴桃果皮中各类香气含量较高[6],同时富含氨基酸、钾和钙等物质[7],且具有较强的抗氧化性[8],因而将其应用于猕猴桃果酒加工具有较强的可行性。有研究指出,带皮发酵可提高酒体的香气和抗氧化能力[9],同时亦可改变酒体外观并增强酒体结构[10]。陈红梅等[5]研究发现,带皮发酵工艺可一定程度提高野生猕猴桃酒的品质。
GB/T 15038—2006《葡萄酒、果酒通用分析方法》约束了从外观、滋味和香气等三个维度对果酒进行感官检查与评价的方法,然而感官鉴评法具有对评价人员要求高和评价指标体系研究不够深入等不足[11]。近年来色度仪[12-13]、电子舌[14-15]、气相色谱-质谱联用(gas chromatograph mass spectroscopy,GC-MS)仪[16-17]、电子鼻[18-19]和高效液相色谱(highperformance liquidchromatography,HPLC)仪[20-21]等检测技术在酒类品质评价方面有了广泛的应用,实现了食品色泽、滋味和气味指标的数字化评价,因而将上述检测技术引入猕猴桃果酒品质评价中具有积极的意义。采用GC-MS技术,陈红梅等[5]研究发现,带皮发酵猕猴桃果酒中酯类、萜烯类和酮类物质质量浓度相对较高。然而目前关于不同处理工艺猕猴桃果酒滋味和色泽品质评价的报道尚少。
本研究采用电子舌、电子鼻、HPLC仪和色度仪对不同处理工艺酿造猕猴桃果酒的品质进行了数字化评价,并结合多元统计学分析方法探讨了不同处理工艺对猕猴桃果酒品质的影响,以期为后续猕猴桃果酒的生产和品质评价提供参考。
1 材料与方法
1.1 材料与试剂
徐香猕猴桃:市售;苹果酸、奎宁酸、柠檬酸、乳酸(均为优级纯)、乙腈(色谱纯):国药集团化学试剂有限公司;磷酸二氢钾、磷酸(均为分析纯):西陇科学股份有限公司;果胶酶(5万U/g)、偏重亚硫酸钾(均为食品级):烟台帝伯仕自酿机有限公司;RW葡萄酒·果酒专用酵母:安琪酵母股份有限公司;阳离子溶液、阴离子溶液、预处理溶液、参比溶液和内部溶液:日本Insent公司。
1.2 仪器与设备
SA402B电子舌(配备2个参比电极和5个味觉传感器):日本Insent公司;LC-20ADXR高效液相色谱仪(配备有SPDM20A二极管阵列紫外-可见光检测器)、InertSustainSwift C18色谱柱(250 mm×4.6 mm,5 μm):日本岛津公司;PEN3电子鼻(配备10个金属氧化传感器):德国Airsense公司;Ultra Scan PRO色度仪:美国Hunter Lab公司。
1.3 实验方法
1.3.1 猕猴桃果酒的制作
参照参考文献[5]的方法制作猕猴桃果酒并进行适当修改。工艺流程及主要步骤如下所示:

清汁发酵组:将猕猴桃破碎后加入果胶酶进行酶解,10 000 r/min离心5 min,取上清液备用。
去皮发酵组:将猕猴桃样品去皮后,果肉破碎入罐添加果胶酶进行酶解。
带皮发酵组:将猕猴桃破碎后入罐添加果胶酶进行酶解。
不同处理工艺组均添加0.06%的果胶酶酶解12 h提高出汁率和0.10 mg/L偏重亚硫酸钾防止氧化;搅拌均匀后使用蔗糖调节糖度为22°Bx;按照0.2‰猕猴桃鲜果的比例接种酵母菌;前发酵为22℃发酵7 d;后发酵为18℃发酵20 d;10000r/min离心5min,取上清液,备用。每个处理工艺组做5个平行。
1.3.2 基于电子舌猕猴桃果酒滋味品质评价
样品处理:准确量取40mL猕猴桃果酒与80 mL超纯水混合均匀,静置15min后抽滤,滤液10000r/min离心10min,取上清液待用。
电子舌测试条件:参照郭壮等[22]的方法并进行适当的优化,每组样品平行测定4次。
数据处理:删除第1次测试实验值,取第2、3和4次实验值作为原始数据,并使用电子舌自带工作站对电子舌的响应值进行分析。
1.3.3 基于高效液相色谱猕猴桃果酒中有机酸测定
样品处理:准确吸取2 mL猕猴桃果酒和0.20 mL的0.10mol/L磷酸溶液于10mL容量瓶中,用流动相定容,混合均匀后过0.22 μm一次性针头式过滤器,滤液待用。
色谱条件:参照杨成聪等[23]的方法并进行适当的优化。流动相为0.01 mol/L磷酸二氢钾溶液,pH值为2.90,柱温为30℃,流速为1.00 mL/min,检测波长为215 nm,进样量为20 μL,平行测定3 次。
数据处理:使用高效液相色谱自带的工作站对测定的猕猴桃果酒中有机酸信号值进行分析,采用保留时间对猕猴桃果酒中4种有机酸进行定性分析,使用外标法对猕猴桃果酒4种有机酸进行定量分析。
1.3.4 基于电子鼻技术猕猴桃果酒风味品质评价
样品处理:准确吸取15 mL猕猴桃果酒样品于电子鼻样品瓶中,55℃保温10 min后室温平衡10 min,即可插入电子鼻探头进行顶空进样测试。
电子鼻测试条件:参照张淼等[24]对芝麻酱品质评价中的测试条件,并进行适当优化。
数据处理:金属氧化电极测定在45s后达到稳定,本研究选取49s、50s和51s时的平均值为测试数据,平行测定3次。
1.3.5 基于色度仪猕猴桃果酒色泽品质评价
将猕猴桃果酒样品倒入50 mm×10 mm的比色皿中,使用透射模式对猕猴桃果酒的各色度指标进行测定,读数以CIE1976色度空间值L*值(暗→亮:0→100)、a*值(绿-→红+)、b*值(蓝-→黄+)表示,平行测定3次[25]。
1.3.6 统计学分析
采用主成分分析(principalcomponentanalysis,PCA)法、聚类分析(cluster analysis,CA)和多变量方差分析(multivariateanalysisofvariance,MANOVA)法对不同处理工艺猕猴桃果酒的风味品质进行评价,采用冗余分析(redundancy analysis,RDA)和Kruskal-Wallis检验对不同处理工艺猕猴桃果酒品质差异的关键性指标进行甄别。采用Cannoco 4.5软件进行RDA,其他分析均采用MATLAB 2016b,采用Origin 2017绘图。
2 结果与分析
2.1 不同处理工艺对猕猴桃果酒滋味品质的影响
首先使用电子舌技术对不同处理工艺猕猴桃果酒的滋味品质进行评价,其结果如图1所示。

图1 不同酿造工艺猕猴桃果酒各滋味指标相对强度的雷达图
Fig.1 Radar chart of relative intensity of each taste indexes of kiwifruit wines fermented by different brewing processes
由图1可知,不同处理工艺猕猴桃果酒在咸味、苦味、酸味和鲜味滋味指标上的差异较大,其极差值分别为3.10、2.45、1.88和1.48,而在后味B(苦味的回味)、涩味、后味A(涩味的回味)和丰度(鲜味的回味)上的差异较小且极差值均<1。由此可见,不同处理工艺猕猴桃果酒滋味品质的差异主要体现在咸味、苦味、酸味和鲜味上,虽然在其他滋味指标上存在差异,但其差异不会对消费者对产品的喜好程度产生影响[26]。经Kruskal-Wallis检验发现,酸味、苦味、鲜味和咸味4个滋味指标在不同处理工艺猕猴桃果酒之间的差异显著(P<0.05),其中带皮发酵猕猴桃果酒的鲜味和咸味显著偏高(P<0.05),而酸味和苦味显著偏低(P<0.05)。本研究进一步使用高效液相色谱仪对猕猴桃果酒中4种有机酸的含量进行测定,结果如表1所示。
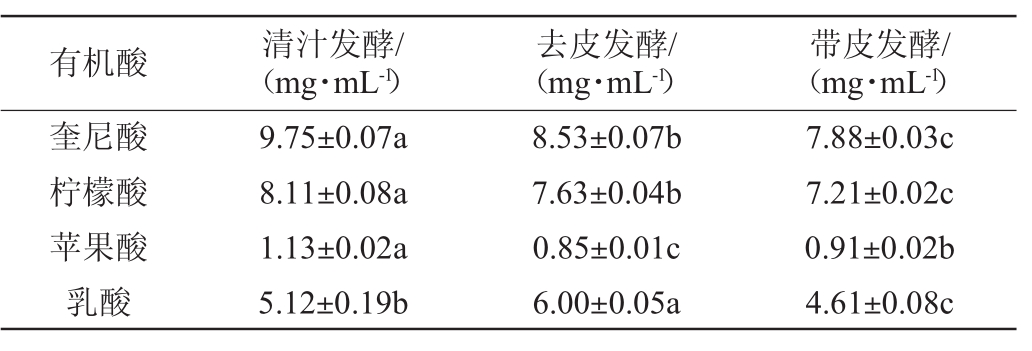
表1 猕猴桃果酒中4种有机酸的含量
Table 1 Contents of 4 kinds of organic acids in kiwifruit wine
注:同行字母不同,表示差异显著(P<0.05)。下同。
有机酸 清汁发酵/(mg·mL-1)去皮发酵/(mg·mL-1)带皮发酵/(mg·mL-1)奎尼酸柠檬酸苹果酸乳酸9.75±0.07a 8.11±0.08a 1.13±0.02a 5.12±0.19b 8.53±0.07b 7.63±0.04b 0.85±0.01c 6.00±0.05a 7.88±0.03c 7.21±0.02c 0.91±0.02b 4.61±0.08c
由表1可知,奎尼酸、柠檬酸、苹果酸和乳酸在不同处理工艺猕猴桃果酒中均有检出,通过Kruskal-Wallis检验发现,4种有机酸在不同处理工艺猕猴桃果酒中均差异显著(P<0.05),且带皮发酵猕猴桃果酒中4种有机酸含量显著偏低(P<0.05)。
2.2 不同处理工艺对猕猴桃果酒气味品质的影响
本研究进一步使用电子鼻技术对猕猴桃果酒的风味品质进行评价,果酒中典型挥发性风味物质的相对强度如表2所示。
表2 不同酿造工艺猕猴桃果酒各气味指标相对强度的差异性分析
Table 2 Difference analysis of relative intensity of each flavor indexes of kiwifruit wines fermented by different brewing processes
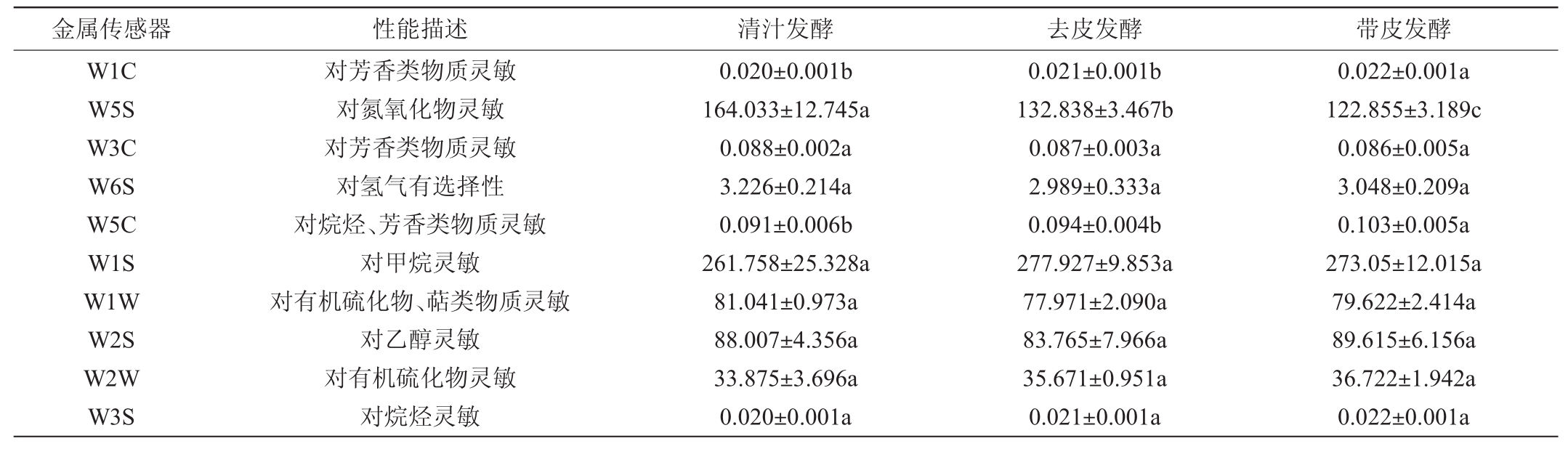
金属传感器 性能描述 清汁发酵 去皮发酵 带皮发酵W1C W5S W3C W6S W5C W1S W1W W2S W2W W3S对芳香类物质灵敏对氮氧化物灵敏对芳香类物质灵敏对氢气有选择性对烷烃、芳香类物质灵敏对甲烷灵敏对有机硫化物、萜类物质灵敏对乙醇灵敏对有机硫化物灵敏对烷烃灵敏0.020±0.001b 164.033±12.745a 0.088±0.002a 3.226±0.214a 0.091±0.006b 261.758±25.328a 81.041±0.973a 88.007±4.356a 33.875±3.696a 0.020±0.001a 0.021±0.001b 132.838±3.467b 0.087±0.003a 2.989±0.333a 0.094±0.004b 277.927±9.853a 77.971±2.090a 83.765±7.966a 35.671±0.951a 0.021±0.001a 0.022±0.001a 122.855±3.189c 0.086±0.005a 3.048±0.209a 0.103±0.005a 273.05±12.015a 79.622±2.414a 89.615±6.156a 36.722±1.942a 0.022±0.001a
由表2可知,传感器W1C和W5C对带皮发酵猕猴桃果酒的响应值显著偏高(P<0.05),而传感器W5S对其响应值显著偏低(P<0.05)。传感器W1C和W5C主要对食品中的芳香类物质灵敏,而传感器W5S主要对氮氧化物灵敏。值得一提的是,传感器W3C、W6S、W1S、W1W、W2S、W2W和W3S对不同处理工艺猕猴桃果酒的相应值差异不显著(P>0.05)。由此可见,带皮发酵猕猴果酒的风味品质较清汁发酵和去皮发酵较佳。陈红梅等[5]的研究结果与本研究相同,通过采用GC-MS技术对不同工艺处理野生猕猴桃酒风味品质进行解析发现,带皮发酵的猕猴桃果酒香气物质总量显著偏高(P<0.05),且酒中的酯类、萜烯类和酮类物质质量浓度亦相对较高[5]。
2.3 不同处理工艺对猕猴桃果酒色泽品质的影响
不同处理工艺猕猴桃果酒的色泽测定结果如表3所示。
由表3可知,带皮发酵的猕猴桃果酒其亮度(L*值)显著高于清汁发酵(P<0.05),而红绿度(a*值)显著高于去皮发酵(P<0.05)。值得一提的是,不同处理工艺的猕猴桃果酒在黄蓝度(b*值)上并无显著性差异(P>0.05)。
表3 不同处理工艺猕猴桃果酒色泽品质的差异性分析
Table 3 Difference analysis of each color indexes of kiwifruit wines fermented by different treatment processes
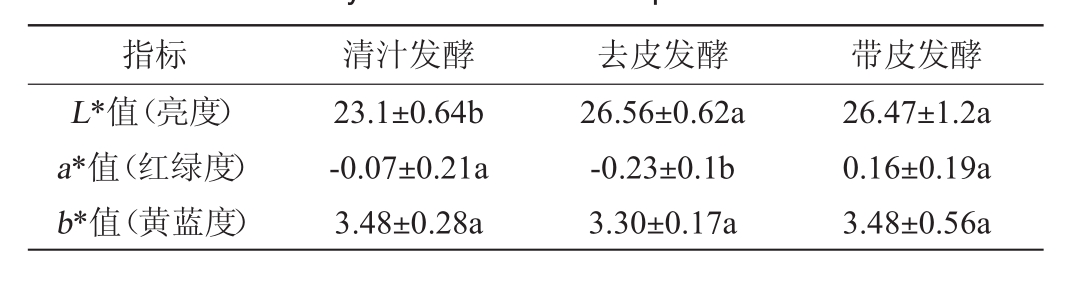
指标 清汁发酵 去皮发酵 带皮发酵L*值(亮度)a*值(红绿度)b*值(黄蓝度)23.1±0.64b-0.07±0.21a 3.48±0.28a 26.56±0.62a-0.23±0.1b 3.30±0.17a 26.47±1.2a 0.16±0.19a 3.48±0.56a
2.4 不同处理工艺猕猴桃果酒品质区分度的评价
以滋味和气味为评价指标,基于PCA不同处理工艺猕猴桃果酒品质的因子载荷图如图2所示。
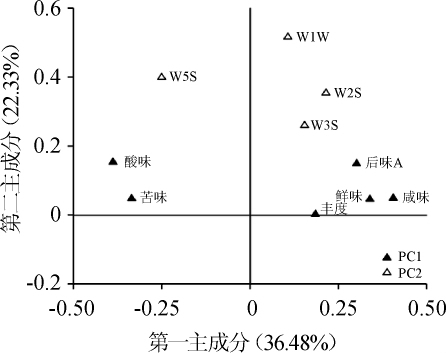
图2 基于PCA不同处理工艺猕猴桃果酒品质的因子载荷图
Fig.2 Factor loading plot of the quality of kiwifruit wines fermented by different treatment processes based on PCA
由图2可知,第一主成分(principal component,PC)由咸味、鲜味、后味A(涩味的回味)、丰度(鲜味的回味)、苦味和酸味构成,占全部权重的36.48%;第二主成分(PC2)由W1W(对有机硫化物敏感)、W5S(对氢氧化物灵敏)、W2S(对乙醇灵敏)和W3S(对烷烃类物质灵敏)4个指标构成,占全部权重的22.33%。由此可见,PC1主要由猕猴桃果酒的滋味指标构成,而PC2主要由猕猴桃果酒的气味指标构成。进一步分析发现,PC1中载荷量最高的正相关指标是W1W,其载荷量为0.52,即PC1的差异主要集中在有机硫化物上;PC2中载荷量最高的正相关指标是咸味,其载荷量为0.41,而载荷量最高的负相关指标为酸味,其载荷量为0.39,即PC2的差异主要集中在酸味和咸味上。基于PCA不同处理工艺猕猴桃果酒品质的因子得分图如图3所示。
由图3可知,不同处理工艺猕猴桃果酒样品在空间排布上呈现出明显的分离趋势,其中清汁发酵样品全部分布于第二象限,去皮发酵样品多数分布于第三象限,而带皮发酵样品则主要分布于第一和第四象限。由此可见,不同处理工艺猕猴桃果酒品质存在明显的差异。带皮发酵样品较其他处理工艺样品在空间上的排布偏右,结合因子载荷图可知,带皮发酵果酒的咸味、鲜味、后味A(涩味的回味)和丰度(鲜味的回味)较强,这与Kruskal-Wallis检验结果一致。本研究进一步采用马氏距离聚类对不同处理工艺猕猴桃果酒品质的差异性进行了分析,其结果如图4所示。
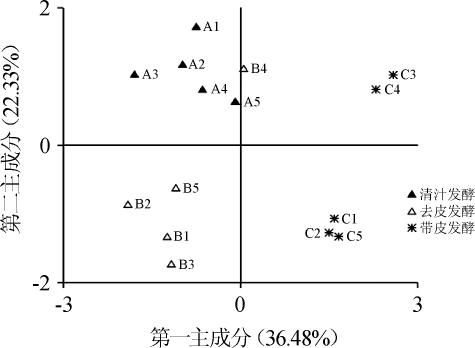
图3 基于PCA不同处理工艺猕猴桃果酒品质的因子得分图
Fig.3 Factor score plot of kiwifruit wines fermented by different treatment processes based on PCA
由图4可知,清汁发酵和去皮发酵两者之间存在显著差异(P<0.05),且两者与带皮发酵存在极显著差异(P<0.001)。由此可见,不同处理工艺猕猴桃果酒的品质存在显著差异。
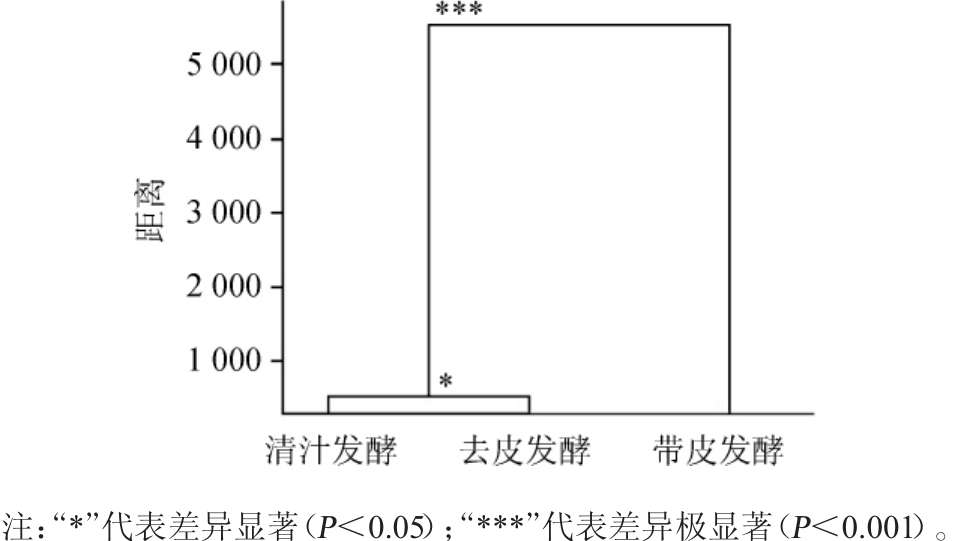
图4 不同处理工艺猕猴桃果酒品质的聚类分析
Fig.4 Cluster analysis of the quality of kiwifruit wines fermented by different treatment processes
2.5 导致不同处理工艺猕猴桃果酒品质存在差异关键性指标的甄别
本研究采用RDA对导致不同处理工艺猕猴桃果酒品质存在显著差异的关键性指标进行了甄别,其结果如图5所示。
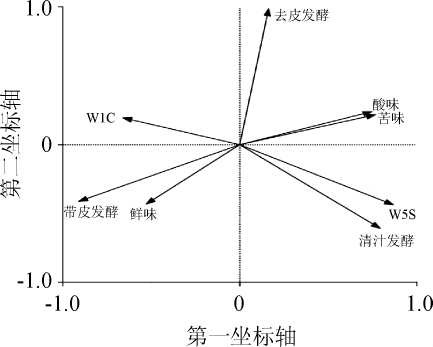
图5 不同处理工艺酿造猕猴桃果酒的RDA双序图
Fig.5 RDA biplot of kiwifruit wines fermented by different treatment processes
由图5可知,酸味、苦味、鲜味、W5S(对氮氧化物灵敏)和W1C(对芳香类物质灵敏)5个指标与RDA排序图约束轴上样本具有良好的赋值相关,因而代表了与不同处理工艺猕猴桃果酒品质差异显著相关的关键指标。由图5亦可知,酸味和苦味位于去皮发酵和清汁发酵猕猴桃果酒一侧,W5S位于清汁发酵一侧,而W1C和鲜味则位于带皮发酵一侧,由此可见,带皮发酵的猕猴桃果酒中鲜味和芳香类挥发性风味物质的强度要大于其余两组,而酸味、苦味和氮氧化物挥发性风味物质呈现出相反的趋势,这进一步证明带皮发酵猕猴桃果酒品质要优于清汁和去皮发酵的猕猴桃果酒。3结论
使用电子舌、HPLC仪、电子鼻和色度仪对清汁、去皮和带皮发酵猕猴桃果酒的品质进行了评价,结果发现带皮发酵猕猴桃果酒的鲜味和咸味显著偏高(P<0.05),而酸味和苦味显著偏低(P<0.05),同时带皮发酵猕猴桃果酒中芳香类物质较多而氮氧化物较少;带皮发酵猕猴桃果酒明亮度(L*值)显著高于清汁发酵(P<0.05),而红绿度(a*值)显著高于去皮发酵(P<0.05);带皮发酵猕猴桃果酒的品质与清汁和去皮发酵猕猴桃果酒的品质差异显著(P<0.001)。由此可见,带皮发酵的猕猴桃果酒品质更优。
[1]张美芳,何玲,张美丽,等.猕猴桃鲜果贮藏保鲜研究进展[J].食品科学,2014,35(11):343-347.
[2]LEE H Y,SEO W T,JEONG S H,et al.Physicochemical characteristics and volatile flavor compounds of produced mixture wine with kiwi and permission fruits using wild yeast,Saccharomyces cerevisiaeY28[J].Kor J Microbiol,2016,52(1):98-109.
[3]WOO S M,KIM O M,CHOI I W,et al.Condition of acetic acid fermentation and effect of oligosaccharide addition on kiwi vinegar[J].Kor J Food Pres,2007,14(1):100-104.
[4]孙海涛,邵信儒,姜瑞平,等.响应面试验优化超声渗糖制备野生软枣猕猴桃果脯工艺及其质构分析[J].食品科学,2015,36(20):49-55.
[5]陈红梅,王沙沙,尹何南,等.不同工艺处理对野生猕猴桃酒品质的影响[J].食品科学,2018,39(4):233-240.
[6]GARCIA C V,QUEK S Y,STEVENSON R J,et al.Characterisation of bound volatile compounds of a low flavour kiwifruit species:Actinidia eriantha[J].Food Chem,2012,134(2):655-661.
[7]KIM J G,BEPPU K,KATAOKA I.Varietal differences in phenolic content and astringencyin skin and flesh of hardy kiwifruit resources in Japan[J].Sci Hortic-Amsterdam,2009,120(4):551-554.
[8]SELLIS,CABAROGLUT,CANBASA,etal.Effectofskincontactonthe aroma composition of the musts ofVitis viniferaL.cv.Muscat of Bornova and Narince grown in Turkey[J].Food Chem,2003,81(3):341-347.
[9]杜昌陈,余元善,肖更生,等.添加柚果皮对沙田柚蒸馏酒风味品质的影响[J].广东农业科学,2015,42(17):90-95.
[10]AMOS R L.Sensory properties of fruit skins[J].Postharvest Biol Tec,2007,44(3):307-311.
[11]MARSANASCO M,MÁRQUEZ A L,WAGNER J R,et al.Bioactive compounds as functional food ingredients:characterization in model system and sensory evaluation in chocolate milk[J].J Food Eng,2015,166:55-63.
[12]NASSUR R C M R,PEREIRA G E,GLÓRIA M B A,et al.Rootstock influencing the quality and biogenic amines content on Syrah tropical wines[J].Com Sci,2017,8(2):202-208.
[13]BIMPILAS A,PANAGOPOULOU M,TSIMOGIANNIS D,et al.Anthocyanin copigmentation and color of wine:the effect of naturally obtainedhydroxycinnamicacidsascofactors[J].Food Chem,2016,197(4):39-46.
[14]CETÓ X,GONZÁLEZ-CALABUIG A,CAPDEVILA J,et al.Instrumental measurement of wine sensory descriptors using a voltammetric electronic tongue[J].Sensor Actuat B-Chem,2015,207:1053-1059.
[15]COSTA A M S,SOBRAL M M C,DELGADILLO I,et al.Astringency quantification in wine:comparison of the electronic tongue and FT-MIR spectroscopy[J].Sensor Actuat B-Chem,2015,207:1095-1103.
[16]ZIÓŁKOWSKAA,W SOWICZE,JELE HH.Differentiationofwines according to grape variety and geographical origin based on volatiles profiling using SPME-MS and SPME-GC/MS methods[J].Food Chem,2016,213:714-720.
[17]MAYR C M,CAPONE D L,PARDON K H,et al.Quantitative analysis by GC-MS/MS of 18 aroma compounds related to oxidative off-flavor in wines[J].J Agr Food Chem,2015,63(13):3394-3401.
[18]RODRIGUEZ-MENDEZ M L,APETREI C,GAY M,et al.Evaluation of oxygen exposure levels and polyphenolic content of red wines using anelectronicpanelformed byan electronic nose and an electronic tongue[J].Food Chem,2014,155(7):91-97.
[19]MANUELA,CABELLOSJ M,TERESA A,et al.Quantification of wine mixtures with an electronic nose and a human panel[J].Front Bioeng Biot,2018,6:14.
[20]MANETTA A C,DI GIUSEPPE L,TOFALO R,et al.Evaluation of biogenic amines in wine:determination by an improved HPLC-PDA method[J].Food Control,2016,62:351-356.
[21]LEE S,YOO M,SHIN D.The identification and quantification of biogenic amines in Korean turbid rice wine,Makgeolli by HPLC with mass spectrometrydetection[J].LWT-Food Sci Tech,2015,62(1):350-356.
[22]郭壮,汤尚文,王玉荣,等.基于电子舌技术的襄阳市售米酒滋味品质评价[J].食品工业科技,2015,36(15):289-293.
[23]杨成聪,沈馨,马雪伟,等.高效液相色谱法测定米酒中有机酸的含量[J].食品研究与开发,2018,39(10):116-123.
[24]张淼,贾洪锋,刘国群,等.电子鼻在芝麻酱品质识别中的应用[J].食品科学,2017,38(8):313-317.
[25]王玉荣,张俊英,潘婷,等.籼米米酒和糯米米酒品质的评价[J].食品与发酵工业,2017,43(1):186-191.
[26]KOBAYASHI Y,HABARA M,IKEZAZKI H,et al.Advanced taste sensors based on artificial lipids with global selectivity to basic taste qualities and high correlation to sensory scores[J].Sensors,2010,10(4):3411-3443.