黄酒以稻米、小米、黍米、玉米和小麦等为主要原料,经过蒸煮、加曲、糖化、发酵等工艺酿制而成,含有丰富的蛋白质、氨基酸、活性肽、酚类、低聚糖等营养成分,是营养价值较高的酿造酒[1-2]。作为我国传统酒,与啤酒、葡萄酒并称为世界三大古酒,享有“国酒”之美誉[3]。但与啤酒和葡萄酒的研究相比,黄酒的研究大多集中于理化检测和发酵工艺等方面,对黄酒的生理功效和活性物质研究还停留在起步阶段[4]。
叶新苗等[5]研究了太旨黄特型绍兴黄酒对高脂大鼠的降血脂功效,但其选用的是添加槐花、葛根等多种中药材的特制黄酒,而非传统的黄酒。倪赞等[6]通过铅中毒模型小鼠发现,黄酒可降低铅中毒小鼠血液和肝脏中的铅含量;沈赤等[7]通过免疫缺陷小鼠发现,黄酒多糖可以提高免疫缺陷小鼠的免疫功能;马良[8]通过观察黄酒对慢性应激大鼠肠道微生物的影响,认为黄酒中富含的低聚糖可以促进肠道内乳酸菌的生长,对肠道微生物具有一定的调控作用;孟立平等[9]通过低密度脂蛋白受体(low density lipoprotein receptor,LDLR)敲除小鼠发现,黄酒多酚和黄酒多肽成分具有抑制高脂饮食诱导的LDLR小鼠动脉粥样硬化的作用;王璟等[4]研究了黄酒对正常小鼠抗疲劳能力和D-半乳糖所致亚急性衰老小鼠免疫器官的影响,发现黄酒能显著提高小鼠体内肝糖原的含量,增加运动后小鼠血乳酸增长率,抑制衰老小鼠胸腺和脾脏质量的减少。近年来对肠道微生态的多项研究表明,肠道菌群能够被环境和饮食影响,并对宿主健康产生重要作用,特别是与代谢相关的慢性疾病关系密切[10]。高脂血症是引发老年人心脑血管疾病的一种常见慢性疾病,目前对传统黄酒的降血脂功能及对肠道微生态的影响研究甚少。因此,本实验通过高脂饲料喂养SD大鼠制作高脂模型,在灌胃不同剂量黄酒之后,通过测定高脂大鼠的体质量、肝脏质量、血脂以及肠道菌群,研究黄酒在高脂饲料模式下对实验动物血脂及肠道菌群的调节作用,以期为黄酒的营养价值及肠道益生作用提供理论依据。
1 材料与方法
1.1 材料与试剂
黄酒(绍兴黄酒,三年陈酿,酒精度为15%vol):浙江古越龙山绍兴酒股份有限公司生产。
无特定病原体(specific pathogen free,SPF)级SD大鼠(雄性,体质量(200±20)g):北京斯贝福(北京)生物技术有限公司[生产许可证:SCXK(京)2014-0006]。
高脂饲料(78.8%基础饲料、1%胆固醇、10%蛋黄粉、10%猪油和0.2%胆盐)、动物基础饲料:北京科奥协力饲料有限公司。
血脂四项测定试剂盒(总胆固醇(total cholesterol,TC)测定试剂盒,993-33491、997-33391;甘油三酯(triacylglyceride,TG)(去游离甘油)测定试剂盒,999-32991、999-33091;高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒,991-09001、997-09101;低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒,991-39891、997-39991):和光纯药工业株式会社。肠道细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:深圳华大基因科技有限公司。
1.2 仪器与设备
7600系列全自动生化分析仪:日本HITACHI公司;RV10V-C旋转蒸发仪:德国IKA公司;BY-320C低速离心机:北京白洋医疗器械有限公司;Illumina HiSe2500测序仪:美国Illumina公司;NANO DROP紫外分光光度计:美国Thermo公司;SQ510C立式压力蒸汽灭菌器:重庆雅马拓科技有限公司。
1.3 方法
1.3.1 黄酒的浓缩
黄酒经旋转蒸发仪进行低温真空浓缩,浓缩6倍。
1.3.2 动物实验
动物饲养于中国疾病预防控制中心南纬路动物实验室,许可证号SYXK(京)2009-0032,室温(20~26℃),相对湿度40%~70%,12 h光照,12 h黑暗。适应3 d后根据体质量随机分为2组,10只大鼠作为空白对照组给予基础饲料,剩余40只作为模型组给予高脂饲料。模型组给予高脂饲料两周后,空白对照组和模型组大鼠眼眶采血测定血清TC、TG、HDL-C和LDL-C。根据TC水平将模型组随机分为4组,即高脂模型组和3个剂量组,每组10只,分笼饲养。根据2016版《中国居民膳食指南》中建议的成年人每日饮用酒精量和黄酒的酒精含量,成人以60kg计,设定成人每日黄酒适宜摄入量为100mL。动物分组后,设黄酒低、中、高剂量组分别为8.3 mL/kg体质量、16.6 mL/kg体质量和50 mL/kg体质量(分别相当于人体推荐摄入量的5、10、30倍)[11],由于大鼠最大灌胃量宜为10 mL/kg体质量,为达到黄酒不同剂量组浓度的要求,将黄酒进行浓缩后,再用酒基调制成不同浓度(最终酒精度均为15%vol)。空白对照组和高脂模型组给予等体积蒸馏水,灌胃量均为10 mL/kg体质量,连续灌胃30 d。实验期间,空白对照组给予基础饲料,高脂模型组和3个剂量组给予高脂饲料,每周称质量一次,动物自由进食和饮水。实验结束时,眼眶采血,离心收集血清待测;取肝脏称重;取各组动物粪便-80℃冷冻保存待测。
本研究方案在通过中国疾病预防控制中心营养与健康所动物实验伦理委员会审查许可后实施。
1.3.3 肝指数测定[12]
解剖大鼠取出大鼠肝脏,用脱脂棉擦拭后,称质量。肝指数=肝质量/体质量。
1.3.4 血液生化指标
大鼠眼眶取血后于3000r/min离心15min,分离血清,采用全自动生化分析仪检测血清中TC、TG、HDL-C和LDL-C。
1.3.5 肠道菌群高通量测序分析
大鼠粪便样品的DNA提取采用华大基因研发的肠道细菌DNA提取试剂盒,使用通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和 806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rDNA的V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。
应用IlluminaHiSe2500平台对PCR产物进行测序,测序类型为PE250。下机数据滤除低质量的reads,获得cleandata。序列拼接使用软件FLASH(Fast Length Adjustment of Short reads,v1.2.11),将双末端测序得到的reads拼接成Tags,利用软件USEARCH(v7.0.1090)将优化好的Tags在97%的相似度下聚类为分类操作单元(operational taxonomic units,OTU)。得到OTU代表序列后,通过核糖体数据计划(ribosomal database project,RDP)classifer(v2.2)软件将OTU代表序列与数据库(Greengene V201305)已知序列比对进行物种注释,置信度阈值设置为0.6。随后进行物种复杂度分析以及组间物种α-多样性分析。
2 结果与分析
2.1 动物模型的建立
模型组给予高脂饲料两周后,空白对照组和模型组大鼠眼眶采血测定TC、TG、HDL-C和LDL-C,结果如表1所示。
由表1可知,模型组与空白对照组相比,上述四项指标差异均极显著(P<0.01),因此表明建模成功。
表1 建模后两组大鼠血脂指标的检测结果
Table 1 Determination results of blood lipid indexes of two groups of rats after modeling

注:与空白对照组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
LDL-C/(mmol·L-1)空白对照组模型组组别 TC/(mmol·L-1)TG/(mmol·L-1)HDL-C/(mmol·L-1)1.97±0.26 3.08±0.51**1.51±0.26 2.56±0.43**1.11±0.17 0.95±0.13**0.38±0.07 1.53±0.38**
2.2 黄酒对大鼠体质量增量和肝脏指数的影响
表2 各组大鼠体质量增量和肝脏指数检测结果
Table 2 Determination results of body mass increment and liver index of different groups of rats

注:与空白对照组比较,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01);与高脂模型组比较,“a”表示差异显著(P<0.05),“b”表示差异极显著(P<0.01)。下同。
组别 体质量增量/g 肝脏指数/%空白对照组高脂模型组低剂量组中剂量组高剂量组119.62±11.04 134.85±12.06**129.53±9.84a 123.42±11.28a 119.39±9.55b 3.88±0.52 4.60±0.36**4.17±0.44a 4.19±0.30a 4.20±0.26a
由表2可知,经灌胃30 d后,高脂模型组大鼠体质量增量和肝脏指数极显著(P<0.01)高于空白对照组,黄酒高、中、低剂量组大鼠体质量增量和肝脏指数与空白对照组相比差异不显著(P>0.05);与高脂模型组大鼠相比,黄酒中、低剂量组体质量增量显著(P<0.05)低于高脂模型组,高剂量组极显著(P<0.01)低于高脂模型组;黄酒高、中、低剂量组的肝脏指数均显著(P<0.05)低于高脂模型组。结果表明,黄酒能有效控制因高脂饲料引起的大鼠体质量增加,对高脂饲料引起的肝脏指数的升高具有一定的改善作用。
2.3 黄酒对大鼠血脂的影响
表3 各组大鼠血脂指标的检测结果
Table 3 Determination results of blood lipid indexes of different groups of rats
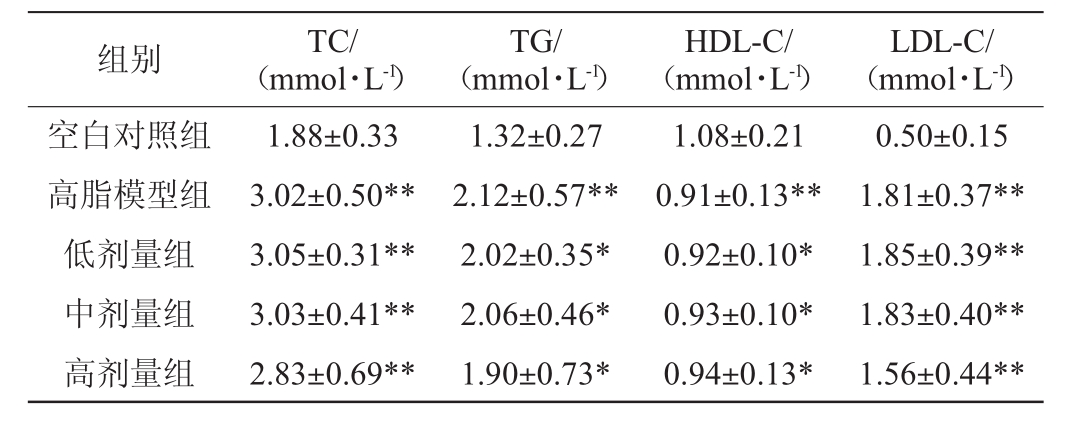
组别 TC/(mmol·L-1)TG/(mmol·L-1)HDL-C/(mmol·L-1)LDL-C/(mmol·L-1)空白对照组高脂模型组低剂量组中剂量组高剂量组1.88±0.33 3.02±0.50**3.05±0.31**3.03±0.41**2.83±0.69**1.32±0.27 2.12±0.57**2.02±0.35*2.06±0.46*1.90±0.73*1.08±0.21 0.91±0.13**0.92±0.10*0.93±0.10*0.94±0.13*0.50±0.15 1.81±0.37**1.85±0.39**1.83±0.40**1.56±0.44**
由表3可知,经灌胃30d后,高脂模型组大鼠的血清TC、TG、HDL-C、LDL-C含量与空白对照组相比差异极显著(P<0.01);黄酒高、中、低剂量组与空白对照组相比差异显著或极显著,与高脂模型组相比差异不显著(P>0.05)。虽然高剂量组大鼠血清TC、TG、LDL-C值较高脂模型组有所下降,但差异不显著(P>0.05),表明实验周期内黄酒对高脂大鼠的降血脂作用不明显。
2.4 黄酒对高脂大鼠肠道菌群的影响
2.4.1 不同试验组动物肠道菌群门水平的变化
各组样品共产生834个OTU,被注释到9个细菌门类,分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、柔膜菌门(Tenericutes)、放线菌门(Actinobacteria)、蓝藻细菌门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、迷踪菌门(Elusimicrobia)和脱铁杆菌门(Deferribacteres),各组菌群组成和比例如图1所示。
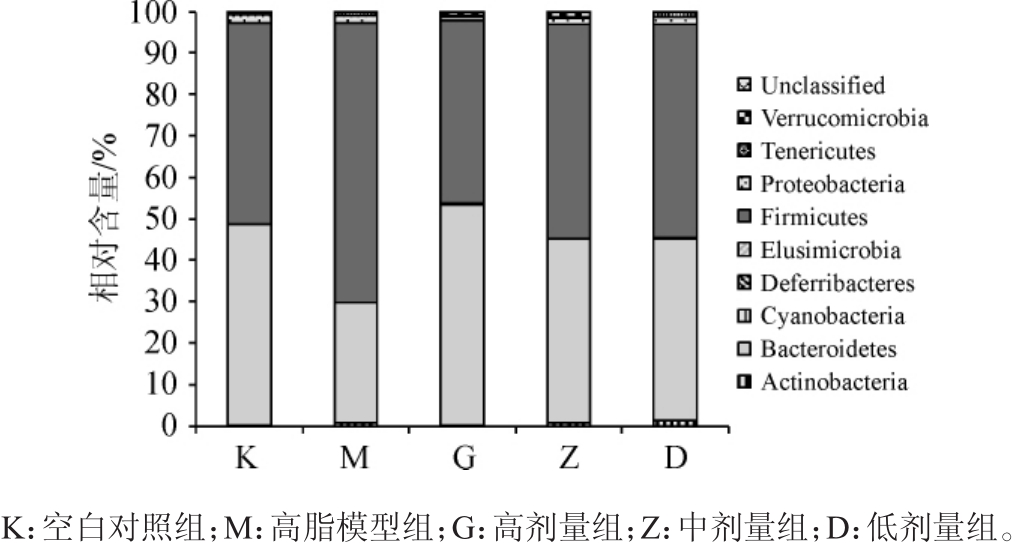
图1 各组大鼠肠道菌群在门水平上的注释结果
Fig.1 Annotation results of intestinal flora in different groups of rats based on phylum-level
厚壁菌门和拟杆菌门是肠道菌群中影响能量代谢平衡的两个主要群落,多项研究表明,厚壁菌门和拟杆菌门的含量和比例可作为判定肥胖潜在可能的依据[13-15]。XIE W等[16-17]研究发现,肥胖的动物或人比瘦的对照组具有更多的厚壁菌门和较少的拟杆菌门,与本研究结果一致,本实验中,与空白对照组相比,高脂模型组中的厚壁菌门上升了39%,拟杆菌门下降了40%,黄酒中、低剂量组中的厚壁菌门分别上升了7%和6%,拟杆菌门分别下降了8%和10%,而高剂量组中的厚壁菌门下降了9%,拟杆菌门上升了9%,这一结果表明,黄酒能有效抑制高脂饲料引起的肠道菌群中厚壁菌门的上升和拟杆菌门的下降,使二者的含量和比值更接近于空白对照组,结合2.2中的结果分析,推断黄酒有助于改善高脂饲料引起的厚壁菌门和拟杆菌门含量失衡,而二者含量失衡可能与高脂血症大鼠体质量和肝脏指数的变化相关。
2.4.2 不同试验组动物肠道菌群属水平的变化
能够进行物种注释的OTU会随着注释等级的降低而减少,本实验中能注释到门的有97%以上,能注释到属的不到52%。在属的水平上共比对到16个菌属,包括乳杆菌属(Lactobacillus)、普雷沃菌属(Prevotella)、颤螺旋菌属(Oscillospira)、肠球菌属(Enterococcus)、拟杆菌属(Bac-teroides)、嗜粘蛋白-艾克曼菌属(Akkermansia)、瘤胃球菌属(Ruminococcus)、粪球菌属(Coprococcus)、双歧杆菌属(Bifidobacterium)、考拉杆菌属(Phascolarctobacterium)、Turicibacter菌属、大肠埃希氏菌属(Escherichia)等。各组肠道菌群在属水平上的注释结果如图2所示。

图2 各组大鼠肠道菌群在属水平上的注释结果
Fig.2 Annotation results of intestinal flora in different groups of rats based on genus-level
由图2可知,普雷沃菌属在空白对照组,黄酒高、中、低剂量组中的丰度相对较高,其次是乳杆菌属。与空白对照组相比,高脂模型组和黄酒低剂量组中的嗜粘蛋白-艾克曼菌属组成比例分别下降了35%和28%,而黄酒高、中剂量组中的艾克曼菌属组成比例分别上升了390%和481%;高脂模型组中的拟杆菌属组成比例较空白对照组降低了63%,而黄酒高、中、低剂量组中的拟杆菌属组成比例较空白对照组分别上升了70%、33%和14%,黄酒改善并提高了高脂大鼠肠道内艾克曼菌属和拟杆菌属的组成比例。结合2.2中的结果可知,艾克曼菌属和拟杆菌属组成比例与高脂大鼠体质量、肝脏指数的上升呈负相关。DAO M C等[18-20]研究表明,Akkermansia muciniphila(艾克曼菌属中被注释到的主要菌种)是肠道中的一种黏蛋白降解菌,在肥胖及相关代谢疾病(如糖尿病)中具有关键作用,可以调节人体能量平衡及脂代谢水平,其组成比例与宿主的健康之间存在正相关。近年来,国内外学者对拟杆菌的益生作用进行了大量研究,发现它在帮助宿主分解多糖、加快肠粘膜血管形成以及提高宿主免疫力、维持肠道微生态平衡等方面起到了重要作用[21-22]。上述两种菌有望成为新一代益生菌研究的方向。
2.4.3 不同试验组动物肠道菌群多样性的变化
Alpha多样性是对单个样品中物种多样性的分析[23],其中包括Chao指数、Ace指数、Shannon指数以及Simpson指数。其中Chao指数和Ace指数反映样品中群落的丰富度,即简单指群落中物种的数量,而不考虑群落中每个物种的丰度情况,Shannon和Simpson指数反映群落的多样性,受样品群落中物种丰富度和物种均匀度的影响。相同物种丰富度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性[24]。由表4可知,空白对照组的Chao指数、Ace指数及Shannon指数要相对高于其他组,Simpson指数要相对低于其他组,但五组之间的各项指标差异均无显著性(P>0.05)。因此可推断,高脂饲料或黄酒对大鼠肠道菌群的α-多样性没有显著影响。
表4 肠道菌群α-多样性指数比较
Table 4 Comparison of alpha diversity index of intestinal flora
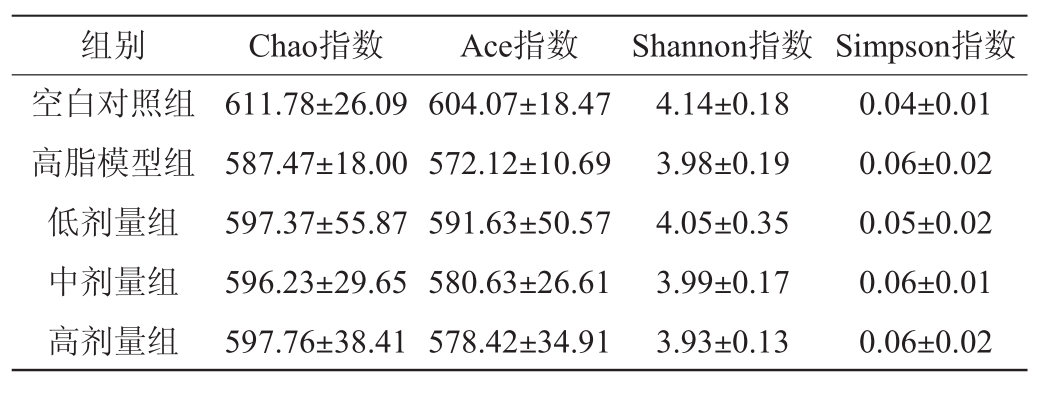
组别 Chao指数 Ace指数 Shannon指数 Simpson指数空白对照组高脂模型组低剂量组中剂量组高剂量组611.78±26.09 587.47±18.00 597.37±55.87 596.23±29.65 597.76±38.41 604.07±18.47 572.12±10.69 591.63±50.57 580.63±26.61 578.42±34.91 4.14±0.18 3.98±0.19 4.05±0.35 3.99±0.17 3.93±0.13 0.04±0.01 0.06±0.02 0.05±0.02 0.06±0.01 0.06±0.02
3 结论
黄酒能有效控制因高脂饲料引起的大鼠体质量增加以及肝脏指数的升高,在实验周期内对因高脂饲料引起的大鼠血清中TC、TG、LDL-C含量的上升和HDL-C含量的下降无明显的改善作用。因高脂饲料和黄酒引起的大鼠肠道菌群改变中,在门水平上,黄酒能有效抑制高脂饲料引起的大鼠肠道菌群中厚壁菌门与拟杆菌门比值的升高,使二者的含量和比值更接近于空白对照组,改善高脂饲料引起的厚壁菌门和拟杆菌门含量失衡。在属水平上,黄酒改善并提高了高脂大鼠肠道内艾克曼菌属和拟杆菌属的组成比例。
[1]刘月,祁国栋,张炳文.黄酒功能成分的研究进展[J].中国酿造,2015,34(11):27-30.
[2]谢广发,戴军,赵光鳌,等.科学认识黄酒的保健养生功能[J].中国酿造,2004,23(1):30-31.
[3]吴子阳,秦丹,李有明,等.饮料酒中阿魏酸的研究进展[J].中国酿造,2018,37(11):1-6.
[4]王璟,秦雪,仝令印,等.黄酒对小鼠抗疲劳能力和衰老小鼠免疫器官的影响[J].食品科学,2016,37(21):224-228.
[5]叶新苗,杨寅,叶肖琳,等.太旨黄特型绍兴黄酒降血脂的实验研究[J].中华中医药杂志,2012,27(6):1655-1658.
[6]倪赞,寿春波,史锋,等.黄酒对实验性铅中毒的拮抗作用研究[J].中国食品学报,2007,7(2):38-41.
[7]沈赤,毛健,陈永泉,等.黄酒多糖对免疫缺陷小鼠血清免疫相关因子的影响[J].食品科学,2015,36(5):158-162.
[8]马良.黄酒对慢性应激大鼠肠道微生物的影响[J].中国微生态学杂志,2013,25(5):553-555.
[9]孟立平,翟小亚,蒋承建,等.黄酒中抗低密度脂蛋白受体敲除小鼠动脉粥样硬化成分研究[J].营养学报,2015,37(6):559-564.
[10]ROOKS M G,GARRETT W S.Gut microbiota,metabolites and host immunity[J].Nat Rev Immunol,2016,16(6):341-352.
[11]周玮忻,伍梓汐,万群,等.黄酒中生物胺对小鼠胺类氧化酶和免疫功能的影响[J].中国酿造,2018,37(7):67-71.
[12]郑婧,张贵君,孙湛,等.木耳超微粉降血脂作用研究[J].西部中医药,2017,30(4):20-23.
[13]LEY R E,BACKHED F,TURNBAUGH P,et al.Obesity alters gut microbial ecology[J].P Natl Acad Sci USA,2005,102(31):11070-11075.
[14]TURNBAUGH P J,LEY R E,MAHOWALD M A,et al.The gut microbiome as a biomarker and therapeutic target for treating obesity or an obesity related disorder:US,EP2102350[P].2009-09-23.
[15]SERINO M,LUCHE E,GRES S,et al.Metabolic adaptation to a highfat diet is associated with a change in the gut microbiota[J].Gut,2012,61(4):543-553.
[16]XIE W,GU D,LI J,et al.Effects and action mechanisms of berberine and rhizoma coptidis on gut microbes and obesity in high-fat diet-fed C57BL/6J mice[J].Plos One,2011,6(9):e24520.
[17]LEY R E,TURNBAUGH P J,KLEIN S,et al.Human gut microbes associated with obesity[J].Nature,2006,444(21):1022-1023.
[18]DAO M C,EVERARD A,ARONWISNEWSKY J,et al.Akkermansia muciniphilaand improved metabolic health during a dietary intervention in obesity:relationship with gut microbiome richness and ecology[J].Gut,2016,65(3):426-436.
[19]REMELY M,HIPPE B,ZANNER J,et al.Gut microbiota of obese,type 2 diabetic individuals is enriched inFaecalibacterium prausnitzii,Akkermansia muciniphilaandPeptostreptococcus anacrobiusafter weight loss[J].Endocr Metab Imm Disord-Drug Targets,2016,16(2):99-106.
[20]DERRIEN M,BELZER C,VOS W M D.Akkermansia muciniphilaand its role in regulating host functions[J].Microb Pathogenesis,2017,106:171-181.
[21]冯淑贞,张和平.脆弱拟杆菌的研究进展[J].微生物学通报,2015,42(7):1366-1371.
[22]曾艳华,陈玛宁,张宁,等.大蒜多糖对人体肠道中拟杆菌生长的影响[J].现代食品科技,2010,26(5):445-447.
[23]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mother:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[24]高洁,孙静,黄建,等.开菲尔对高脂金黄地鼠肠道菌群的调节作用研究[J].中国酿造,2017,36(4):15-19.