胆固醇氧化酶是一种黄素蛋白的氧化还原酶,能催化胆固醇为胆甾-4-烯-3-酮和过氧化氢,是胆固醇代谢过程中的一个关键酶[1]。其广泛应用于血清、其他临床样品和食品中的胆固醇水平的测定[2-3]、杀虫剂、许多甾醇和非甾醇的生物转化等[4-6]。此外,该酶在胆固醇代谢、细菌发病机制以及大环内酯类抗真菌抗生素的生物合成等方面具有多种生物学作用[7-9]。
胆固醇氧化酶的生产方法有提取分离法、化学合成法、生物合成法等,其中生物合成法又有微生物发酵法与动植物细胞培养法。由于微生物具有多样性、繁殖快速、易发生遗传变异、胞外酶易分离纯化,且产生的胆固醇氧化酶比动植物胆固醇氧化酶具有更宽的pH、反应温度范围和底物特异性的优势[10],因此,微生物胆固醇氧化酶是工业胆固醇氧化酶的重要来源。现已发现的产胆固醇氧化酶的菌株有假单胞菌属(Pseudomonassp.)[11]、红球菌属(Rhodoccus sp.)[12]、诺卡氏菌属(Nocardiasp.)[13]、节杆菌属(Arthrobac teriumsp.)[14]、链霉菌属(Strepromycessp.)[15]等。我国关于胆固醇氧化酶的研究虽然起步晚,但是进展快且得到了很有应用价值的成果[16-17]。
本研究通过菌落染色法从海洋中分离筛选高产胆固醇氧化酶的细菌,采用分子生物学技术对其进行鉴定,并对其产酶发酵条件进行单因素试验优化,为胆固醇氧化酶提供新的来源。最后通过硫酸铵沉淀、凝胶过滤层析法对其所产的胆固醇氧化酶进行分离纯化。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
海泥样品:中国辽宁大连渤海海域附近(鹿岛港,N:39°11′,S:121°35′;滨海路沿线N:39°7′,S:121°41′;荞麦山桥,N:39°13′,S:121°42′)。
1.1.2 试剂
琼脂、蛋白胨、酵母浸粉、胰蛋白胨(均为生化试剂):吉林东博生物公司;硫酸镁、磷酸二氢钾、氯化钠、4-氨基-安替比林(均为分析纯):北京赛德科技有限公司;胆固醇(分析纯):阿拉丁试剂(上海)有限公司;辣根过氧化物酶(≥200 U/mg):上海B-BI生物科技有限公司。
1.1.3 培养基
液体富集培养基:胆固醇0.1%,NH4NO30.1%,KH2PO4 0.025%,MgSO40.025%,FeSO40.000 1%,pH 7.0。
筛选培养基:酵母粉0.5%,胆固醇0.1%,吐温-80 0.1%,琼脂2%,NH4NO30.1%,KH2PO40.025%,MgSO40.025%,FeSO40.000 1%,pH 7.0。
种子培养基:葡萄糖2%,牛肉膏0.5%,蛋白胨1%,NaCl 0.5%,pH 7.0。
发酵培养基:酵母粉0.5%,胆固醇0.1%,吐温-80 0.1%,NH4NO30.1%,KH2PO40.025%,MgSO40.025%,FeSO4 0.000 1%,pH 7.0。
以上培养基均在121℃高温灭菌20 min。
1.2 仪器与设备
GS-158低温台式离心机:美国BECKMAN公司;CH1015超级恒温水浴槽:上海恒平科学仪器有限公司;Inazge MlasterRVDS电泳成像系统:美国Parmacia Biotech公司;PB-10型精密pH计:上海精密仪器厂;DZF-6052真空干燥箱:上海风棱实验设备有限公司;HVE-50超高压灭菌锅:日本Hirayama公司。
1.3 试验方法
1.3.1 菌株的筛选
菌株初筛:将1g海泥样品置于含有100 mL液体富集培养基的250 mL三角烧瓶中,在25℃条件下培养48 h,并用无菌水进行梯度稀释(10-1~10-6)。将100 μL各梯度的稀释液涂布于筛选固体培养基平板,并在25℃条件下倒置培养48h。选取不同形态的菌落,采用点种法接种于两个新的平板上,其中一个平板进行菌落染色,即将一片滤纸浸入含有0.5%胆固醇、3 000 U/L辣根过氧化物酶、1.7%4-氨基-安替吡啶和6%苯酚的100 mmol/L磷酸钾缓冲液(pH 7.0)中,再将其平铺在平板上,将平板在室温下温育24 h。由于醌亚胺染料的形成,通过测试菌落周围形成的粉红色的大小及颜色的深浅来评估胆固醇氧化酶活性的高低[18-19]。
菌株复筛:对初筛菌株的胆固醇氧化酶活力进行测定,筛选高产胆固醇氧化酶的菌株。
1.3.2 胆固醇氧化酶活力的测定[20]
以OD500nm值(x)为横坐标,H2O2浓度(y)为纵坐标,绘制H2O2标准曲线。H2O2标准曲线回归方程为y=0.413x-0.1279,R2=0.999 4,表明线性关系良好,可用于胆固醇氧化酶活力的测定。
粗酶液的制备:将筛选得到的菌落接种到种子培养基中,装液量为100 mL/250 mL,在25℃、200 r/min条件下培养12 h。然后,将1 mL液体种子接种到发酵培养基中,装液量为100 mL/250 mL,在25℃、200 r/min条件下培养48 h。发酵液经8 000 r/min离心10 min,取上清液作为粗酶液。
胆固醇氧化酶活力定义:在37℃、pH 7.5条件下,1 min催化1μmol胆固醇氧化成胆甾-4-烯-3-酮所需的酶量为一个酶活力单位(U)。
1.3.3 菌种的鉴定
将胆固醇氧化酶活力最高的菌株送至宝生物工程(大连)有限公司进行16Sr DNA测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genebank中进行BLAST比对,选取同源性较高的模式菌株,利用MEGA5软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 发酵条件优化
发酵周期:按10%(V/V)的接种量将筛选菌株接种于发酵培养基中,装液量为100mL/250mL,在25℃、200r/min条件下进行发酵,每隔2 h取样测定胆固醇氧化酶活性。
发酵温度:将发酵培养基置于不同温度条件下(20℃、22℃、24℃、26℃、28℃、30℃、32℃、34℃、36℃)发酵24 h后,测定胆固醇氧化酶活性。采用单因素轮换法依次考察接种量(2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%)、初始pH值(5.0、5.4、5.8、6.2、6.6、7.0、7.4、7.8、8.2、8.6)、通气量(在250 mL的锥形瓶中加入60 mL、70 mL、80 mL、90 mL、100 mL、110 mL、120 mL、130 mL的发酵培养基,放在转速为100 r/min、150 r/min、200 r/min、250 r/min的摇床振荡培养)对菌株产胆固醇氧化酶的影响。
在此基础上,依次考察碳源种类(在培养基分别加入0.5%蔗糖、果糖、葡萄糖、乙酸钠、柠檬酸钠、柠檬酸、甘油)、氮源种类(以0.5%蛋白胨、酵母提取物、肉提取物、硫酸铵、乙酸铵、硝酸铵、硝酸钾、氯化铵代替原发酵培养基中的酵母粉及NH4NO3)、胆固醇含量(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%)对菌株产胆固醇氧化酶的影响。
1.3.5 胆固醇氧化酶的分离纯化
硫酸铵沉淀:向粗酶液中缓慢加入细磨的硫酸铵,使饱和度为0~90%。4℃保存过夜,离心(10 000 r/min、30 min)后保留沉淀。将沉淀物悬浮在Tris-HCl(0.1 mol/L,pH 7.0)缓冲溶液中,测定不同饱和度下胆固醇氧化酶的活性,并绘制硫酸铵盐析曲线[21]。
透析:在4℃条件下,使用透析袋对样品进行透析,期间不断更换透析液,直至不再有SO42-残留在透析液中。
超滤:将透析后的样品加入超滤管中,离心(8000r/min、20 min)后取上清进行Sephadex G-100凝胶过滤层析。
凝胶过滤层析[22]:将Sephadex G-100填料装入凝胶过滤柱中,加入2 mL超滤酶液,采用Tris-HCl(0.1 mol/L,pH 7.0)缓冲溶液进行洗脱,洗脱速度为0.3 mL/min,收集时间为4 min。查看洗脱峰并测定相应试管中样品的胆固醇氧化酶活力。
纯化的酶液经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)[23]进行检测。
2 结果与分析
2.1 高产胆固醇氧化酶菌株的筛选
使用胆固醇作为唯一碳源,通过菌落染色法从海泥中筛选到83株能产生胆固醇氧化酶的菌株。通过复筛筛选到一株高产胆固醇氧化酶的菌株,编号为XLH059,其胆固醇氧化酶活力为0.407 U/mL。
2.2 菌株的鉴定
采用MEGA 5.05软件中的NJ法构建菌株XLH059的系统发育树,结果如图1所示。由图1可知,菌株XLH059与蜡样芽胞杆菌(Bacillus cereus)聚于一支,同源性最高,为99%。因此,初步鉴定其为蜡样芽孢杆菌(Bacillus cereus)。
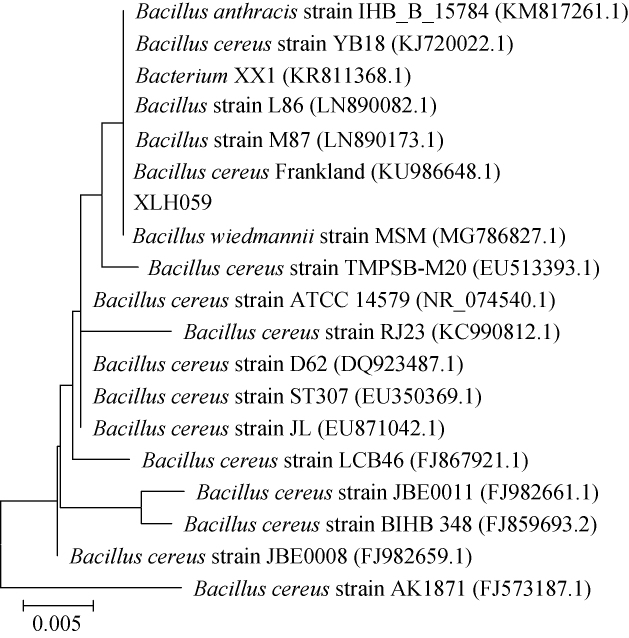
图1 基于16S rDNA序列菌株XLH059的系统发育树
Fig.1 Phylogenetic tree of strain XLH059 based on 16S rDNA sequence
2.3 菌株XLH059产胆固醇氧化酶发酵条件优化
2.3.1 发酵周期的确定
发酵时间对胆固醇氧化酶活性的影响如图2所示。由图2可知,随着发酵时间的推移,胆固醇氧化酶的活性呈先升高后下降的趋势,在发酵26 h时达到最大酶活,为0.412 U/mL;发酵26 h之后,随着发酵时间的延长,酶活性开始下降,分析原因可能是菌株进入衰退期,或营养不足。因此,24 h为最佳培养时间。
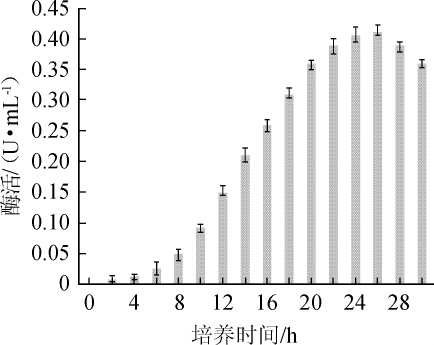
图2 发酵时间对胆固醇氧化酶活力的影响
Fig.2 Effect of fermentation time on cholesterol oxidase activity
2.3.2 发酵温度对胆固醇氧化酶活力的影响
发酵温度对胆固醇氧化酶活性的影响如图3所示。由图3可知,随着发酵温度的不断升高,胆固醇氧化酶的酶活性呈先升高后下降的趋势。当发酵温度为26℃时,达到最大酶活性,为0.431 U/mL;当发酵温度高于26℃之后,随着发酵温度的升高,酶活性开始下降。因此,26℃为最佳培养温度。因其产酶菌株来源于海洋,生长温度较低,所以较陆地来源微生物所产的胆固醇氧化酶,其在低温环境下仍然能够保持较高的酶活性[24]。
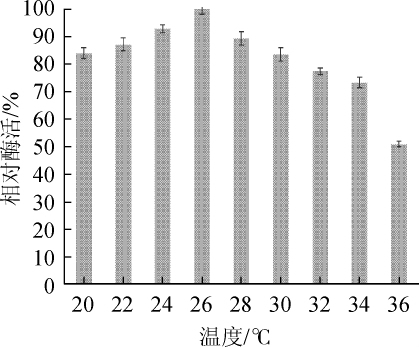
图3 发酵温度对胆固醇氧化酶活力的影响
Fig.3 Effect of fermentation temperature on cholesterol oxidase activity
2.3.3 接种量对胆固醇氧化酶活力的影响
接种量对胆固醇氧化酶活性的影响如图4所示。由图4可知,随着接种量的增加,胆固醇氧化酶的酶活性呈先升高后下降的趋势。当接种量为10%时,酶活性最大,为0.536 U/mL。因此,10%的接种量为最佳接种量。
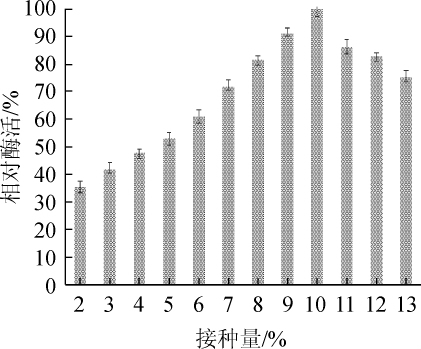
图4 接种量对胆固醇氧化酶活力的影响
Fig.4 Effect of inoculum on cholesterol oxidase activity
2.3.4 初始pH值对胆固醇氧化酶活力的影响
初始pH值对胆固醇氧化酶活力的影响如图5所示。由图5可知,随着初始pH值的升高,胆固醇氧化酶的酶活性呈先升高后下降的趋势。当初始pH值为7.0时,达到最大酶活性,为0.583 U/mL。因此,最适pH值为7.0。

图5 初始pH值对胆固醇氧化酶活力的影响
Fig.5 Effect of initial pH value on cholesterol oxidase activity
2.3.5 通气量对胆固醇氧化酶活力的影响
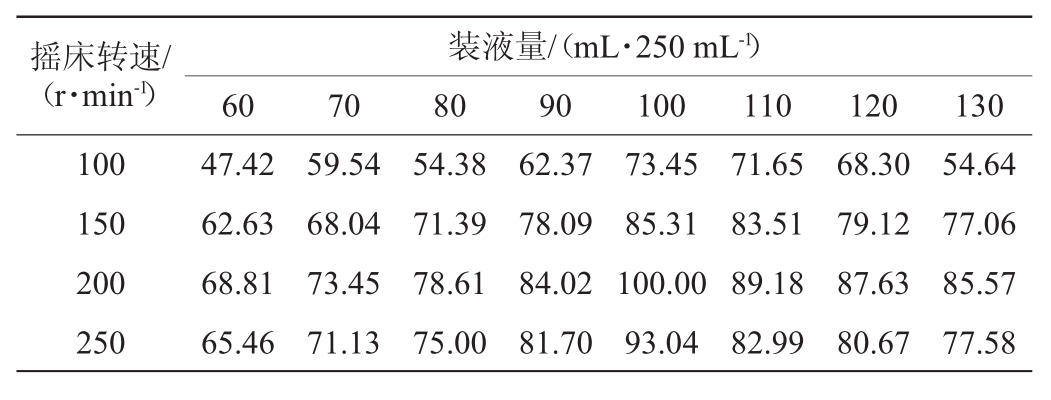
表1 通气量对胆固醇氧化酶活力的影响
Table 1 Effect of ventilation on cholesterol oxidase activity%
摇床转速/(r·min-1)100 150 200 250装液量/(mL·250 mL-1)60 70 80 90 100 110 120 130 47.42 62.63 68.81 65.46 59.54 68.04 73.45 71.13 54.38 71.39 78.61 75.00 62.37 78.09 84.02 81.70 73.45 85.31 100.00 93.04 71.65 83.51 89.18 82.99 68.30 79.12 87.63 80.67 54.64 77.06 85.57 77.58
通气量对胆固醇氧化酶活力的影响见表1。由表1可知,当转速为200r/min时,不同装液量条件下酶活力均最高,说明该转速最适合胆固醇氧化酶的产出与积累;当装液量为100 mL/250 mL时,不同转速条件下的酶活力均最高,说明该装液量最适合胆固醇氧化酶的产出与积累。因此,选择100 mL/250 mL的装液量和200 r/min的转速作为最优发酵条件,在此条件下酶活性最大,为0.610 U/mL。
2.3.6 碳源种类对胆固醇氧化酶活力的影响
微生物的生长与碳源提供的能量是不可分离的,碳源是微生物生长不可缺少的营养素。不同碳源对菌株XLH059产胆固醇氧化酶活力的影响如图6所示。由图6可知,当碳源为葡萄糖时,胆固醇氧化酶活力最高,为0.657 U/mL。因此,确定葡萄糖为最佳碳源。

图6 碳源种类对胆固醇氧化酶活力的影响
Fig.6 Effect of carbon source types on cholesterol oxidase activity
2.3.7 氮源种类对胆固醇氧化酶活力的影响
微生物的生长与氮源提供的能量是不可分离的,氮源是微生物生长不可缺少的营养素。不同氮源对菌株XLH059产胆固醇氧化酶活力的影响见图7。由图7可知,当氮源为蛋白胨时,胆固醇氧化酶活力最高,为0.698 U/mL。因此,确定蛋白胨为最佳氮源。

图7 氮源种类对胆固醇氧化酶活力的影响
Fig.7 Effect of nitrogen source types on cholesterol oxidase activity
2.3.8 胆固醇含量对胆固醇氧化酶活力的影响
胆固醇是胆固醇氧化酶产生的诱导物,其在培养基中的含量直接影响胆固醇氧化酶的产量,胆固醇含量对胆固醇氧化酶活力的影响结果如图8所示。由图8可知,随着胆固醇含量的增加,胆固醇氧化酶活力呈先增加后稳定的趋势,当胆固醇含量为0.5%时,胆固醇氧化酶活力达到最高,为0.718 U/mL。因此,胆固醇的最佳含量为0.5%。
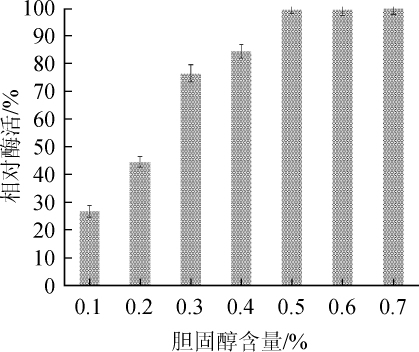
图8 胆固醇含量对胆固醇氧化酶活力的影响
Fig.8 Effect of cholesterol content on cholesterol oxidase activity
2.4 胆固醇氧化酶的分离纯化
2.4.1 硫酸铵沉淀
硫酸铵盐析曲线如图9所示。由图9可知,当硫酸铵饱和度为85%时,上清液基本没有酶活。因此,选择最适硫酸铵饱和度为80%进行盐析,收集沉淀物,然后进行透析和脱盐。

图9 硫酸铵盐析曲线
Fig.9 Salting out curve of ammonium sulfate
2.4.2 凝胶过滤层析
凝胶过滤层析结果如图10所示。由图10可知,硫酸铵沉淀经SephadexG-100凝胶柱层析后,一共有8个蛋白质吸收峰。对收集液的酶活力进行测定,结果发现,只有58至70个管的收集液具有胆固醇氧化酶活性。将收集的胆固醇氧化酶溶液储存在4℃冰箱中并进行SDS-PAGE检测。

图10 Sephadex G-100凝胶过滤层析色谱图
Fig.10 Gel filtration chromatogram by Sephadex G-100
2.4.3 SDS-PAGE结果
由图11可知,凝胶过滤层析后的样品经SDS-PAGE检测后,得到单一条带,大小约为59 kDa,与预期大小一致。

图11 胆固醇氧化酶的SDS-PAGE电泳图
Fig.11 SDS-PAGE electrophoretogram of cholesterol oxidase
3 结论
本研究以胆固醇为唯一碳源,筛选出具有高胆固醇氧化酶活性的菌株XLH059,酶活力为0.407U/mL。菌株XLH059经16S rDNA序列鉴定为蜡状芽孢杆菌(Bacillus cereus)。通过发酵条件优化确定菌株XLH059的最佳产酶条件:发酵周期24 h,发酵温度26℃,接种量10%,初始pH值7.0,装液量100 mL/250 mL,转速200 r/min,以葡萄糖、蛋白胨分别作为碳源和氮源,胆固醇含量0.5%。在此最优条件下,胆固醇氧化酶活力为0.718 U/mL,是优化前的1.76倍。该酶经硫酸铵沉淀、透析超滤、凝胶过滤层析纯化及SDS-PAGE凝胶电泳检测后得到分子质量约为59 kDa胆固醇氧化酶。该研究为胆固醇氧化酶制剂的工业化生产提供新的候选菌株,并为进一步研发奠定理论基础。
[1]KREIT J,SAMPSON N S.Cholesterol oxidase:physiological functions[J].Febs J,2010,276(23):6844-6856.
[2]徐坚强,谢服役,顾华庆.血清胆固醇单试剂酶法测定[J].现代实用医学,2012,24(10):1146-1147.
[3]尚柱,邓朝晖,郝万鹏.胆固醇测定酶法与参考方法相关性探讨[J].兵团医学,2005(2):31-32.
[4]沈凤翠.高密度脂蛋白胆固醇检测方法的研究[D].南京:南京理工大学,2009.
[5]VRIELINK A,GHISLA S.Cholesterol oxidase:biochemistry and structural features[J].Febs J,2009,276(23):6826-6843.
[6]DOUKYU N.Characteristics and biotechnological applications of microbial cholesterol oxidase[J].Appl Microbiol Biotechn,2009,83(5):825-837.
[7]吉少娴.新型离子液体对简单节杆菌及催化胆固醇的影响[D].天津:天津科技大学,2016.
[8]PURCELL J P,GREENPLATE J T,JENNINGS M J,et al.Cholesterol oxidase:A potent insecticidal active against boll weevil larvae[J].Biochem Biophys Res Commun,1993,196(3):1406-1413.
[9]VRILINK A,GHISLA S.Cholesterol oxidase:biochemistry and structural features[J].Febs J,2009,276(23):6826-6843.
[10]陈麒宇.胆固醇氧化酶高产菌株的筛选及酶学性质研究[D].沈阳:大连工业大学,2012.
[11]张公亮,侯红漫.Pseudomonadaceaesp.胆固醇氧化酶产酶条件优化及其初步纯化[J].中国酿造,2012,31(2):118-122.
[12]TURFITT G E.The microbiological degradation of steroids(Ⅱ):Oxidation of cholesterol byProactinomycesspp.[J].Biochem J,1944,38(5):492-496.
[13]郭倩倩,高登科,程晓涛,等.胆固醇氧化酶PsCO_4异源表达、纯化及酶学性质分析[J].中国生物工程杂志,2018(6):34-42.
[14]张璟,张玉富,秦慧民,等.一株高效氧化胆固醇的简单节杆菌构建与转化条件优化[J].中国生物工程杂志,2016,36(11):70-75.
[15]于振海.维吉尼亚链霉菌IBL-14中胆固醇氧化酶基因的鉴定及功能分析[D].合肥:安徽大学,2015.
[16]陈敦富,王建军,闫晓丹,等.胆固醇氧化酶最新研究进展[J].生物技术,2017,1(2):198-204.
[17]马玉超.微生物胆固醇氧化酶的研究进展[J].北京林业大学学报,2012,34(6):148-151.
[18]EL-NAGGAR N E,SOLIMAN H M,EL-SHWEIHY N M.Extracellular cholesterol oxidase production byStreptomyces aegyptia,in vitroanticancer activities against rhabdomyosarcoma,breast cancer cell-lines and in vivoapoptosis[J].Sci Rep,2018,8(1):2706.
[19]WATANABE K,SHUMIZU H,AIHARA H,et al.Isolation and identificationofcholesteroldegradingrhodococcusstrainsfromfoodofanimal origin and their cholesterol oxidase activities[J].J Gener Appl Microbiol,1986,32(2):137-148.
[20]季文明,陈毅力,张和春,等.比色法测定胆固醇氧化酶酶活[J].无锡轻工学报,2000,19(3):251-254.
[21]张学俊,ABELL C.酶的硫酸铵沉淀浓度范围的确定[J].贵州工业大学学报(自然科学版),2000(6):25-29.
[22]刘敏,陆伟跃,潘俊,等.凝胶过滤层析法调节脂质体内外水相pH的探讨[J].实验室研究与探索,2017,36(6):18-20.
[23]林方养,杨耀东,万婕,等.几种SDS-PAGE凝胶电泳染色方法的比较[J].安徽农业科学,2014,42(8):2295-2296.
[24]葛飞,龚倩,张慧敏,等.Bacillus cereusSG03 10L发酵罐中产胞外胆固醇氧化酶发酵条件优化[J].食品工业科技,2014,35(17):137-140,146.