酵母作为发酵工业中常用的菌株之一,在发酵过程中,自身代谢易受环境的影响,如高盐会导致细胞内水分活度降低、细胞质组成发生变化并伴随细胞膜损伤等,从而使发酵过程难以进行。但是,在发酵某些产品的后期,采用高盐稀态发酵能改善产品的风味与口感,闫美[1]研究发现,在酱油酿造的发酵后期添加耐盐酵母进行高盐稀态发酵,明显改善了酱油的口感。谢韩等[2]在发酵酱油过程中添加耐盐酵母,酱油的风味变得鲜甜适口,酯香浓郁。此外,在医学上耐盐酵母可作为模式菌研究离子通道疾病如高血压、心血管疾病等[3-4]。因此,从自然界中筛选出具有优良耐盐性能的酵母菌株,并对其耐盐机理进行研究在工业生产菌株性状的改造[5]和药物研发[6]方面都具有重要意义。
近年来对酵母耐盐机理的研究已取得突破性进展。高盐使酵母细胞内积累过量有毒阳离子,同时造成一定的渗透压,使质膜因细胞缺水而皱缩[7]。在盐胁迫条件下,酵母细胞通过多种复杂的信号传导途径将外界刺激传入细胞核内,激活特异性转录因子引发盐胁迫应答反应,包括:将有毒阳离子排出胞外,提高质膜对阳离子的选择性吸收,如吸收K+[8-9];调节一些相溶性物质的积累,如海藻糖[10]、麦角固醇[11]、甘油[12-13]等,维持细胞一定的渗透压。此外,细胞膜的成分变化以及膜完整性也会对酵母耐受能力产生一定的影响[14-15],所以对细胞膜相关基因的研究也是一个热点。赵经文等[16-17]研究发现,在酵母质膜和细胞器表面都存在相应的离子转运体,主要负责运输K+、Na+等金属阳离子,并且膜上可能还存在特定的蛋白能帮助这些离子通道蛋白正确定位。ICT1基因编码的蛋白属于α/β水解酶蛋白,对其结构进行分析发现,含有脂质结构域和脂肪酶水解酶/酰基转移酶域[18]。基于该发现,GHOSH A K等[19]对ICT1与磷脂代谢的关系进行了研究,推测出一种可溶性脂质生物合成途径:在烷烃暴露条件下,诱导了基因ICT1的表达以及磷脂的合成,最终促使了细胞膜的修复。HUAL等[20]研究发现,细胞膜成分相关基因ICT1的敲除与过表达能够提高酵母对烷烃极端环境的耐受性。因此,ICT1作为影响膜成分的基因,对酵母的耐受性至关重要。
本研究以酿酒酵母(Saccharomycescerevisiae)BY4741作为出发菌,采用同源重组技术构建ICT1基因缺失酿酒酵母菌株,分析ICT1基因敲除对酵母耐盐性的影响,并分别采用梯度点滴实验、碘化丙啶(propidium iodide,PI)染色法、实时荧光定量聚合酶链式反应(real time-quantitativepolymerase chain reaction,RT-QPCR)等技术分析ICT1基因在酿酒酵母耐盐机制中的作用。以期为后续酵母耐盐机理的解析提供一定的理论基础,并对浓醪发酵工业生产菌株性状的改造具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与质粒
酿酒酵母(S.cerevisiae)BY4741:中国普通微生物菌种保藏管理中心;质粒pUG6(携带Kanr抗性基因,两端带有loxP位点,具有G418抗性):广西大学杜丽琴教授惠赠。
1.1.2 引物
根据酿酒酵母基因组数据库(Saccharomycesgenome database,SGD)中ICT1基因(S000004089)和GenBank的pUG6序列(AF298793.1)设计引物,敲除引物命名为QC-F、QC-R,验证引物为A/YZ-a、YZ-b/B。引物均由南京金斯瑞有限公司合成,所涉及的引物及其序列见表1。
表1 实验所用引物的序列
Table 1 Sequences of primers used in the experiment

引物序列(5'→3')QC-F QC-R A YZ-a YZ-b B TTGTTCAGGACATATACATACGTAAGCGTAGTTTTCTTCAGTAGACAGCTGAAGCTTCGTACGC CGTGGTTTTCCATATTGTATTTTTCTTCTCTACTCTATATAGGCAGCATAGGCCACTAGTGGATCTG GTACGTGGAGTAGTAGAAGTATATTCGC GACTGTCAAGGAGGGTATTC GGTTTGGTTGATGCGAGTGAT GCTCACATATGAGAGGTTTACAC
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母膏5 g/L,蛋白胨10 g/L,葡萄糖20 g/L,琼脂20 g/L,自然pH。去除琼脂即为YPD液体培养基。
筛选培养基:每50 mL YPD培养基中加入500 μL质量浓度为10 mg/mL的G418母液。
盐浓度梯度培养基:YPD培养基中分别加入不同终浓度的NaCl(0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L)。
LB培养基:酵母提取物5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,琼脂20 g/L。
以上培养基均需在高压蒸汽灭菌锅中121℃灭菌20min。
1.1.4 试剂
rTaq酶、PrimeSTAR@Max脱氧核糖核酸(deoxyri bonucleic acid,DNA)Polymerase(酶活2.5 U/μL)、DL2000 DNA Marker、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、5×PrimeSTAR Buffer(Mg2+plus)、5×PrimeScript RT Master Mix、2×qPCR Master Mix、ROXI染料、质粒小量提取试剂盒、小量琼脂糖凝胶DNA回收试剂盒:日本TaKaRa公司;基因提取试剂盒、G418:生工生物工程(上海)有限公司。
1.2 仪器与设备
TRGADIENT聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Biometra公司;GPXcell 10-3000V电转仪、170-8170凝胶成像系统:美国Bio-Rad公司;5804R高速冷冻离心机:德国Eppendorf公司;leica DM2500IED荧光显微镜:德国徕卡公司。
1.3 试验方法
1.3.1 ICT1基因敲除组件的构建
以质粒pUG6为模板,采用引物QC-F、QC-R进行PCR扩增,获得同源臂ICT1基因敲除组件。PCR扩增产物含G418抗性基因(kanr)及ICT1同源臂基因,碱基长度约1 800 bp。
PCR扩增体系:PrimeSTAR@Max DNA Polymerase 1 μL、dNTP 8 μL、5×Prime STAR Buffer 20 μL、QC-F 2 μL、QC-R2μL、DNA模板1μL,双蒸水(ddH2O)补充至100 μL。PCR扩增程序:95℃预变性5 min;95℃变性30 s,59℃退火30 s,72℃延伸2 min,共30个循环;72℃再延伸10 min。PCR扩增产物经0.8%琼脂糖凝胶电泳进行分析。
参照SAMBROOK J等[21]所述方法制备酿酒酵母感受态细胞。将含G418抗性(Kanr)及ICT1同源臂的PCR扩增产物(约400ng)加入新制备的100μL酿酒酵母感受态细胞中,混匀,转移至电转杯后冰预冷5 min,电转化(电击参数:电压1.5 kV,电容25 μF,电阻400 Ω,电击间距2 mm)。电转化结束后立即加入1mL冰预冷的山梨醇复苏,混匀,8000r/min离心1 min,弃上清,取100 μL浓缩液涂布于含100 μg/mL G418的YPD固体培养基,30℃培养2~3 d。
1.3.2 ICT1基因敲除重组菌的筛选与验证
挑取单菌落接种于含100 μg/mL G418的YPD液体培养基中,30℃、180 r/min条件下摇床培养12 h后,8 000 r/min离心1 min,收集菌体。采用基因提取盒试剂盒提取重组菌的基因组DNA,以其为模板,A/YZ-a和B/YZ-b为引物分别进行PCR扩增,对ICT1基因敲除菌进行验证。PCR扩增体系:引物A/YZ-a(B/YZ-b)各2μL,Buffer2μL、rTaq酶10μL、DNA模板1 μL,双蒸水(ddH2O)补充至20 μL。PCR扩增程序:95℃预变性3 min;95℃变性30 s,50℃(55℃)退火30 s,72℃延伸1min(2min),共30个循环;72℃再延伸10min。将PCR扩增产物送至南京金斯瑞公司测序。
引物对A/YZ-a、B/YZ-b以及整合“loxP-kanMX-loxP”组建后的基因组相对序列如图1所示。
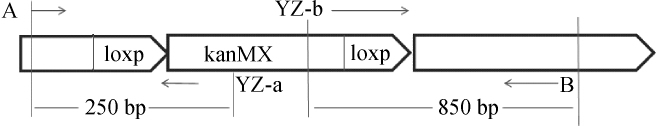
图1 引物与整合后的序列的相对位置关系
Fig.1 Relative position relationship between primer and the integrated sequence
1.3.3 盐耐受性试验
种子液的制备:将出发菌BY4741和验证成功的重组菌分别接种于10mLYPD液体培养基和含100 μg/mLG418的10mLYPD液体培养基中,30℃、180 r/min条件下摇床培养12 h后,采用无菌生理盐水调整至相同菌体浓度。
耐盐性测定:出发菌BY4741和重组菌的种子液经梯度(10-1、10-2、10-3、10-4、10-5、10-6、10-7)稀释后,取3 μL稀释液分别接种于含0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/LNaCl的YPD平板上,30℃倒置培养3 d,观察菌体生长情况。
1.3.4 麦角固醇含量的测定[22]
麦角固醇标准曲线的绘制:以石油醚为溶剂制备质量浓度为0.1g/L的麦角固醇标准溶液;分别取标准溶液1 mL、2 mL、3 mL、4 mL、5 mL于10 mL容量瓶中,石油醚定容至10 mL,在波长280 nm处测定OD280 nm值。以OD280 nm值(y)为纵坐标,麦角固醇质量浓度(x)为横坐标,绘制麦角固醇标准曲线。
麦角固醇的提取:菌株BY4741和BY4741-ΔICT1在含不同浓度NaCl的YPD液体培养基中,30℃、180 r/min条件下培养12 h后,分别取10 mL出发菌BY4741和重组菌BY4741-ΔICT1的菌液离心,8000r/min离心1 min,取沉淀,冰预冷的去离子水洗涤2次后转入到50 mL锥形瓶中。加入2 g KOH、30 mL无水甲醇和5 mL无水乙醇,通入氮气防止氧化。75℃水浴提取30 min后取出,待冷却后加入10 mL去离子水和10 mL石油醚进行麦角固醇的萃取,剧烈振荡10 min,静置1 h,过滤。
麦角固醇含量的测定:吸取萃取试样,测定其在波长280 nm处的吸光度值,根据麦角固醇标准曲线回归方程计算麦角固醇含量,进而得出单位质量细胞内麦角固醇含量。
1.3.5 细胞膜完整性的测定[23]
将出发菌BY4741和重组菌BY4741-ΔICT1接种于含1.0 mol/L NaCl的YPD液体培养基中,30℃、180 r/min条件下摇床培养至对数期,经碘化丙啶(PI)染色后,采用荧光显微镜观察两株菌细胞膜的受损情况。
1.3.6 实时荧光定量PCR
按照Takara试剂盒步骤在4℃条件下提取重组菌的总核糖核酸(ribonucleicacid,RNA),以其为模板反转录为cDNA。反转录PCR(reverse transcription-PCR,RT-PCR)扩增体系:5×PrimeScript RT Master Mix 4 μL、RNA模板1 μL,双蒸水(ddH2O)补充至20μL。RT-PCR扩增程序:37℃反转录15min;85℃热变性30s;4℃保存。根据所测离子转运体基因ENA1和NHA1的序列设计RT-QPCR引物,引物信息见表2。
表2 实时荧光定量PCR所用引物
Table 2 Primers used for RT-QPCR

基因引物序列(5'→3')NHA1 ENA1 NHA1-F NHA1-R ENA1-F ENA1-R AGTTGAATGATCTGGGACG GTGTATTGACGGCTGTGCT TCCTGCTGATTTGCGTTTA CAATACCCTTGGCTCTTCC
RT-QPCR扩增体系:2×qPCR Master Mix 10 μL、正向引物(10μmol/L)0.2μL、反向引物(10μmoL/L)0.2 μL、ROXI染料 0.4 μL、cDNA 2 μL,ddH2O补充至20 μL。RT-QPCR扩增曲线:95 ℃,5 min,1个循环;95 ℃,5 s;60 ℃,31 s,40个循环;熔解曲线:95 ℃,15 s;60 ℃,30 s;95 ℃,15 s。
2 结果与分析
2.1 ICT1基因敲除组件的构建
以质粒pUG6为模板,采用引物QC-F、QC-R进行PCR扩增,获得同源臂ICT1基因敲除组件,结果见图2。

图2 ICT1基因敲除组件PCR扩增产物的琼脂糖凝胶电泳分析
Fig.2 Agarose gel electrophoresis analysis of PCR amplification products ofICT1gene knockout component
由图2可知,PCR扩增产物的碱基长度约为1 800 bp,说明ICT1基因敲除组件构建成功。
2.2 ICT1基因敲除重组菌株的构建
采用电转化法将ICT1基因敲除组件转化至酿酒酵母BY4741中。由于ICT1基因敲除组件中包含异源显性的Kanr标记基因,将ICT1基因敲除组件转化至酵母细胞后,其两端与酵母基因组同源的序列进行同源重组,最终以loxP-Kanr-loxP取代基因组中的ICT1基因,从而赋予转化子G418抗性。在含G418的YPD平板上培养2~3 d后获得转化子,结果见图3。

图3 ICT1基因敲除重组菌株
Fig.3 Recombinant strains withICT1gene knockout
由图3可以看出,在含G418的YPD平板上明显长出了转化子,但为避免假阳性的存在,进行进一步的验证。
2.3 ICT1基因敲除重组菌的验证
提取转化子BY4741-ΔICT1的基因组,分别以A/YZ-a、B/YZ-b为引物进行PCR扩增。正确整合了ICT1基因敲除组件的细胞以引物对A/YZ-a为引物时,可得到碱基长度为250 bp左右的PCR扩增产物,以引物对B/YZ-b为引物时,可得到碱基长度为850 bp左右的PCR扩增产物。PCR扩增结果见图4。
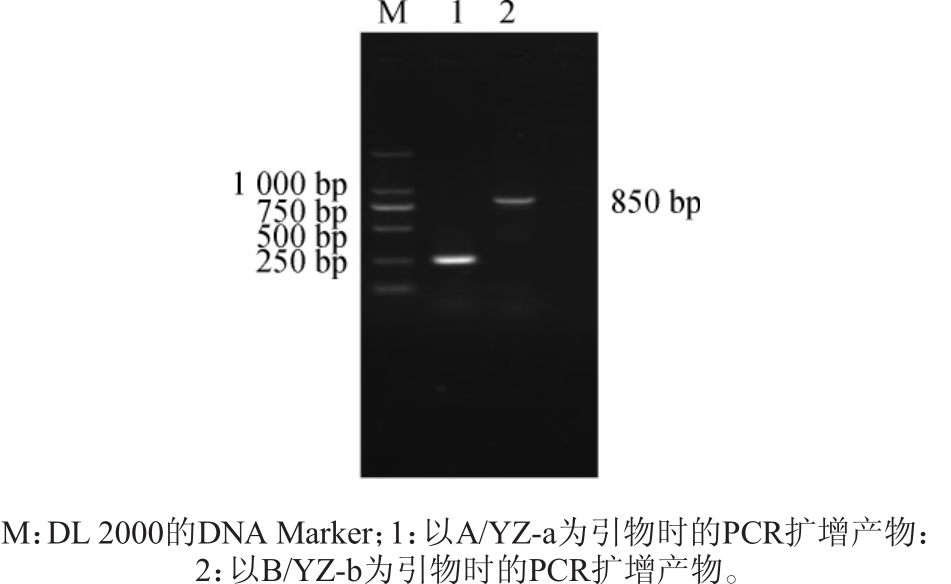
图4 ICT1基因敲除重组菌株的验证
Fig.4 Verification of recombinant strain withICT1gene knockout
由图4可知,以引物对A/YZ-a为引物时,PCR扩增产物碱基长度为250 bp左右;以引物对B/YZ-b为引物时,PCR扩增产物碱基长度为850 bp左右,与预测结果一致,说明转化子BY4741-ΔICT1中的ICT1基因已被敲除。
将PCR扩增产物送至南京金斯瑞有限公司测序,测序结果经比对后发现,ICT1基因敲除组件已被完全整合到染色体上,进一步说明ICT1基因已被敲除。
2.4 菌株BY4741和BY4741-ΔICT1的盐耐受性测定
不同稀释度的出发菌BY4741和重组菌BY4741-ΔICT1在盐浓度梯度培养基上的生长情况见图5。

图5 菌株BY4741与BY4741-ΔICT1在不同NaCl浓度平板上的生长情况
Fig.5 Growth situation of strain BY4741 and BY4741-ΔICT1on the plates with different NaCl contents
由图5可知,与出发菌BY4741相比,重组菌BY4741-ΔICT1对NaCl更为敏感。经0.4 mol/L NaCl处理后,两株菌的生长趋势较为接近,随着NaCl含量的增加,重组菌BY4741-ΔICT1的生长明显受到抑制,说明ICT1基因的敲除提高了酿酒酵母对盐的敏感性。
2.5 菌株BY4741和BY4741-ΔICT1在不同盐浓度下麦角固醇含量的测定
以麦角固醇质量浓度(x)为横坐标,OD280nm值(y)为纵坐标,绘制麦角固醇的标准曲线,经线性回归拟合后得到的回归方程为y=24.286 6x+0.055 6,R2=0.999 2,说明麦角固醇质量浓度与OD280nm值呈良好的线性关系,可用于麦角固醇含量的测定。
麦角固醇是酵母细胞膜中的主要成分之一,能够影响细胞膜的渗透性和流动性,麦角固醇含量变化可影响膜内外物质的输送[24]。菌株BY4741和BY4741-ΔICT1在含不同浓度NaCl的YPD液体培养基中培养12 h后,测定菌株胞内麦角固醇的含量,结果见图6。
由图6可知,随着NaCl浓度在0~1.0 mol/L范围内的增加,出发菌BY4741胞内麦角固醇含量虽有所下降,但下降幅度较小,仅下降了11.2%;而重组菌BY4741-ΔICT1胞内麦角固醇含量下降趋势较为明显,下降了66.9%。出发菌BY4741和重组菌BY4741-ΔICT1胞内麦角固醇含量在不含NaCl的条件下差异不显著(P>0.05),但随着NaCl浓度的升高,两株菌的胞内麦角固醇含量差异越大。结果表明,BY4741-ICT1基因的敲除使得胞内麦角固醇合成减少,降低了细胞膜的稳定性,使得酵母在高盐环境下难以生存。
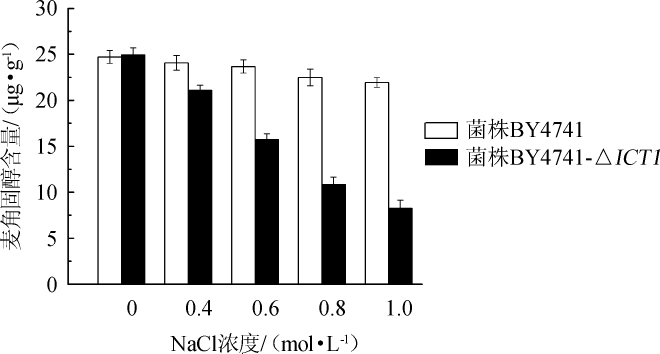
图6 不同NaCl浓度下菌株BY4741和BY4741-ΔICT1胞内麦角固醇含量的测定结果
Fig.6 Determination results of ergosterol contents in the cells of strain BY4741 and BY4741-ΔICT1under different NaCl contents
2.6 菌株BY4741和BY4741-ΔICT1细胞膜完整性的测定
出发菌BY4741和重组菌BY4741-ΔICT1经1.0 mol/L NaCl的YPD液体培养基培养后,细胞膜的受损情况见图7。

图7 1 mol/L NaCl条件下菌株BY4741(A)和BY4741-ΔICT1(B)细胞膜的受损情况
Fig.7 Damage of cell membrane of strain BY4741(A)and BY4741-ΔICT1(B)under 1 mol/L NaCl
由图7可知,经1.0mol/LNaCl处理后,出发菌BY4741几乎未被染成红色,细胞膜受损程度很低,而重组菌BY4741-ΔICT1被染成红色,细胞膜受损程度严重。由此可见,ICT1基因的敲除确实在一定程度上影响了细胞膜的完整性,进而影响了酵母的耐盐性。
2.7 菌株BY4741和BY4741-ΔICT1细胞膜上转运蛋白基因的转录水平
研究发现,与出发菌BY4741相比,重组菌BY4741-ΔICT1对NaCl比较敏感,细胞膜受损严重,为研究ICT1基因的敲除是否对存在于细胞膜上的一些转运蛋白有影响,因此,采用RT-QPCR技术对与细胞膜上离子转运蛋白相关的两个基因ENA1和NHA1进行基因转录水平测定,结果见图8。

图8 菌株BY4741和BY4741-ΔICT1细胞膜上离子转运蛋白基因的转录水平
Fig.8 Transcriptional levels of ion transporter gene on the cell membrane of strain BY4741 and BY4741-ΔICT1
由图8可知,经1.0mol/LNaCl处理后,与出发菌BY4741相比,重组菌BY4741-ΔICT1细胞膜上的离子转运蛋白基因的转录水平明显下降,NHA1和ENA1基因的转录水平分别下降65.6%、90.5%,由此推测,ICT1的缺失影响了酵母转运蛋白在高盐应激时的转录水平,降低了有毒阳离子向胞外运输的速率,从而使得其盐耐受性下降。
3 结论
本研究以酿酒酵母BY4741为出发菌,利用同源重组技术敲除出发菌的ICT1基因,成功获得了ICT1基因缺失菌株,命名为BY4741-ΔICT1。与出发菌BY4741相比,重组菌BY4741-ΔICT1对NaCl的耐受性减弱;经1.0 mol/L NaCl处理后,麦角固醇含量下降66.9%,细胞膜严重受损,细胞膜上存在的两个转运蛋白基因NHA1和ENA1转录水平分别下降65.6%和90.5%。说明ICT1基因的敲除,使得酿酒酵母盐耐受性下降,可能与胞内麦角固醇合成减少、膜受损、离子转运蛋白基因的转录水平下降有关,ICT1的缺失在影响膜成分的同时影响了离子转运蛋白相关基因的表达。
本研究明确了ICT1基因缺失破坏了酵母生物膜的完整性,降低了酵母细胞的耐盐性,但其具体机制尚不清楚,有待于进一步研究。本研究可为后续酵母耐盐机理的解析提供一定的理论基础,并对浓醪发酵工业生产菌株性状的改造具有重要意义。
[1]闫美.高耐盐酱油酵母的选育及其在酱油酿造中的应用[D].武汉:湖北工业大学,2014.
[2]谢韩,丁洪波.添加耐盐酵母改善低盐固态酱油风味[J].江苏调味副食品,2002(4):6-7.
[3]SCHNETKAMP P P M,JALLOUL A H,LIU G,et al.The SLC24 family of K+-dependent Na+-Ca2+exchangers:structure-function relationships[J].Curr Top Membr,2014,73:263.
[4]FUSTER D G,ALEXANDER R T.Traditional and emerging roles for the SLC9 Na+/H+exchangers[J].Pflug Arch Eur J Phy,2014,466(1):61-76.
[5]ZUZUARREGUI A,OLMO M L D.Analyses of stress resistance under laboratory conditions constitute a suitable criterion for wine yeast selection[J].Anton Leeuw Int J G,2004,85(4):271-280.
[6]BOONE C,BUSSEY H,ANDREWS B J.Exploring genetic interactions and networks with yeast[J].Nat Rev Genet,2007,8(6):437-449.
[7]王聪.耐盐酵母基因组学的研究[D].天津:天津科技大学,2015.
[8]HERRERA R,ÁLVAREZ,MARÍA C,GELIS S,et al.Role of Saccharomyces cerevisiaeTrk1 in stabilization of intracellular potassium content upon changes in external potassium levels[J].BBA-Bioenergetics,2014,1838(1):127-133.
[9]ZAHRÁDKA J,SYCHROVÁ H.Plasma-membrane hyperpolarization diminishes the cation efflux via Nha1 antiporter and Ena ATPase under potassium-limiting conditions[J].Fems Yeast Res,2012,12(4):439-446.
[10]程书梅,王昌禄,顾金兰,等.海藻糖对耐盐酵母的影响[J].中国酿造,2005,24(8):8-11.
[11]ZIEGLER S E,BILLINGS S A,LANE C S,et al.Warming alters routing of labile and slower-turnover carbon through distinct microbial groups in boreal forest organic soils[J].Soil Biol Biochem,2013,60:23-32.
[12]NADAL E D,CASADOMÉ L,POSAS F.Targeting the MEF2-like transcription factor Smp1 by the stress-activated Hog1 mitogen-activated protein kinase[J].Mol Cell Biol,2003,23(1):229-237.
[13]SU C,LU Y,LIU H.Reduced TOR signaling sustains hyphal development inCandida albicansby lowering Hog1 basal activity[J].Mol Biol Cell,2013,24(3):385-397.
[14]HERRERA R,SALAZAR A,RAMOS-MORENO L,et al.Vacuolar control of subcellular cation distribution is a key parameter in the adaptation ofDebaryomyces hanseniito high salt concentrations[J].Fungal Genet Biol,2017,100:52-60.
[15]KIMJ,OHJ,SUNGGH.RegulationofMAPkinaseHog1bycalmodulin during hyperosmotic stress[J].BBA-Mol Cell Res,2016,1863(11):2551-2559.
[16]赵经文.酿酒酵母耐锂盐的分子机理研究[D].天津:天津大学,2014.
[17]PETREZSELYOVA S,KINCLOVAZIMMERMANNOVA O,SYCHROVA H.Vhc1,a novel transporter belonging to the family of electroneutral cation-Cl(-)cotransporters,participates in the regulation of cation content and morphology ofSaccharomyces cerevisiaevacuoles[J].BBABioenergetics,2013,1828(2):623-631.
[18]AKIYAMA M.Truncation of CGI-58 protein causes malformation of lamellar granules resulting in ichthyosis in dorfman-chanarin syndrome[J].J Invest Dermatol,2003,121(5):1029-1034.
[19]GHOSH A K,RAMAKRISHNAN G,RAJASEKHARAN R.YLR099C(ICT1)encodes a soluble Acyl-CoA-dependent lysophosphatidic acid acyltransferaseresponsibleforenhancedphospholipidsynthesisonorganic solvent stress inSaccharomyces cerevisiae[J].J Biol Chem,2008,283(15):9768-9775.
[20]HUA L,JUWONO N K P,WEI S T,et al.Engineering transcription factors to improve tolerance against alkane biofuels inSaccharomyces cerevisiae[J].Biotechnol Biofuels,2015,8(1):231.
[21]SAMBROOK J,RUSSEL D W.分子克隆实验指南[M].北京:科学出版社,2002:87.
[22]钱寿根.用紫外分光光度法测定酵母中麦角固醇的含量[J].江苏食品与发酵,1987(1):38-40.
[23]黄生权,付萌,唐青涛,等.流式细胞术检测单增李斯特菌与酿酒酵母[J].现代食品科技,2014(3):195-200.
[24]TAYLOR M,RAMOND J B,TUFFIN M,et al.Mechanisms and applications of microbial solvent tolerance[J].Microbiol Monogr,2011,22:177-208.