李果实成熟期一般在7、8月份,采后极易遭到微生物侵染而腐败,造成经济损失。已有研究表明,引起李果实腐败变质的微生物包括褐腐病菌(Monilinia fructicola)、酵母菌(Saccharomycetes)、黑曲霉(Aspergillus niger)、米曲霉(Aspergillus oryzae)等,其中褐腐病菌是最主要的致腐真菌[1-3]。目前主要使用人工合成的化学杀菌剂来控制李果实采后的微生物侵染(如扑海因、特克多、仲丁胺等),但这些化学合成物质残留量较大,长期摄入过多后会对人体产生危害[4-5],因此寻找更加安全、有效的控制李果实采后病害的方法十分迫切。近年来很多研究证实了天然植物抑菌成分对果蔬贮藏保鲜的效果[6-9],吴振宇等[10]研究了黄连等四种植物提取物对桃褐腐病的抑制作用,得出黄柏和黄连以1∶7复配增效作用最显著。艾启俊[11]研究发现,鹿蹄草提取液对根霉、黑曲霉、青霉有明显抑制作用,在苹果贮藏防腐方面有良好效果。本研究通过离体抑菌实验,从甘草、肉桂、丁香、高良姜、小茴香、八角、肉豆蔻七种植物原料中筛选出能有效抑制褐腐病菌(Monilinia fructicola)、酵母菌(Saccharomycetes)、黑曲霉(Aspergillus niger)、米曲霉(Aspergillus oryzae)生长的植物原料,将抑菌效果较好的甘草、肉桂提取液联合使用,研究其对褐腐病菌的抑制效果,并通过生化检测探究这两种提取液对褐腐病菌的抑菌机理,为天然防腐剂的进一步研究和开发提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
肉桂、丁香、高良姜、甘草、小茴香、八角、肉豆蔻:四川省成都市武侯区华安堂药业零售连锁有限公司;褐腐病菌(Monilinia fructicola):中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC);黑曲霉(Aspergillus niger)、米曲霉(Aspergillus oryzae)、酵母菌(Saccharomycetes):四川大学生态食品工程与生物技术研究室保藏。
1.1.2 化学试剂
牛血清蛋白标准品(纯度≥98%):上海蓝季科技发展有限公司;考马斯亮蓝G250、无水葡萄糖、琼脂、酵母膏、蛋白胨:成都市科龙试剂有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基:马铃薯20%,无水葡萄糖2%,琼脂1.5%~2.0%,自然pH,121℃灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:蛋白胨2%,酵母膏1%,无水葡萄糖2%,琼脂1.5%~2.0%,自然pH,121℃灭菌20 min。
1.2 仪器与设备
JSP-250高速多功能粉碎机:浙江省永康市金穗机械制造厂;RE52-1旋转蒸发器:上海申顺生物科技有限公司;SpectraMax-90酶标仪:美谷分子仪器(上海)有限公司;TDZ5-WS低速离心机:湖南长沙湘仪离心机仪器有限公司;DDS-307电导率仪:上海越平科学仪器有限公司;UV-1600型紫外分光光度计:上海美谱达仪器有限公司。
1.3 方法
1.3.1 菌悬液制备
褐腐病菌、黑曲霉和米曲霉在无菌条件下,用PDA培养基斜面活化,置于28℃条件下培养2~3 d,用生理盐水洗下,制成105CFU/mL的单孢子悬液,低温保存备用。酵母菌在无菌操作下从YEPD培养基斜面中取出,接种到装有液体YEPD培养基的三角瓶中,置于28℃条件下培养2 d,将培养液在4000r/min条件下离心10min,用生理盐水洗涤2次,弃去上清液,加入生理盐水制成105CFU/mL菌悬液,低温保存备用。
1.3.2 植物提取液制备
将七种植物原料分别粉碎后过40目筛(孔径0.37mm),分别称取10.0 g,装入有磨口塞的三角烧瓶中,加入50 mL体积分数为80%的乙醇,浸泡48 h,超声30 min后抽滤;收集滤液后重复上述过程再提取1次,合并滤液将滤液旋转蒸发浓缩至10 mL,即得到七种植物提取液原液,置于常温避光条件下,密封保存,备用。
1.3.3 植物提取液抑菌圈测定
采用滤纸片法[11]测定抑菌圈直径(滤纸片直径6 mm)。抑菌效果判断标准[12]:抑菌圈直径>15 mm就表明该微生物对抑菌剂高度敏感、10~15 mm为中度敏感、6~10 mm为低度敏感、<6 mm则为不敏感。
1.3.4 植物提取液最低抑菌浓度测定
采用倍比稀释法[13]测定最低抑菌浓度(minimalinhibitoryconcentration,MIC)。用酶标仪测定菌液OD600nm值。培养前后的OD600nm值未发生变化即表示供试微生物在此条件下没有生长,此时的浓度即为该植物提取液的MIC。一般认为MIC≤62.5 mg/mL时抑菌效果较好,MIC≥125 mg/mL时抑菌效果较差[14]。
1.3.5 甘草、肉桂复配提取液抑菌效果评价
采用微量棋盘稀释法[15]将甘草、肉桂提取液进行复配,测定复配提取液的抑菌效果。甘草和肉桂复配提取液的抑菌效果可用分级抑制浓度(fractional inhibitory concen tration,FIC)指数加以评价。FIC指数=MIC复合A/MIC单一A+MIC复合B/MIC单一B。FIC指数判断标准:FIC指数≤0.5,协同作用;0.5<FIC指数≤1.0,相加作用;1.0<FIC 指数<4.0,无相关作用;FIC指数≥4.0,拮抗作用。
1.3.6 甘草、肉桂提取液对褐腐病菌抑菌机理研究
甘草、肉桂提取液对褐腐病菌菌液电导率及对褐腐病菌菌液可溶性蛋白质的影响分别参照文献[16-17]的方法测定。
2 结果与分析
2.1 提取液对四种致腐真菌的抑菌圈直径
质量浓度为1.0 g/mL和0.5 g/mL的植物提取液对四种致腐真菌抑菌圈直径测定结果见表1。由表1可知,质量浓度为1.0 g/mL和0.5 g/mL的甘草提取液对褐腐病菌抑菌作用最强,其抑菌圈直径为12.03 mm、11.33 mm,抑菌效果为中度敏感,而对其他三种真菌(酵母菌、米曲霉及黑曲霉)无抑菌效果。肉桂提取液对酵母菌、米曲霉、黑曲霉三种供试菌抑菌作用最强,质量浓度为1.0 g/mL和0.5 g/mL的肉桂提取液对其抑菌圈直径分别为21.25mm、10.19mm,13.28mm、10.79 mm,17.49 mm、15.62 mm,抑菌效果为中高度敏感。其他植物提取液对上述四种致腐真菌的抑菌效果相对较弱,其抑菌圈直径维持在6~12 mm。
表1 七种药食两用植物提取液对四种致腐真菌的抑菌圈测定结果
Table1 Determination results of the inhibition zone of seven kinds of medicinal and edible plants extracts on four kinds of rot-causing fungi
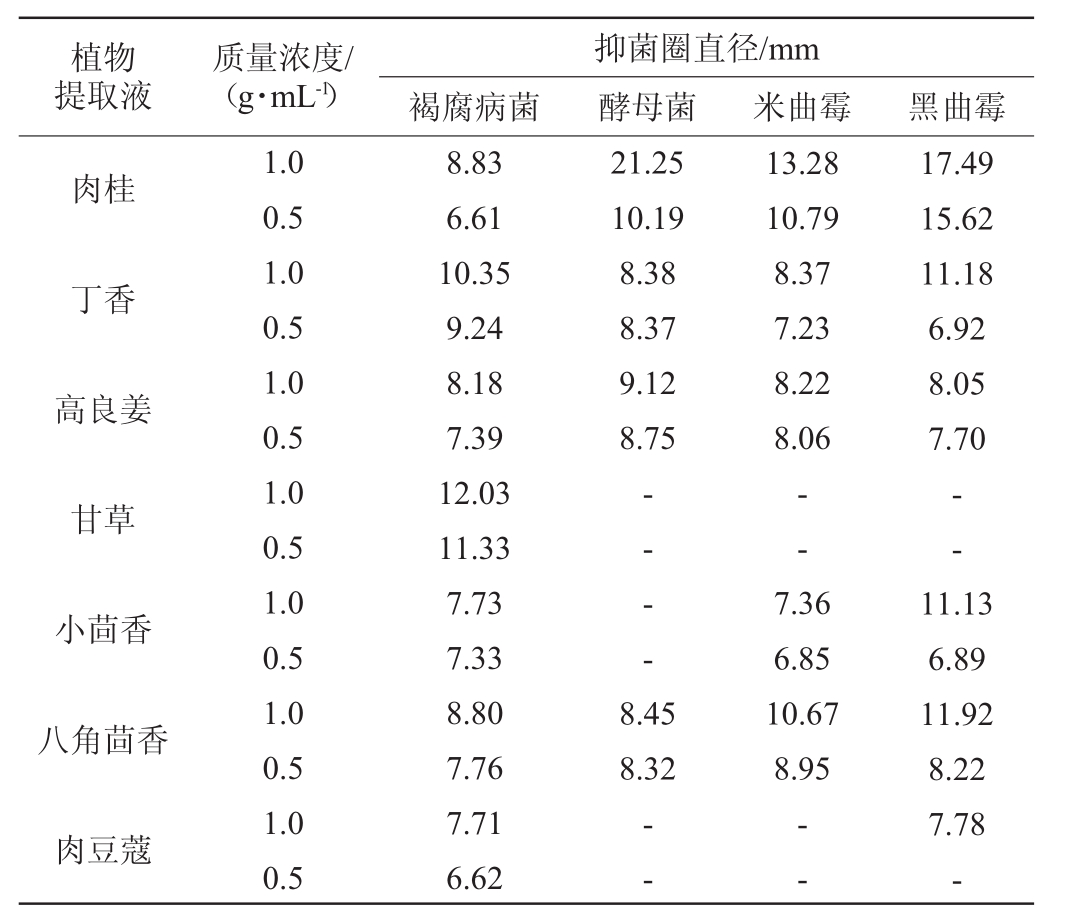
注:“-”表示无抑菌圈出现。
?
2.2 提取液对四种致腐真菌的MIC
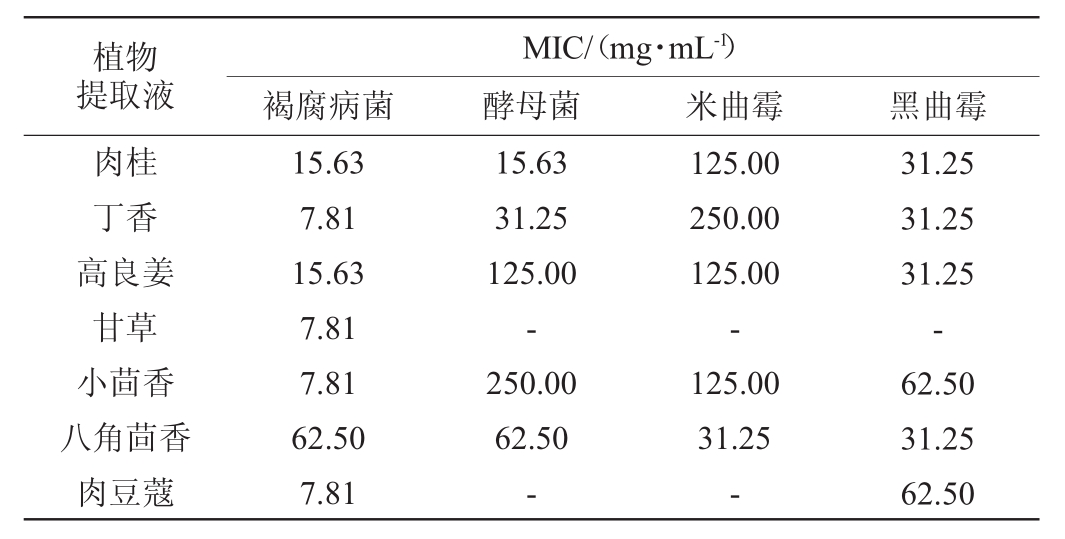
植物提取液对四种致腐真菌的MIC测定结果见表2。由表2可知,七种植物提取液对褐腐病菌、黑曲霉的MIC≤62.5mg/mL,抑菌效果好;肉桂、丁香、八角茴香提取液对酵母菌的MIC值分别为15.63mg/mL、31.25mg/mL、62.50mg/mL,抑制作用强;八角茴香提取液对米曲霉的MIC值为31.25mg/mL,抑菌效果好。
表2 七种药食两用植物提取液对四种致腐真菌的MIC测定结果
Table2 Determination results of the MIC of seven kinds of medicinal and edible plants extracts on four kinds of rot-causing fungi
?
综合来看,对褐腐病菌抑制作用最强的是甘草提取液,MIC值为7.81 mg/mL,1.0 mg/mL甘草提取液抑菌圈直径为12.03 mm。对酵母菌、米曲霉、黑曲霉抑制作用最强的是肉桂提取液,MIC值分别为15.63 mg/mL、125.00 mg/mL、31.25 mg/mL,1.0 mg/mL肉桂提取液抑菌圈直径分别为21.25 mm、13.28 mm、17.49 mm;但其对褐腐病菌的MIC值为15.63 mg/mL,抑菌圈直径为8.83 mm,抑制效果弱于甘草提取液。
2.3 甘草、肉桂复配提取液对褐腐病菌的抑菌效果
甘草和肉桂复配提取液对褐腐病菌的联合抑菌效果见表3。由表3可知,在1/2MIC甘草提取液与1/4MIC肉桂提取液联合作用下,对褐腐病菌的抑制作用明显。此时FIC指数为0.75,抑菌效果增强。
表3 甘草和肉桂复配提取液对褐腐病菌联合抑菌效果
Table3 Antibacterial effects of compound extracts of licorice and cinnamon onMonilinia fructicola
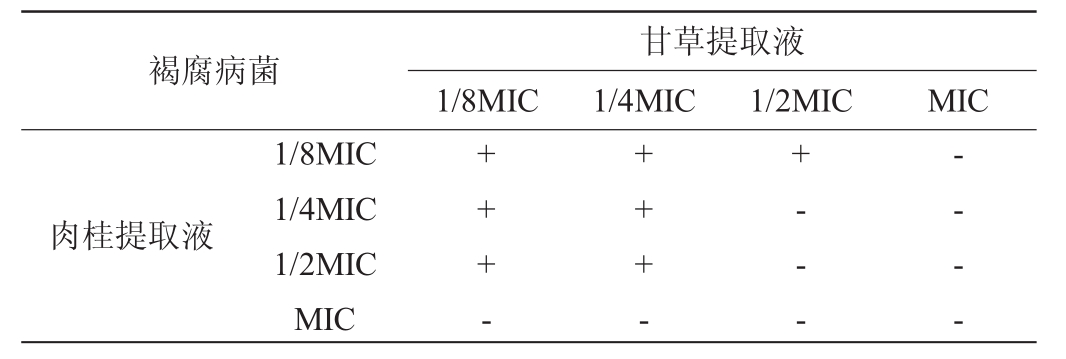
注:“+”表示有菌生长,“-”表示无菌生长。
?
2.4 甘草和肉桂提取液对褐腐病菌抑制作用机理的探讨
植物提取液主要通过破坏酵母菌、米曲霉、黑曲霉等真菌细胞膜结构,改变细胞膜渗透性从而发挥抑菌作用[18],但其对褐腐病菌抑制作用机理的报道不多。选择褐腐病菌为研究对象,进一步研究甘草、肉桂提取液对其的抑制作用机理。甘草和肉桂提取液对褐腐病菌菌液相对电导率和可溶性蛋白质含量影响结果见图1。
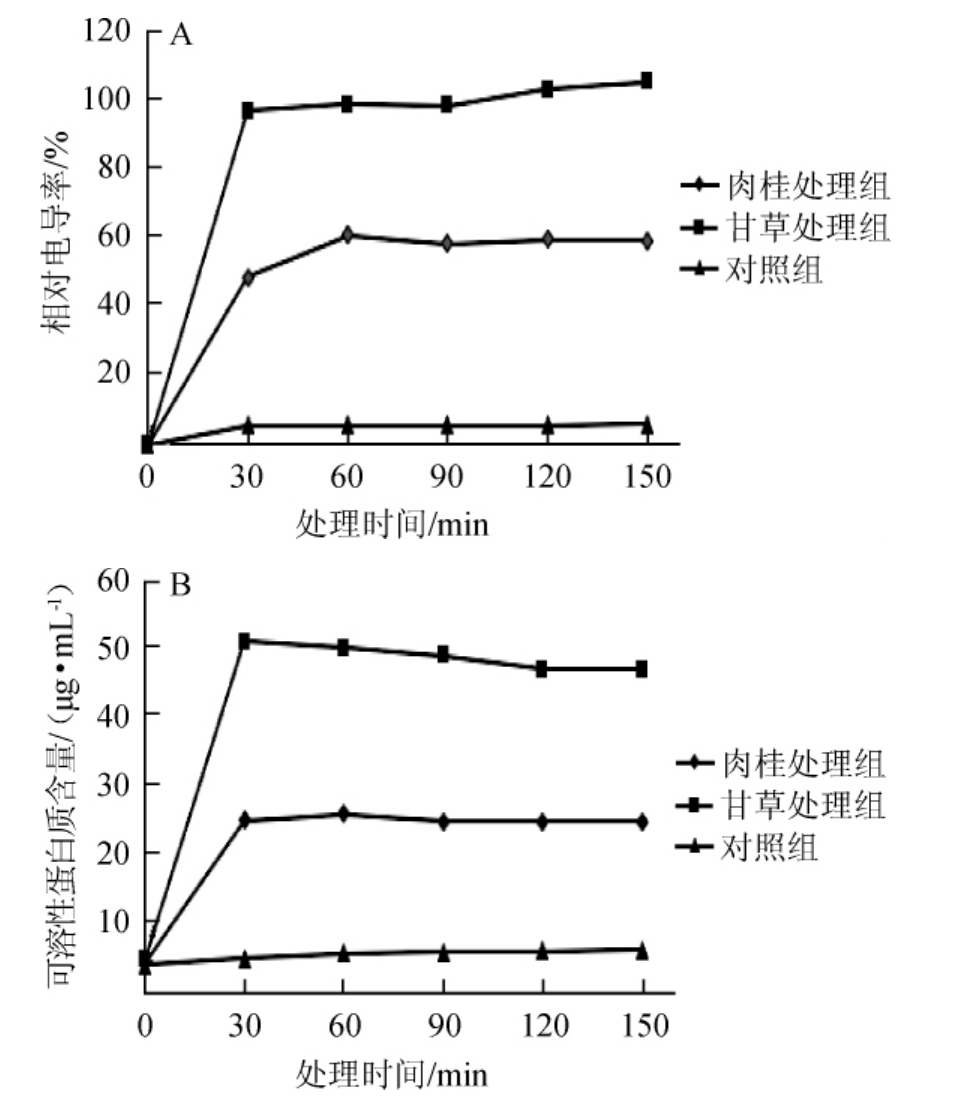
图1 甘草、肉桂提取液处理下褐腐病菌菌液相对电导率(A)和可溶性蛋白质含量(B)的变化
Fig.1 Changes of relative conductivity(A)and soluble protein content(B)ofMonilinia fructicolasolution treated with licorice and cinnamon extracts
从图1A可知,甘草、肉桂提取液处理0~30 min,菌液相对电导率迅速升高,并在30 min时达到峰值,分别为96.64%、48.47%,此后基本保持不变。在整个时间段,对照组相对电导率变化幅度很小,保持在6%左右。由图1B可知,可溶性蛋白质含量变化趋势与电导率变化趋势一致,在整个时间段,对照组可溶性蛋白质含量维持在6.0 μg/mL左右,而甘草、肉桂处理组可溶性蛋白质含量在30min时达到最大值,分别为50.6μg/mL、25.1μg/mL,此后基本保持不变。细胞正常代谢必须依靠一个完整的细胞膜结构。当细胞膜遭到破坏时,其渗透性发生改变,细胞内部电解质大量外泄至细胞外,导致培养液电导率上升,镶嵌在细胞膜上的蛋白质泄露到细胞外,使培养液蛋白质含量增加[19]。由图1推测甘草、肉桂提取液处理破坏了菌体细胞膜结构,导致细胞质外渗,可溶性蛋白质含量上升。已有研究[20-21]显示,甘草、肉桂提取液发挥抑菌作用主要是通过改变细胞膜渗透性及破坏细胞膜结构得以实现,与本研究得出的结论相似。在本研究中,甘草对褐腐病菌抑制效果明显强于肉桂,推测是由于两种植物提取液在细胞膜上抑菌作用位点不同,从而导致抑菌效果出现差异。
3 结论
本研究以褐腐病菌、酵母菌、黑曲霉、米曲霉为供试菌,通过体外抑菌试验研究了甘草、肉桂、丁香等七种植物提取液的抑菌效果。结果表明,1.0 g/mL甘草提取液对褐腐病菌有较强的抑制效果,抑菌圈为12.03 mm;1.0 g/mL肉桂提取液对酵母菌、黑曲霉、米曲霉有较强的抑制效果,抑菌圈直径分别达到21.25 mm、17.49 mm、13.28 mm。1/2MIC甘草提取液与1/4MIC肉桂提取液联合使用时,对褐腐病菌的FIC指数为0.75,表现为相加作用。甘草、肉桂提取液处理后腐病菌培养液相对电导率分别为96.64%、48.47%,可溶性蛋白质含量增加至50.6 μg/mL、25.1 μg/mL,提示其抑菌机制可能是通过破坏细胞膜结构从而导致褐腐病菌死亡。
[1]GONÇALVES F P,MARTINS M C,JUNIOR G J S,et al.Postharvest control of brown rot and Rhizopusrot in plums and nectarines using carnauba wax[J].Postharvest Biol Tec,2010,58(3):211-217.
[2]ZHANG D P,SPADARO D,GARIBALDI A,et al.Efficacy of the antagonist Aureobasidium pullulans PL5 against postharvest pathogens of peach,apple and plum and its modes of action[J].Biol Control,2010,54(3):172-180.
[3]孙晓婷,曹建康,陈妮,等.酵母甘露聚糖处理对李果实褐腐病及贮藏特性的影响[J].食品科学,2011,32(6):261-264.
[4]王雷.果蔬采后病害的发生及控制病害的主要方法[J].现代农业科学,2009,16(11):84-85.
[5]孙元军,李文香,岳本芳,等.中草药提取液对桃果实采后致腐真菌抑制效应[J].食品与生物技术学报,2012,31(10):1074-1079.
[6]王丹,陈文学,胡月英.益智提取物的抑菌性能研究[J].中国酿造,2013,32(3):76-78.
[7]JOYJ,CHUNJY,KWONYJ,etal.Physicalandantimicrobial properties of trans-cinnamaldehyde nanoemulsions in water melon juice[J].LWTFood Sci Tech,2015,60(1):444-451.
[8]YAMAMOTO-RIBEIRO M M G,GRESPAN R,KOHIYAMA C Y,et al.Effect of Zingiber officinaleessential oil on Fusarium verticillioides and fumonis in production[J].Food Chem,2013,141(3):3147-3152.
[9]NYAMBUYAT,MAUTSA R,MUKANGANYAMA S.Alkaloid extracts from Combretum zeyheriinhibit the growth of Mycobacterium smegmatis[J].BMC Complement Altern Med,2017,17(1):124-134.
[10]吴振宇,艾启俊,王燕,等.中草药提取液对几种果蔬采后病原真菌的离体抑制作用研究[J].食品科技,2008(5):259-262.
[11]艾启俊.苹果贮藏中鹿蹄草浸提物抗真菌研究初探[J].西北园艺,2003(12):9-11.
[12]SHARMA A,BAJPAI V K,BAEK K H.Determination of antibacterial mode of action of a llium sativum essential oil against foodborne pathogens using membrane permeability and surface characteristic parameters[J].J Food Safety,2013,33(2):197-208.
[13]柴丽,张公亮,侯红漫.灰树花多酚类物质抑菌作用的研究[J].中国酿造,2012,31(3):96-98.
[14]彭练慈,殷中琼,贾仁勇,等.20味中药提取物对无乳链球菌的体外抑菌活性研究[J].华南农业大学学报,2014,35(4):22-25.
[15]赵宜双.常用抗菌药联合作用及亚-MIC抗菌药对细菌成膜能力的影响[D].武汉:华中农业大学,2014.
[16]李雯霞,于司达,诸葛斌,等.芍药花提取液对果蔬腐败菌的抑菌活性及其在樱桃番茄保鲜中的应用[J].食品与发酵工业,2018,44(2):228-232.
[17]LV F,LIANG H,YUAN Q,et al.In vitroantimicrobial effects and mechanism of action of selected plant essential oil combinations against four food-related microorganisms[J].Food Res Int,2011,44(9):3057-3064.
[18]阮贤妹,史道华.中药有效成分及单体抗菌作用机制的研究进展[J].中国微生态学杂志,2015,27(2):244-248.
[19]杨苏声,周俊初.微生物生物学[M].北京:科学出版社,2005:156-160.
[20]罗建军,翁群芳,胡美英.抑菌植物的筛选及甘草对5种植物病原真菌抑菌活性的研究[J].华南农业大学学报,2012,33(3):356-360.
[21]余小亮,陈舜胜,贠三月,等.茶多酚肉桂精油复合保鲜剂抗氧化活性及抑菌作用[J].食品工业科技,2017,38(22):226-230,245.