大豆是重要的副食品及工业原料,其加工业已经形成比较完整的产业链条,相关产品涉及营养保健、饲料加工、包装、化工、环保、医药等诸多领域,具有广阔的发展前景[1]。与此同时,大量的生物质“废弃物”也在上述产品加工过程中产生。典型代表是提取油脂及蛋白质后的残渣即大豆渣(soybean dregs)[2],其富含膳食纤维(60%~70%)、蛋白质(13%~20%)、脂肪(6%~19%)及微量元素等成分[3-4]。然而,由于新鲜豆渣含水量大、运输困难且易腐败变质,主要被就近用作动物饲料、肥料或直接被丢弃,导致了资源浪费、企业经济效益降低而且严重影响了环境。为此,实现大豆渣综合利用、深入开发其高附加值组分和营养成分已成为当今研究的热点和趋势。
大豆渣中的糖分主要存在于纤维素、半纤维素及可溶性大豆多糖中,其中L-阿拉伯糖是半纤维素的重要组成成分,具有控制血糖、预防便秘、促进双歧杆菌生长、促进钙的吸收以及改变骨骼肌纤维成分等生理功能[5-6]。此外,L-阿拉伯糖也是一种重要的医药中间体,用来合成抗癌、抗病毒和治疗心脑血管疾病的药物,还可以作为生化试剂用于细菌培养基的制备,或进行香料的合成,广泛应用于食品、保健品和医药领域,是备受关注的新型功能糖[7]。纤维素乙醇是先进生物燃料(advanced biofuels)的典型代表,亦是最有前景的石化燃料替代品之一[8],与以淀粉质原料为主生产的第一代燃料乙醇相比具有诸多优势,是燃料乙醇规模化、可持续发展的方向。
酿酒酵母(Saccharomyces cerevisiae)对葡萄糖和木糖的高效同步共发酵可提高发酵液中乙醇浓度和生产速率,普遍被认为是降低纤维素乙醇生产成本的有效措施。另外,除了原料预处理、纤维素酶等占据主要生产成本外,木质纤维素原料本身的成本也日益凸显。若寻找一种能提供部分碳源同时提供丰富氮源的原料添加至木质纤维素酶解液中进行补料分批发酵,则可降低原料及氮源成本从而进一步降低纤维素乙醇生产成本,对其规模化生产具有积极意义。大豆渣在提取L-阿拉伯糖之后,尚存在丰富的纤维素、蛋白质等成分,利用纤维素酶及蛋白酶对其进行水解后,理论上可为酿酒酵母发酵提供丰富的氮源以及碳源补充,从而提高纤维素乙醇的产量和生产效率。
本研究从大豆渣成分分析入手,确定了大豆渣中L-阿拉伯糖、葡萄糖及蛋白质等含量;进一步以硫酸浓度、料液比和水解温度等为考察指标,通过单因素试验探索合适的酸水解工艺,优化大豆渣原料提取L-阿拉伯糖的条件;利用课题组前期构建的葡萄糖木糖共发酵酿酒酵母菌株LF1对稀酸预处理玉米秸秆酶解液(enzymatichydrolysateofcorn stover,EHCS)进行分批及补料分批发酵,通过在发酵过程中补加酸解大豆渣(acidolysis soybean dregs,ASD)及酶解大豆渣(enzymolysis soybean dregs,ESD),验证大豆渣中丰富碳源、蛋白及微量元素对提高纤维素乙醇产量、降低发酵培养基成本的可行性,初步建立大豆渣辅助玉米秸秆酶解液发酵产乙醇的工艺路线。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及样品
酿酒酵母(Saccharomyces cerevisiae)LF1:课题组前期通过代谢工程及进化工程策略构建选育得到[9];大豆渣(干基含水量为10.21%):由山东大学药学院娄红祥教授馈赠;稀酸预处理玉米秸秆酶解液(EHCS):由华东理工大学鲍杰教授馈赠[10]。
1.1.2 化学试剂
酵母膏、蛋白胨(均为生化试剂):英国OXOID公司;中温α-淀粉酶(5 000 U/mL)、糖化酶(10万U/mL)、纤维素酶(20万U/mL)、酸性蛋白酶(10万U/g):山东隆大生物工程有限公司;甲基异丁基甲酮(methyl isobutyl ketone,MIBK)(纯度>99.5%):美国Sigma公司;葡萄糖(纯度>99.8%)、木糖(纯度>98.0%)、木糖醇(纯度>99.5%)、甘油(纯度>99.0%)、乙酸(纯度>99.5%)、乙醇(纯度>99.7%)、半乳糖(纯度>99.0%)、L-阿拉伯糖(纯度>98.0%)、甘露糖(纯度>98.0%)、纤维二糖(纯度>98.0%):上海生工生物工程股份有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母浸出粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,115℃灭菌30 min。固体YEPD培养基灭菌前添加琼脂粉至20 g/L。
EHCS-YP培养基:添加KH2PO4、(NH4)2SO4、MgSO4至EHCS中,至终质量浓度分别为2 g/L、2 g/L和1 g/L;同时添加酵母浸出粉至10 g/L,蛋白胨至20 g/L;pH值调节至4.8,115℃灭菌20 min。
EHCS-Urea培养基:添加KH2PO4、(NH4)2SO4、MgSO4至ESCS中,至终质量浓度分别为2 g/L、2 g/L和1 g/L;同时添加尿素(urea)至终质量浓度5 g/L,以部分代替酵母膏和蛋白胨提供发酵氮源;pH值调至4.8,115℃灭菌20 min。
1.2 仪器与设备
LC-20A高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;Milli-Q Advantage A10超纯水系统:美国Millipore公司;ZWYR-D2403多功能智能三叠加摇床:上海智诚分析仪器制造有限公司;KH-300SPV超声波清洗机:昆山禾创超声以期有限公司;BSA124S-CW分析天平、PB-10酸度计:赛多利斯科学仪器(北京)有限公司;DK-8B恒温水浴槽、DHG-9140A鼓风干燥箱:上海精宏实验设备有限公司;D30核酸蛋白测定仪:艾本德中国有限公司;Fresco17台式高速离心机:赛默飞世尔科技中国有限公司;L-8900全自动氨基酸分析仪:日本日立公司;HG63卤素水分测定仪:瑞士梅特勒-托利多公司。
1.3 方法
1.3.1 分析检测
(1)大豆渣含水量及灰分测定
取粒度较均匀的大豆渣3份,每份质量约0.8~1.0 g,采用卤素水分测定仪依次测定样品的含水量,取其平均值得到大豆渣的含水量[11];灰分测定参照国标GB 5009.4—2010《食品中灰分的测定》[12]。
(2)大豆渣粗脂肪及木质素含量检测
粗脂肪的测定参照国标GB 5009.6—2016《食品中脂肪的测定》中的索氏抽提法[13-15];木质素含量的测定参照HYMAN D等[16-17]方法。
(3)大豆渣总蛋白及氨基酸组成分析
采用凯氏定氮法[18-19]及全自动氨基酸分析仪[20-21]分别测定大豆渣中总蛋白及氨基酸含量。
(4)大豆渣总糖及淀粉含量测定
参照美国国家可再生能源实验室(national renewable energylaboratory,NREL)方法采用高效液相色谱测定大豆渣强酸水解液中葡萄糖、木糖、半乳糖、L-阿拉伯糖及甘露糖等的含量,并计算得到大豆渣总糖(包括淀粉、纤维素、半纤维素及可溶性大豆多糖)含量[17];参照国标GB 5009.9—2016《食品中淀粉的测定》[22]进行大豆渣淀粉含量的测定。色谱条件为:Bio-RadAminexHPX-87P离子交换柱(300mm×7.8 mm),流动相为超纯水,流速为0.6 mL/min,柱温78℃,进样量为10 μL,采用RID-20A示差折光检测器(refractive index detector,RID)进行检测[9,23]。
(5)EHCS糖分分析
EHCS经固液分离,固相和液相组分分别经强酸彻底水解后,经高效液相色谱检测葡萄糖、木糖、半乳糖、L-阿拉伯糖及甘露糖等含量。
1.3.2 L-阿拉伯糖提取条件优化
将大豆渣分别与0.3mol/L、0.4mol/L、0.5mol/L、0.7mol/L和1.0 mol/L的稀硫酸溶液,按照料液比1∶5、1∶10、1∶20、1∶30、1∶50(g∶mL)混匀,在80 ℃、90 ℃、100 ℃、110 ℃、120 ℃条件下处理45 min,以水解液中L-阿拉伯糖含量为评价指标,探索L-阿拉伯糖提取的最佳条件。
1.3.3 ASD及ESD制备
在最优L-阿拉伯糖酸提取条件下处理大豆渣,之后进行固相和液相分离。固相组分经水洗至中性后自然风干,得到酸解大豆渣ASD;固相组分pH值调节至酸性蛋白酶最适范围2.5~3.5,按照0.22g/100g比例添加酸性蛋白酶,50r/min、40℃条件下反应24 h,随后将全部酶解产物自然风干后,得到酶解大豆渣ESD。
1.3.4 酵母菌种制备及补料分批发酵
菌种制备:挑取YEPD固体平板上LF1菌落至2mLYEPD液体培养基中活化24 h后,以10%接种量转接至含有5%(V/V)EHCS的YEPD液体培养基中继续培养12 h,离心收集菌体作为发酵菌种。
发酵条件:以EHCS-YP为主培养基进行分批发酵及在发酵过程中补加ASD进行补料分批发酵作为对照组;以EHCS-Urea为主培养基,在发酵过程中补加ESD为实验组进行补料分批发酵。发酵在100 mL限氧摇瓶中进行,发酵温度30℃,转速200 r/min,发酵底物EHCS的pH值调节至4.8,初始接种量为0.5 g/L细胞干质量[9],在发酵6 h、12 h、24 h和36 h分别补加1.8 g ASD或1.8 g ESD(绝干质量),同时按100 μL/g添加纤维素酶,定期取样进行底物及代谢产物分析。
1.3.5 发酵底物及代谢产物分析
发酵样品经离心(10 000 r/min、10 min)去除沉淀,用0.22μm微孔滤膜过滤,高效液相色谱法检测样品中底物和代谢产物浓度,包括葡萄糖、木糖、木糖醇、甘油、乙酸、乙醇等。色谱条件:Bio-Rad Aminex HPX-87H离子交换柱(300 mm×7.8 mm),流动相为5 mmol/L稀H2SO4,流速0.6 mL/min,柱温45℃,进样量为10 μL,RID-20A型示差折光检测器。
2 结果与分析
2.1 大豆渣成分分析及玉米秸秆水解液糖分分析
大豆渣含水量为10.21%,其灰分、粗脂肪、木质素、蛋白质、总糖等成分检测结果见表1,氨基酸种类及含量测定结果见表2,大豆渣总糖及淀粉含量检测结果见表3。稀酸预处理玉米秸秆酶解液(EHCS)的糖分分析见表4。
表1 大豆渣成分分析
Table1 Component analysis of soybean dreg
?
由表1可知,基于大豆渣干质量计算得出,灰分、粗脂肪、蛋白质、木质素及总糖含量分别为6.76%、3.43%、24.11%、8.20%和54.71%。
表2 大豆渣氨基酸含量
Table2 Amino acid content in soybean dreg
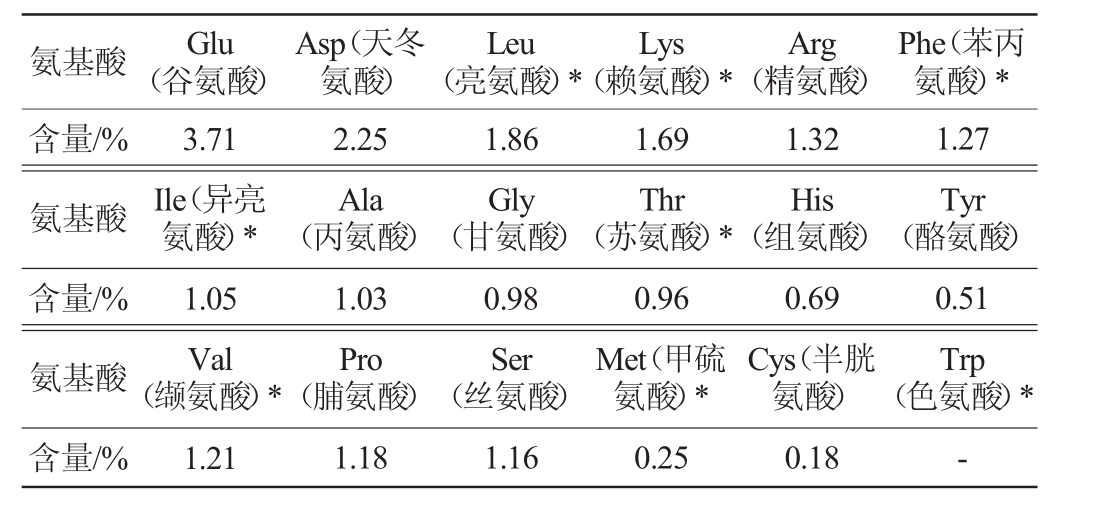
注:“*”表示必需氨基酸,“-”表示未检出。
?
由表2可知,除天冬酰胺、谷氨酰胺外,共检测了大豆渣中18种游离氨基酸,其中8种人体必需氨基酸的含量(基于大豆渣干质量计算)分别为苏氨酸0.96%、缬氨酸1.21%、甲硫氨酸0.25%、异亮氨酸1.05%、亮氨酸1.86%、苯丙氨酸1.27%、赖氨酸1.69%、色氨酸未检测出。
表3 大豆渣糖类及淀粉含量
Table3 Saccharide and starch contents in soybean dreg
?
由表3可知,大豆渣中葡萄糖、木糖、半乳糖、L-阿拉伯糖及甘露糖等单糖残基含量(基于大豆渣干质量计算)分别为16.38%、4.71%、18.82%、10.48%和4.32%。淀粉约占大豆渣干质量的3.23%。结果表明,大豆渣中L-阿拉伯糖含量丰富,以其为原料提取L-阿拉伯糖是可行的。
表4 EHCS固相及液相糖分析
Table4 Sugar analysis of solid and liquid phase of EHCS

注:A:EHCS固形物经强酸彻底水解后糖分分析;B:EHCS上清液糖分分析;C:EHCS上清液经强酸彻底水解后糖分分析;“-”表示未检出。
?
由表4可知,EHCS上清液经强酸彻底水解后,葡萄糖和木糖质量浓度都有显著提高,其中葡萄糖提高了约17%,由131.9g/L提高至154.0g/L,木糖由12.61g/L提高至25.35g/L,提高了约101%,说明在EHCS液相部分中尚存在一定量的低聚葡萄糖和低聚木糖等组分;此外,EHCS固形物含有约9%的葡萄糖组分,若在发酵体系中经完全酶解,理论上可提供约19.8 g/L葡萄糖,可为后续发酵提供充足碳源。
2.2 大豆渣提取L-阿拉伯糖条件优化
稀酸法是木质纤维素预处理过程比较常用且成熟的方法之一[24],采用稀硫酸对大豆渣进行预处理,初步探索了不同稀硫酸浓度、料液比及处理温度对L-阿拉伯糖提取效率的影响。
2.2.1 稀硫酸浓度对L-阿拉伯糖提取的影响
将大豆渣分别与0.3mol/L、0.4mol/L、0.5mol/L、0.7mol/L和1.0 mol/L的稀硫酸溶液配制成料液比为1∶50(g∶mL)的酸水解体系,在120℃条件下对大豆渣处理45 min,以水解液中L-阿拉伯糖含量为评价指标,初步探索不同浓度稀硫酸对大豆渣中L-阿拉伯糖提取的影响,结果如图1所示。

图1 不同浓度稀硫酸对L-阿拉伯糖提取的影响
Fig.1 Effect of different dilute sulfuric acid concentration on L-arabinose extraction
如图1所示,在120℃条件下,随稀硫酸浓度的增加,L-阿拉伯糖浓度及得率随之呈现先增加随后降低的趋势。在0.3~0.5 mol/L稀硫酸浓度下,L-阿拉伯糖质量浓度及得率随着稀硫酸浓度的增大而增大;并在稀硫酸浓度为0.5 mol/L时,水解液L-阿拉伯糖质量浓度及得率达到最大值;然而,继续增加硫酸浓度之后,L-阿拉伯糖质量浓度及得率随之下降。L-阿拉伯糖浓度降低与其在较高的硫酸浓度下被进一步降解为醛类化合物有关。因此,选择稀硫酸浓度0.5 mol/L为宜。
2.2.2 料液比对L-阿拉伯糖提取的影响
采用0.5 mol/L的稀硫酸在120℃条件下对大豆渣进行预处理,进一步探索不同料液比条件(1∶5、1∶10、1∶20、1∶30、1∶50(g∶mL))对L-阿拉伯糖提取的影响,结果如图2所示。

图2 不同料液比对L-阿拉伯糖提取的影响
Fig.2 Effect of different solid-liquid ratio on L-arabinose extraction
如图2所示,料液比在1∶50~1∶5(g∶mL)时,随着底物中大豆渣质量浓度逐渐增加,水解液中L-阿拉伯糖含量也随之逐渐增加;L-阿拉伯糖得率在料液比为1∶10(g∶mL)时达到最大值0.119g/g大豆渣。而继续增加料液比至1∶5(g∶mL),酸水解液中L-阿拉伯糖质量浓度达到最大值21.008 g/L,得率略微下降至0.117 g/g大豆渣。考虑L-阿拉伯糖浓度高有利于简化下游纯化工艺,同时高的料液比可以大大节约硫酸成本、用水成本及提高了设备使用效率。因此,选择料液比1∶5(g∶mL)为宜。
2.2.3 水解温度对L-阿拉伯糖提取的影响
在料液比1∶5(g∶mL),酸度为0.5 mol/L,水解时间为45 min条件下,选择120℃、110℃、100℃、90℃、80℃条件对大豆渣进行酸水解预处理,结果如图3所示。

图3 不同水解温度对L-阿拉伯糖提取的影响。
Fig.3 Effect of different hydrolysis temperature on L-arabinose extraction
如图3示,水解温度由120℃降至100℃,L-阿拉伯糖含量及得率缓慢下降,而水解温度从100℃逐渐降至80℃时,L-阿拉伯糖质量浓度及得率出现快速下降。综合L-阿拉伯糖得率及水解工艺复杂性和能耗。因此,水解温度100℃为宜。
2.3 补料分批发酵
为探寻在发酵过程中补加大豆渣能否为纤维素乙醇生产提供氮源及额外的碳源,从而提高纤维素乙醇产量。以EHCS-YP为主培养基进行分批发酵及在发酵过程中补加ASD进行补料分批发酵作为对照组;以EHCS-Urea为主培养基,在发酵过程中补加ESD为实验组进行补料分批发酵,结果见图4。EHCS分批和补料分批发酵乙醇产量结果见表5。

图4 EHCS补料分批发酵对葡萄糖、木糖及乙醇产量的影响
Fig.4 Effect of fed-batch fermentation of EHCS on glucose,xylose and ethanol production
表5 EHCS分批和补料分批发酵中乙醇得率
Table5 Ethanol yields in ESCS by batch and fed-batch fermentation

注:a:发酵结束(64 h)乙醇质量浓度(g·L-1);b:基于总糖的乙醇得率;c:基于消耗糖的乙醇得率。
?
如图4A所示,酿酒酵母LF1接种至EHCS-YP培养基,补加ASD及纤维素酶,发酵64 h时产生约114 g/L乙醇,基于总糖及消耗糖的乙醇得率分别为0.406 g/g和0.493 g/g。
如图4B所示,酿酒酵母LF1接种至EHCS-Urea培养基,补加ESD及纤维素酶,至发酵64h产生约110 g/L乙醇,基于总糖及消耗糖的乙醇得率分别为0.402 g/g和0.503 g/g。
由表5可知,无论补加ASD或ESD,发酵结束乙醇产量与EHCS-YP培养基分批发酵相比,都有明显提高,乙醇产量分别增加了约34g/L和30g/L,说明补料ASD或ESD给EHCS为底物的纤维素乙醇发酵提供了额外的碳源,从而显著增加了乙醇的产量。
在EHCS-Urea培养基中进行补料分批发酵,乙醇产量、得率均达到以丰富氮源(酵母膏、蛋白胨)为基础的发酵水平,说明ESD中丰富的氨基酸为发酵过程提供了充足的氮源,尿素和ESD补料相结合可以替代成本较高的酵母膏和蛋白胨,降低纤维素乙醇工业化生产成本。
补料分批发酵过程中,木糖消耗速率明显低于葡萄糖消耗速率,且木糖浓度在24 h后均出现升高的趋势,分别由约6.7 g/L增加至18.1 g/L(见图4A)和20.2 g/L(见图4B);同时,补料ASD或ESD后,酶解产生的葡萄糖未能被及时消耗,发酵液中葡萄糖也出现一定程度的积累,如图4A所示,葡萄糖由3.5 g/L增加至发酵结束的28.4 g/L。结果表明,由于葡萄糖的存在降低了酿酒酵母菌株LF1对木糖的利用,尤其在EHCS中抑制物存在下,这种抑制作用更加明显[25];此外,葡萄糖对木糖利用的后继效应[26]以及酵母菌株自身活性的降低也导致了发酵后期葡萄糖和木糖的积累。上述问题的存在降低了纤维素乙醇的产量和生产效率,后期需要通过代谢工程结合进化工程及发酵过程控制等手段进一步提高酿酒酵母菌株对抑制物的耐受性以及在抑制物存在条件下葡萄糖和木糖的共代谢能力。
3 结论
本研究大豆渣中葡萄糖、半乳糖、L-阿拉伯糖和蛋白质含量分别为16.4%、18.8%、10.5%、24.1%。从大豆渣成分分析入手,进行L-阿拉伯糖提取条件优化的单因素试验,且综合考虑能耗、硫酸及水用料成本、以及设备利用率,选择大豆渣与0.5 mol/L稀硫酸按照料液比1∶5(g∶mL)混匀并在100℃条件下水解45 min为大豆渣提取L-阿拉伯糖的最佳条件,在此条件下,L-阿拉伯糖质量浓度为21.0g/L。EHCS发酵补料ASD或ESD,乙醇产量均可达到110g/L以上,比分批发酵乙醇产量提高了37%,说明无论酸解大豆渣ASD或是其经蛋白酶酶解后的ESD都可以为纤维素乙醇的发酵提供额外的碳源,且ESD提供的氮源等营养物能够与酵母膏蛋白胨相媲美,在一定程度实现对酵母膏和蛋白胨的替代,有效节约发酵成本,对纤维素乙醇的经济有效生产具有重要意义。
[1]江连洲.大豆加工新技术[M].北京:化学工业出版社,2016:1-10.
[2]赵影,韩建春,郑环宇,等.豆渣深加工及综合利用的研究现状[J].大豆科学,2013,32(4):555-560.
[3]董英.大豆渣营养价值及其综合利用[J].粮食与油脂,2001(12):41-42.
[4]桂雨豪.水压热法制备水溶性大豆多糖与其应用研究[D].广州:华南理工大学,2016.
[5]KAATS G R,KEITH S C,KEITH P L,et al.A combination of L-arabinose and chromium lowers circulating glucose and insulin levels after an acute oral sucrose challenge[J].Nutr J,2011,10(1):42.
[6]郑敏.玉米皮中L-阿拉伯糖的制备工艺的研究[D].天津:天津科技大学,2012.
[7]袁其朋,王乐,范晓光,等.一种清洁高效的制备木糖与L-阿拉伯糖的生产工艺:CN102286571B[P].2014-04-02.
[8]GAO J, FENG H, YUAN W, et al. Enhanced fermentative performanceunder stresses of multiple lignocellulose-derived inhibitors by overexpressionof a typical 2-Cys peroxiredoxin from Kluyveromyces marxianus [J].Biotech Biofuels, 2017, 10(1): 79.
[9]LI H, SHEN Y, WU M, et al. Engineering a wild-type diploid Saccharomycescerevisiae strain for second-generation bioethanol production[J].Bioresources Bioproc, 2016, 3(1): 51.
[10]ZHANG H, LIU G, ZHANG J, et al. Fermentative production of hightiter gluconic and xylonic acids fromcorn stover feedstock by Gluconobacteroxydans and techno-economic analysis[J]. Bioresource Technol, 2016,219: 123-131.
[11]WANG G,THOMPSON M R,LIU Q.Controlling the moisture absorption capacity in a fiber-reinforced thermoplastic starch using sodium trimetaphosphate[J].Ind Crop Prod,2012,36(1):299-303.
[12]中华人民共和国国家卫生和计划生育委员会.GB 5009.4—2010食品中灰分的测定[S].北京:中国标准出版社,2010.
[13]苗霖兴,苗佳.大豆粗脂肪含量测定中影响因素的分析[J].粮食科技与经济,2011,36(3):42-42.
[14]韦芳三,李纯厚,戴明,等.索氏提取法测定海洋微藻粗脂肪含量及其优化方法的研究[J].上海海洋大学学报,2011,20(4):619-623.
[15]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.6—2016食品中脂肪的测定[S].北京:中国标准出版社,2008.
[16]HYMAN D,SLUITER A,CROCKER D,et al.Determination of acid soluble lignin concentration curve by UV-vis spectroscopy[J].Natl Renew Energ Lab Anal Proced,2008:1-13.
[17]谭丽萍.油棕空果壳预处理、糖化发酵生产乙醇及预处理机制的研究[D].济南:山东大学,2015.
[18]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.5—2016食品中蛋白质含量的测定[S].北京:中国标准出版社,2010.
[19]CHROM V,VINKLÁRKOVÁ B,ŠPRONGL L,et al.The Kjeldahl method as a primary reference procedure for total protein in certified reference materials used in clinical chemistry.I.A review of Kjeldahl methods adopted by laboratory medicine[J].Crit Rev Anal Chem,2015,45(2):106-111.
V,VINKLÁRKOVÁ B,ŠPRONGL L,et al.The Kjeldahl method as a primary reference procedure for total protein in certified reference materials used in clinical chemistry.I.A review of Kjeldahl methods adopted by laboratory medicine[J].Crit Rev Anal Chem,2015,45(2):106-111.
[20]齐建双,铁双贵,韩小花,等.氨基酸分析仪法快速测定玉米籽粒中赖氨酸含量[J].中国农学通报,2014,30(30):199-202.
[21]黄晓荣,张良晓,李培武,等.黑芝麻和白芝麻中氨基酸组成的比较研究[J].中国油料作物学报,2017,39(1):123.
[22]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.9—2016食品中淀粉的测定[S].北京:中国标准出版社,2016.
[23]WANG C,BAO X,LI Y,et al.Cloning and characterization of heterologous transporters in Saccharomyces cerevisiae and identification of important amino acids for xylose utilization[J].Metab Eng,2015,30:79-88.
[24]SAHOO D,UMMALYMA S B,OKRAM A K,et al.Effect of dilute acid pretreatment of wild rice grass(Zizania latifolia)from Loktak Lake for enzymatic hydrolysis[J].Bioresource technol,2018,253:252-255.
[25]LI H,SCHMITZ O,ALPER H S.Enabling glucose/xylose co-transport in yeast through the directed evolution of a sugar transporter[J].Appl Microbiol Biot,2016,100(23):10215-10223.
[26]WEI S,LIU Y,WU M,et al.Disruption of the transcription factors Thi2p and Nrm1p alleviates the post-glucose effect on xylose utilization in Saccharomyces cerevisiae[J].Biotech Biofuels,2018,11(1):112.