发酵酒精生产工业主要是以粮谷为主要原料(如玉米、高粱、薯类和糖蜜等[1])。相比于其他粮食作物,利用玉米生产酒精有许多优点[2]:(1)玉米产量大,价格低廉;(2)玉米生产出的酒精品质高于其他粮食作物,对人体有害的副产物(如甲醇、异丁醇含量)较少;(3)玉米酒糟污染易于解决:玉米酒糟干燥后直接作为动物干饲料,蛋白含量丰富[3]。在中国,玉米酒精是优质食用酒精的重要来源。
氧化还原电位(oxidation-reduction potential,ORP)用来反映水溶液中所有物质表现出来的宏观氧化-还原性。氧化还原电位越高,氧化性越强;电位越低,氧化性越弱。电位为正表示溶液显示出一定的氧化性,为负则说明溶液显示出还原性[4-5]。
微生物的大多代谢由多种多样的氧化还原反应组成,氧化还原电位对微生物的生长繁殖及存活有很大影响,不同的微生物对生长环境的氧化还原电位有不同的要求[6]。近十年来,氧化还原电位控制发酵条件,增加目标产物的生成,减少副产物积累逐渐引起关注,已被应用于乙醇、丁二酸、琥珀酸、乳酸等发酵过程优化中[7-11]。但将ORP应用于乙醇发酵优化研究中,局限于酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[7-8];利用玉米酒精浓醪发酵的优化研究还鲜有报道。本试验利用玉米酒精浓醪作为培养基,进行乙醇发酵研究,探寻最优氧化还原电位条件,更接近酒精实际生产,为发酵酒精工业的过程控制提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1菌种
安琪超级酿酒高活性干酵母:安琪酵母股份有限公司。
1.1.2 试剂
玉米醪:[干玉米粉(淀粉含量60%~62%,水分含量12%),料液比1∶2(g∶mL),经糖化处理,总糖含量23 °Bx,初始pH=4.1]:资中县银山鸿展工业有限责任公司。
1.1.3 化学试剂
3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):厦门海标科技有限公司;甘油三酯试剂盒:南京建成生物工程研究所;0.1%次甲基蓝指示剂:上海展云化工有限公司;葡萄糖(生化试剂):成都科隆化学品有限公司。试验所用其他化学试剂均为国产分析纯。
1.2 仪器与设备
BIOTECH-5BG离位灭菌玻璃发酵罐:上海保兴生物设备有限公司;SIN-PH160P ORP控制器:深圳联测仪表有限公司;T4805-60-P-PAORP电极:瑞士MettlerToledo公司;DH-30空气压缩机:惠州市德鸿空气压缩机有限公司;GSCC9SA-BB26流量控制器:瑞士Vögtlin设备公司;17805E Midisart 2000过滤器:德国Sartorius公司;QT08-LM79-J3酒精计:北京北信未来电子仪器有限公司;EX-ZNHW数显恒温型电热套:上海力辰邦西仪器科技有限公司;UV-2450紫外可见分光光度计:日本岛津公司;DK-8D数显恒温水浴锅:金坛市医疗仪器厂;JA1003分析天平:上海天平仪器厂。
1.3 方法
1.3.1 ORP控制策略
发酵罐装配温度电极、pH电极、ORP实时监测系统(包括ORP控制器和ORP电极)、循环冷却水系统、无菌空气进出系统和玻璃转子流量控制仪。通过发酵罐控制器将气体流量计和ORP实时监测系统相关联,控制通气量将ORP值控制在预设水平。在不控制的乙醇发酵过程中,ORP值最低能够降至-150 mV以下,因此将氧化还原电位值控制3个水平:-50 mV、-100 mV、-150 mV,以不控制氧化还原电位的发酵作为对照组。发酵初始阶段停止通气,当ORP值降到设定值以下时,控制器开启气泵以0.8 L/min的速度泵入空气,提升ORP直至设定值。
1.3.2 发酵方法
取4 g干酵母粉,置于40 mL的2%葡萄糖溶液中活化2 h,温度32℃。将活化液接种于装有4 L玉米醪的5 L发酵罐中,温度28℃,发酵时间为48 h。
1.3.3 分析方法
菌体数量:血球计数板法[12]。
细胞存活率:使用0.1%亚甲基蓝染色细胞,染色5 min,在显微镜下观测细胞,存活率为未被染色的细胞数目与总细胞数目的比值。
乙醇测定:取发酵醪液100 mL于500 mL蒸馏瓶中加入150 mL蒸馏水,采用常压蒸馏,馏出液用100 mL量筒收集,置数分钟,待酒中气泡消失后,放入酒精计,同时插入温度计,平衡约5 min,水平观测,读取与弯月面相切处的刻度值,同时记录温度[13]。
葡萄糖质量浓度测定:DNS法[14];甘油含量测定:甘油三酯试剂盒。
1.3.4 计算公式
糖醇转化率是生成乙醇的量与消耗葡萄糖的量的比值,其计算公式如下:
式中:Yp/s为糖-醇转化率,%;ΔP为生成乙醇的量,g/L;ΔS为消耗葡萄糖的量,g/L。
发酵效率为糖醇转化率与理论糖醇转化率的比值,其计算公式如下:
式中:η为发酵效率,%;Yp/s为糖醇转化率,%;0.511为理论糖醇转化率,%。
乙醇生成速率为单位时间内乙醇的增量,反映乙醇生成的快慢,其计算公式如下:
式中:Pro为乙醇生成速率,g/(L·h);ΔP为生成乙醇的量,g/L。Δt为时间的变化量,h。
1.3.5 数据处理
每个ORP水平(-50 mV、-100 mV、-150 mV、对照)均重复试验6次进行分析,得到的数据经SPSS Duncun运算分析后,绘制图表。
2 结果与分析
2.1 氧化还原电位曲线变化特点
在装有4 L玉米醪的5 L发酵罐中,用ORP电极对发酵过程中的氧化还原电位变化进行实时监控,每隔1 h采集一次ORP值;每个ORP水平(-50mV、-100mV、-150mV、对照)均重复试验6次,取平均值,结果见图1。
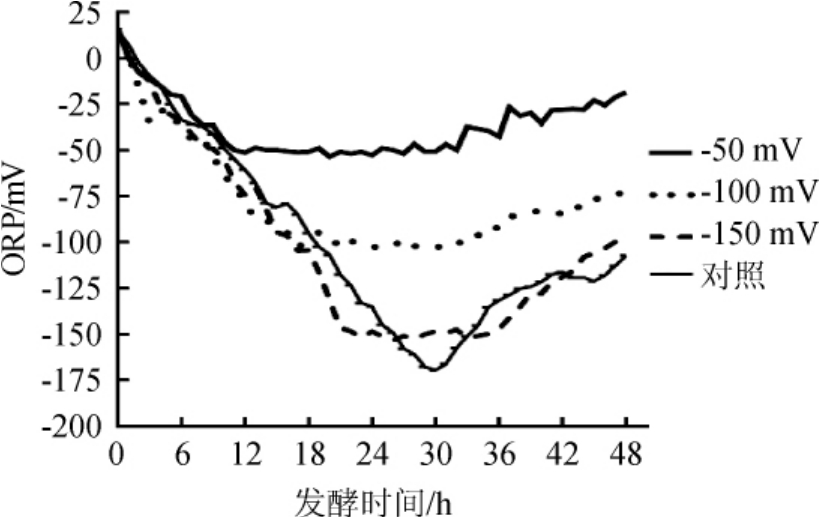
图1 发酵过程中氧化还原电位变化曲线
Fig.1 Variation curve of oxidation-reduction potential during fermentation process
由图1可知,根据氧化还原电位变化的趋势,将乙醇发酵过程分为ORP下降期、ORP稳定期、ORP上升期。在ORP下降期,由于酵母细胞处于迟缓期和对数期,细胞的快速生长消耗发酵液中的溶氧和发酵液上方的空气,同时产生烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH),造成了ORP值的迅速下降;当ORP值下降至设定值时,进入ORP稳定期,此时控制系统开启,通过向发酵罐通入适量的空气,将ORP值维持在设定值附近。酵母细胞处于对数增长的后期和稳定期;在ORP上升期,因为发酵后期乙醇的积累和葡萄糖的消耗殆尽,酵母细胞进入衰亡期,NADH积累减少,ORP值逐步上升,ORP调控结束。利用传统的酵母浸出粉胨葡萄糖(YPD)培养基进行乙醇发酵时,氧化还原电位可下降至-200 mV以下[7-8]。由于玉米醪成分的复杂性,发酵时氧化还原电位仅最低降至-176 mV。这可能是因为玉米中含有大量的亚油酸,具有酸性基团-COOH,容易被氧化,使玉米醪的氧化还原电位升高。
2.2 糖醇转化率和不同氧化还原电位调控的关系
每个ORP水平(-50 mV、-100 mV、-150 mV、对照)均重复试验6次,记录发酵起始的葡萄糖和乙醇含量的变化,取平均值进行分析,结果见表1。每隔8 h或者10 h取发酵液5 mL,离心5 min后,上清液用于测量葡萄糖含量变化;并用蒸馏法测量发酵完成乙醇生成量,结果见图2和图3。
表1 不同氧化还原电位下的糖醇转化率、发酵效率和乙醇生成速率
Table1 Conversion rate from sugar to ethanol,fermentation efficiency and the production rate of ethanol under different oxidation-reduction potential levels
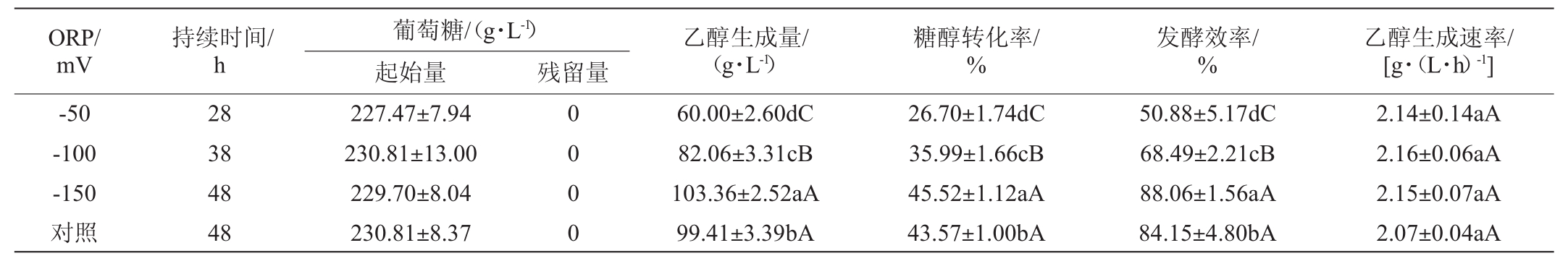
注:不同小写字母表示在P<0.05水平差异显著,不同大写字母表示在P<0.01水平差异显著。
?
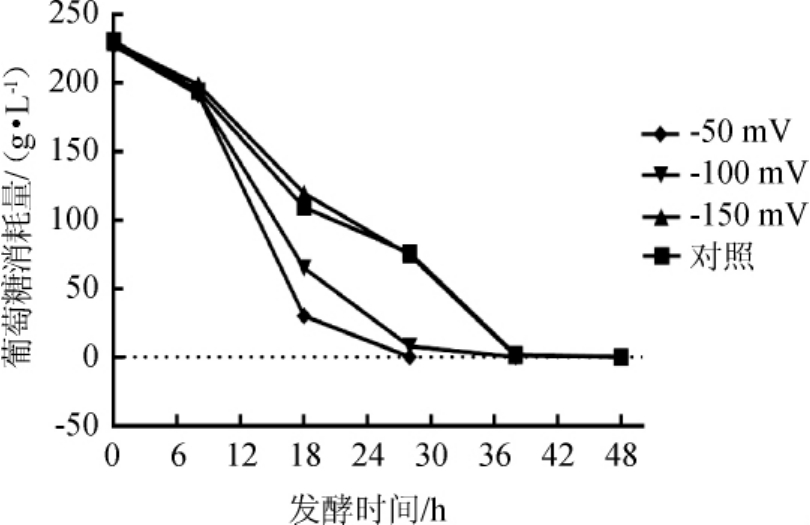
图2 发酵过程中不同氧化还原电位下葡萄糖的变化曲线
Fig.2 Variation curve of glucose under different oxidation-reduction potentials during fermentation process
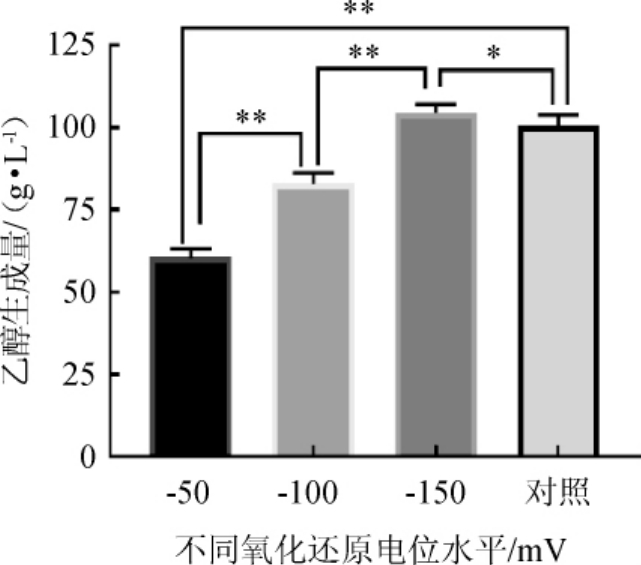
图3 发酵过程中不同氧化还原电位下的乙醇生成量
Fig.3 Ethanol production under different oxidation-reduction potentials during fermentation process
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
为了比较糖醇转化率,将葡萄糖最初消耗为0时设置为时间终点。由图2可知,在4种不同的ORP条件下,将葡萄糖耗尽的时间不同。由表1可知,当ORP控制值为-150 mV时,乙醇产量最高为103.36 g/L,分别为ORP值为-50 mV、-100 mV及对照的1.72倍、1.26倍、1.04倍。
由图3可知,4种不同的ORP条件下的乙醇产量均具有显著性差异(P<0.05)。且ORP值为-150 mV时,糖醇转化率和发酵效率高于其他三组,为45.52%和88.06%。ORP控制值为-50 mV时,乙醇产量、糖醇转化率、发酵效率均最低,说明高溶氧水平导致糖酵解途径被抑制,乙醇产量降低。当ORP控制值为-100 mV时,乙醇生成速率最高,为2.16 g/(L·h),与ORP控制值为-150 mV的乙醇生成速率[2.15 g/(L·h)]相差较小(P>0.05)。因此,将ORP值控制在-150mV时,糖醇转化率、发酵效率及乙醇生产速率均为最佳,分别为45.52%、88.06%、2.15 g/(L·h),对玉米发酵熟醪利用最好。糖醇转化率是衡量淀粉质原料酒精发酵成绩好坏的指标之一,其高低与原料消耗有直接关系。对于发酵酒精生产行业而言,利用ORP控制,可以提高酒精产率,减少原料损失。
2.3 甘油产量和不同氧化还原电位调控的关系
甘油是乙醇发酵的主要副产物。甘油作为细胞保护剂,可以调节渗透压,在缺氧、低温、高渗透压等逆境下,被细胞大量合成;同时甘油也被用于维持细胞内的氧化还原电位。细胞内过量的烟酰胺腺嘌呤二核苷酸[15-16]通过甘油合成消耗。甘油合成会消耗掉一部分糖分,影响糖醇转化率[17]。每个ORP水平(-50 mV、-100 mV、-150 mV、对照)均重复试验6次,每隔8 h或者10 h取发酵液5 mL,离心5 min后,上清液用于测量甘油含量变化,结果见图4。
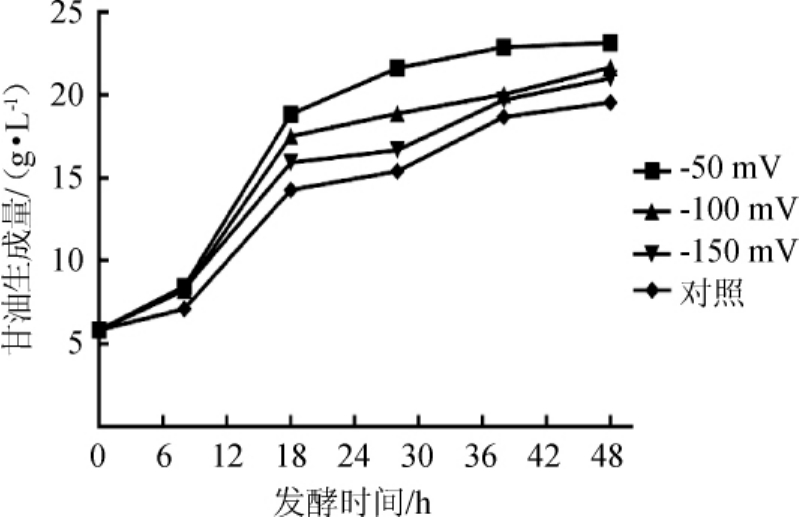
图4 发酵过程中不同氧化还原电位下甘油产量变化曲线
Fig.4 Variation curve of glycerol production under different oxidationreduction potentials during fermentation process
由图4可知,在不同的氧化还原电位控制条件下,甘油产量不同。当ORP控制值为-50 mV时,甘油产量最高,为23.13 g/L,分别为ORP值为-100 mV、-150 mV及对照的1.07倍、1.17倍、1.31倍。因此设定的ORP控制值越高,甘油的产量越高,且甘油在酒精发酵初期大量产生。原因可能如下两点:其一,在发酵初期酵母进行有氧呼吸,细胞内累积了大量的NADH,糖酵解途径的正常进行需要NAD+的再生。第一个是通过乙醇途径,第二个是通过甘油磷酸途径[18]。由于发酵初期缺少醇脱氢酶,NAD+的再生只能通过甘油磷酸途径;其二,发酵初期发酵液中糖质量浓度较高(约为230 g/L),产生高渗透压,磷酸甘油脱氢酶(glycerophosphate dehydrogenase,GPDH)响应高渗条件表达,以保护细胞免于脱水。而高ORP值意味着细胞有氧呼吸较为旺盛。
每个ORP水平(-50 mV、-100 mV、-150 mV、对照)均重复试验6次,每隔8 h或者10 h取发酵液5 mL,离心5 min后,上清液用于测量酵母数量变化,并结合甘油生成量进行对比,结果见图5。由图5可知,随着酵母细胞数量增加,甘油的产量也随之升高。在不同氧化还原电位条件下,甘油的产量从发酵起始点的5.8 g/L分别增至23.13 g/L(-50 mV)、21.65g/L(-100mV)、21.00g/L(-150mV)、19.56g/L(对照);在发酵8~18 h内,酵母菌细胞的数量变化曲线急剧上升,而甘油的产量分别从8.46g/L(-50mV)、8.24g/L(-100mV)、8.32g/L(-150mV)、7.12g/L(对照)增至18.84 g/L(-50 mV)、17.52g/L(-100mV)、15.92g/L(-150mV)、14.29g/L(对照),因此对数期细胞甘油生成率最大。这可能是因为在对数期细胞生长旺盛,需要蛋白质、脂质大量合成,用于生长繁殖。

图5 发酵过程中不同氧化还原电位下酵母菌体数量与甘油产量的关系
Fig.5 Relationship between yeast number and glycerol production under different oxidation-reduction potentials during fermentation process
尽管甘油对细胞有保护作用,但是对于发酵酒精生产行业而言,甘油的产生降低了酒精产率,造成碳源浪费。因此,利用氧化还原电极监控发酵液中ORP,可以探寻一个最佳ORP位点,达到酒精产率的最合理化。
2.4 酵母细胞生长和不同氧化还原电位调控的关系
酵母细胞的数量对乙醇发酵至关重要。每个ORP水平(-50mV、-100 mV、-150 mV、对照)均重复试验6次,每隔8 h或者10 h取发酵液5 mL,离心5 min后,上清液用于测量酵母菌体数量变化,并计算存活率,结果见图6。
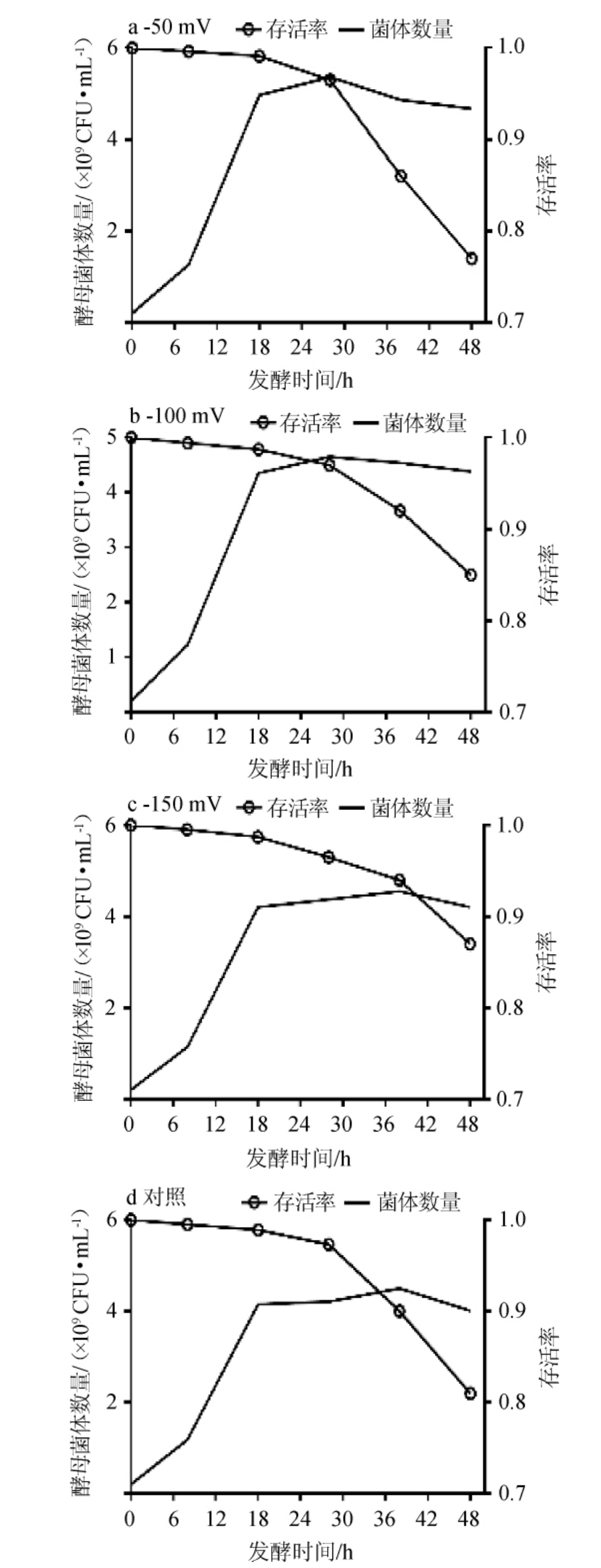
图6 发酵过程中不同氧化还原电位下酵母菌的菌体数量变化曲线
Fig.6 Variation curve of yeast number under different oxidationreduction potentials during fermentation process
由图6可知,在不同的氧化还原电位控制条件下,酵母细胞的数量不同。控制ORP的乙醇发酵,菌体数量均大于对照。设定的ORP值越高,控制系统通入更多的空气,这对发酵初期菌体生长有利,因此,酵母细胞数量越高。在不进行ORP控制的自然情况下,酵母的最高菌体数量最低,为4.50×109CFU/mL。当ORP控制值为-50 mV时,最高菌体数量达到了5.36×109CFU/mL,分别为ORP值为-100 mV、-150 mV、对照的1.15倍、1.18倍和1.19倍。
细胞存活率也是发酵的重要指标之一。对比不同氧化还原电位下的酵母存活率,结果见图7。
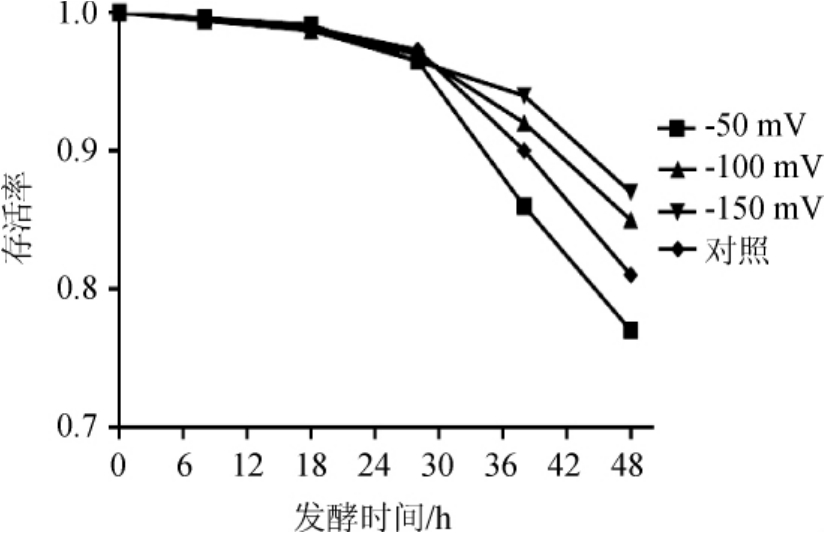
图7 发酵过程中不同氧化还原电位下的酵母存活率
Fig.7 Yeast viability under different oxidation-reduction potentials during fermentation process
由图7可知,当ORP控制值为-150 mV时,发酵终点的酵母细胞存活率最高,为0.87,分别为ORP值为-50 mV、-100 mV、对照的1.12倍、1.02倍、1.07倍。当ORP控制值为-50mV时,虽然其菌体数量最高,但存活率远低于其他三组。而ORP控制值为-100mV,其最高菌体数量虽然与ORP值为-150mV相近,其存活率却低于后者,说明过多的溶氧对于细胞存活有不利的影响。虽然发酵液中微量的溶氧可以提高酵母生物合成能力,保持细胞活性[19]。但同时,溶氧水平过高一方面会导致细胞在有氧生长过程中产生活性氧,如过氧化氢、超氧化物等,这些物质对细胞造成损伤、死亡和老化[20-21],一方面抑制糖酵解途径的活性,乙醇合成量减少[22]。所有试验组在发酵28 h后,菌体存活率下降,这可能是因为乙醇的累积,对细胞产生毒性。而ORP控制值为-50 mV时,存活率下降趋势最为剧烈。虽然在此条件下甘油产量最高,可以帮助酵母抵御逆境,但是可能因为葡萄糖的耗尽,使细胞缺少碳源,加上乙醇积累双重影响,造成细胞死亡。与传统的YPD培养基相比[7],利用玉米醪进行乙醇发酵,在相同时间点酵母细胞存活率更高,这可能意味着玉米醪更适合酵母细胞生长。
因此,对于发酵酒精生产行业而言,利用氧化还原电极可以精确检测发酵液中溶氧情况,同时适当控制ORP值,可以避免酵母细胞的过量生长,维持在高存活率状态。
3 结论
本试验首次将ORP控制运用于工厂玉米醪,监控乙醇发酵过程的酵母的菌体数量、存活率、糖醇转化率和甘油生成量变化。结果表明,ORP控制值越高,酵母菌体数量和甘油生成量越高,恰当的ORP值利于细胞存活率提升。在一定范围内,ORP控制值越低,糖醇转化率呈下降趋势,而控制值为-150 mV时,糖醇转化率最高。本试验的最佳ORP控制值为-150 mV。控制氧化还原电位,增加乙醇的生成,减少副产物积累,为发酵酒精工业提供思路。
[1]贾连平,王春才,张学峰,等.几种不同原料酒精的质量差异[J].酿酒,2004,31(6):27-29.
[2]石明亮,薛林,胡加如,等.玉米和特用玉米的营养保健作用及加工利用途径[J].化工科技,2011,17(2):66-71.
[3]王继艳,张显友,薄长凯,等.玉米燃料乙醇副产物酒糟及酒糟液高值化利用的研究现状[J].生物工程学报,2016,24(5):88-92.
[4]LIN Y H,HWANG S C J,GONG J T,et al.Using redox potential to detect microbial activities during clavulanic acid biosyn thesis in Streptomyces clavuligerus[J].Biotechnol Lett,2005,27(22):1791.
[5]SIZER I J.The activity of yeast invertase as a function of oxidation-reduction potential[J].J Gen Physiol,1942,25(3):399-409.
[6]BLACKSTONE N W J B.Redox control and the evolution of multicellularity[J].Bioessays,2015,22(10):947-953.
[7]喻扬,王永红,储炬,等.控制发酵过程氧化还原电位优化酿酒酵母乙醇生产[J].生物工程学报,2007,23(5):878-884.
[8]王娜,刘晨光,袁文杰,等.氧化还原电位控制下自絮凝酵母高浓度乙醇发酵[J].化工学报,2012,63(4):1168-1174.
[9]张泽.应用氧化还原电位调控拟干酪乳杆菌(Lactobacillus paracasei)发酵产乳酸过程[D].上海:华东理工大学,2011.
[10]张栩,吴又多,齐高相,等.氧化还原电位调控混合糖为底物的丁醇发酵[J].化工学报,2014,65(6):2225-2231.
[11]姜岷,李建,陈可泉,等.氧化还原电位调控对Actinobacillus succinogenes厌氧发酵产丁二酸的影响[J].化工进展,2008,27(8):1250-1253.
[12]张祥强.血球计数板法测定酵母数及出芽率时应注意的问题[J].啤酒科技,2007(7):30.
[13]陈丹丹,施炎炎,朱云,等.酒中乙醇浓度国标检测方法的改进[J].福建分析测试,2017,26(6):31-33.
[14]王俊丽,聂国兴,李素贞,等.DNS法测定还原糖含量时最适波长的确定[J].河南农业科学,2010,39(4):115-118.
[15]BAKKER B M,OVERKAMP K M,KTTER P,et al.Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae[J].Yeast,2001,25(1):15-37.
[16]VAN DIJKEN J P,SCHEFFERS W A J F M L.Redox balances in the metabolism of sugars by yeasts[J].Fems Microbio Lett,1986,32(3):199-224.
[17]ALFENORES,CAMELEYREX,BENBADISL,et al.Aeration strategy:a need for very high ethanol performance in Saccharomyces cerevisiae fed-batch process[J].Appl Microbiol Biotechnol,2004,63(5):537-542.
[18]NISSEN T L,KIELLAND-BRANDT M C,NIELSEN J,et al.Optimization of ethanol production in Saccharomyces cerevisiaeby metabolic engineering of the ammonium assimilation[J].Metab Eng,2000,2(1):69-77.
[19]李仁健.氧对啤酒的影响与减少氧化的措施[J].啤酒科技,2004(3):36.
[20]GIBSON B R,LAWRENCE S J,LECLAIRE J P,et al.Yeast responses to stresses associated with industrial brewery handling[J].Fems Microbiol Rev,2010,31(5):535-569.
[21]ESTRUCH F.Stress-controlled transcription factors,stress-induced genes and stress tolerance in budding yeast[J].Fems Microbiol Rev,2000,24(4):469-486.
[22]CHU J,LI Y R.Modern industrial fermentation regulation[M].Beijing:Chemical Industry Press:142-144.