酵母菌是一群单细胞的真核微生物,与人类的关系密切,是工业上最重要,应用最广泛的一类微生物,在酿造、食品、医药、工业等方面占有重要地位。我国白酒的发酵过程是依靠酒曲及环境中多种微生物共同作用的固态混合发酵过程,其中酵母菌在发酵过程中起主导作用[1]。开放的生产环境使得酵母菌在酿造过程中呈现了丰富的多样性,不同酵母菌的次级代谢产物也往往与酿造过程中呈香呈味物质紧密相关。
在牛栏山二锅头酿造过程中,酵母菌种类较多,如魏金旺[2]研究表明,牛栏山酿造过程中共有13种酵母菌参与,周森等[3]利用传统分离结合高通量测序计数确定了牛栏山二锅头中生香酵母和酿酒酵母在发酵前期数量快速增长的变化规律。目前,对于白酒中酵母菌挥发性代谢产物研究主要采用气相色谱(gas chromatography,GC)和气质联用技术(gaschromatography-massspectrometer,GC-MS),如杨强等[4]利用气相色谱从小曲酵母中筛选出2株产乙酸乙酯能力较强的酵母菌;王晓丹等[5]利用气质联用法筛选40株形态不同酵母菌,最终筛选出两株产酯能力较强的酵母。而在牛栏山酿造过程中,酒醅中的酵母菌在酿造过程中具体代谢能力及功能作用尚不明确。因此,本研究利用传统微生物分离方法,从牛栏山清香型白酒发酵酒醅中分离获得多种酵母菌,通过对其26S rDNA D1/D2区测序分析,对分离酵母菌进行鉴定,并利用高粱和酒醅两种培养基,模拟了酵母菌发酵过程,分别采用气相色谱(GC)和气质联用(GC-MS)分析不同种酵母菌可挥发性代谢产物,旨在获取不同酵母菌产香能力,解析牛栏山二锅头风味,为今后特色基酒开发及基酒质控提供一定理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
清香型白酒发酵酒醅:北京顺鑫农业股份有限公司牛栏山酒厂。
1.1.2 化学试剂
三氯甲烷、异丙醇、氯仿、醋酸钾、无水乙醇、葡萄糖(均为分析纯):北京化工厂;乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS):上海生工生物工程有限公司;蛋白胨、酵母膏、琼脂(均为生化试剂):国药集团化学试剂有限公司;α-淀粉酶(3 700 U/g):奥博星生物技术有限责任公司;糖化酶(10万U/g):江苏博立生物制品有限公司。
1.1.3 培养基
酵母分离培养基:酵母提取物10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂20 g/L,水1 L,115℃灭菌30 min,倒平板前加入20 mg/L氯霉素。
酵母浸出粉葡萄糖(yeastextractpeptonedextrose,YEPD)培养基:蛋白胨2%,酵母膏1%,葡萄糖2%,115℃灭菌30min,接菌前加入20 mg/L氯霉素。
高粱发酵培养基:高粱粉碎后按料水比1∶4(g∶mL)与水混匀,煮沸后纱布过滤去除液体,固体中加入液化酶,90℃保温1 h,随后冷却至60℃加入糖化酶,保温糖化2 h,搅拌均匀后,称取100g于500mL磨口三角瓶中,115℃灭菌30 min,接菌前加入1 mL无水乙醇[6]。
酒醅发酵培养基:称取大茬发酵3 d酒醅50 g于250 mL磨口三角瓶中,115℃灭菌30 min,接菌前加入1 mL无水乙醇。
1.2 仪器与设备
SC-1100ⅡA2型生物安全柜:北京东联哈尔仪器制造有限公司;C1000快速梯度基因扩增仪、PowerpacBasic基础型水平电泳仪、GelDoc XR+BIO-RAD全自动凝胶成像仪:美国Bio Rad公司;1-14k高速冷冻离心机:德国Eppendorf公司;SPX-320型生化培养箱:宁波江南仪器厂;KQ250DE数控超声波清洗机:昆山市超声仪器有限公司;7890B气相色谱仪、7890B-5977B气质联用仪:美国安捷伦公司。
1.3 方法
1.3.1 生香酵母分离
分离:分别取牛栏山清香型白酒发酵5d、7d、10d酒醅,按四分法混合取样后,称取10 g混合酒醅于90 mL无菌水混匀,拟定为10-1浓度,吸取1 mL于9 mL无菌水中,为10-2,依次稀释为10-3、10-4、10-5梯度。吸取不同梯度液0.1 mL,分别涂布分离培养基平板中,28℃培养24~48 h[7]。
筛选:根据酵母菌形态,随机挑取平板内形态差异较大酵母菌,挑取的菌落接种到YEPD培养基中,培养3 d后进行分子鉴定及甘油冻存[8-9]。
1.3.2 分子生物学鉴定
挑取少量活化的菌体,于已灭过菌的1.5 mL离心管内;加入100 μL裂解液(100 mmol/L Tris,30 mmol/L EDTA,0.5%SDS,pH8.0,115℃灭菌30min备用);100℃水浴15min;加入100 μL 2.5 mol/L的醋酸钾溶液,冰浴60 min;4℃条件下13 000 r/min离心5 min,取上清液200 μL至0.5 mL离心管中;加入等体积的氯仿-异戊醇(24∶1,V/V),剧烈振荡10min,13 000 r/min离心15 min,移取100 μL上清液至0.5 mL离心管中;加入100 μL预冷的异丙醇,混匀后-20℃条件下放置20 min;13 000 r/min离心15 min,弃去上清;用体积分数为70%的酒精洗涤沉淀两次;沉淀过夜自然干燥;加入50 μL已灭菌的超纯水,室温条件下溶解1 h,-20℃条件下备用。
对所提取脱氧核糖核酸(deoxyribonucleic acid,DNA)进行聚合酶链式反应(polymerase chain reaction,PCR)测序,测序引物及反应条件如表1所示。PCR产物送北京博迈德基因技术有限公司测序后,用Chromas软件分析测序质量,去除峰图不可靠的部分,用BioEdit软件对DNA正反向序列进行拼接和校正,校正后在美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation,NCBI)网站(http://www.ncbi.nlm.nih.gov/blast)中进行同源序列搜索,比较该菌株在序列上亲缘关系最近的已知信息,包括模式菌株与实验菌株的碱基差异,近缘模式菌株GenBank序列号,利用软件MEGA5.10对所有序列进行比对后,删除两端未对齐的碱基生成进化树,并进行1 000次的Bootstrap method检验。采用邻接(neighbor-joining,NJ)法显示进化树,判断待测菌株的分类地位[10]。
表1 PCR引物及反应条件
Table1 PCR primers and reaction conditions

?
1.3.3 酵母菌高粱发酵培养基产物挥发性物质测定
将鉴定的酵母菌活化后,接入液体富集培养基,30℃、120 r/min培养3 d,吸取1 mL培养液接入高粱发酵培养基中混匀,5 mL 2.61 mol/L H2SO4发酵栓封口,30℃静置培养5 d后,加入体积分数为60%的乙醇溶液400mL进行串蒸,接取串蒸液100 mL,以未添加酵母菌液固体培养基为对照,利用气相色谱(gas chromatography,GC)法对蒸馏液挥发性物质进行定量分析。
气相色谱条件:CPwax57色谱柱(50m×0.25mm×0.2μm);进样口温度250 ℃;进样量0.8 μL;分流比=30∶1;控制方式流量;检测器温度280℃;柱流速1 mL/min;空气流量300 mL/min;氢气流量30 mL/min;尾吹气流量25 mL/min;柱箱温度:35℃保持3min,以1℃/min升至50℃,再以20℃/min升至200℃,保持15 min。
1.3.4 酵母菌酒醅发酵产物挥发性物质的测定
吸取1 mL不同酵母培养液接入酒醅发酵培养基中充分混匀,5 mL 2.61 mol/L H2SO4发酵栓封口,28℃静置培养8 d后,拔去发酵栓,加入50 mL无水乙醇,常温200 W超声萃取40 min后,吸取上清5 mL,12 000 r/min离心20 min,0.22μm滤膜过滤后利用气质联用(gaschromatography-mass spectrometry,GC-MS)法对挥发性物质进行分析。
GC条件:进样口温度250℃,载气氦气(He),流速2mL/min。进样量1μL,不分流进样,DB-FFAP色谱柱(60m×0.25 mm×0.25 μm),升温程序:50℃恒温2 min,以4℃/min的速度升温至230℃,保持15min。MS条件:电子电离(electronicionization,EI)源,电子能量70eV,离子源温度230℃,扫描范围30.00~350.00 amu[13-14]。
以丙酸辛酯(300 μg/L)作为酯类物质内标,薄荷醇(200μg/L)作为醇、醛、酚类物质检测内标,叔戊酸(200 μg/L)作为酸类物质检测内标,根据内标峰图对所测样品微量成分进行半定量分析。
1.3.5 数据处理
根据内标峰图面积比,分别以丙酸辛酯、薄荷醇、叔戊酸标品量对气质数据进行半定量分析,获得各微量成分含量。将各组分数值减去对照数值后,利用Heml软件进行热图处理。
2 结果与分析
2.1 酒醅产香酵母分离鉴定
从牛栏山酒醅中获得120株酵母菌,通过对其26SrDNA D1/D2区进行PCR测序分析,共获得9株酵母菌,分别标记为菌株NLS-1~NLS-9。系统发育树采用Mega5.1软件的Kimura 2-parameter model模型,邻接法自举1 000构建而成[15-16],结果见图1。
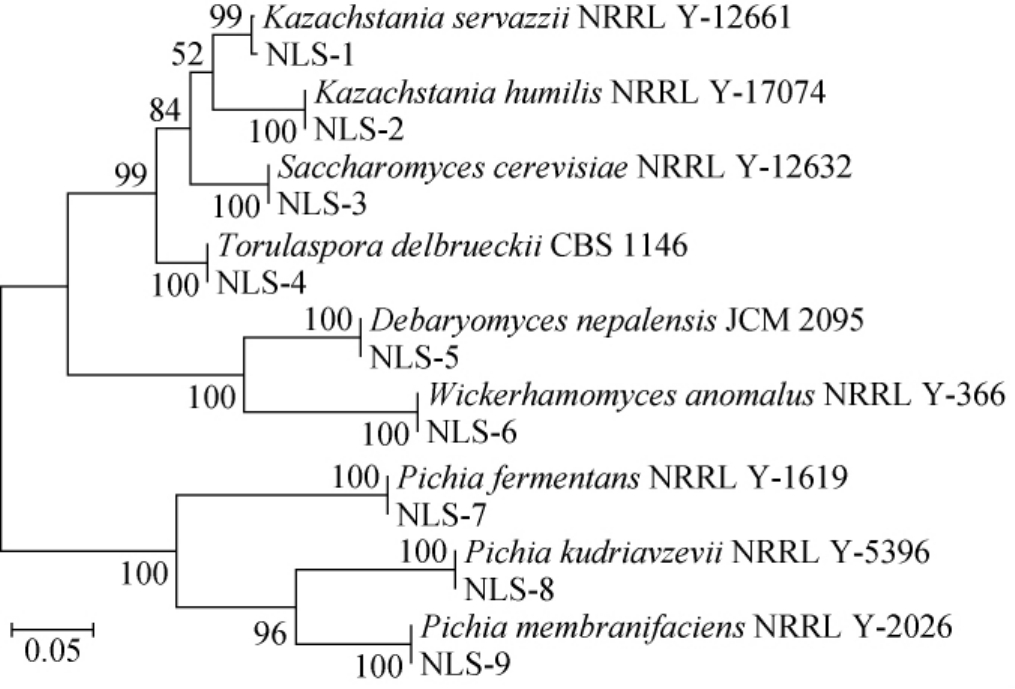
图1 9株酵母菌基于26S rDNA的D1/D2序列构建的发育树
Fig.1 Phylogenetic tree of 9 yeasts based on 26S rDNA D1/D2 sequences
由图1可知,从牛栏山酒醅中共分离鉴定获得9株酵母菌,分别为发酵毕赤酵母(Pichia fermentans)、库德里阿兹氏毕赤酵母(P.kudriavzevii)、膜醭毕赤酵母(P.membranifaciens)、异常威克汉姆酵母(Wickerhamomycesanomalus)、尼泊尔德巴利酵母(Debaryomyces nepalensis)、戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)、酿酒酵母(Saccharomyces cerevisiae)、矮小哈萨克斯坦酵母(Kazachstania humilis)和瑟氏哈萨克斯坦酵母(K.servazzii),其中毕赤酵母属种类较多,共获得3种不同毕赤酵母,同时也获得2种哈萨克斯坦酵母,而异常威克汉姆酵母、尼泊尔德巴利酵母、戴尔凯氏有孢圆酵母、酿酒酵母各为一种。
2.2 酵母菌高粱发酵培养基风味物质的分析
将所获得的9株酵母菌纯化后通过液体富集培养后,加入高粱发酵培养基中,模拟发酵5 d后,利用酒精混匀进行串蒸。9株酵母菌经过模拟发酵蒸馏后,测定了蒸馏液中风味成分,测定结果见表2。
表2 筛选酵母菌高粱培养基风味物质检测结果
Table2 Determination results of flavor substances of screening yeasts in sorghum medium mg/L

?
续表

注:“ND”表示未检出。
?
由表2可知,在牛栏山二锅头酒中,酯类是重要呈香物质,大部分表现为水果香、花香[17],乙酸乙酯和乳酸乙酯更是二锅头酒中的主要呈香呈味物质,P.kudriavzevii发酵蒸馏液中乙酸乙酯含量能够达到969.0 mg/L,W.anomalus发酵蒸馏液中含量能够达到541.4 mg/L,而K.servazzii和K.humilis发酵蒸馏液中乙酯含量仅为28.4mg/L和29.7mg/L,说明同种酵母菌产乙酸乙酯能力相差较大。
醇类物质是牛栏山二锅头酒体香气的重要组成部分,其往往能够赋予酒体醇香、水果香。在酵母发酵蒸馏液中,共检测出6种醇类物质,含量较高的主要为正丙醇、异丁醇、异戊醇3类高级醇。高级醇是白酒中的重要呈香呈味成分之一,如果白酒中主要高级醇含量过少,会缺乏传统白酒的风味,含量过多,不仅会导致酒苦涩、辣味还会出现头痛、易醉等现象[18]。整体看来,9种蒸馏液中正丙醇、异丁醇、异戊醇含量均高于对照组,但含量上存在不同差异:如正丙醇,对照组含量为34.5 mg/L,K.humilis和S.cerevisiae发酵蒸馏液含量为58.2 mg/L和56.9 mg/L,与对照相比分别增长了68.7%和64.9%,而P.membranifaciens和P.manshurica发酵蒸馏液正丙醇含量仅稍高于对照组;对照样品中异丁醇含量较低仅为1.2mg/L,P.kudriavzevii发酵蒸馏液中增长较多,达到了89.3 mg/L,P.membranifaciens和P.manshurica含量分别为2.1mg/L、1.8mg/L;异戊醇与异丁醇结果较为相似,同样是对照组中含量较低1.5mg/L,蒸馏液中S.cerevisiae和P.kudriavzevii大量增长。
醛类物质对白酒呈香起着辅助作用,成品酒中的醛类物质可在贮存过程中通过氧化缩合、自然挥发而使自身含量降低,酒质也随之逐渐变得绵柔,但过量则使白酒有强烈的刺激感和辛辣味[12]。9种酵母蒸馏液中变化较为明显的醛类为乙醛,D.nepalensis发酵产乙醛能力最高,能够产生58 mg/L的乙醛,其次为S.cerevisiae25.8 mg/L、T.delbrueckii 22.7 mg/L和K.servazzii22.0 mg/L。
2.3 酵母菌酒醅发酵风味物质分析
将富集培养后的9种酵母菌加入酒醅培养基中,以空白酒醅发酵培养基作为对照,28℃模拟发酵8 d后,酒精萃取后进行挥发物质气质联用半定量分析。
2.3.1 酯类物质分析
以丙酸辛酯为内标,对不同酵母酯类挥发性产物进行半定量分析,结果见表3。
表3 筛选酵母菌酒醅培养基酯类物质含量检测结果
Table3 Determination results of esters contents of screening yeasts in fermented grains medium μg/L

?
续表
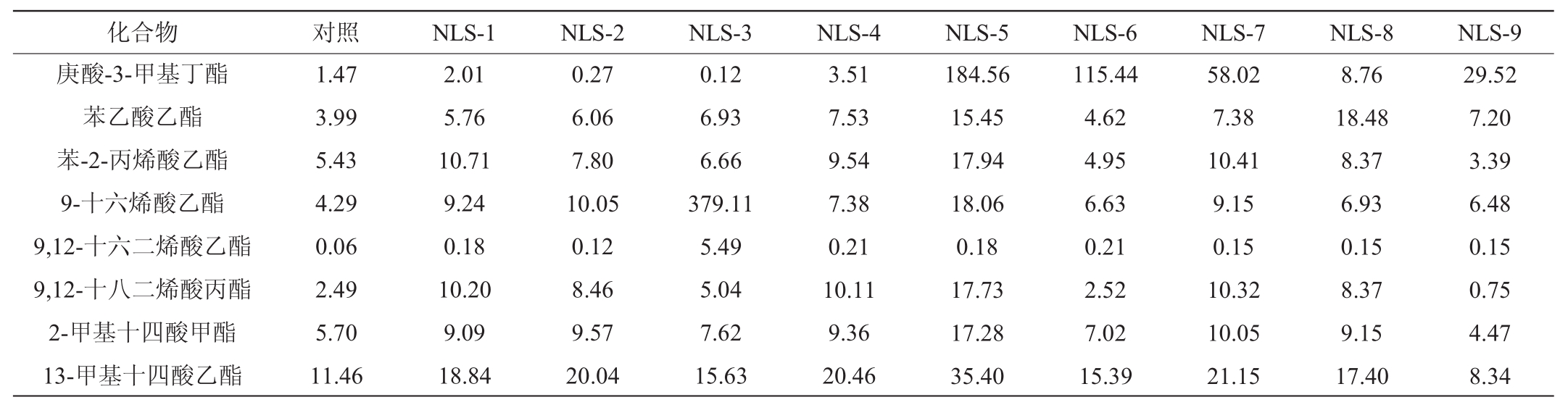
注:“ND”表示未检出。
?
由表3可知,9株酵母菌代谢产物中共检测到24种酯类物质,如乙酸乙酯、乙酸-3-甲基丁酯、辛酸乙酯、乙酸苯乙酯、十六酸乙酯、油酸乙酯和亚油酸乙酯等,说明9种酵母菌能够以酒醅作为底物生成多种酯类物质,酯类中的大多数具有水果样芳香,同时也是构成二锅头白酒香味的主要成分。将不同酵母酯类物质扣除对照含量后进行含量热图分析,初步获得不同酵母产酯能力,结果见图2。
由表3及图2可知,9株酵母菌利用酒醅中底物能够合成24种酯类物质,但多数酯类产量较低,辛酸乙酯、十六酸乙酯、油酸乙酯、亚油酸乙酯、乙酸苯乙酯这几种酯类物质在多数酵母菌产物中含量稍高,同时发现某些酵母菌能够生成较高的酯类物质,如W.anomalus(NLS-6)和P.kudriavzevii(NLS-8)具有较强的产乙酸乙酯能力,分别为4 494.27 μg/L、546.21 μg/L,同时也能够生成乙酸-3甲基丁酯;S.cerevisiae(NLS-3)具有较高的产9-十六烯酸乙酯的能力;W.anomalus(NLS-6)、P.fermentans(NLS-7)和P.membranifaciens(NLS-9)庚酸-3-甲基丁酯合成较高。

图2 筛选酵母菌酒醅培养基酯类含量热图分析
Fig.2 Heat map analysis of esters contents of screening yeasts in fermented grains medium
2.3.2 醇、醛及酚类物质分析
以薄荷醇为内标,对不同酵母菌醇类、醛类、酚类物质进行半定量分析,结果见表4。
表4 筛选酵母菌酒醅培养基醇、醛、酚类物质含量检测结果
Table4 Determination results of alcohols,aldehydes and phenolics substances contents of screening yeasts in fermented grains medium μg/L

?
续表
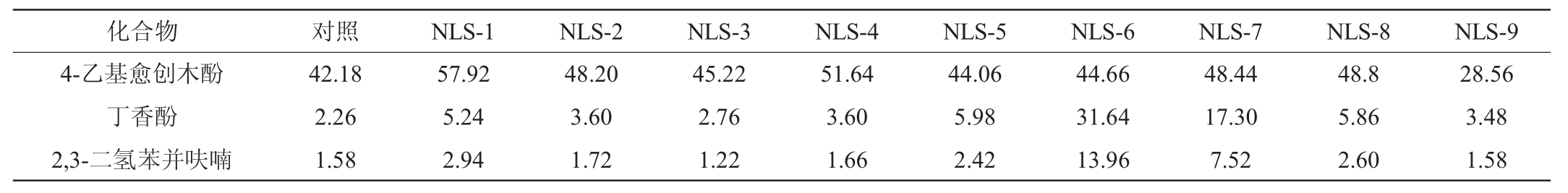
注:“ND”表示未检出。
?
由表4可知,在9种酵母菌中共检测到9种醇、2种酮、2种醛、2种酚类及1种呋喃类风味物质,醇类在二锅头酒中占有重要地位,它是酒中醇甜和助香的主要物质,同时也是酒中香味成分的前驱物质,可与酸形成酯类物质。醛酮及酚类和呋喃类物质,虽然含量较低,但每种都有各自的香气和口味,也是白酒香味成分之一。将表4中风味扣除对照样品含量后进行含量热图分析,结果如图3所示。

图3 筛选酵母菌酒醅培养基醇、醛、酚类物质含量热图分析
Fig.3 Heat map analysis of alcohols,aldehydes and phenolics substances contents of screening yeasts in fermented grains medium
由图3可知,在9种醇类物质中,生成量较为突出的为2-甲基丙醇(异丁醇)、3-甲基丁醇(异戊醇)和苯乙醇,其中T.delbrueckii(NLS-4)、P.kudriavzevii(NLS-8)生成异丁醇、异戊醇能力较强,这与单菌定量分析结果存在一定不同,说明在以酒醅作为底物的培养条件下,不同酵母菌所代谢的产物与纯培养存在差异;9种酵母菌中,S.cerevisiae(NLS-3)、T.delbrueckii(NLS-4)和P.kudriavzevii(NLS-8)具有较强的合成苯乙醇的能力,苯乙醇作为芳香族化合物,具有较强的呈香作用,有着令人身心愉悦的花香和水果香,其含量在百分之一、甚至千分之一时就能使人感到强烈的香味[19];在醛、酮、酚物质中,T.delbrueckii(NLS-4)具有较高的合成苯甲醛的能力(263.6 μg/L)。
2.3.3 酸类物质定性分析
以叔戊酸为内标,对9种酵母菌酸类物质进行半定量分析,结果如表5所示。
由表5可知,本实验所检测酸类物质种类较少,9种酵母菌中共检测到5种酸类物质,分别为乙酸、2-甲基丙酸、丁酸、辛酸和9-十六稀酸,不同有机酸在香气和味觉上均有差异,但都是二锅头酒中重要的呈香物质及酯类合成的前体。将表5中风味扣除对照样品含量后进行含量热图分析,结果如图4所示。
表5 筛选酵母菌酒醅培养基酸类物质含量检测结果
Table5 Determination results of acids content of screening yeasts in fermented grains medium μg/L
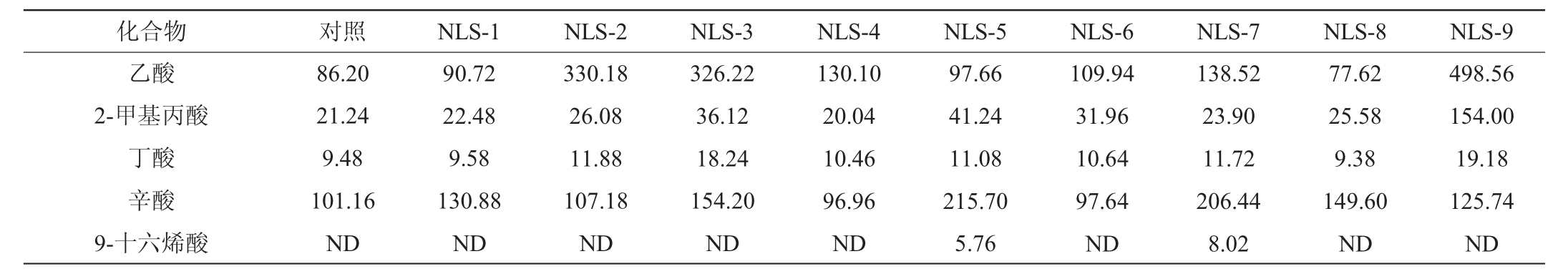
注:“ND”表示未检出。
?

图4 筛选酵母菌酒醅培养基酸类物质含量热图分析
Fig.4 Heat map analysis of acids content of screening yeasts in fermented grains medium
由图4可知,9种酵母菌代谢酸类产物中,生成量较高的是乙酸和辛酸,其中K.humilis(NLS-2)和P.membranifaciens(NLS-9)具有较强的产乙酸能力,P.fermentans(NLS-7)具有较高的产辛酸能力。在白酒众多有机酸中,乙酸具有爽口带甜等特点,辛酸虽然具有脂肪臭,呈刺激感,但这些酸类在白酒味道调节中起重要作用[20]。
3 结论
本研究从牛栏山二锅头酿造酒醅中共分离获得9株酵母菌,在高粱培养基中,库德里阿兹氏毕赤酵母(Pichia kudriavzevii)和异常威克汉姆酵母(Wickerhamomycesanomalus)乙酸乙酯产量较高,分别为969.0 mg/L和541.4 mg/L,9种蒸馏液中正丙醇、异丁醇、异戊醇含量均高于对照组,尼泊尔德巴利酵母(Debaryomyces nepalensis)发酵产乙醛能力最高(58mg/L);在酒醅培养基中,9株酵母菌代谢产物中共检测到25种酯、9种醇、5种酸、2种酮、2种醛、2种酚及1种呋喃,其中W.anomalus产乙酸乙酯能力最强4 494.27 μg/L,P.kudriavzevii具有较强的产乙酸乙酯、苯乙醇、异丁醇及异戊醇能力,分别为546.21 μg/L、724.96 μg/L、31.56 μg/L及142.52 μg/L,膜醭毕赤酵母(P.membranifaciens)产乙酸能力最强(498.56 μg/L)。通过两种方法的筛查分析,可以初步获得不同酵母菌在不同条件下生成挥发性风味的能力,这将有助于解析发酵过程中不同酵母菌的作用,更加系统的了解白酒的产香机理,同时也为今后的基酒酿造提供一定的基础信息。
[1]陈美竹,邱树毅,胡宝东,等.酱香型白酒酿造体系中酵母菌研究进展[J].中国酿造,2015,34(6):5-10.
[2]魏金旺.浅谈牛栏山二锅头酒生产中的微生物[J].中国酿造,2017,36(4):1-5.
[3]周森,韩培杰,胡佳音,等.牛栏山二锅头酿造过程中的真菌多样性分析[J].食品工业科技,2018,38(1):127-131.
[4]杨强,唐洁,杨生智,等.清香型小曲白酒产酯酵母的筛选及应用[J].酿酒科技,2016(1):78-80.
[5]王晓丹,庞博,陈孟强,等.酱香白酒酒醅中产香酵母分离与鉴定[J].食品安全质量检测学报,2014,5(6):1799-1808.
[6]周森,李艳敏,胡佳音,等.清香型大曲酿酒酵母株系分类及其可挥发代谢产物分析[J].中国酿造,2017,36(9):137-141.
[7]朱婷婷.牛栏山大曲可培养微生物多样性分析[J].酿酒科技,2018(5):75-79.
[8]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:101-117.
[9]王旭亮,王异静,王德良,等.清香型白酒优质产酯酵母菌筛选[J].酿酒,2012,39(4):28-32.
[10]窦晓,韩培杰,刘莉,等.泸型酒酿造期间酒醅中可培养细菌的分离鉴定及其种群演替规律研究[J].食品工业科技,2017,38(1):169-174.
[11]刘坤.气相色谱法测定白酒中的主要成分[J].河北化工,2012,35(3):58-60.
[12]周玮婧,江小明.气相色谱法测定不同香型白酒中醇类与醛类物质含量[J].中国酿造,2017,36(4):180-183.
[13]吕磊.芝麻香型白酒关键微生物产香分析研究[D].济南:齐鲁工业大学,2014.
[14]常宇桐,罗云敬,钱承敬,等.顶空固相微萃取-气相色谱法测定馥郁香型白酒中的挥发性香气成分[J].食品安全质量检测学报,2018,9(17):4618-4627.
[15]王凤梅.26S rDNA D1/D2区与5.8S-ITS rDNA序列分析法在酵母菌鉴定中的应用[J].现代农业,2016(12):96-96.
[16]赵丽丽,陈存社,郭凤莲.26S rDNA序列分析法鉴定酵母菌[J].中国酿造,2008,27(15):49-51.
[17]王勇,徐岩,范文来,等.应用GC-O技术分析牛栏山二锅头白酒的香气化合物[J].酿酒科技,2011(2):74-76.
[18]罗惠波,苟云凌,叶光斌,等.影响白酒中高级醇生成的工艺条件研究[J].中国酿造,2011,30(8):87-90.
[19]周康文怀,徐岩.中国白酒风味分析及其影响机制的研究[J].北京工商大学学报(自然科学版),2012,30(3):53-56.
[20]蔡雪梅,吴联海,陈梦圆,等.酱香白酒酒糟中生香酵母的筛选及鉴定[J].中国酿造,2017,36(7):42-46.